伴不典型临床病理特征的硬化性肺细胞瘤
2024-01-02袁杭倪恩德陈灵姣王声燕邬慧倩张伶俐何璋海卞丽娟
袁杭,倪恩德,陈灵姣,王声燕,邬慧倩,张伶俐,何璋海,卞丽娟
硬化性肺细胞瘤(pulmonary sclerosing pneumocytoma,PSP)曾被称之为硬化性血管瘤(pulmonary sclerosing haemangioma,PSH),被认为是良性肿瘤,但已有文献报道伴胸膜和淋巴结转移病例,临床上易误诊为恶性,目前认为PSP 肿瘤较大(最大径>5 cm)、界限不清楚、部位多发;表面细胞异型性、间质细胞丰富、浸润性生长;肿瘤细胞增殖指数高(Ki-67>3%)、P53 突变等易发生转移[1-7]。研究认为表面细胞及间质细胞均起源于原始呼吸道上皮,在免疫表型上存在差异是因为两种细胞所处的分化阶段不同,另有研究认为表面细胞分化更为成熟,类似于Ⅱ型肺泡上皮,而间质细胞不仅形态多样且具有多向分化潜能[8,9]。有文献报道上皮间质转化(EMT)与恶性肿瘤转移密切相关[10],孙宇等[11]认为PSP 间质细胞可能源于表面细胞的上皮间质转化,推测EMT 参与了PSP 转移的发生。刘峥璐等[12]研究认为PSP 有独特的临床病理学特点和潜在的低度恶性生物学行为,部分病例与Wnt/β-catenin 信号通路激活以及AKT1、P53 基因突变相关。另有文献报道同时存在AKT1 E17K 体细胞突变和TP53 C176Y 胚系突变可能是良性PSP 发生恶性进展的主要原因[13-15]。
本研究通过对伴不典型临床病理特征的PSP的免疫表型及临床病理学意义的分析,提高PSP术中冰冻及术后诊断的准确率,并报道1 例发生同时性区域淋巴结转移的硬化性肺细胞瘤的基因突变及预后情况,同时对文献进行复习,增加对PSP 的认识,关注PSP 的恶性生物学行为及发生恶性进展的原因。
1 材料与方法
1.1 材料检索
2015 年10 月至2022 年5 月经中山大学孙逸仙纪念医院病理科诊断为硬化性肺细胞瘤或硬化性血管瘤的病例,其中伴不典型临床病理特征的共15 例。
1.2 方法
对伴不典型临床病理特征的硬化性肺细胞瘤或硬化性血管瘤的临床病理资料进行回顾性分析,包括患者年龄、性别、就诊原因、影像学表现(如肿块位置、大小、边界等)、大体及镜下改变以及免疫组化表达特点,并对15 例患者进行生存随访。用10% 福尔马林固定标本,常规脱水、石蜡包埋、切片。切片进行HE 染色,并采用Envision二步法进行免疫组织化学(IHC)染色,光镜下观察HE 切片及IHC切片染色情况。所用抗体CK7及NapsinA 购自福州迈新生物技术开发有限公司,TTF-1购自泉晖贸易国际有限公司,EMA及vimentin购自北京中杉金桥生物技术有限公司,P53 购自罗氏公司,Ki67购自塞诺特生物技术有限公司。泛癌肿520 基因高通量测序检测仪器:Illumina;试剂公司:燃石医学;生信分析平台:Oncomaster。
1.3 诊断标准
CK7、NapsinA 及vimentin 阳性定位于细胞质,EMA 阳性定位于细胞质/膜,TTF-1、P53、Ki-67 阳性定位于细胞核。
2 结 果
在15 例患者中,女性13 例,男性2 例。年龄33~73 岁,中位年龄54 岁。其中因体检发现而无症状者12 例,伴胸闷者1 例,伴胸痛者1 例,伴咳嗽、咳痰者1 例。肿块均为单发,其中1 例合并肺浸润性腺癌。位于左上肺7 例、右下肺5 例、左下肺1 例、右中肺1 例、右纵膈1 例。
影像学检查均为圆形或类圆形肿块,边界尚清,最大径0.55~4.9 cm,其中有1 例误诊为转移性肿瘤,3 例误诊为恶性肿瘤,5 例误诊为其他良性病变,其余6 例为非确定性诊断。
15 例患者均进行手术切除,其中有9 例同时清扫淋巴结。对15 例患者进行随访,其中1 例失访,随访时间为10~99 个月,其余14 例患者均生存良好,无复发及远处转移。
大体检查肿块边界均较清,切面灰黄灰褐色,可有出血灶。15 例中有11 例进行术中冰冻切片,其中仅1 例诊断为硬化性肺细胞瘤,4 例误诊为肺腺癌,其余6 例为非确定性诊断。
石蜡切片中镜下由四种组织结构中的一种或两种为主,各种结构占比不同,乳头区由缺乏纤维血管轴心的乳头状突起复杂排列,表面被覆立方状细胞,间质为圆形或多角形细胞,可硬化或黏液样变;硬化区为致密的胶原纤维透明变性;实性区为片状分布的圆形或多角形细胞,偶见立方状表面细胞形成的小管散在分布;血管瘤样区是大的充满血液的被覆上皮细胞的腔隙或出血灶及含铁血黄素沉积物碎片,可见泡沫样巨噬细胞及胆固醇裂隙。在部分病例中两种细胞可见不同程度的细胞核异型性,表面细胞呈立方状,胞浆透亮或空泡状、多核或核内包涵体,形态类似于活化的Ⅱ型肺泡上皮或细支气管上皮;间质细胞小,呈圆形或多角形,有明显边界,胞浆嗜酸性,可呈空泡状,核圆形或卵圆形,位于中央,核仁不清晰,染色质细而分散,核分裂象少见。
表面细胞:CK7、EMA、TTF-1、NapsinA(+),Vim(±,6/9),ER(部分+,3/3),PR(部分+,2/2);间质细胞:EMA、TTF-1、Vim(+),ER(部分+,3/3),PR(部分+,2/2),CK7、NapsinA(-)。HE 切片15 例中有8 例表面细胞呈中度或重度异型,1 例推挤支气管壁长入支气管腔,1 例P53 突变,5 例Ki-67>3%(间质细胞增殖指数稍高于表面细胞)。
15 例中1 例发生同时性区域淋巴结转移,其余均未见区域淋巴结转移或远处转移。
该例发生区域淋巴结转移的患者为女性,55 岁,因胸痛1 周入院,无其他疾病史。胸部CT平扫+增强+三维重建显示左肺上叶近肺门纵隔旁不规则形软组织肿块,大小约49 mm×38.6 mm×34.3 mm,边界较清晰,肿块呈分叶状改变,其内密度不均,见点状钙化灶,增强扫描不均匀强化,其内见左上肺静脉、左支气管动脉分支小血管供血,纵隔内结构清楚,纵隔内2L、2R、4R、6 区多发淋巴结显示,最大者位于6 区,最大短径约7 mm,边界清晰,考虑恶性肿瘤,肺癌可能,纵隔内淋巴结显示,不除外转移可能。
该例大体呈灰白色、实性、质稍硬、边界尚清,突出于肺表面。术中冰冻显示左上肺肿物,诊断为浸润性癌,考虑为腺癌。术后石蜡显示左上肺肿物,大部分呈乳头状生长,部分伴透明变性及钙化,少数呈实性生长,乳头区表面细胞呈柱状或矮立方状,部分细胞有异型性,间质细胞呈圆形或多角形,可见少数核分裂象,诊断为硬化性肺细胞瘤,部分细胞重度不典型增生,未见明确脉管内瘤栓。
该例原发灶免疫组化:表面细胞CK7(+)、TTF-1(+)、NapsinA(+)、Syn部分弱(+)、CK5/6(-)、P40(-),间质细胞TTF-1(+)、Syn 部分弱(+)、CK7(-)、CK5/6(-)、P40(-)、NapsinA(-),Ki67 约3%(+)、P53 约20%(弱+,野生型),ALK(D5F3)(-)、ALK(Neg)(-);第5 组淋巴结(1/8)转移瘤,转移灶可见表面细胞及间质细胞两种成分,转移灶免疫组化:表面细胞CK7(+),间质细胞CK7(-),P53 约30%(弱+,野生型)。
该例泛癌种520 基因高通量测序检测结果显示:①未检出EGFR/ALK/ROS1等基因变异;②检出CTNNB1(错义突变3 c.95A>G p.Asp32Gly 19.38%)、DICER1(错义突变5 c.442C>G p.Leu148Val 15.02%)基因体细胞变异(意义未明);③未发现致病或可能致病胚系基因变异;④微卫星状态:微卫星稳定(MSS);⑤肿瘤突变负荷(TMB):1.0。
随访10 个月,目前该患者生存良好,无复发及远处转移。
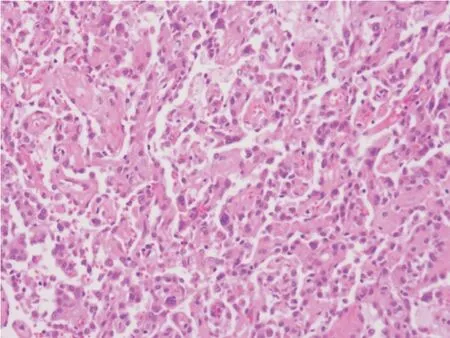
图1 硬化性肺细胞瘤原发灶:乳头区
3 讨 论
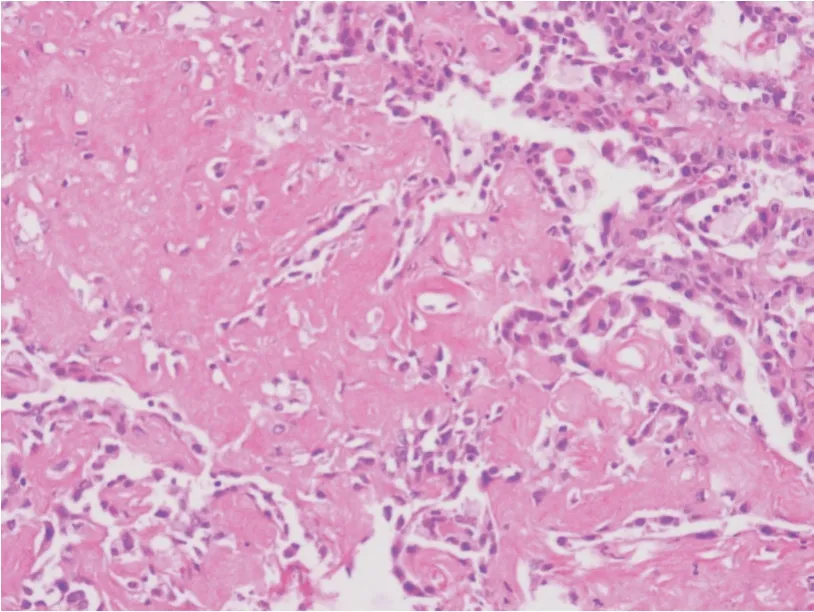
图2 硬化性肺细胞瘤原发灶:硬化区

图3 硬化性肺细胞瘤淋巴结转移

图4 硬化性肺细胞瘤淋巴结转移:实性区
硬化性肺细胞瘤是一种发病率低、临床趋向良性经过的肿瘤。发生机制尚不清楚。发病年龄11~83 岁,好发于中年(中位46 岁),女性多见,男女比例1∶5[16],东方国家发病率高于西方国家。大约90%患者在体检中发现,无症状,少数患者有咳嗽、咯血、胸痛等。影像学多表现为肺外周型的孤立性圆形或类圆形结节(平均直径2 cm),边界清,缺乏周围毛刺征,极少数患者出现两个及以上病灶,可累及双肺,与恶性肿瘤难以鉴别。该疾病于1956 年首次提出并命名,曾归为肺炎性假瘤,被认为是一种瘤样增生性病变,由非特异性炎症所致;1972 年Hill 等人对血管来源提出质疑,并称之为肺硬化性血管瘤(PSH);WHO 肺肿瘤分类:瘤样病变(1981 年)-杂类肿瘤(1999 年,有血管增殖和明显硬化倾向特征的边界清楚的实体性肿瘤)-具有一系列特征性组织学改变的肺肿瘤(2004 年)-腺瘤(2015 年,硬化性肺细胞瘤)。镜下由特征性的四种组织结构及两种细胞构成,有时可见泡沫样组织细胞聚集灶,并见肥大细胞散在分布。韩丽华等[17]研究发现约1/3 PSP 病例出现组织结构和细胞形态变异:多核瘤巨细胞形成、模拟乳头或微乳头结构、硬化性乳头、间质细胞梭形变、间质的透明变及黏液变以及与其它恶性肿瘤共存等。
纤支镜或肺穿因取材的局限性难以取到典型病变,故术前难以明确诊断,常需术中冰冻来决定手术方式,然而PSP 在术中冰冻中最易误诊,导致不必要的肺叶切除和淋巴结清扫。YANG 等[14]总结了术中冰冻误诊的原因,包括:细胞增生密集、细胞异型性、腺腔形成、胶原化或硬化、凝固性坏死等。韩绘宇[18]研究发现冰冻切片中PSP 以乳头状为主,常常误诊为腺癌,诊断准确率较低。通过文献复习,术中冰冻时PSP 多仅见1~2 种组织结构,且2 种细胞在冰冻切片中常难以辩认,术中冰冻切片比石蜡切片细胞体积大、边界不清晰,且术中冰冻切片常放大细胞异型性,误诊或延迟诊断的主要原因是难以与肺腺癌和类癌鉴别:①乳头状腺癌:乳头状结构为真性乳头,间质为增生的纤维组织;细胞异型性;浸润性生长;②类癌:多角形肿瘤细胞呈片巢状或结节状分布,大小较一致,间质薄壁血管明显增生,菊形团样结构偶见。因此,术中冰冻时应多取材仔细寻找其他组织结构,另外,高倍镜下评估细胞异型性需谨慎,低倍镜下对组织结构的仔细观察更为重要。总之,影像学及大体显示肿物边界清楚,切开肿物时容易与周围正常肺组织分离而脱落;肿瘤组织结构的多样性(4 种组织结构)以及由2 种细胞构成是术中冰冻诊断PSP 的重要标志,阅片时应低倍镜、高倍镜相结合,并结合影像学,可避免误诊。
有文献报道2%~4%的PSP出现淋巴结转移[19],大部分为区域淋巴结转移[1,2],发生区域淋巴结转移(SPLNM)与无淋巴结转移相比较:①SPLNM 平均年龄更小(约38.6 岁);②男性比例增加(男∶女约1∶2.2),推测男性更容易发生SPLNM;③原发灶更大(平均最大径约5.0 cm)。容易发生SPLNM 的部位依次为肺门/支气管旁、纵隔、肺内、叶间和主动脉旁[16,20],远处转移少见[3,4]。SPLNM 原发灶多以间质细胞增生为主的实性区和硬化区,部分病例出现间质细胞梭形变和(或)间质细胞异型性,表面细胞无特殊改变[16,20],间质细胞比表面细胞更原始,侵袭能力更强,淋巴结转移灶以间质细胞为主[20,21],故转移灶多以实性区和硬化区为主。Gao 等[20]研究显示2.1%的硬化性肺细胞瘤出现间质细胞梭形变,并增加了淋巴结转移的风险。此外,Ki-67 在SPLNM 原发灶间质细胞(阳性率10%~55%)[1,20]的表达水平比无淋巴结转移的硬化性肺细胞瘤(阳性率<2%)升高[22]。
有文献报道过40 余例硬化性肺细胞瘤通过WES 分析发现了AKT1 E17K 体细胞突变,同时并未发现任何常见的肺癌驱动基因变异,说明尽管有共同的细胞起源,硬化性肺细胞瘤和肺腺癌发生发展的分子机制可能不同,AKT1 E17K 体细胞突变成为该疾病诊断为PSP 而非肺来源恶性肿瘤的关键证据之一[14,15],但是那些病例中出现复发、转移的少见,因此仅仅依据AKT1 E17K 突变或许还不足以解释少数患者恶性进展的原因。有报道认为AKT1 突变结合其他致癌基因可能会加速PSP 的恶性进展[23,24],另有报道认为同时存在TP53 C176Y 胚系突变,与免疫组化P53 表达阳性结果是一致的,推测TP53 C176Y 胚系突变是一个可能致病突变”,该研究认为同时存在AKT1 E17K 体细胞突变和TP53 C176Y 胚系突变是良性PSP 发生恶性进展的主要原因[25]。
然而,本例发生区域淋巴结转移的患者未出现AKT1 E17K 体细胞突变和TP53 C176Y 胚系突变,该例患者为何会发生恶性进展?该转移病例的原发灶以乳头区为主,其次为硬化区,少数为实性区,间质细胞梭形变不明显;淋巴结转移灶以乳头区为主,其次为实性区,表面细胞和间质细胞均可见。目前我们认为肿物较大(约4.9 cm)及出现不典型细胞学改变是该患者易发生转移的主要原因,因此对于肿物较大及出现非典型组织学改变(表面细胞异型性、间质细胞明显增生伴梭形变、侵袭性生长、Ki67 增高等)的硬化性肺细胞瘤患者,应密切关注其转移风险,术后密切随访。
目前大多数研究认为PSP 局部手术切除即可,术后无需放化疗。少数认为其是一种潜在或低度恶性肿瘤,淋巴结转移发生率低,且对预后无影响[26],目前并未发现因淋巴结转移而死亡的病例,所以不推荐常规清扫淋巴结,除非有明显的淋巴结肿大。目前,AKT1 已成为一种新的靶点用于临床试验[27],对于PSP 的治疗,AKT1 抑制剂可能有潜在价值。此外有研究表明女性的高发病率与硬化性肺细胞瘤中ER、PR 的高表达有相关性[28],因此,激素治疗有望提高PSP 患者的生存周期及生存质量。
