蜡梅CpBEAT3启动子克隆及其互作蛋白的初步验证
2024-01-01蔡艳梅付雪梅王华波杨楠陈龙清





关键词:蜡梅;CpBEAT3基因;乙酸苄酯;启动子;酵母单杂交;互作蛋白
蜡梅(Chimonanthus praecoxL.)是蜡梅科(Calycanthaceae)蜡梅属(Chimonanthus)多年生灌木,是特产于中国的传统观赏植物,有悠久的栽培历史;适应性强,具有花香馥郁、花小色艳、树姿优美等特点。蜡梅具有极高的观赏价值、文化价值、药用价值和经济价值,在苗木、切花盆景、香精精油生产等方面具有巨大的开发潜力,也是乡村旅游、观光农业的常用特色花卉。花香作为重要的观赏性状之一,在很大程度上影响蜡梅在园林景观、切花、盆景盆栽、精油等方面的应用。花香的代谢通路较为复杂,研究蜡梅花香物质代谢途径,对于蜡梅生产价值提高和植物花香遗传改良具有重大意义。
转录因子(transcription factor,TF)可以激活植物次生代谢物合成途径中多个合成酶基因的协同表达.有效启动次生代谢物合成途径。目前已发现许多转录因子能够调控植物挥发性化合物的合成,如在桂花(Osmanthus fragrans)花瓣中过表达OfMYB21能够使OfTPS2上调并导致芳樟醇的积累增加:PbbHLH4能够激活PbGDPS和PbTPSlO的启动子并调控蝴蝶兰花中单萜类物质的生物合成:西伯利亚百合(Lilium'Siberia’)中的转录因子LiMYB108能够直接激活LoTPS1的表达从而促进罗勒烯和芳樟醇的合成。但对蜡梅挥发性物质合成具有调控作用的转录因子还鲜有报道。
蜡梅中的花香挥发性化合物主要有萜烯化合物和苯丙烷类化合物,其中苯丙烷类化合物是对蜡梅花香成分贡献值第二大的类群,而乙酸苄酯是该类群中影响蜡梅花香最主要的物质之一。苯甲醇乙酰基转移酶(BEAT)能够以苯甲醇和乙酰辅酶A(acetyl-CoA)为底物催化合成乙酸苄酯,是植物乙酸苄酯生物合成代谢途径下游的关键酶。在矮牵牛、梅花等植物中过表达BEAT基因后乙酸苄酯含量明显提高,干扰BEAT基因表达则会降低乙酸苄酯的含量。本课题组前期研究已经筛选出3条蜡梅乙酸苄酯合酶基因,并通过组织部位表达分析发现CpBEA T3可能是控制蜡梅叶片中乙酸苄酯合成的关键基因,但对其生物合成的分子机制和特异性转录调控研究仍不清楚。因此,本研究通过PCR扩增获得蜡梅乙酸苄酯合酶基因CpBEAT3启动子区片段,并对该序列核心启动子区、顺式作用元件和CpG岛等结构进行生物信息学预测分析,同时利用酵母单杂交技术对可能与CpBEAT3启动子互作的蛋白进行初步验证,以期为进一步揭示CpBEAT3在蜡梅乙酸苄酯生物合成中的作用和转录调控机制奠定基础。
1材料与方法
1.1供试材料
供试植物材料为基因型HLT015的蜡梅植株,由云南省昆明市黑龙潭公园提供。于2022年11月-2023年4月采摘蜡梅不同组织部位(根、叶、花、子叶)样品放人液氮速冻,运回实验室保存于-80℃超低温冰箱,用于提取基因组DNA和总RNA。
1.2实验方法
1.2.1候选转录因子的确定利用已发表文献中鉴定出的与乙酸苄酯合酶基因互作的转录因子及其他对苯环类花香挥发物有调控作用的转录因子序列,在蜡梅基因组数据库中进行同源比对,筛选出5个可能与苯类/苯丙烷类花香物质合成调控有关的MYB转录因子,其中CpMYB42与PhOD01同源,CpMYB4.1、CpMYB4.2与PhMYB4同源,CpMYB108.1、CpMYB108.2与JsMYB108同源。
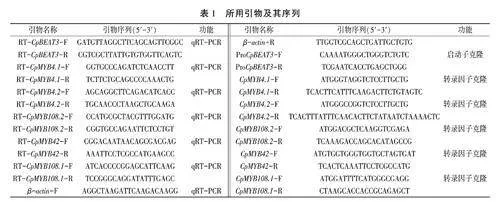
1.2.2组织部位表达特异性分析根据RNA提取试剂盒说明书分别提取蜡梅不同组织部位(根、叶、花、子叶)的总RNA,并反转录为cDNA。根据CpBEA T3及候选转录因子的序列设计qRT-PCR引物(表1),以作为内参基因,进行实时荧光定量PCR反应,并设置3个生物学重复,用2-AAC法计算基因表达量。qRT-PCR反应体系及程序均按照BlasTaq 2x qPCR MasterMix试剂盒说明书。
1.2.3蜡梅CpBEA T3基因启动子克隆及诱饵载体的构建根据CpBEA T3翻译起始密码子上游约2300bp的启动子序列设计特异性扩增引物(表1),利用蜡梅基因组DNA为模板进行PCR扩增。PCR反应体系如下:DNA模板1上、下游引物各扩士曾程序:95℃预变性3min;95℃变性15s,57℃退火15s,72℃延伸2min 30s,共30个循环;72℃终延伸5min,4℃保存。将胶回收产物与克隆载体连接并转化Transl-T1感受态细胞,挑选阳性单克隆菌液送生物公司测序,对测序结果进行比对。在成功扩增CpBEA T3启动子的特异性引物两端引入EcoRI和Sacl接头,进行PCR扩增,将胶回收产物与pHis2载体进行同源重组,获得pHis2-pCpBEAT3诱饵载体。
1.2.4生物信息学分析根据BDGP生物信息学数据库(http://www. fruitfly.
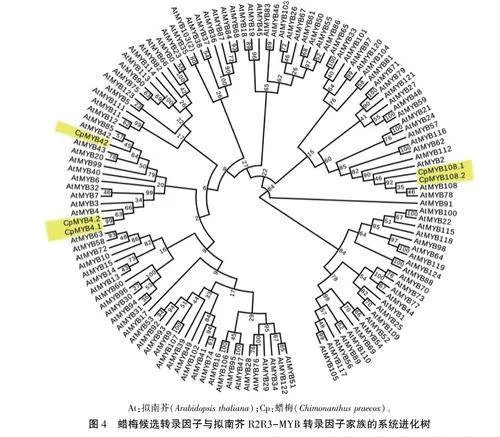
org/seq一tools/pro-moter.html)预测CpBEA T3基因核心启动子区域;利用MethPrimer数据库(http://www.urogene.org/cgi-bin/methprimer/methprimer. cgi)预测Cp-BEAT3基因启动子CpG岛;利用PlantCARE在线软件(http: //bioinformatics. psb. ugent. be/webtools/plantcare/html/)对启动子顺式作用元件进行预测。在拟南芥信息资源网站TAIR(https://www.arabidopsis.org)下载AtMYB家族的氨基酸序列,利用MEGA 5.1软件使用NJ法与CpTFs氨基酸序列进行比对并构建系统进化树,Bootstrap检测数值设置为1000次,分析蜡梅的候选转录因子与拟南芥MYB家族的进化关系。
1.2.5候选转录因子克隆及猎物载体的构建根据候选转录因子的CDS序列,利用Primer 3 In-put在线网站设计特异性引物(表1),以蜡梅cD-NA为模板进行PCR扩增,胶回收产物连接克隆载体并转化DH5ca感受态细胞,挑选阳性单克隆菌液进行测序、比对。在成功扩增候选转录因子的特异性引物两端引入EcoRI和BamH I接头,进行PCR扩增,并将其与pGADT7载体进行同源重组,获得pGADT7-CpTFs猎物载体。
1.2.6酵母单杂交筛选互作转录因子将pHis2-pCpBEAT3转入Y187酵母感受态细胞,涂布于SD/-Trp培养基上,挑取阳性单克隆菌落稀释后点板于含有0、10、20、30、40、50mmol/L 3-AT(3-氨基-1,2,4-三唑)的SD/-Trp-His培养基上,筛选能够抑制HIS3表达的最低3-AT浓度。将诱饵载体质粒与猎物载体质粒共转入酵母感受态细胞,并涂布在SD/-Trp-Leu培养基上,挑取阳性单克隆菌落依次稀释10、100、1000倍,将10uL各浓度菌液分别点板于含有能够抑制酵母HIS3表达的最低浓度3-AT的SD/-His-Trp-Leu培养基上,筛选潜在的转录调控因子。
2结果与分析
2.1CpBEAT3基因及候选转录因子基因的组织表达模式分析
图1显示,CpBEAT3及5个候选转录因子基因在所检测的蜡梅组织中均有表达。CpBEAT3在叶中的表达量最高,其次是在根中,两者间差异不显著,但显著高于在花和子叶中的表达量,在花中的表达量最低。CpMYB4.1和CpMYB108.2均在花中表达量最高,显著高于其他组织;CpMYB4.2在子叶中表达量显著高于在其他组织;CpMYB42在叶、根中有较高表达,显著高于花和子叶,在子叶中表达量最低;CpMYB108.1在花中表达量最高,其次在叶和子叶中表达量也较高,各部位差异显著。
2.2CpBEA T3基因启动子克隆
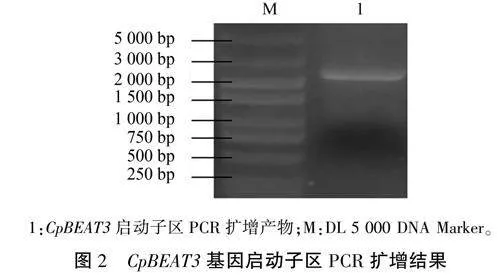
根据CpBEA T3起始密码子上游序列设计引物并进行PCR扩增,1.0%琼脂糖凝胶电泳检测结果(图2)显示,PCR扩增产物约2300bp,目的条带单一,与预期片段大小相符。阳性菌落测序结果比对显示,已成功克隆到长度为2310bp(位于-2115~195bp)的蜡梅CpBEA T3基因启动子区序列,去除CDS段的195bp序列,最终获得了2115bp CpBEAT3启动子序列。
2.3CpBEA T3启动子生物信息学分析
利用BDGP启动子预测软件分析CpBEAT3基因核心启动子区域,结果(表2)显示,CpBEAT3基因可能存在4个转录起始位点,分别位于-1844~-1794bp(得分0.99)、-843~-793bp(得分0.99)、-823~-773bp(得分0.98)、-141~-91bp(得分0.90)。推测其核心启动子区域可能位于-1844~-1794bp处,可能的转录起始区域为CCCGAGTTGATATATATGGAGCTCAACCCGATCCGACCCGACCCGAATTC,启动子核心区域包含典型的TATA-box元件。
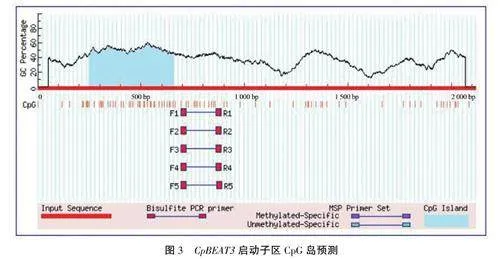
基于在线软件MethPrimer对CpBEAT3基因启动子区(2115bp)进行CpG岛预测,结果(图3)显示存在一个长度为410bp的CpG岛,位于247~656bp处(对应于启动子区的-1869~-1459bp处),可能会对启动子调控基因产生一定的影响。
利用PlantCARE在线软件对扩增获得的2115bp CpBEAT3启动子序列进行分析,结果(表3)发现其中除了包含CAAT-box和TATA-box等启动子必备的核心元件外,还存在多个光Ⅱ向应元件如Box 4、chs-CMAla、GATA-motif、TCT-motif,以及脱落酸响应元件ABRE,乙烯响应元件ERE,参与茉莉酸甲酯(MejA)反应的顺式作用元件CGTCA-motif和TGACG-motif,MYB和MYC结合位点,此外还有多个与低温、干旱、防御和压力等逆境胁迫相关的顺式作用元件LTR、W box、STRE、ARE、TC-rich repeats。
2.4候选转录因子系统进化分析
将搜索到的拟南芥125个R2R3-MYB转录因子氨基酸序列与蜡梅候选转录因子氨基酸序列进行比对,构建系统进化树(图4),可见,CpMYB4.1、CpMYB4.2与AtMYB4亲缘关系最近;CpMYB42与AtMYB42、AtMYB85亲缘关系较近;CpMYB108.1和CpMYB108.2与AtMYB108、At-MYB78亲缘关系较近。
2.5诱饵载体构建与3-AT抑制浓度筛选
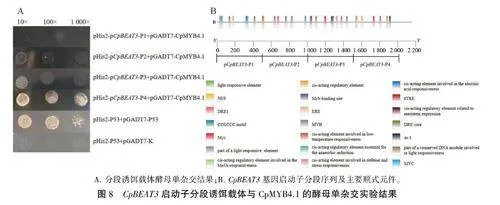
将2115bp的CpBEAT3启动子片段与pHis2载体同源重组,构建诱饵载体pHis2-pCpBEAT3;将诱饵载体转入Y187酵母感受态细胞中,涂布于SD/-Trp培养基上,挑取阳性单克隆菌落依次稀释10、100、1000倍后,分别取10uL点板于含有不同浓度3-AT的SD/-Trp-His培养基上,菌落生长情况如图5所示。可见,诱饵载体菌株在含30mmol/L 3-AT的SD/-Trp-His培养基上仍能生长,说明诱饵载体菌株内的启动子片段存在自激活现象,但在含40mmol/L 3-AT的SD/-Trp-His培养基上生长几乎被完全抑制,说明40mmol/L 3-AT可以抑制住诱饵酵母中报告基因的泄露表达。
2.6候选转录因子克隆及猎物载体的构建
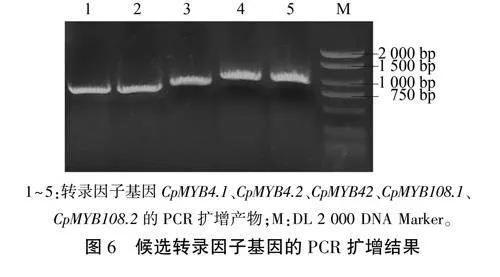
根据转录因子CDS序列设计引物,克隆出5个候选转录因子(图6),然后将其与经双酶切后的pGADT7载体进行同源重组,获得pGADT7-CpTFs猎物载体。
2.7酵母单杂交筛选互作转录因子
将猎物载体pGADT7-CpTFs与诱饵载体pHis2-pCpBEAT3共转Y187进行酵母单杂交互作验证。结果显示,所有共转诱饵质粒和pGADT7载体的酵母菌株在SD/-Trp-Leu培养基上均能正常生长:挑取生长良好的菌落将其稀释后分别取10uL点板于含有40mmol/L 3-AT的SD/-His-Trp-Leu培养基上,菌落生长结果如图7所示。可见,转化pHis2-pCpBEAT3+pGADT7-CpMYB4.1的菌株在SD/-His-Trp-Leu(40mmol/L3-AT)培养基上能够生长,而转化pHis2-pCpBEAT3+pGADT7-CpTFs和空载体质粒的菌株则不能,说明CpMYB4.1蛋白能结合CpBEAT3的启动子。
为进一步探究候选转录因子具体是与Cp-BEAT3启动子的哪个区域互作,将CpBEA T3启动子进行分段,每500 bp为一段,构建分段pHis2诱饵载体,并与pGADT7 -CpMYB4.1共转Y187后进行酵母单杂交实验,结果如图8所示:pHis2 -pCpBEAT3-P4+pGADT7-CpMYB4.1的菌株在SD/-His-Trp-Leu(40mmol/L 3-AT)培养基上能够生长,而转化其余启动子片段和空载体质粒的菌株则不能,说明CpMYB4.1蛋白能与CpBEAT3启动子的P4片段结合。
3讨论与结论
CpBEAT3是蜡梅叶中乙酸苄酯生物合成的关键酶基因,挖掘CpBEAT3上游转录调控因子对揭示乙酸苄酯生物合成机制具有重要意义。本研究克隆获得2115bp的CpBEAT3启动子序列,利用在线软件对其进行生物信息学分析,发现该基因的核心启动子区域可能位于-1844~-1794bp处;存在一个位于-1869~-1459bp处的长度为410bp的CpG岛;含有多个MYB和MYC转录因子结合位点、光响应元件、激素响应元件以及多种胁迫响应元件,说明CpBEAT3基因的表达可能受到光、转录因子和激素的调控,且在逆境胁迫中发挥作用。进一步利用酵母单杂交技术筛选出1个与CpBEAT3启动子区结合的MYB类转录因子CpMYB4.1。
转录因子通过与下游靶基因启动子结合进而激活或抑制靶基因的表达,在植物挥发性物质代谢合成过程中具有重要的调控作用,也是分子生物学领域研究的热点问题。目前,对于花香成分及其生物合成网络的转录调控机制逐渐明晰,发现转录因子在调控花香物质的形成和释放中起着重要作用。MYB转录因子能够调控植物多种次生代谢产物的生物合成,目前已证实MYB4基因能够调节植物花青素、类黄酮及木质素等代谢途径中关键酶基因的表达,从而影响其生物合成。但MYB转录因子对于挥发性苯丙烷类物质有调控作用的报道相对比较少,多见于模式植物矮牵牛中,如R2R3-MYB家族成员的PhODO I能够调节矮牵牛苯丙烷类挥发物的合成,并且能够上调5-烯醇丙酮酰莽草酸磷酸合酶-3-磷酸合成酶(5-enol-pyruvylshikimate-3-phosphate synthase)基因的表达:PhEOB基因也能调控矮牵牛苯丙烷类挥发物的合成,其表达变化能够影响多个花香生物合成相关基因转录水平的改变,进而调控苯甲醛、苯甲酸苄酯及异丁子香酚等花香物质的合成:PhEOB I对矮牵牛挥发性物质合成也具有重要的调控作用,PhEOBH能够调控PhEOB的表达,同时二者又共同对PhODoi的表达进行调节:过表达MYB类转录因子基因PhPAP1使矮牵牛花色变深,且苯丙烷类挥发性物质的含量增加了10倍:沉默PhMYB4基因后转基因植株中的p-香豆酸显著增加,说明PhMYB4与矮牵牛苯丙烷类挥发物的代谢调控有关。另外,在桂花、茉莉、金鱼草、姜花等植物中也有相关报道。
植物苯丙烷类代谢途径较为复杂,而大部分MYB只对某一代特定的代谢通路有调节作用,仅部分MYB能够同时调控多个不同的代谢途径。例如在烟草中表达苦荞(Fagopyrum tata-curLcum) FtMYB1和FtMYB2能显著上调花青素代谢通路上PAL、CHI和F3H基因的表达,增强烟草花青苷合成,使总黄酮含量增加,同时抑制黄酮醇合酶基因FLS的表达,减少黄酮醇的生成:丹参SmMYB39通过抑制苯丙烷类代谢途径C4H基因的表达,对迷迭香酸的合成进行调控。苯丙烷类花香物质生物合成途径与花青素、木质素合成途径有部分重叠,且花香与花色、木质素的生物合成竞争碳通量,有时会抑制某一途径从而改变代谢流,进而使得另一途径过表达.所以在一定程度上存在花色一花香、木质素一花香共调控现象。本研究发现,CpMYB4.1蛋白可以与CpBEAT3启动子互作,表明其可能参与蜡梅乙酸苄酯的生物合成调控。接下来将深入研究转录因子CpMYB4.1对CpBEAT3表达的调控效应,并对其他可能参与协同调控的转录因子进行鉴定,从而为揭示蜡梅乙酸苄酯合成机制奠定基础。
