不同含油量油梨果肉的转录组、生理生化和细胞学水平差异分析
2024-01-01施学东王步天杨学虎赵维峰杨明艳王宏权张镕麒王永全马蔚红葛宇







摘要:【目的】分析不同含油量油梨果肉的转录组、生理生化和细胞学水平差异,为挖掘油梨果肉脂肪酸合成过程 的相关基因及油梨新品种选育提供参考依据。【方法】以3个油梨品种Hass、RL-1和RL-2成熟果肉为试验材料,采用 Illumina HiSeq 2500测序平台完成测序,以|log2Fold Change|gt;1和Plt;0.05为标准,通过DEGseq(v2)获得差异表达 Unigenes,通过韦恩图和火山图分析3个比较组(RL-1 vs Hass、RL-2 vs Hass和RL-2 vs RL-1)差异表达Unigenes,并 进行GO功能注释、KEGG信号通路富集和聚类分析,采用实时荧光定量PCR验证转录组测序结果,测定3个油梨品种 的含油量,采用激光共聚焦技术在40倍物镜下观察油梨成熟果肉中的油体。【结果】3个油梨品种成熟果肉的转录 本中,在至少2个样品间有显著差异的Unigenes共19007条(Plt;0.05,下同);在3个比较组间相对表达量有明显差异的 Unigenes共3000个。在RL-2 vs Hass比较组中有9个功能条目显著富集,RL-1 vs Hass比较组中只有细胞组分类别下 的3个功能条目显著富集;仅2个KEGG信号通路在RL-2 vs Hass比较组中显著富集。筛选到32条参与油梨果肉脂肪 酸合成的差异表达Unigenes;聚类分析结果显示,差异表达Unigenes表达模式分为2组。实时荧光定量PCR验证结果表明转录组测序数据可靠。3个油梨品种成熟果肉含油量排序为Hassgt;RL-2gt;RL-1,油梨果肉油体差异观察结果显示,Hass成熟果肉中油体较大,最大的直径达15~20 um。【结论】筛选到与油梨果肉脂肪酸成分合成相关的32条差异 表达Unigenes,其中5条Unigenes[PaPDH(EIβ)、PaACP4-1、PaACP4-2、PaSAD(FAB2)和PaFaTA]在3个油梨品种成熟 果肉中的相对表达量较高。
关键词:油梨;果肉;脂肪酸;油体;转录组
文献标志码:A
文章编号:2095-1191(2024)03-0754-12
中图分类号:S667.9
Differencial analysis of transcriptome,physio–biochemical and cytological levels of avocado mesocarp with different oil contents
SHI Xue-dong1, WANG Bu-tian1, YANG Xue-hu1, ZHAO Wei-feng1, YANG Ming-yan1, WANG Hong-quan1, ZHANG Rong-qi1, WANG Yong-quan1, MA Wei-hong2, GE Yu1*
(1College of Tropical Crops, Yunnan Agricultural University, Pu'er, Yunnan 665099, China; 2Haikou Experimental Station, Chinese Academy of Tropical Agricultural Sciences, Haikou, Hainan 570102, China)
Abstract: 【Objective】The aim was to analyze the differences in transcriptome, physio-biochemical and cytological levels of avocado mesocarp with different oil contents, so as to provide reference basis for mining related genes in fatty acid synthesis process of avocado mesocarp and breeding new varieties of avocado. 【Method】The mature mesocarp of three avocado varieties Hass, RL-1 and RL-2 were used as experimental materials, and the Illumina HiSeq 2500 sequen- cing platform was used to complete the sequencing. With |log2 Fold Changel gt;1 and Plt;0.05 as the standard, the differen- tially expressed unigenes were obtained by DEGseq (v2). The differentially expressed unigenes in the three comparisongroups (RL-1 vs Hass, RL-2 vs Hass and RL-2 vs RL-1) were analyzed by Venn diagram and volcano diagram. Through GO functional annotation, KEGG signaling pathway enrichment and cluster analysis, real-time fluorescence quantitative PCR was used to verify the transcriptome sequencing results, and the oil contents of three avocado varieties were determined. The oil body in the mature mesocarp of avocado was observed under a 40-time objective lens by laser confocal technique. 【Result] Among transcripts of three varieties of mature avocado mesocarps, a total of 19007 unigenes were found to be significantly different between at least 2 transcripts of samples (Plt;0.05, the same below ). There were 3000 unigenes with obvious differences in relative expression among three comparison groups. In the RL-2 vs Hass comparison group, there were 9 functional items and they were significantly enriched. In the RL-1 vs Hass comparison group, only 3 functional items under the cell component category were significantly enriched. Only two KEGG signaling pathways were significantly enriched in the RL-2 vs Hass comparison group. A total of 32 differentially expressed unigenes involved in fatty acid synthesis in avocado mesocarp were screened. The results of cluster analysis showed that the expression patterns of differentially expressed unigenes were divided into two groups. The results of real-time fluorescence quantitative PCR showed that the transcriptome sequencing data were reliable. The oil contents of the mature mesocarp of the three avoca- dos varieties were ranked as Hassgt;RL-2gt;RL-1. The observation results of the oil body difference of the avocado mesocarp showed that the mature mesocarp of Hass had larger oil bodies, and the maximum diameter was 15-20 um. 【Conclusion】 A total of 32 differentially expressed unigenes related to the synthesis of fatty acid components in avocado mesocarp are screened, among which five unigenes [PaPDH (Elβ), PaACP4-1, PaACP4-2, PaSAD(FAB2) and PaFaTA] had higher relative expression levels in mature mesocarp of three avocado varieties.
Key words: avocado; mesocarp; fatty acids; oil body; transcriptome
Foundation items: National Natural Science Foundation of China (32260735) ; \"Yunnan Revitalization Talent Support Plan\" (Young Talents) Project (XDYC-QNRC-2022-0711) ; Scientific Research Fund Project of Education Department of Yunnan (2024Y343); Yunnan Expert Basic Scientific Research Station Project(2021RYZJGZZ004)
0 引言
【研究意义]油梨(Persea americana Mill.)又名 牛油果,为樟科(Lauraceae)鳄梨属(Persea)的热带、亚热带果树(Hernandez et al.,2022)。现主要种植于 云南、海南及广西,其中,云南省油梨种植面积居全 国第一。油梨果肉含油量仅低于油橄榄和棕榈果肉 (Ramos-aguilar et al.,2021),其含有的不饱和脂肪酸有利于人类心血管健康(罗立娜等,2021;Alkaltham et al.,2021;Reboussin et al.,2021)。此外,油梨油脂还可作为食用油、生物柴油及防晒霜中乳化剂的原 料(Santos et al.,2014)。前期对采集自云南、海南、 广西和贵州的不同油梨资源果肉脂肪酸成分进行检 测,发现不同油梨资源果肉含油量差异显著,不饱和 脂肪酸相对含量最高达60%以上(葛宇等,2017a, 2017b;Liu et al.,2020)。因此,开展不同含油量油梨 果肉的转录组、生理生化和细胞学水平差异研究,对 挖掘油梨果肉脂肪酸合成过程的相关基因及油梨新 品种选育具有重要意义。【前人研究进展】油梨是一 种重要的高热量水果,脂肪酸含量能达到其果实重 量的3%~30%,且.80%左右为不饱和脂肪酸,是油梨 区别于其他水果的重要特征之一(Meyer and Terry, 2010)。Ozdemir和Topuz(2004)选取油梨Hass和Fuerte 2个品种,通过气相色谱法在2个品种的成熟 果肉中均检测到棕榈酸、棕榈油酸、硬脂酸、油酸、亚 油酸、亚麻酸及花生酸等多种脂肪酸,其中2个品种 油酸含量分别高达59%和73%。Villa-Rodriguez等(2011)通过气质联用法,在油梨Hass品种成熟果肉 中也同样检测到上述脂肪酸,其中油酸含量高达 67%~70%。成熟油梨果肉中油酸的含量最高,油酸 是人体必需脂肪酸,与多不饱和脂肪酸相比,油酸具 有减少人体血浆中低密度脂蛋白胆固醇含量,预防 动脉硬化(Mozaffarian et al.,2006)及防晒(Santos et al.,2014)等作用,且油酸在纯化、储存及加热过程中 不易被氧化(Schierholt et al.,2000)。通过激光共聚 焦技术对油梨果肉不同发育时期的油体进行观察发 现,前期油梨果肉的油体仅分布于细胞壁周围,但随 果肉发育,油体逐渐分布于细胞中间,且数目逐渐增 多,体积逐渐增大(葛宇等,2018)。植物脂肪酸合成 途径已初步阐明,已开展相关功能基因的克隆、鉴定 及转基因育种(Ge et al.,2021a;Kazaz et al.,2022)研 究。至今,在种子油料作物的种子中,已发现可显著 调控脂肪酸的相关基因有LeafyCotyledonl、Leafy Cotyledon2、Fusca3和Abscisic Acid Insensitive3等 (Zafar et al.,2019;Zhang et al.,2020),在富含脂肪酸含量的油棕和油梨果肉组织中,已发现可显著调控 脂肪酸的相关基因有Nuclear factor of the Y box A3、 Nuclear factor of the Y box C2和Abscisic Acid Insen- sitive5等(Yeap et al.,2017)。此外,近些年无论在种子油料作物还是其他油料作物中,均发现属于AP2/ERF转录因子家族的WRINKLEDI(WRII)基因调控 脂肪酸合成途径中的一些关键酶基因,在从糖或淀 粉到脂肪酸的碳流动中起着关键性作用(Ortiz etal.,2020;Zhang et al.,2020)。前人基于油梨果肉发育阶段转录组与脂肪酸代谢组联合分析发现,在脂 肪酸合成途径上的多个关键酶基因在油梨果肉发育 阶段的表达量趋势与脂肪酸变化趋势一致(Kilaruet al.,2015;Ge et al.,2021b)。【本研究切入点】目前, 关于不同油梨资源果肉含油量差异的生理生化研究 涉及较多,但有关不同含油量油梨果肉的转录组、生 理生化和细胞学水平差异的分子机制研究鲜见报 道。【拟解决的关键问题】本研究以3个油梨品种成 熟果肉为试验材料,通过二代转录组测序技术、含油 量测定及油体观察,从分子、生理生化及细胞学多角 度综合分析导致不同油梨品种果肉含油量差异的分 子基础,为进一步挖掘油梨果肉脂肪酸合成过程的 相关基因及油梨新品种选育提供理论基础。
1材料与方法
1.1试验材料
采集自云南省瑞丽市油梨基地5年生Hass、RL-1和RL-2等3个油梨品种成熟果实(图1)。3个油梨品种的3个生物学重复分别标记为Hass-1、Hass-2、Hass-3、RL-1-1、RL-1-2、RL-1-3、RL-2-1、RL-2-2和RL-2-3。主要试剂:植物RNA试剂盒(美国OMEGABio-Tek 公司),NEBNext® UltraTM RNA Library Prep Kit for Illumina®试剂盒(美国New England Biolabs 公司)。主要仪器设备:Zeiss LSM 510 META激光共聚焦显微镜购自德国Carl Zeiss公司。
1.2转录组测序与组装
采用植物RNA试剂盒提取油梨果肉总RNA,采用聚合T寡聚体吸附磁珠纯化总mRNA。采用 NEBNext® UltraTM RNA Library Prep Kit for Illumina® 试剂盒构建RNA测序文库,以油梨果肉mRNA为模板,反转录合成cDNA,构建3个油梨品种果肉的cDNA文库。采用Illumina HiSeq 2500测序平台完成测序。所获得的原始序列(Raw reads)通过剔除低质 量的Reads后,即获得有效序列(Clean reads)。基于Clean reads计算出Q20、Q30和GC含量。采用HISAT2 v2.1.0(Kim et al.,2015)将Clean reads与油梨参考基 因组序列进行比对(Rendon-Anaya et al.,2019)。
1.3 Unigenes差异表达分析与功能注释
采用每千碱基的片段数(Fragments per kilobase of exon model per million mappedreads,FPKM)值表 示Unigene的相对表达量。采用DEGseq(v2)分析 3个油梨品种3个比较组(RL-1 vs Hass、RL-2 vs Hass 和RL-2 vs RL-1)的差异表达Unigenes(Love et al.,2014)。差异表达Unigenes的筛选标准:|log2Fold Change|gt;1且Plt;0.05。差异表达Unigenes的GO功能注释和KEGG信号通路富集分析分别采用GOseq R(v1.20.0)(Young et al.,2010)和KOBAS(v3)(Xie et al.,2011)进行,以Plt;0.05作为显著性富集的阈值。
1.4实时荧光定量PCR验证
以3个油梨品种成熟果肉的cDNA为模板,基于 转录组数据筛选到的32条与油梨果肉脂肪酸合成 相关的差异表达Unigenes,随机选取其中6条Unige- nes [PaPDH(E1β)、PaACP4-2、PaSAD (FAB2)、Pa- LACS8、PaFAD2和PaLDAP2-2]进行实时荧光定量PCR验证。根据6条Unigenes序列设计荧光定量PCR引物,以油梨PaActin7作为内参基因(表1)。实时荧光定量PCR反应体系参考葛宇等(2019)。扩增程序:95℃预变性90s;95℃5s,60℃15s, 72C20s,进行40个循环。采用2-AAa法计算目的基因的相对表达量(Livak and Schmittgen,2001)。 1.5油梨含油量检测将油梨果肉干燥后研磨成粉末,50℃下加入无 水乙醚,将5g干粉转移到滤纸筒中。样品干粉与无 水乙醚的体积比为1:20。使用索氏萃取器将过滤后 的溶液提取至无油后,将提取物在旋转蒸发器上蒸 发并称重。
1.6油梨油体激光扫描共聚焦显微观察
于100mL的丙酮溶液中加入100mg尼罗红, 4℃下避光保存。用刀片分离出油梨成熟果肉,将
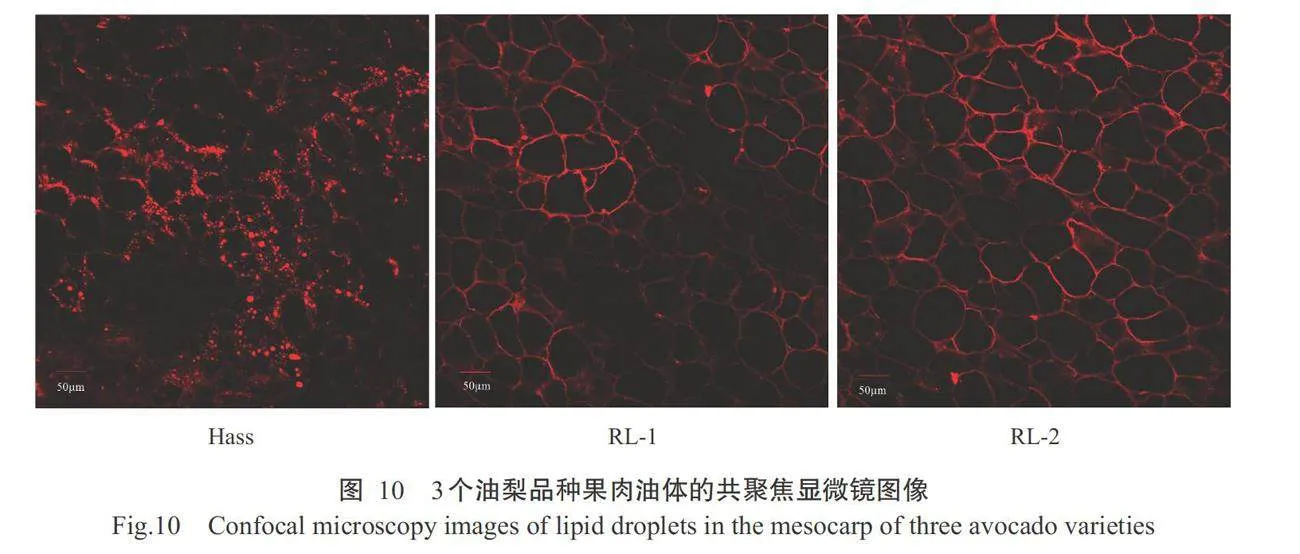
果肉切成面积约为1mm²的小块。将样品放入尼罗 红溶液中避光孵育15 min,然后用0.1 mol/L PBS缓 冲液反复冲洗3次,洗去尚未与样品结合的染料。采用Zeiss LSM510 META激光共聚焦显微镜,在40 倍物镜下观察油梨成熟果肉中的油体,激发波长为 543nm,信号采集为BP514~548nm。
1.7统计分析
采用SPSS17.0对试验数据进行统计整理,并进 行差异显著性分析。
2结果与分析
2.1测序数据与组装结果
3个油梨品种测序后获得的相关数据见表2。9个样品的Raw reads为44304404~47854426条,Cleanreads为42664574~46280680条,有效碱基为6.40~6.94 Gb。Q20为98.52%~98.77%,Q30为95.70%~96.28%,GC含量为43.64%~46.12%。
2. 2 油梨果肉基因差异表达Unigenes
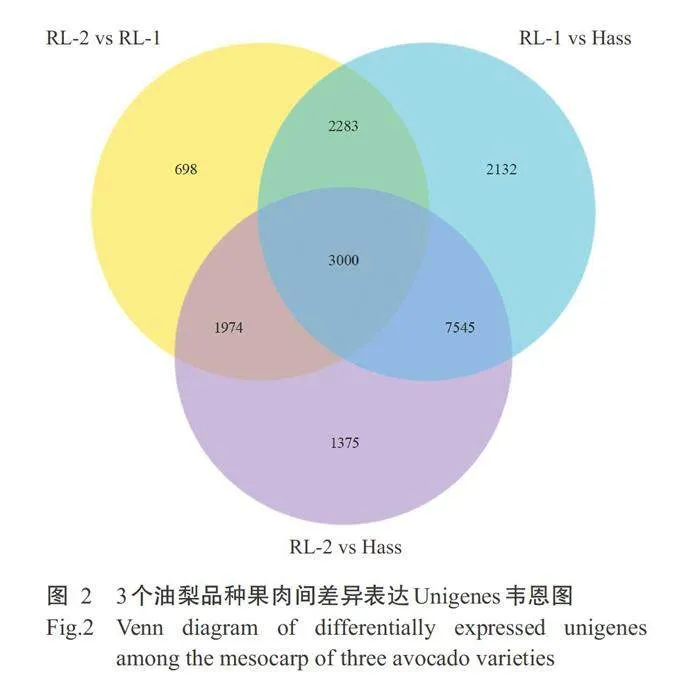
根据3个油梨品种果肉样品2个比较组的差异表达Unigenes相对表达量不同,分为上调Unigenes和下调Unigenes。3个油梨品种成熟果肉的转录本 中,在至少2个油梨品种间的相对表达量有差异的Unigenes共19007条,3个油梨品种间相对表达量有明显差异的Unigenes共3000条(图2)。在RL-1 vs Hass 比较组中相对表达量有差异的Unigenes共 14960条,其中8080条表达量上调,6880条表达量下 调;RL-2 vs Hass 比较组中相对表达量有差异的Unigenes共13894条,其中7507条表达量上调,6387条表达量下调;在RL-2vsRL-1比较组中相对表达量有差异的Unigenes共7955条,其中3809条表达量 上调,4146条表达量下调(图3)。
2.3油梨果肉差异表达Unigenes GO功能注释和 KEGG信号通路富集分析结果
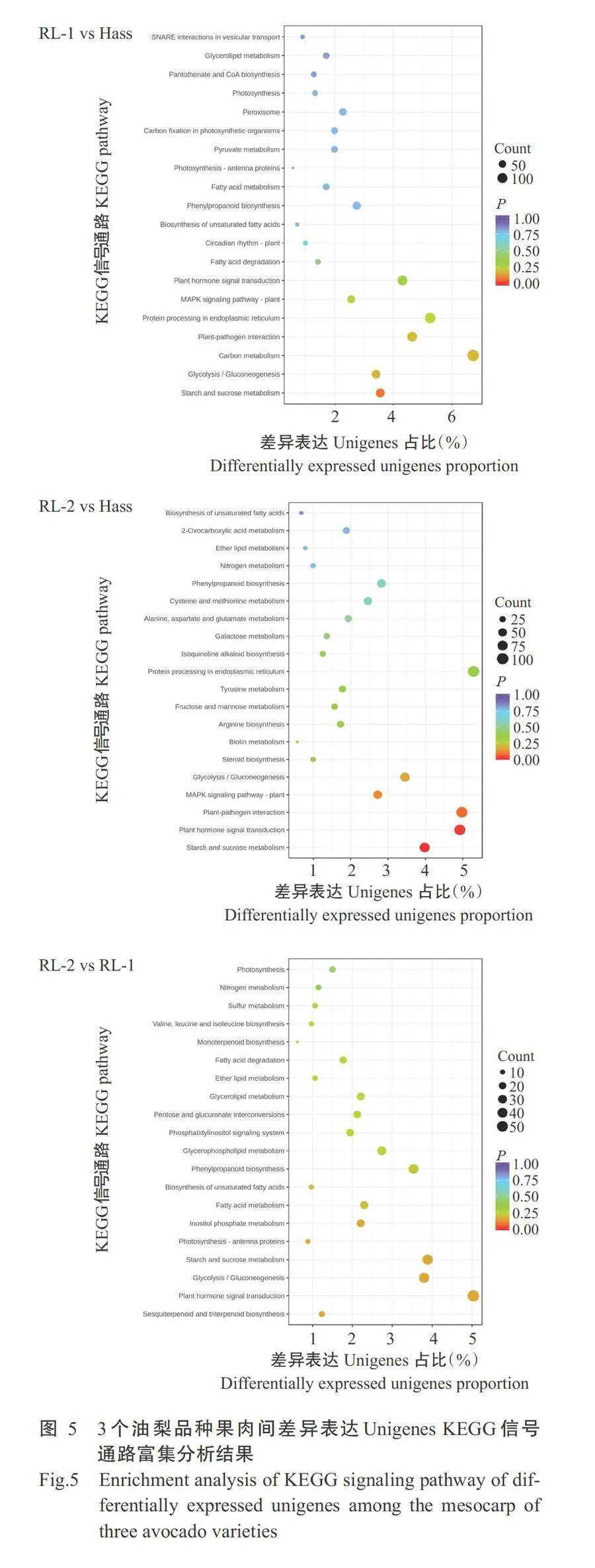
对3个油梨品种成熟果肉差异表达Unigenes进 行GO功能注释分析。RL-1 vs Hass比较组中只有细胞组分类别下的3个子类别显著富集(Plt;0.05,下 同),分别为细胞外围、细胞壁与外部封装结构。在 RL-2 vs Hass 比较组中有9个子类别显著富集,分别 为细胞组分类别下的细胞壁、外部封装结构、胞外 区、质外体与分子功能类别下的木葡聚糖:木葡聚糖 转移酶活性、水解酶活性(作用于糖基键)、葡糖基转 移酶活性、ADP结合和水解酶活性(水解O-糖基化合物)。在RL-2 vs RL-1比较组中只有分子功能类别下的4个子类别显著富集,分别为ADP结合、转移酶活性(转移烷基或芳基)、UPD-葡糖基转移酶活性 和葡糖基转移酶活性(图4)。对3个油梨品种成熟 果肉差异表达Unigenes的KEGG信号通路进行显著 富集分析,在RL-1 vs Hass中,未发现任何KEGG代谢通路显著富集。在RL-2vs Hass中有2个代谢通 路显著富集,分别为淀粉、蔗糖代谢和植物激素信号 转导。在RL-2 vs RL-1中,未发现任何KEGG代谢 通路显著富集(图5)。
2.4油梨果肉脂肪酸成分生物合成相关差异表达Unigenes 鉴定结果
基于3个油梨品种成熟果肉差异表达Unigenes 数据,在脂肪酸生物合成通路中,共筛选差异表达 Unigenes共32条,其中13条参与叶绿体内脂肪酸合 成,14条参与内质网上甘油三酯组装,5条参与胞质 内油体形成(表3和图6)。在32条差异表达Unige-nes中,参与叶绿体内脂肪酸合成的13条Unigenes 相对表达量是参与内质网上甘油三酯组装的14条 Unigenes相对表达量的6.35倍。此外,从图6可知, 其中有5条Unigenes[PaPDH(E1β)、PaACP4-1、 PaACP4-2、PaSAD(FAB2)和PaFaTA]在3个油梨品 种成熟果肉的相对表达量较高。32条差异表达Unigenes在Hass、RL-1和RL-2等3个油梨品种成 熟果肉中的相对表达量分别为408.40、131.85和 192.54 FPKM。在RL-1 vs Hass比较组中差异表达Unigenes共30条,其中8条相对表达量上调,22条相对表达量下调。PaLDAP2-1和PaSTERO的相对表达量差异最明显,其中,油梨品种Hass中PaLDAP2-1相对表达量为RL-1的27.47倍,RL-1油梨品种PaSTERO相对表达量为Hass的26.75倍。在RL-2 vs Hass 比较组中相对表达量有差异的Unigenes共24条,其中 9条相对表达量上调,15条相对表达量下调。相关差异表达Unigenes中,RL-2油梨品种PaSTERO相对表达量为Hass的31.41倍。在RL-2 vs RL-1比较 组中共18条差异表达的Unigenes参与脂肪酸生 物合成,其中12条Unigenes相对表达量上调,6条 Unigenes相对表达量下调。RL-2油梨品种的PaFaTA相对表达量为RL-1的2.65倍。
2.5油梨果肉脂肪酸成分生物合成相关差异表达Unigenes聚类分析结果
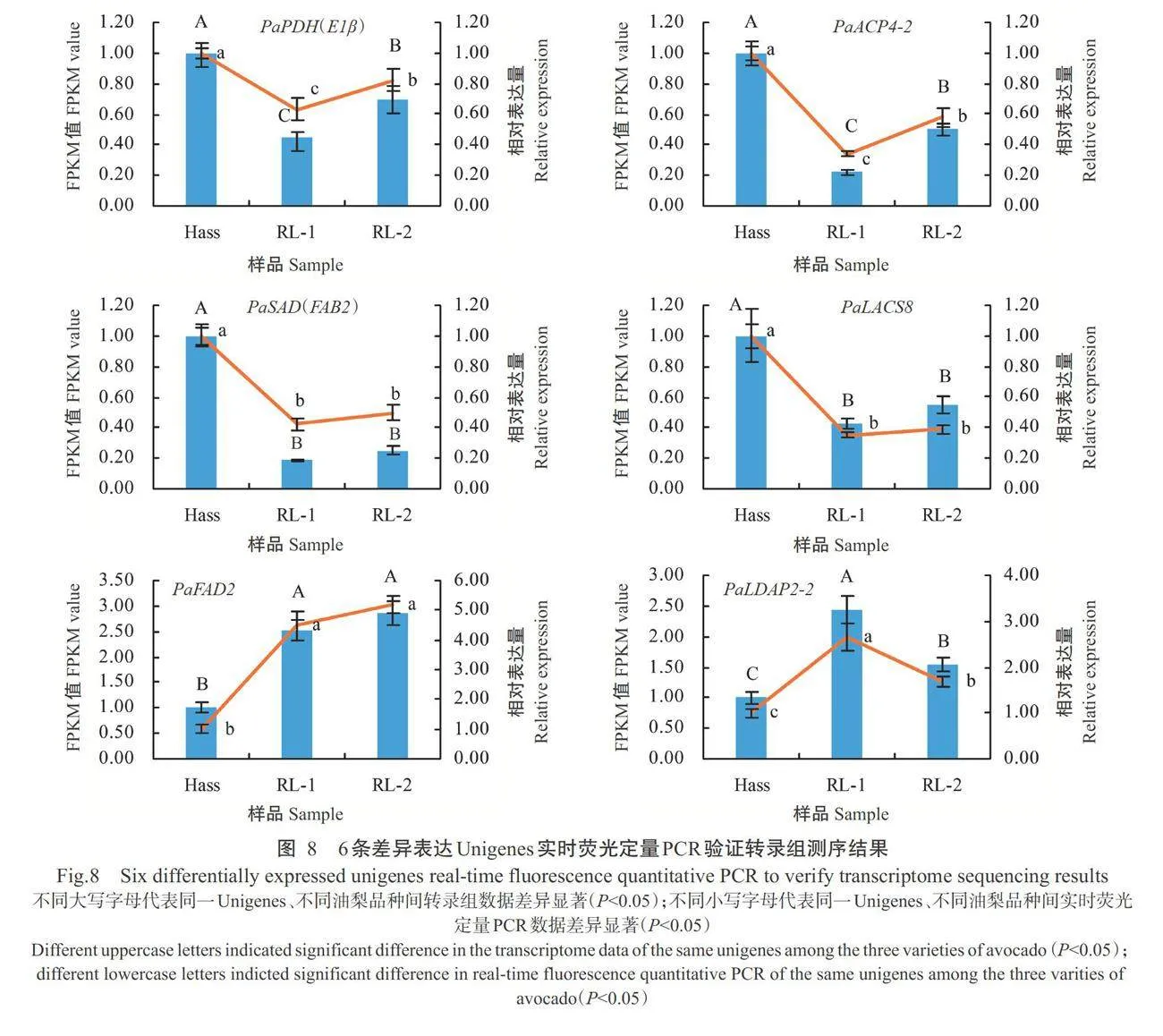
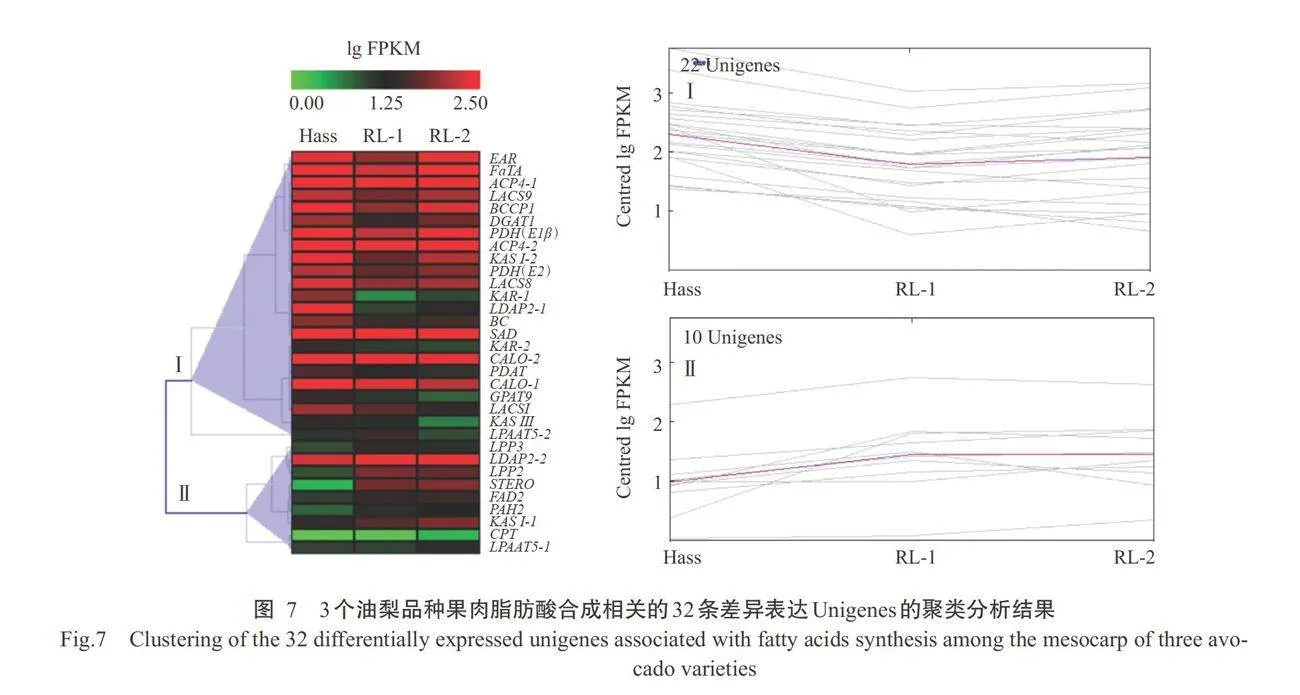
对筛选到的与油梨果肉脂肪酸成分合成相关的 32条差异表达Unigenes开展聚类分析(图7)可知,在脂肪酸成分生物合成相关差异表达Unigenes中,基因的表达模式可分为2组。I组包含22条差异表达Unigenes,在Hass中相对表达量最高,其次是RL-2,相对表达量最低的是RL-1。Ⅱ组包含10条差异表达Unigenes,其在RL-2相对表达量最高,其次是RL-1,Hass相对表达量最低。随机选择6条与油梨 果肉脂肪酸成分合成相关的差异表达Unigenes开展 实时荧光定量PCR验证。结果表明,6个Unigenes 在3个油梨果肉组织中表达趋势与转录组测序结果 基本一致,表明转录组测序数据可靠(图8)。
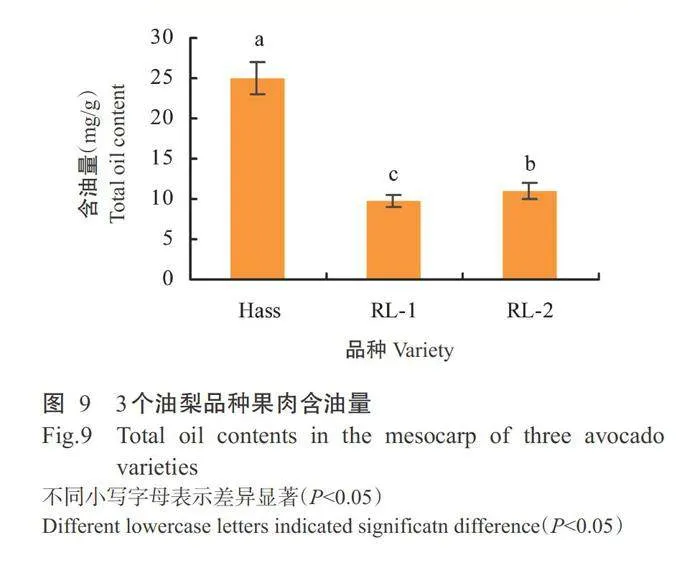
2.6油梨果肉含油量差异分析结果
3个油梨品种成熟果肉的含油量排序为Hassgt; RL-2gt;RL-1(图9)。其中,Hass成熟果肉含油量显著高于其他2个油梨品种。RL-2成熟果肉的含油量显著高于RL-1。
2.7油梨果肉油体差异观察
采用激光共聚焦显微镜,可观察到被尼罗红染 成红色的3个油梨品种成熟果肉中的油体(图10)。 3个油梨品种成熟果肉油体有差异,油体直径为2~ 20μm,细胞单位面积内所包含的油体数量排序为 Hassgt;RL-2gt;RL-1。在RL-1和RL-2成熟果肉中,油体仅出现在细胞壁边缘,而在Hass成熟果肉中,油体不仅分布于细胞壁附近,还分布于细胞中间,并且 油体数目增多,出现较大油体,最大直径达15~20μm。
3讨论
本研究共筛选到与油梨果肉脂肪酸成分合成相 关的32条差异表达Unigenes,其中参与叶绿体内脂 肪酸合成的13条Unigenes相对表达量高于参与内 质网上甘油三酯组装的14条Unigenes相对表达量。 前人在油莎豆、风筝果、油茶等富含油脂的组织中发 现参与叶绿体内脂肪酸合成的基因可能比参与内质 网上甘油三酯组装的基因对植物组织油脂积累更重要(Yang et al.,2016;Tian et al.,2019;Zhang et al., 2021),Ge等(2021b)研究也发现油梨果肉发育期参 与叶绿体内脂肪酸合成的基因相对表达量是参与内 质网上甘油三酯组装的基因相对表达量4.56倍,本 研究结果与之一致,推测参与油脂合成的相关基因 在富含油脂的不同植物组织的表达模式相对保守。对于本研究3个油梨品种成熟果肉的相对表达量较高的5条Unigenes[PaPDH(EIβ)、PaACP4-1、PaACP4-2、PaSAD(FAB2)和PaFaTA]中,PDH(E1β) 所翻译的蛋白质酶功能为在叶绿体中将丙酮酸转化 为脂肪酸前体。本研究在高含油量Hass中PDH(EIβ)的相对表达量高于低含油量RL-1与RL-2。与在油棕3个富含油脂的组织中发现PDH(EIβ)是促进油脂积累的主要基因之一的研究结果一致(Dussert etal.,2013)。SAD基因所翻译的酶为硬脂酰载体蛋白 去饱和酶,其功能为催化硬脂酰载体蛋白转化为油 酰-ACP(Du et al.,2016)。在拟南芥中共鉴定出7个 同源AtSAD基因(AtFAB2、AtDES1、AtDES2、AtDES3、 AtDES4、AtDES5和AtDES6)(Kachroo et al.,2007)。 在本研究中,PaSAD(FAB2)在3个油梨品种成熟果肉间差异表达,并且在高含油量Hass中的相对表达量高于低含油量RL-1与RL-2。在其他油料作物富含油脂的组织中常检测到SAD(FAB2)的同源基因,其相对表达量常高于其他6个SAD旁系同源基因,说明SAD(FAB2)对油脂合成具有重要作用(Kilaru et al., 2015; Du et al., 2016; Yang et al., 2016; Ge et al.,2021b;Zhang et al.,2021)。本研究与油梨果肉脂肪酸成分合成相关的32条差异表达Unigenes中,PaSAD(FAB2)和PaACP4-2的相对表达量高于其他 30条的Unigenes,表明PaSAD(FAB2)和PaACP4-2 基因对于油梨果肉油脂积累具有重要作用,与其他 作物富含油脂组织中的转录组结果类似(Kilaru etal.,2015;Du et al., 2016; Yang et al., 2016; Ge et al., 2021b;Zhang et al.,2021)。此外,酰基-ACP硫酯酶催化酰基-ACP中间产物水解,在叶绿体内脂肪酸合成的最后一步释放游离脂肪酸,而FaTA所翻译的蛋白质酶便是构成酰基-ACP硫酯酶的1个亚基(Jianget al.,2018)。本研究高含油量Hass中PaFaTA的相对表达量高于低含油量RL-1与RL-2,与前人研究结 果一致。
本研究筛选到的参与油体形成的相关的5条差
异表达Unigenes中,有3条Unigenes(PaLDAP2-2、 PaCALO-1和PaCALO-2)在3个油梨品种成熟果肉 的相对表达量较高。油体由单层磷脂和油体蛋白构 成,Yang等(2016)研究表明,LDAP、OBO、STERO和CALO是油体蛋白的主要基因。本研究中高含油量Hass油梨品种中PaCALO-1、PaCALO-2和PaLDAP2-2 的相对表达量均高于低含油量RL-1与RL-2。Tian 等(2019)、Yang等(2016)发现OBO、STERO和CALO 基因在油料作物富含油脂的种子和块茎组织中大量表达,推测3个基因对油体形成具有重要作用,本研 究结果进一步表明,油梨果肉含油量相关Unigenes 差异表达与油体形成有直接关系。
油体观察结果表明,3个油梨品种成熟果肉油体 体积直径为2~20um,其含油量与油体的数量和体 积成正比。前人研究发现,油棕胚乳和果肉的油体 较大(直径5~20μm),在果实成熟时油体占据 细胞体积绝大部分,而油棕胚的油体较小(直径约 2μm),基本处于细胞边缘,并且油棕3种富含油脂 的组织的含油量与油体数目和体积成正比(Dussertet al.,2013;Guerin et al.,2016)。同样,在富含油脂的 油菜和油茶种子中均发现,其含油量与油体的数量 和体积成正比(何宇清等,2017;Zhang et al.,2021)。
4结论
筛选到与油梨果肉脂肪酸成分合成相关的32条 差异表达Unigenes,其中5条Unigenes[PaPDH(E1β)、PaACP4-1、PaACP4-2、PaSAD(FAB2)和PaFaTA]在3个油梨品种成熟果肉中的相对表达量较高。
参考文献(References):
葛宇,董相书,张腾,程志号,林兴娥,王甲水,臧小平,徐梓 宁,宋勇,马蔚红.2019.油梨PaWRI1和PaWRI2基因的克隆、序列分析及表达研究[J].中国果树,2:37-42.[Ge Y,Dong X S,Zhang T,Cheng Z H, Lin X E, Wang J S, Zang X P, Xu Z N, Song Y, Ma W H. 2019. Cloning, sequence analyses,and expressions of PaWRIl and PaWRI2 genes from avocado (Persea americana)[J]. China Fruit, 2:37-42.] doi:10.16626/j.cnki.issn1000-8047.2019.02.008.
葛宇,马伏宁,韩文博,王甲水,胡福初,臧小平,马蔚红.
2017a.海南几种油梨果实中的脂肪酸成分测定与评价 [J].热带农业科学,37(12):81-86.[Ge Y,Ma F N,Han W B, Wang J S,Hu F C,Zang X P,Ma W H. 2017a. Iden- tification of fatty acid components in avocado fruit by gas chromatography-mass spectrometry[J]. Chinese Journal of Tropical Agriculture,37(12) : 81-86.] doi: 10.12008/j.issn.1009-2196.2017.12.016.
葛宇,司雄元,胡福初,熊科胜,臧小平,马蔚红.2017b.7个油 梨品种(系)果肉的脂肪酸含量及其相关性[J].贵州农业科学,45(8):104-108.[Ge Y,SiXY,Hu FC,Xiong KS, Zang X P, Ma W H. 2017b. Fatty acid content in pulp of seven Persea americana varieties (lines) and the correla-tions[J]. Guizhou Agricultural Sciences,45(8): 104-108.] 葛宇,吴斌,孙长君,吴琼.2018.梨果实不同发育时期油体的显微结构观察[J].中国园艺文摘,34(6):7-9.[Ge Y,Wu
B, Sun C J, Wu Q. 2018. Observation on the microstructure of oil bodies in different developmental stages of avocado fruit[J]. Chinese Horticulture Abstracts,34(6):7-9.]
何宇清,操春燕,沈文忠,黄冬,马胜,吴燕.2017.甘蓝型油菜 种子中油体的超微结构及蛋白质组分析[J].植物科学学报,35(4):566-573.[He Y Q,Cao C Y,Shen W Z,Huang D, Ma S, Wu Y. 2017. Study on the ultrastructure and pro- teome of oil bodies in Brassica napus L. seeds [J]. Plant Science Journal,35(4):566-573.] doi: 10.11913/PSJ.2095-0837.2017.40566.
罗立娜,韩树全,王代谷,李茂富,马蔚红,张正学,刘小翠.2021.油梨果实品质的差异分析与评价[J].中国农业科技导报,23(3):105-113.[Luo LN,Han SQ,Wang D G, Li M F,Ma W H,Zhang Z X, Liu X C. 2021. Analysis and evaluation of the differences in fruit quality of avocado[J].
Journal of Agricultural Science and Technology , 23(3) :105-113.] doi:10.13304/j.nykjdb.2019.0785.
Alkaltham M S, Uslu N, Özcan M M, Salamatullah A M, Ahmed I A M,Hayat K. 2021. Effect of drying process on oil, phenolic composition and antioxidant activity of avo- cado (cv. Hass) fruits harvested at two different maturity stages[J]. LWT,148:111716. doi:10.1016/j.lwt.2021.111716.
Du H W, Huang M, Hu J Y, Li J S. 2016. Modification of the fatty acid composition in Arabidopsis and maize seeds using a stearoyl-acyl carrier protein desaturase-1(ZmSAD1) gene [J]. BMC Plant Biology, 16 (1) : 137. doi: 10.1186/s12870-016-0827-z.
Dussert S, Guerin C, Andersson M, Joet T, Tranbarger T J, Pizot M, Sarah G, Omore A, Durand-Gasselin T, Morcillo
F. 2013. Comparative transcriptome analysis of three oil palm fruit and seed tissues that differ in oil content and fatty acid composition[J]. Plant Physiology, 162(3):13371358. doi: 10.1104/pp.113.220525.
Ge Y,Dong X S, Liu Y Z, Yang Y,Zhan R L. 2021a. Molecular and biochemical an alyses of avocado (Persea americana) reveal differences in the oil accumulation pattern between the mesocarp and seed during the fruit developmental period[J]. Scientia Horticulturae, 276 (1) : 109717.
doi: 10.1016/j.scienta.2020.109717.
Ge Y, Zang X P, Yang Y, Wang T, Ma W H. 2021b. In-depth analysis of potential PaAP2/ERF transcription factor related to fatty acid accumulation in avocado (Persea americana Mill.) and functional characterization of two PaAP2/ERF genes in transgenic tomato[J]. Plant Physiology and Biochemistry, 158 (8) : 308-320. doi: 10.1016/j.plaphy.2020.11.016.
Guerin C, Joet T, Serret J, Lashermes P, Vaissayre V, Agbessi M D T,Beule T, Severac D, Amblard P, Tregear J,DurandGasselin T, Morcillo F, Dussert S. 2016. Gene coexpres-sion network analysis of oil biosynthesis in an interspecifific backcross of oil palm[J]. The Plant Journal, 87
(5):423-441. doi:10.1111/tpj.13208.
Hernandez I, Uarrota V, Fuentealba C, Paredes D, Defilippi B G, Campos-Vargas R, Nunez G, Carrera E, Meneses C, Hertog M, Pedreschi R. 2022. Transcriptome and hormone analyses reveals differences in physiological age of 'Hass' avocado fruit[J]. Postharvest Biology and Technology,185: 111806. doi: 10.1016/j.postharvbio.2021.111806.
Jiang F Y, Zhao L, Yandeau-Nelson M D, Nikolau B J. 2018. Two distinct domains contribute to the substrate acyl chain length selectivity of plant acyl-ACP thioesterase [J]. Nature Communication, 9(1): 860. doi: 10.1038/s41467-018-03310-z.
Kachroo A, Shanklin J, Whittle E, Lapchyk L, Hildebrand D, Kachroo P. 2007. The Arabidopsis stearoyl-acyl carrier protein-desaturase family and the contribution of leaf isoforms to oleic acid synthesis[J]. Plant Molecular Biology,63(2):257-271. doi:10.1007/s11103-006-9086-y.
Kazaz S, Miray R, Lepiniec L, Baud S. 2022. Plant monoun-saturated fatty acids:Diversity,biosynthesis,functions and uses [J]. Progress in Lipid Research, 85: 101138. doi: 10.1016/j.plipres.2021.101138.
Kilaru A, Cao X, Dabbs P B,Sung H J,Rahman M M, Thrower N, Zynda G, Podicheti R, Ibarra-Laclette E, HerreraEstrella L, Mockaitis K, Ohlrogge J B. 2015. Oil biosynthesis in a basal angiosperm: Transcriptome analysis of Persea americana mesocarp [J]. BMC Plant Biology, 15: 203. doi:10.1186/s12870-015-0586-2.
Kim D, Langmead B,Salzberg S L. 2015. HISAT: A fast spliced aligner with low memory requirements [J]. Nature Methods,12:357-360. doi:10.1038/nmeth.3317.
Liu Y Z,Ge Y,Zhan R L,Lin X E,Zang XP,Li Y X,Yang Y, Ma W H. 2020. Molecular markers and a quality trait evaluation for assessing the genetic diversity of avocado landraces from China[J]. Agriculture, 10(4): 102. doi: 10.3390/agriculture10040102.
Livak K J, Schmittgen T D. 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2-Aaa method[J]. Methods, 25 (4) : 402-408. doi: 10.1006/ meth.2001.1262.
Love M I, Huber W, Anders S. 2014. Moderated estimation of fold change and dispersion for RNA-Seq data with DESeq2 [J]. Genome Biology, 15 (12) :550. doi: 10.1186/s13059-014-0550-8.
Meyer M D, Terry L A. 2010. Fatty acid and sugar composition of avocado, cv. Hass, in response to treatment with an ethylene scavenger or 1-methylcyclopropene to extend storage life[J]. Food Chemistry, 121(4):1203-1210. doi: 10.1016/
j.foodchem.2010.02.005.
Mozaffarian D, Katan M B, Ascherio A, Stampfer M J, Willett W C. 2006. Trans fatty acids and cardiovascular disease [J]. The New Ehgland Lournal of Medicine, 61: 525-526.
doi:10.1056/NEJMra054035.
Ortiz R, Geleta M, Gustafsson C, Lager I, Hofvander P, Lofstedt C, Cahoon E B, Minina E, Bozhkov P, Stymne S.
2020. Oil crops for the future[J]. Current Opinion in Plant Biology,56:181-189. doi:10.1016/j.pbi.2019.12.003.
Ozdemir F, Topuz A. 2004. Changes in dry matter, oil content and fatty acids composition of avocado during harvesting time and post-harvesting ripening period[J]. Food Chemistry,86:79-83. doi:10.1016/j.foodchem.2003.08.012.
Ramos-Aguilar A L, Ornelas-Paz J, Tapia-Vargas L M, GardeaBejar A, Yahia E M, Ornelas-Paz J D J, Perez-Martinez J D, Rios-Velasco C, Escalante-Minakata P. 2021. Metabolomic analysis and physical attributes of ripe fruits from Mexican Creole (Persea americana var. Drymifolia) and ‘Hass' avocados [J]. Food Chemistry, 354: 129571. doi: 10.1016/j.foodchem.2021.129571.
Reboussin D M, Kris-Etherton P M, Lichtenstein A H, Li Z P, Sabate J,Matthan N R,Petersen K,Rajaram S, Vitolins M, Ford N. 2021. The design and rationale of a multi-center randomized clinical trial comparing one avocado per day to usual diet: The habitual diet and avocado trial(HAT) [J].Contemporary Clinical Trials, 110: 106565. doi: 10.1016/j.cct.2021.106565.
Rendon-Anaya M, Ibarra-Laclette E, Mendez-Bravo A, Lan T Y, Zheng C F, Carretero-Paulet L, Perez-Torres C A, Chacon-Lopez A, Hernandez-Guzman G, Chang T H. 2019. The avocado genome informs deep angiosperm phylogeny, highlights introgressive hybridization, and reveals pathogen-influenced gene space adaptation [J]. Proceedings of the National Academy of Sciences of the United States of America, 116 (34) : 17081-17089. doi: 10.1073/
pnas.1822129116.
Santos M A Z,Alicieo T V R,Pereira C M P,Ramis-Ramos G, Mendonca C R B. 2014. Profile of bioactive compounds in avocado pulp oil: Influence of the drying processes and extraction methods[J]. Journal of American Oil Chemists'Society,91(1):19-27. doi:10.1007/s11746-013-2289-x.
Schierholt A, Becker H C, Ecke W. 2000. Mapping a high oleic acid mutation in winter oilseed rape (Brassica napus L.) [J]. Theoretical and Applied Genetics, 101: 897-901. doi:10.1007/s001220051559.
Tian B, Lu T Q, Xu Y, Wang R L, Chen G Q. 2019. Identifcation of genes associated with ricinoleic acid accumulation in Hiptage benghalensis via transcriptome analysis[J]. Biotechnology for Biofuels, 12: 16. doi: 10.1186/s13068-019-1358-2.
Villa-Rodríguez J A, Molina-Corral F J, Ayala-Zavala J F, Oli- vas G I, González-Aguilar G A. 2011. Effect of maturity stage on the content of fatty acids and antioxidant activity of 'Hass' avocado[J]. Food Research International, 44: 1231-1237. doi: 10.1016/j.foodres.2010.11.012.
Xie C,Mao X Z,Huang J J,Ding Y,Wu J M,Dong S,Kong L, Gao G, Li C Y, Wei L P. 2011. KOBAS 2.0: A web server for annotation and identification of enriched pathways and diseases[J]. Nucleic Acids Research, 39(2) : 316-322. doi: 10.1093/nar/gkr483.
Yang Z L, Ji H Y, Liu D T. 2016. Oil biosynthesis in underground oil-rich storage vegetative tissue: Comparison of Cyperus esculentus ruber with oil seeds and fruits[J].Plant amp; Cell Physiology, 57 (12) : 2519-2540. doi: 10.1093/pcp/pcw165.
Yeap W C, Lee F C, Shan D K S, Musa H, Appleton D R, Kulaveerasingam H. 2017. WRI1-1, ABI5, NF-YA3 and NF-YC2 increase oil biosynthesis in coordination with hormonal signaling during fruit development in oil palm[J].
Plant Journal,91(1):97-113. doi: 10.1111/tpj.13549.
Young M D, Wakefield M J, Smyth G K, Oshlack A. 2010. Gene ontology analysis for RNA-Seq: Accounting for selection bias[J]. Genome Biology, 11: R14. doi: 10.1186/ gb-2010-11-2-r14.
Zafar S, Li Y-L, Li N N, Zhu K M, Tan X L. 2019. Recent advances in enhancement of oil content in oilseed crops [J]. Journal of Biotechnology, 301: 35-44. doi: 10.1016/j.
jbiotec.2019.05.307.
Zhang F H,Li Z,Zhou J Q, Gu Y Y, Tan X F. 2021. Comparative study on fruit development and oil synthesis in two cultivars of Camellia oleifera [J]. BMC Plant Biology,21
(3):348. doi:10.1186/s12870-021-03114-2.
Zhang S T,Zhu C,Lyu Y M,Chen Y,Zhang Z H,Lai Z X,Lin Y L. 2020. Genome-wide identification, molecular evolution, and expression analysis provide new insights into the APETALA2/ethylene responsive factor (AP2/ERF) superfamily in Dimocarpus longan Lour [J]. BMC Genomics,
21:62. doi:10.1186/s12864-020-6469-4.
(责任编辑李洪艳)
