基于转录组测序的菜心茎尖组织开花相关基因差异表达分析
2024-01-01王帷千龚泽平陈妍娜李荣华黄红弟郭少龙李光光郭培国夏岩石


摘要:【目的】基于转录组测序数据分析鉴定调控菜心抽薹开花相关的候选基因及信号通路,为今后阐明菜心抽薹 开花调控分子机制及选育不同熟性菜心品种提供理论参考。【方法】对四九-19号(早熟型)和80天油绿(晚熟型)菜心的 七叶期和现蕾期茎尖组织进行转录组测序,比较不同熟性菜心品种间及不同生长时期间的差异表达基因(DEGs),并对 其进行GO功能注释及KEGG信号通路富集分析,结合FLOR-ID和UniProt数据库筛选出不同熟性菜心参与调控抽薹开花时间的候选基因及信号通路,通过实时荧光定量PCR验证转录组数据的可靠性。【结果】菜心茎尖组织转录组测序数 据为81.93 Gb,经质控过滤后得到536679570条Clean reads,GC含量为47.24%~47.63%,Q20为97.11%~98.00%,Q30为91.97%~94.11%,平均87.98%的Clean reads比对上参考基因组。四九-19号菜心的七叶期和现蕾期间有1965个DEGs,80天油绿菜心的七叶期和现蕾期有6007个DEGs。GO功能注释结果显示,涉及分子功能的DEGs最多,主要注释为蛋白 质二聚化活性、血红素结合和四吡咯结合等;其次是生物学过程,主要注释为小分子代谢过程、脂质代谢过程和离子运 输等过程;细胞成分类别中,DEGs主要注释为核糖体、细胞器部分、染色体、核小体、蛋白质一DNA复合物和DNA包装复合体。KEGG信号通路富集结果显示,四九-19号菜心七叶期和现蕾期间的DEGs显著(Palt;0.05,下同)富集在光合生物中的碳固定及角质、木栓质和蜡生物合成等通路;80天油绿菜心七叶期和现蕾期间的DEGs显著富集在苯丙素生物合成、DNA复制和植物激素信号转导等通路。四九-19号和80天油绿菜心品种间有750个DEGs,其中16个为开花相关基 因,涉及光周期途径、自主途径、赤霉素途径、春化途径、温度途径和年龄途径等,部分开花基因在2个菜心品种中表达量 存在明显差异。实时荧光定量PCR检测结果与转录组测序结果相关性较强。【结论】菜心抽薹开花过程受到光周期途 径、自主途径和赤霉素途径等关键途径调控,同时受到春化途径、温度途径和年龄途径的影响。虽然2个不同熟性菜心 品种开花调控所涉及的途径基本相同,但开花调控途径中的基因响应不一致,导致二者开花时间存在差异。
关键词:菜心;茎尖组织;转录组;差异表达基因(DEGs);开花调控
中图分类号:S634.5
文章编号:2095-1191(2024)03-0721-12
文献标志码:A
Differential expression analysis of flowering–related genes in stem apex tissues of flowering Chinese cabbage based on trans-criptome sequencing
WANG Wei-qian1, GONG Ze-ping1, CHEN Yan-na1, LI Rong-hua1, HUANG Hong-di2, GUO Shao-long2, LI Guang-guang3, GUO Pei-guo1, XIA Yan-shi1*
(1College of Life Sciences Guangzhou University, Guangzhou/Guangdong Key Laboratory of Plant Adaptation and Molecular Design, Guangdong 510006, China; 2Guangdong Provincial Improved Variety Introduce Service Corporation, Guangzhou, Guangdong 510091, China; Guangzhou Academy of Agricultural Sciences, Guangzhou, Guangdong510308, China)
Abstract: [Objective]The purpose of the study was to analyze and identify candidate genes and signal pathways re-lated to the regulation of bolting and flowering of flowering Chinese cabbage based on transcriptome sequencing data, in order to explore the regulatory molecular mechanism of bolting and flowering of flowering Chinese cabbage and provide theoretical reference for the selection and breeding of flowering Chinese cabbage varieties with different maturity properties in the future. 【Method】 Transcriptome sequencing was performed on stem apex tissues at both seven-leaf stage and budding stage of two flowering Chinese cabbage varieties, Siju-19 (early-maturing type) and 80 Tian Youlü (late- maturing type). Differentially expressed genes (DEGs) between different maturity properties of flowering Chinese cab- bage and between different growth stages were compared. GO functional annotation and KEGG signal pathway enrich- ment analysis were conducted to analyze DEGs. Candidate genes and signal pathways involved in the regulation of bolting and flowering time of flowering Chinese cabbage with different maturity properties were selected by integrating FLOR-ID and UniProt databases. The reliability of transcriptome data was verified through real-time fluorescence quantitative PCR.【Result】Transcriptome sequencing data of flowering Chinese cabbage stem apex tissues was 81.93 Gb, and 536679570 clean reads were obtained after quality control filtering. The GC content ranged from 47.24% to 47.63%, with Q20 be- tween 97.11% and 98.00%, and Q30 between 91.97% and 94.11%. On average, 87.98% of the data were aligned to the reference genome. A total of 1965 and 6007 DEGs were identified in Siju-19 and 80 Tian Youlü during the seven-leaf stage and the budding stage, respectively. GO functional annotation results revealed that the majority of the DEGs were as- sociated with molecular function, mainly annotated as protein dimerization activity, heme binding and tetrapyrrole bin- ding. Followed by biological process, which was mainly annotated as small molecule metabolic process, lipid metabolic process and ion transport. In the cellular component category, the DEGs were mainly annotated as ribosomes, organelles part, chromosomes, nuclesome, protein-DNA complexes and DNA packaging complexes. The results of KEGG signal pathway enrichment analysis showed that DEGs of Sijiu-19 flowering Chinese cabbage were significantly enriched (Pad 0.05, the same below) in photosynthetic organisms pathways such ascarbon fixation , cutin, suberin and wax biosynthe- sis. DEGs of 80 Tian Youlü flowering Chinese cabbage were significantly enriched in pathways such as phenylpropanoid biosynthesis, DNA replication and plant hormone signal transduction during the seven-leaf stage and the budding stage.There were 750 DEGs between Sijiu-19 and 80 Tian Youlü, 16 of which were flowering-related genes, involving the pho- toperiod pathway, autonomous pathway, gibberellin pathway, vernalization pathway, temperature pathway and age path- way. Some flowering-related genes showed obvious differences in expression between the two flowering Chinese cabbage varieties. The results of real-time fluorescence quantitative PCR were strongly correlated with those of transcriptome se- quencing. 【Conclusion】The bolting and flowering process of flowering Chinese cabbage is regulated by key pathways such as the photoperiodic pathway, autonomous pathway and gibberellin pathway, while it is also affected by vernaliza-tion pathway, temperature pathway and age pathway.The pathways involved in the flowering regulation of two flowering Chinese cabbage varieties of different maturity are fundamentally consistent. However, the inconsistent gene responses in the flowering regulatory pathway leads to the differences in flowering time between the two flowering Chinese cabbage varieties.
Key words: flowering Chinese cabbage; stem apex tissues; transcriptome; differentially expressed genes (DEGs) ; flowering regulation
Foundation items: Guangdong Natural Science Foundation (2019A1515011587) ; Guangdong Special Project for Rural Revitalization Strategy (2022-NPY-03-001) ; Guangzhou Science and Technology Plan Project(202102010414)
0 引言
【研究意义】菜心(Brassica campestris L.ssp. chinesis var. utilis Tsen et Lee)是十字花科芸薹属芸 薹种白菜亚种中的一个变种,主要以花薹为食用部 分(Liu et al.,2021),因其口感脆嫩、营养丰富,深受 大众喜爱,是华南地区栽培面积最广和产量最高的 特色蔬菜,在全国各地均有栽培(原远等,2018)。菜 心的抽薹开花是指茎尖从叶丛中生长出薹茎直至现 蕾开花的过程。菜心茎尖在2~3片真叶时开始花芽 分化,其组织中大量开花调控基因特异表达。不同 菜心品种的花薹分化始期和速度均存在差异,根据 抽薹开花时间的不同,菜心品种可分为早熟、中熟和 晚熟3种类型,其发育进程则按早、中、晚熟性依次 推迟。因此,不同熟性菜心的茎尖分化时期存在差 异,从而造成抽薹开花时间的早晚(关佩聪等,2005)。抽薹开花是菜心产品器官形成的主要过程, 是菜心重要的农艺性状。根据生产季节、地域环境 和耕作制度,选择适宜的菜心品种,可有效避免菜心 先期抽薹而造成的经济损失,更好地保证菜心的产 量和品质(Jung and Muller,2009)。因此,开展菜心 抽薹开花时间性状的研究,分析调控抽薹开花时间 早晚的分子机制、挖掘调控抽薹开花的相关基因、制 定符合花期的栽培计划,对提高菜心产量和选育优 质菜心品种具有重要意义。【前人研究进展】植物开 花时间的早晚属于数量性状,受多基因控制,在拟南 芥中发现300多个相关基因参与开花调控(Bouché et al.,2016)。同时,植物开花也受到外界环境影响, 与遗传因素共同形成了自主途径、年龄途径、赤霉素 途径、光周期途径、春化途径、温度途径和糖信号途 径等多个途径(Srikanth and Schmid,2011)。菜心与拟南芥同属十字花科,亲缘关系密切,对菜心开花调控机制的研究一般以拟南芥为参照。菜心开花无需 低温春化诱导,对光照也不敏感,一年四季均可开花 (张帅威等,2023)。肖旭峰等(2008,2010,2017)从菜心克隆获得BrcuFLC、BrcuFRI、BrcuFCA和Brcu-HAC1等多个基因,并进行了表达分析,推测菜心的 开花调控不属于春化途径,很可能属于自主开花途 径。Huang等(2017)对1个早熟菜心品种苗期、现 蕾期和开花期3个时期茎尖组织进行转录组分析, 结果发现菜心的薹茎发育和开花时间受到激素信号 转导和细胞周期相关基因的调控,其中赤霉素途径 和年龄途径可能是调控抽薹开花的关键途径。陶鹏 等(2020)研究发现,菜心BcFLC1基因的SNP变异与选择性剪接造成FLC1蛋白发生变异,使得FLC1 抑制开花功能失常,这可能是菜心不需低温诱导,极 易提早开花的原因之一。苏蔚等(2020)研究发现, 15℃低温处理菜心幼苗能使菜心叶片和茎尖中 BcSOCI基因的相对表达量升高,植株提前开花。岳智臣等(2020)研究发现,菜心光敏色素B基因(BcPHYB)5'端非编码区(UTR)的InDel变异和选择 性剪接可能是导致其对光周期不敏感的原因。周贤 玉等(2022)研究发现,与光照处理12h相比,光照处理16h可使菜心抽薹平均提前1d,开花提前5d,且 早熟品种对光照的反应较中晚熟品种敏感。李桂花 等(2023)对菜心F2代群体进行QTL分析,预测到4个与开花时间相关的QTL区域,筛选获得3个候选基因(Bra004125、Bra004162和Bra004165),通过赤 霉素途径、光周期途径和自主途径调控菜心的开花 时间。【本研究切入点】菜心抽薹开花的分子机制较 为复杂,可能通过多种途径调控,且不同熟性菜心的 调控机制存在差异,但目前鲜见有关不同熟性的菜 心茎尖组织转录组测序及其开花相关基因差异表达 分析的研究报道。【拟解决的关键问题】选择2个不 同熟性的菜心品种对七叶期和现蕾期的茎尖组织进 行转录组测序,比较2个生长时期茎尖组织中的差 异表达基因(DEGs),并对其进行GO功能注释及KEGG信号通路富集分析,筛选出参与调控菜心抽薹开花的相关基因及信号通路,结合FLOR-ID和 UniProt数据库筛选出调控不同熟性菜心抽薹开花 时间的候选基因,通过实时荧光定量PCR验证转录 组数据的可靠性,为今后阐明菜心抽薹开花调控分 子机制及选育不同熟性菜心品种提供理论参考。
1材料与方法
1.1试验材料
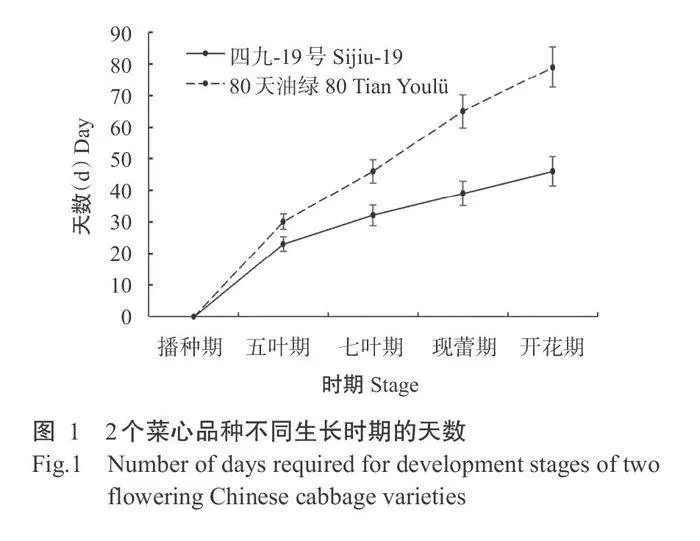
选用四九-19号和80天油绿2个菜心品种作为试验材料,其中四九-19号为早熟型菜心品种,80天 油绿为晚熟型菜心品种,其不同生长期如图1所示。
1.2试验方法
1.2.1菜心种植及采样
选取四九-19号和80天 油绿菜心的优质种子播种于穴盘中,待发芽长至2 片真叶时进行盆栽,置于广州大学温室大棚进行种 植,温度控制在22~30℃,光源为自然光,采用常规 水肥管理和病虫害防治。
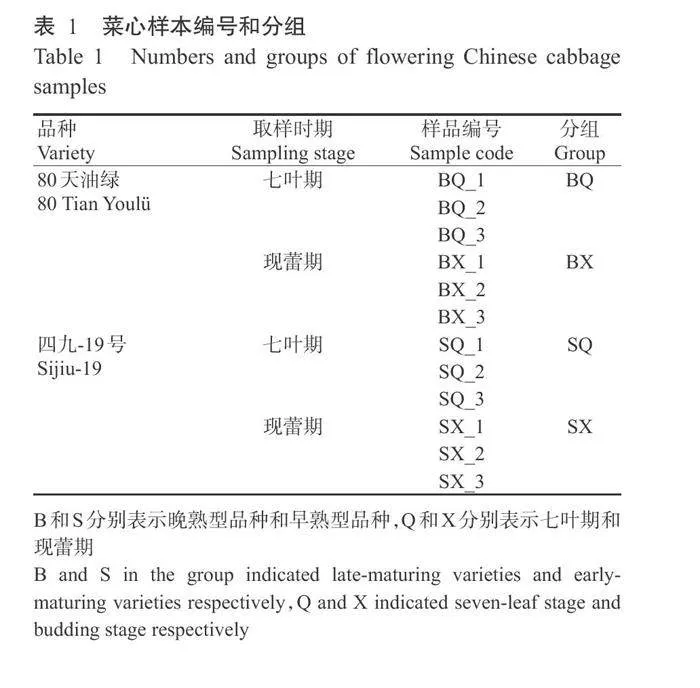
参照Huang等(2017)的采样方法,分别于七叶 期和现蕾期采取2种菜心的茎尖组织(从上往下截 取5mm),立刻放入液氮中速冻,随后放入-80℃冰 箱保存备用,每组样品设3个重复(表1),共12个样 本,送至北京诺禾致源科技有限公司进行RNA提取、质控、建库及IIlumina测序工作。
1.2.2数据质控及比对
使用fastQC过滤掉原始 数据中带有接头的序列、含有未知碱基的序列及低质量的序列(Chen et al.,2018),然后从BRAD数 据库(http://brassicadb.cn)获取白菜基因组(Brara Chiifu_V3.5)序列,以其为模板使用HISAT2软件构 建参考基因组的索引,并将过滤后的序列与参考基 因组进行比对,得到Mapped reads(Mortazavi et al.,2008)。
1.2.3菜心茎尖组织的差异表达分析
使用DESeq2 对2个不同生长期菜心的茎尖组织转录组进行差异 表达分析(Ander and Huber,2010),2个菜心品种均 以七叶期为对照组,现蕾期为试验组,四九-19号和 80天油绿的对比组合分别为BQvs BX和SQvs SX,使用Benjamini和Hochberg的方法引入错误发 现率(False discovery rate,FDR)对假设检验的P进 行校正,从而控制假阳性比例(Young et al.,2010)。 以|log2Fold Change|gt;1.00和FDRlt;0.05为阈值进行DEGs筛选,其中Fold Change表示2个对比组合间 表达量的差异倍数。
1.2.4DEGs的GO功能注释及KEGG信号通路富集分析
采用clusterProfiler软件对筛选得到的显著DEGs进行GO功能注释分析(Ashburner et al.,2000;Yu et al.,2012)和KEGG信号通路富集分析(Kanehisa and Goto,2000)。
1.2.5开花相关基因的差异表达分析
利用开花互作数据库(FLOR-ID,http://www.phytosystems.ulg.ac.be/florid/)中拟南芥调控开花的基因信息,对2个 生长时期茎尖组织DEGs的GO功能注释信息进行 检索筛选,并结合UniProt数据库(https://www.uni-prot.org/)进行BLAST比对分析,鉴定早熟型和晚熟型菜心参与开花调控的基因类型及相关途径,并根 据基因表达热图分析开花相关基因在四九-19号和 80天油绿菜心在2个生长时期间的表达模式。
1.2.6实时荧光定量PCR验证为验证
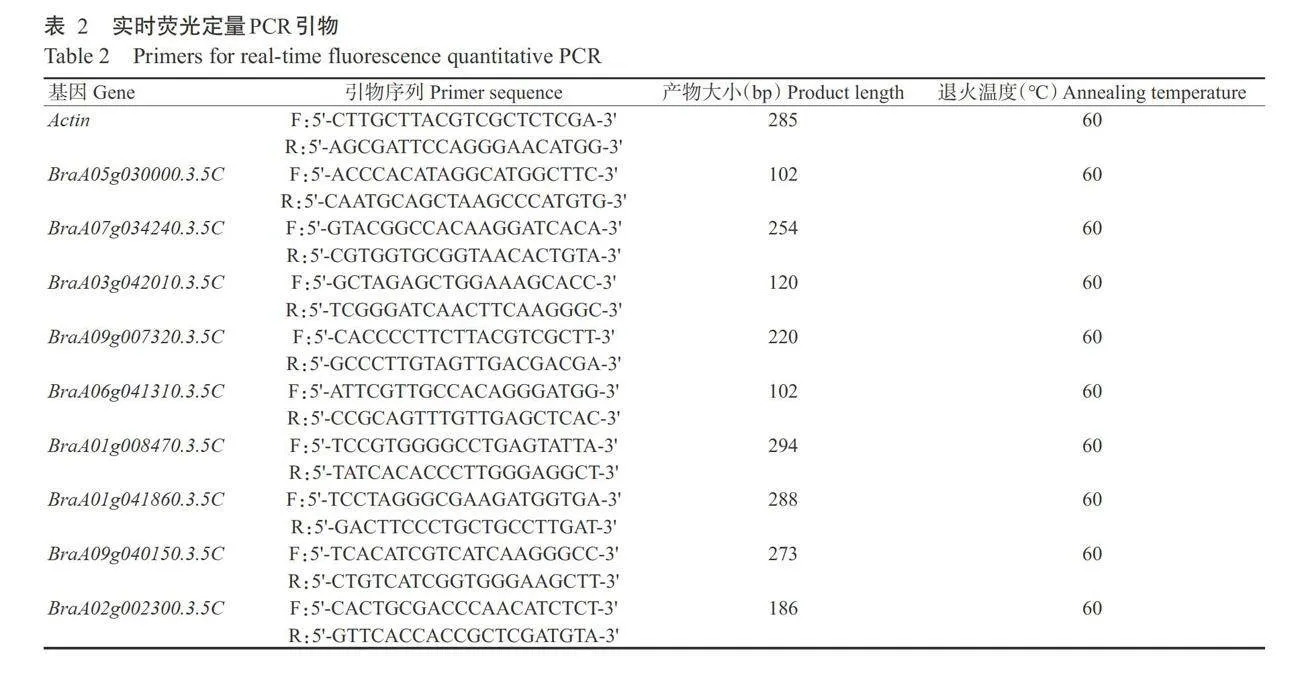
转录组数 据的可靠性,从2个菜心品种的转录组中选取9个 关键基因进行实时荧光定量PCR检测,包括4个上调的DEGs(BraA03g042010.3.5C、BraA09g007320.3.5C、BraA06g041310.3.5C和BraA02g002300.3.5C),2个下调的DEGs(BraA05g030000.3.5C和BraA07g034240.3.5C),3个表达无差异的基因(BraA01g041860.3.5C、BraA09g040150.3.5C和BraA01g008470.3.5C),以Actin为内参基因,每个样品进行3次重复。采用Primer Premier6.0设计引物(表2),均由广州伯 信生物科技有限公司合成。扩增程序:95℃预变性 10min;95℃10s,60℃20s,72℃20s,进行40个10min;95℃10s,60℃20s,72℃20s,进行40个 循环。采用2-AAc法计算相对表达量。
2结果与分析
2.1转录组测序数据统计
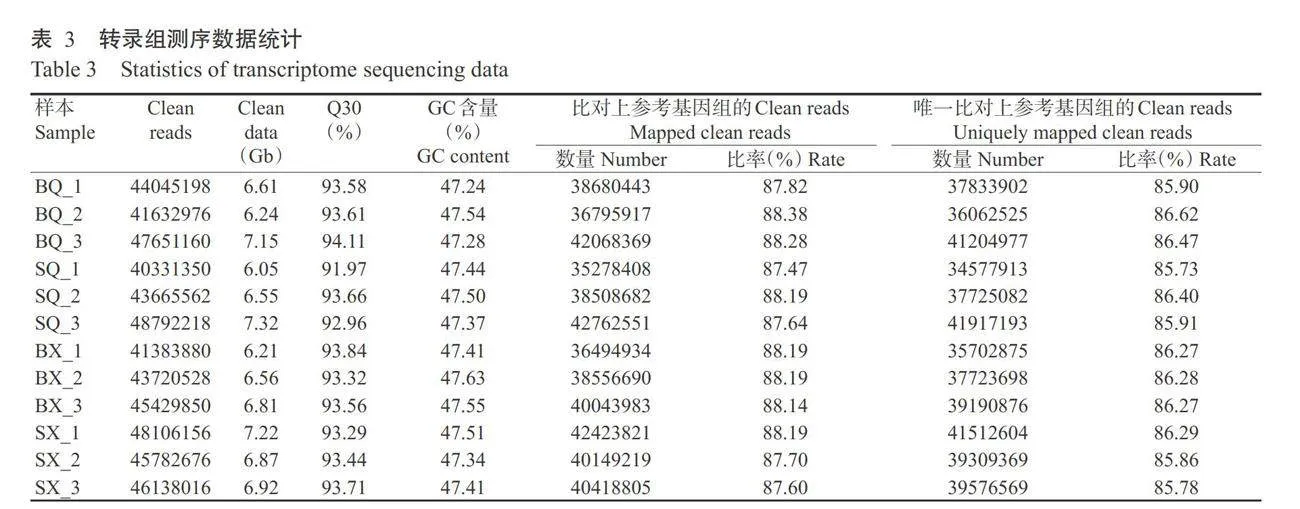
2个菜心品种七叶期和现蕾期的12个样本经转 录组测序后共获得81.93Gb数据,经质控过滤后得 到536679570条Clean reads,各样本的Clean data平均达6.71Gb。所有样本的GC含量为47.24%~47.63%,FDR均在0.03,Q20为97.11%~98.00%,Q30为91.97%~ 94.11%(表3),说明本研究转录组测序质量符合试 验要求,可进行后续生物信息学分析。
分别将各样品的Clean reads与白菜基因组 (Brara_Chiifu_V3.5)进行序列对比及定位,结果显示,87.47%以上的Clean reads能准确定位,平均比 对率达87.98%,表明参考基因组合适,样本未受外源 物种的污染。进一步分析唯一比对到基因组的Clean reads在基因组区域的分布情况,结果显示,唯一比 对上参考基因组的Clean reads比率均在85.73%以 上,且超过95.29%的数据能映射到外显子区域, 而仅有少量序列分布于内含子区(1.73%~1.91%)和基 因间隔区(2.24%~2.85%)。
2.2不同生长时期茎尖组织的DEGs分析结果
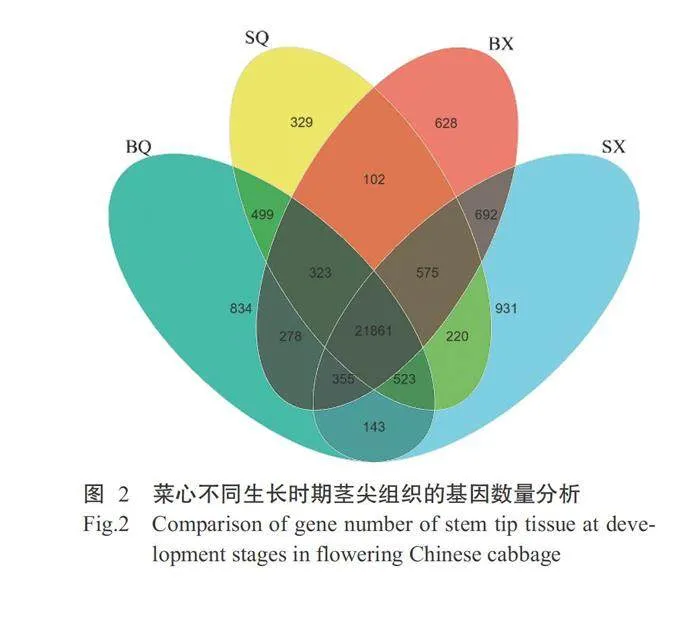
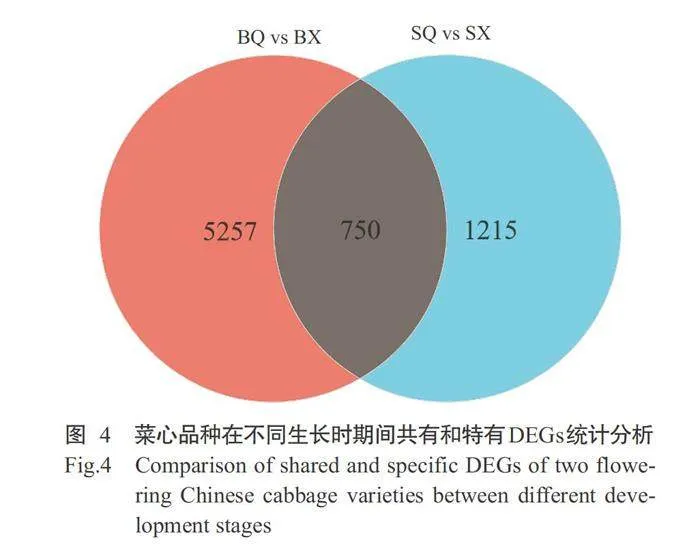
由图2可知,12个样本共鉴定到28293个基因,其中四九-19号菜心2个时期共有的表达基因23179 个,七叶期(SQ)特异表达基因1253个,现蕾期(SX) 特异表达基因2121个;80天油绿菜心2个时期共有 的表达基因23817个,七叶期(BQ)特异表达基因1999个,现蕾期(BX)特异表达基因1997个。根据筛选条件FDRlt;0.05且|log2Fold Change|gt;1.00,筛选同一品种的2个生长时期间的DEGs,结果如图3所示。与七叶期相比,四九-19号菜心品种 的现蕾期有1965个DEGs,其中1208个DEGs上调表达,757个DEGs下调表达;80天油绿菜心品种的现蕾期有6007个DEGs,其中2750个DEGs上调表达,3257个DEGs下调表达。2个菜心品种间共有750个DEGs(图4)。2个菜心品种在不同生长时期的基因 表达水平存在明显差异,80天油绿菜心现蕾期与七 叶期的DEGs数量(6007个)明显高于四九-19号菜心(1965个),且下调表达的DEGs数量(3257个)明显多于上调表达的DEGs(2750个)。推测不同熟性 菜心品种在生长过程中存在不同功能基因调控其生 长发育过程,这些在不同时期特定的表达基因及其 表达模式的改变,导致2个早晚熟菜心品种间发育 时间存在差异。
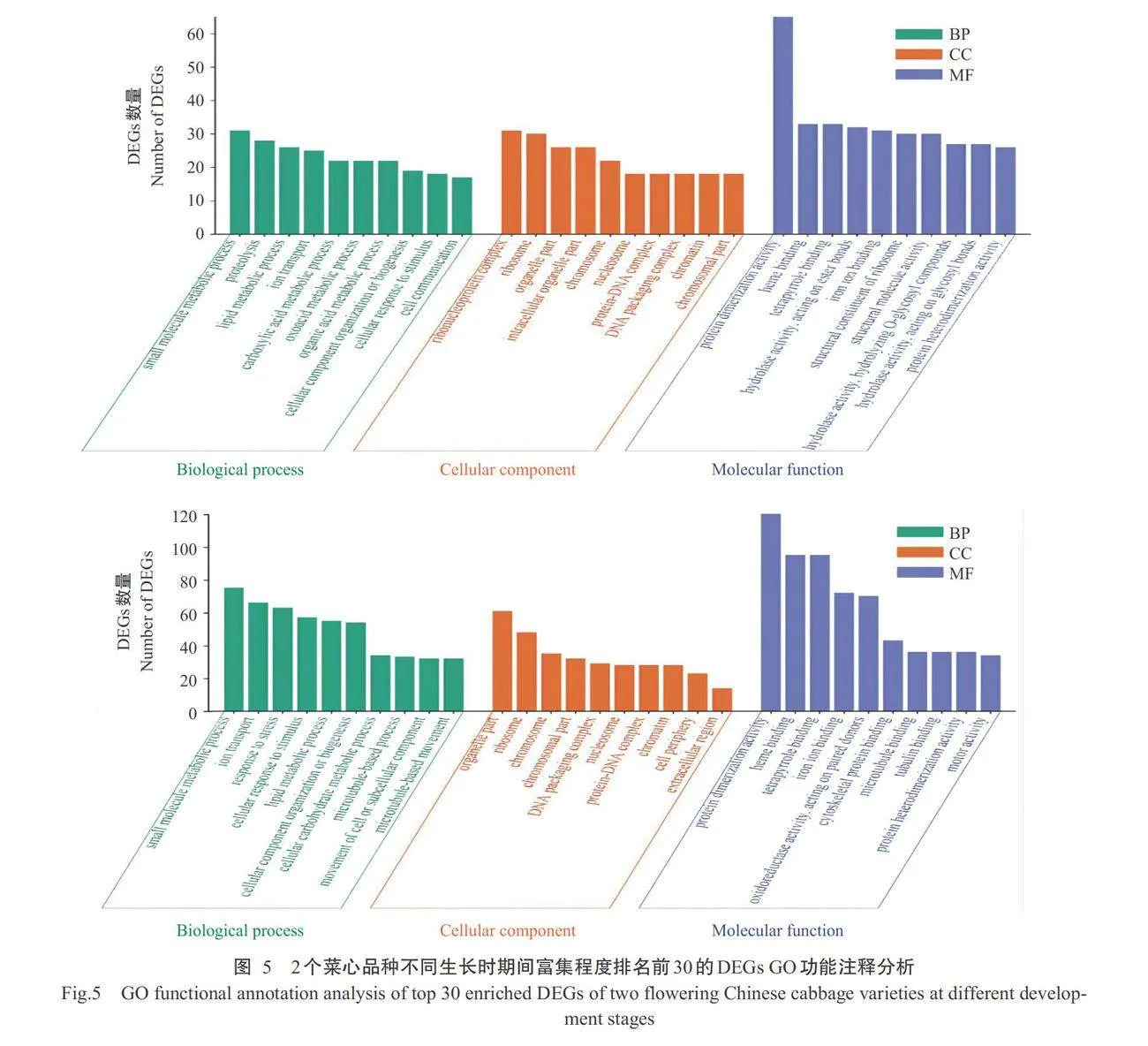
2.3DEGs的G0功能注释分析结果
对四九-19号和80天油绿菜心在2个生长时期间(SQvs SX和BQ vs BX)的DEGs进行GO功能注释分析,结果如图5所示。SQvs SX共有1632个DEGs 得到注释,包括1111个上调基因和521个下调基因;BQvs BX共有4532个DEGs得到注释,包括2300个上调基因和2232个下调基因。SQ vs SX和BQ vsBX这2个对比组的注释结果具有较高的相似性,均以涉及分子功能的DEGs最多,分别占DEGs的 52.21%和53.80%;其次是生物学过程,占比分别为32.72%和33.98%;注释为细胞成分的DEGs占比 最少,分别为15.07%和12.22%。分子功能类别中, DEGs主要注释为蛋白质二聚化活性(Protein dime- rization activity)、血红素结合(Heme binding)、四吡 咯结合(Tetrapyrrole binding)、铁离子结合(Iron ion binding)和蛋白异二聚化活性(Protein heterodimeri- zation activity)等功能。生物学过程类别中,DEGs 主要注释为小分子代谢过程(Small molecule meta-bolic process)、脂质代谢过程(Lipid metabolic pro- cess)、离子运输(Ion transport)、细胞成分组织或 生物发生(Cellular component organization or bioge- nesis)、细胞对刺激的反应(Cellular response to stimulus)等方面。细胞成分类别中,DEGs主要注释 为核糖体(Ribosome)、细胞器部分(Organelle part)、 染色体(Chromosome)、核小体(Nucleosome)、蛋白 质—DNA复合物(Protein-DNA complex)和DNA包装 复合体(DNA packaging complex)等方面。综上可知,2个菜心品种在2个生长时期的DEGs主要富集在蛋白质、脂质和DNA等分子的合成及代谢上,表 明菜心在发育过程中均需要大量的物质积累作为基 础,并通过对刺激的响应进一步诱导花薹分化。
2.4DEGs的KEGG信号通路富集分析结果
对四九-19号和80天油绿菜心在2个生长时期
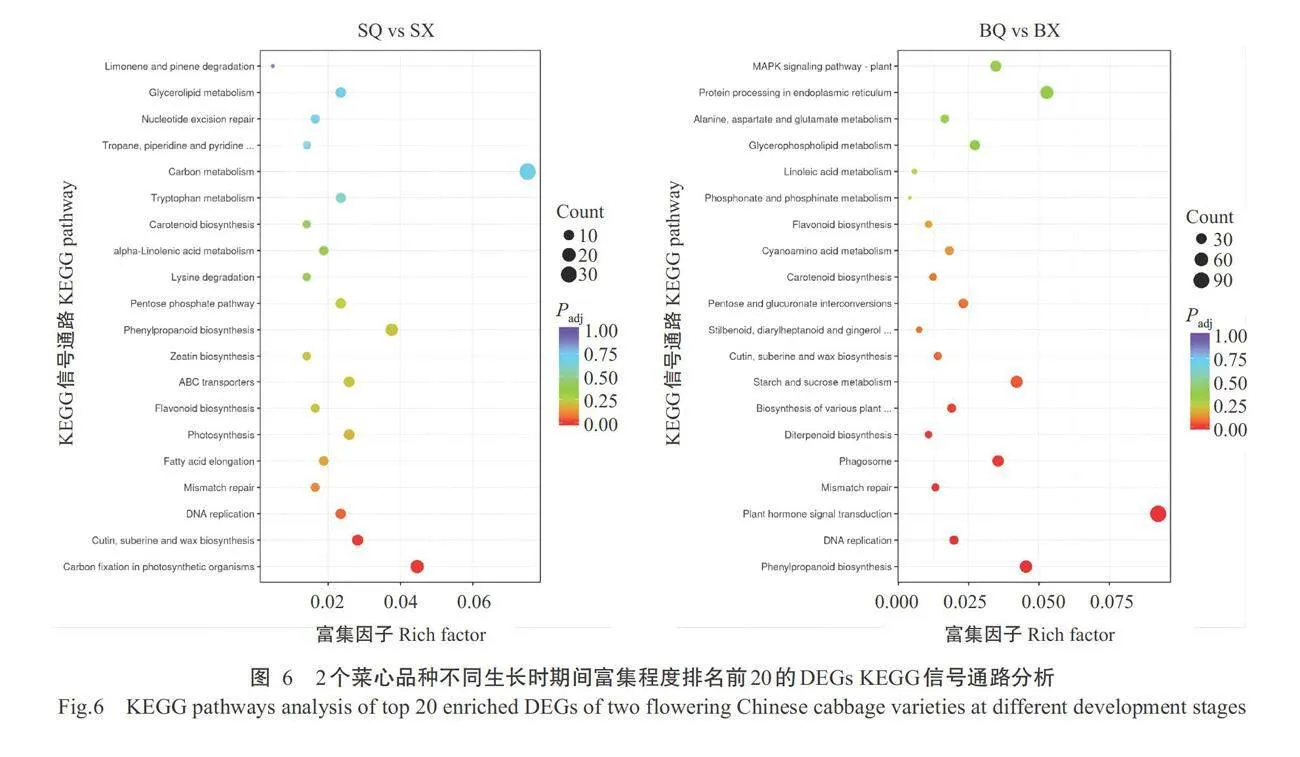
间(SQvs SX和BQvs BX)的DEGs进行KEGG信号 通路富集分析,结果显示,SQvsSX对比组中有426个DEGs在KEGG数据库中富集在118个通路,其中显著(Paalt;0.05,下同)富集的通路仅2条,分别是光合 生物中的碳固定(Carbon fixation in photosynthetic organisms)及角质、木栓质和蜡生物合成(Cutin,suber- ine and wax biosynthesis)。BQ vs BX对比组中有 1212个DEGs在KEGG数据库中富集在124个通 路,其中显著富集的通路共8条,分别是苯丙素生物合成(Phenylpropanoid biosynthesis)、DNA复制(DNA replication)、植物激素信号转导(Plant hormone sig-nal transduction)、错配修复(Mismatch repair)、吞噬 体(Phagosome)、二萜生物合成(Diterpenoid biosyn- thesis)、多种植物次生代谢产物的生物合成(Biosyn- thesis of various plant secondary metabolites)及淀粉 和蔗糖代谢(Starch and sucrose metabolism)等。综 上可知,2个菜心品种在发育过程中所涉及的通路存 在差异,表明二者在七叶期到现蕾期的分化出现明 显差异,这2个时期是菜心发育的关键。
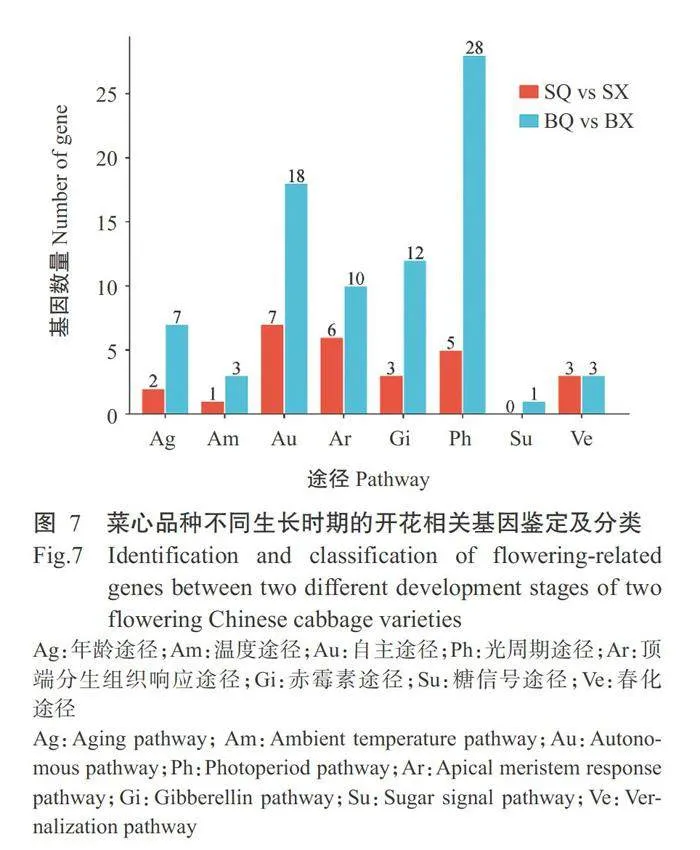
2.5开花相关基因的差异表达分析结果
利用FLOR-ID和UniProt数据库对四九-19号和80天油绿菜心2个生长时期间(SQvs SX和BQvsBX)的DEGs进行开花相关基因鉴定,分别筛选到27和82个DEGs,均主要集中在自主途径、光周期途 径、赤霉素途径和顶端分生组织响应途径等(图7), 其中16个开花相关基因在2个菜心品种中均显著差异表达,涉及7个途径(表4)。参与自主途径的相关基因 AGL6(AGAMOUS-LIKE 6)、SRO1(SIMILAR TO RCD ONE 1)和HDA5(HISTONE DEACETYLASE 5) 各1个,温度途径相关基因PIF4(PHYTOCHROMEINTERACTING FACTOR4)1个,春化途径相关基因AGL19(AGAMOUS-LIKE 19)1个,赤霉素途径相关 基因有GA2OXI(GIBBERELLIN20-OXIDASE1)2个、 FPF1(FLOWERING PROMOTING FACTOR 1)1个, 光周期途径相关基因COL9(CONSTANS-LIKE 9)1个,年龄途径相关基因SPL5(SQUAMOSA PROMOTERBINDING PROTEIN-LIKE 5)1个,顶端分生组织响应途径相关基因AGL8(AGAMOUS-LIKE 8)3个、 SOCI (SUPPRESSOR OF OVEREXPRESSION OF CO 1)2个、AP1(APETALA1)1个。
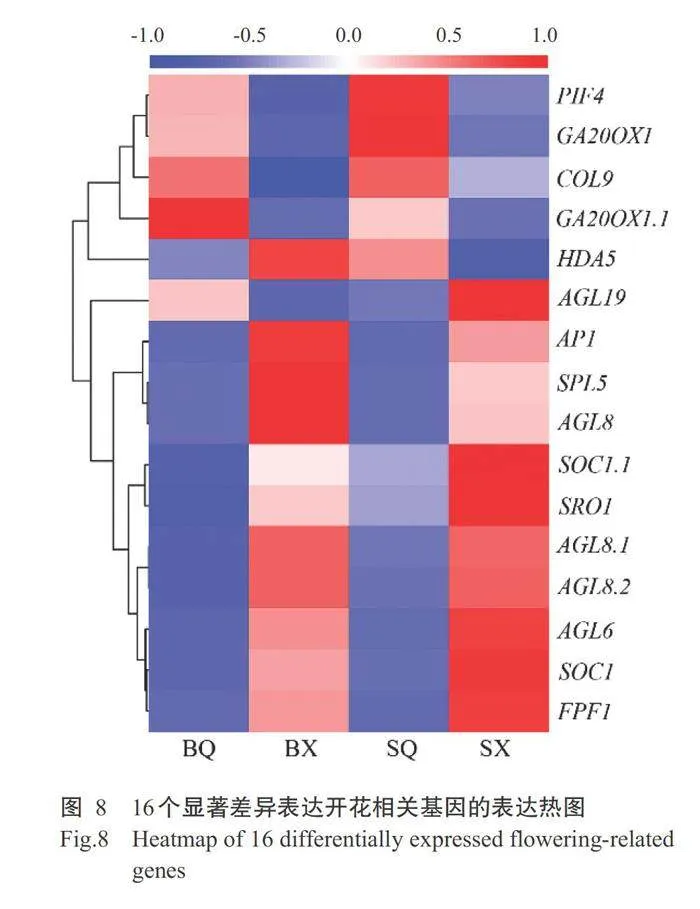
16个开花相关基因在四九-19号和80天油绿菜 心2个生长时期间的表达热图如图8所示。光周期 途径中关键基因COL9(BraA01g042590.3.5C)在 2个菜心品种中均为下调表达,尤其在80天油绿菜 心中大幅下调。自主途径中MADS-box家族成员AGL6基因(BraA05g005280.3.5C)和ADP-核糖基转移酶基因SRO1(BraA05g009670.3.5C)均为上调表达,但2个基因在四九-19号菜心2个生长时期的上调幅度 均高于80天油绿菜心。组蛋白去乙酰化酶基因 HDA5(BraA02g044690.3.5C)在四九-19号菜心中下 调表达,而在80天油绿菜心则相反,为上调表达。 春化途径中AGL19基因(BraA01g013660.3.5C)亦属于MADS-box家族,该基因在两个菜心品种中表达 模式相反,在四九-19号菜心中为上调表达,而在80天 油绿菜心中为下调表达。温度途径中PIF4基因(BraA03g022590.3.5C)编码bHLH转录因子,该基 因在2个菜心品种均为下调表达,但在四九-19号菜 心中2个生长时期的表达量均高于80天油绿菜 心。赤霉素途径中2个赤霉素氧化酶基因GA2OXI(BraA02g025510.3.5C和BraA07g042540.3.5C)表达模式一致,均为下调表达。开花促进因子FPFI基因(BraA06g033500.3.5C)在2个菜心品种中均为上调 表达,尤其在四九-19号菜心现蕾期中的表达量更 高。年龄途径中SPL5基因(BraA05g032940.3.5C)编码SBP-box转录因子,该基因在2个菜心品种中均 为上调表达,尤其在80天油绿菜心中大幅上调。顶端分生组织响应途径相关基因又称为开花时间整合 子,可整合各个途径的开花信号。本研究检测到的2个SOCI(BraA03g023930.3.5C和BraA05g005290.3.5C)、3个AGL8(BraA02g044610.3.5C、BraA09g006900.3.5C和BraA03g044400.3.5C)和1个AP1(BraA02g019540.3.5C)基因的表达模式均一致,为上调表 达,且在2个品种间的表达量相近。这些基因在2个 菜心品种中的表达模式基本相同,且大部分基因均 为上调表达,表达量均较高,表明这些基因在菜心抽 薹开花过程中起重要调控作用,同时自主途径、赤霉 素途径、光周期途径、春化途径、年龄途径、温度途径和顶端分生组织响应途径均参与菜心开花调控。
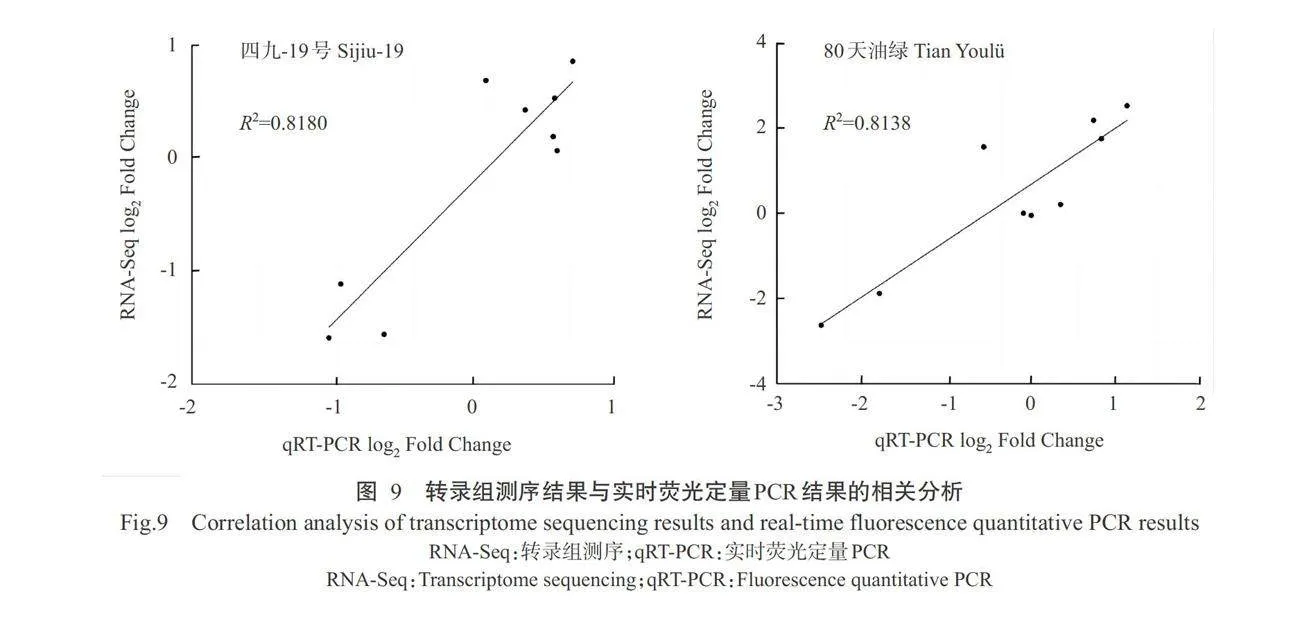
2.6实时荧光定量PCR验证结果
为验证转录组测序数据的可靠性,利用实时荧 光定量PCR验证9个DEGs在2个熟性菜心品种2个 生长时期间的表达差异。四九-19号和80天油绿菜 心的转录组测序结果与实时荧光定量PCR结果的 相关分析结果如图9所示。相关指数(R2)分别为 0.8180和0.8138,均大于0.8000,表明转录组测序结 果与实时荧光定量PCR结果的相关性较强,证实了本研究转录组测序数据的可靠性。
3讨论
植物抽薹开花的机制相当复杂,其本身基因的 表达对抽薹开花的时间和成功与否至关重要。目 前,在白菜、油菜和甘蓝等芸苔属作物中均已鉴定出 大量调控开花的相关候选基因,但对菜心抽薹开花 的分子生物学研究相对较少。因此,本研究利用转 录组测序技术对2种不同熟性菜心的开花相关基因 的表达模式进行分析,结果发现SQvs SX和BQvsBX对比组分别筛选出1965和6007个DEGs,并鉴定出16个开花相关基因,且发现CCT、MYB、K-box、TCP和bHLH等与开花相关的转录因子也差异表达。GO功能注释和KEGG信号富集分析结果显示,菜心在 发育过程中需以光合作用和碳水化合物代谢为基 础,并伴随多种次生代谢产物的合成及蛋白质、糖 类、脂质和有机酸等分子的合成、加工及代谢。张雨 萌等(2017)研究发现,菜心在七叶期快速生长,生物 量迅速积累,现蕾后增长最快。结合本研究结果可 知,七叶期和现蕾期是影响菜心分化的关键时期,菜 心通过响应光周期、温度等环境因素结合激素诱导下游基因表达及其他转录因子调控茎尖向开花转 变。大量研究表明,菜心开花调控主要是光周期途 径、自主途径和赤霉素途径(肖旭峰等,2010;周贤 玉,2022;李桂花等,2023)。本研究筛选出的DEGs也 富集到这些通路,同时还参与其他通路的调控。
光周期是影响抽薹开花的重要环境因素,光信 号由光敏色素和隐花色素等受体感知后,经生物钟 节律组件处理形成昼夜节律,可调控光周期途径关键基因CO(CONSTANT)(Yanovsky and Kay,2001)。COL9是CO的同源基因,在功能上高度保守,处于 光周期途径下游和节律钟的中心地位,可直接促进整合基因FT(FLOWERING LOCUS T)表达,以促进开花(Suarez-Lopez et al.,2001;Imaizumi and Kay, 2006)。刘栓桃等(2014)研究发现,光敏色素PHYB 是光周期途径中抑制CO表达的关键开花抑制因 子,而光周期不依赖型大白菜的光敏色素PHYB基 因的启动子和5'UTR的InDel均与早花性状相关联; 岳智臣等(2020)研究也发现,菜心BcPHYB基因5'UTR亦存在InDel和选择性剪接,但本研究中早熟 和晚熟菜心中COL9基因均为下调表达且表达量相 当,推测这是菜心对光周期不敏感的原因之一,同时 存在其他调控机制影响菜心开花。另外,在筛选到 的开花相关基因中,响应光周期的基因总数较多,且 在早熟和晚熟菜心中存在明显不同,特别是涉及生 物钟节律组件。周贤玉等(2022)研究也发现,不同 菜心品种对光周期的反应存在差异,早熟菜心对光 周期较晚熟菜心敏感,表明内源节律差异会影响菜 心对下游基因表达的调控。虽然菜心对光周期不敏 感,但温度等外界环境的改变也会影响光周期途径 相关基因的表达,菜心如何响应光周期并调控下游 基因表达,还有待深入研究。
自主途径是由FCA、FLD、FVE、FLK、FPA、FY和 LD等多个基因平行独立地调控开花抑制基因FLC (FLOWERING LOCUS C),从而促进开花(Michaels and Amasino,2001)。Xiao等(2015)研究发现,菜心中自主途径关键基因BrcuFCA、BrcuFLD和BrcuFVE 的空间表达模式相似,且在花中表达量最高。肖旭 峰等(2017)研究也发现,菜心自主途径中组蛋白乙 酰化转移酶基因BruHAC1表达量的升高与花形态 建成同步,推测菜心开花调控的主要途径可能是自 主途径。AGL6基因一方面可通过对FLC基因所在 的染色体进行修饰,从而抑制其表达表达,另一方面 可直接促进整合子FT表达(Yoo et al.,2011);SRO1基因编码ADP-核糖基转移酶,其突变会造成晚花表 型(Teotia and Lamb,2009);HDA5基因编码去乙酰化酶可抑制FLC基因表达(Luo et al.,2015)。本研 究AGL6基因和SRO1基因在2个不同熟性菜心现蕾 期的表达量均明显高于七叶期,而HDA5基因在早 熟菜心中下调表达,在晚熟菜心中上调表达,从而导 致FLC基因在早熟和晚熟菜心中的表达量存在差 异,影响开花时间,说明自主途径在菜心开花调控过 程中发挥重要作用。
赤霉素是成花的关键激素,对菜心茎尖进行 赤霉素处理,可使其提前抽薹开花,赤霉素可快速下调开花关键抑制基因SVP(SHORT VEGETATIVEPHASE)的表达,亦可上调SOCI基因的表达,从而 促进成花基因LFY(LEAFY)的表达(Blazquez and Weigel,2000;Song et al.,2019)。本研究从2个不同熟性菜心中均筛选到2个GA2OX1基因,其作为关键氧化酶可调节内源赤霉素含量的稳态(Rieu et al.,2008),以及开花促进因子基因FPFI,其参与赤霉素依赖性反应,从而调节茎尖开花能力(Kania et al., 1997),表明赤霉素途径参与菜心开花调控。
温度是影响开花的另一个重要环境因素,与其 他十字花科植物不同的是,菜心对温度适应范围较 广,属于非春化需求型蔬菜,无需低温诱导即可开 花,但低温处理可促使菜心提前开花(苏蔚等,2020)。 本研究挖掘到AGL19基因,属于春化反应支路相关 酶基因,其作为开花的强激活剂在春化途径中独立 于FLC,经低温诱导激活后可直接激活成花基因 LFY表达以促进开花(Schönrock et al.,2006)。此外,Song等(2019)研究发现,春化处理菜心可显著提高 茎尖赤霉素合成酶基因的表达,提高赤霉素含量以 促进开花,说明春化途径并非菜心开花调控的关键 途径,但春化作用可改变赤霉素途径相关基因的表 达量以影响菜心抽薹开花时间。此外,本研究还筛选到温度途径相关基因PIF4和年龄途径相关基因 SPL5,均可激活多个整合子,以诱导开花。
植物中的多条开花途径最终汇集到开花整合子 中,SOCI作为关键整合子,受FT基因在日照下CO信号的诱导,同时受FLC基因的负调控、赤霉素激活 诱导以及多个途径基因直接调控,并密切参与花形 态建成、花器官发育和花分生组织特异性分化等 (Lee and Lee,2010)。SOC1基因将上游的信号传递给花分生组织基因AGL8和API后,协同作用以启 动花的发育(Mandel and Yanofsky,1995)。本研究筛选到的多个SOC1、AGL8和API基因均为上调表达,其中SOC1基因在早熟菜心2个生长时期中的表 达量明显高于晚熟菜心,说明这些基因是菜心开花 调控所必需,且SOCI可促进菜心提早开花。此外, 本研究还发现,四九-19号菜心和80天油绿菜心2个 生长时期所特有的开花相关基因主要集中在光周期 途径、自主途径和赤霉素途径等,这些途径对菜心 开花调控期关键作用,与肖旭峰等(2017)、李桂花 (2023)的研究结果一致。菜心开花调控过程中,各 途径之间如何共同协作组成系统的调控网络,各途 径之间交汇处基因表达量的改变如何影响对下游基因表达的调控以及其他与环境有关的途径如何相互 作用,有待深入研究。
4结论
菜心抽薹开花过程受到光周期途径、自主途径 和赤霉素途径等关键途径调控,同时受到春化途径、 温度途径和年龄途径的影响。虽然2个不同熟性菜 心品种开花调控所涉及的途径基本相同,但开花调 控途径中的基因响应不一致,导致二者开花时间存 在差异。
参考文献(References):
关佩聪,刘厚诚,陈日远,罗冠英.2005.菜薹(菜心)生长动态 与花茎形成[J].中国蔬菜,(2):16-18.[Guan P C,Liu H C, Chen R Y, Luo G Y. 2005. The growth and flowering stalk formation of Brassica campestris L. ssp. Chinensis (L.) Makino var. utilis Tsen et Lee[J]. China Vegetables,(2):16-18.] doi: 10.3969/j.issn.1000-6346.2005.02. 006.
李桂花,符梅,罗文龙,骆善伟,郭巨先.2023.菜薹抽薹时间、 开花时间QTL定位及候选基因分析[J].中国农学通报,39(13):19-24. [Li G H,Fu M,Luo W L,Luo S W,Guo J X. 2023. QTL Mapping and candidate gene analysis for bolting and flowering time of flowering Chinese cabbage [J]. Chinese Agricultural Science Bulletin, 39 (13) : 19-24.]
doi: 10.11924/j.issn.1000-6850.casb2022-0330.
刘栓桃,张志刚,李巧云,王淑芬,赵智中,卢金东,张晓燕,徐 文玲,刘贤娴,付卫民.2014.光敏色素B基因(PHYB)启
动子突变及与大白菜开花时间的关联分析[J].农业生物
技术学报,22(7):853-861.[Liu ST,Zhang Z G,LiQY, Wang S F,Zhao Z Z,Lu J D,Zhang X Y,Xu W L,Liu X X, Fu W M. 2014. Association analysis between phyto- chrome B gene (PHYB) promoter mutantions and flowe- ring time in Chinese cabbage (Brassica rapa L. ssp. peki- nensis) [J]. Journal of Agricultural Biotechnology, 22(7):
853-861.] doi:10.3969/j.issn.1674-7968.2014.07.008.
苏蔚,肖柳英,孙光闻,刘厚诚,宋世威,陈日远.2020.转录因
子BcWRKY22在低温促进菜心抽薹开花中的功能分析 [J].分子植物育种,18(12):3862-3870.[Su W,Xiao LY, Sun G W, Liu H C, Song S W, Chen R Y. 2020. Function of transcriptional factor BcWRKY22 in early bolting and flowering at low temperature of Chinese flowering cabbage [J]. Molecular Plant Breeding, 18 (12) : 3862-3870.] doi: 10.13271/j.mpb.018. 003862.
陶鹏,赵彦婷,钟新民,岳智臣,雷娟利,李必元.2020.菜心 BcFLCI的SNP变异与选择性剪接[J].分子植物育种,
18(22):7429-7435. [Tao P,Zhao Y T,Zhong X M, Yue Z C, Lei J L, Li B Y. 2020. SNP variation and alternative splicing of BcFLC1 of Chinese flowering cabbage[J]. Molecular Plant Breeding,18(22):7429-7435.] doi: 10.13271/j.mpb.018.007429.
肖旭峰,曹必好,王勇,陈国菊,雷建军.2008.菜薹花芽分化 及BrcuFLC基因的克隆与表达[J].园艺学报,(6):827- 832. [Xiao X F, Cao B H, Wang Y, Chen G J, Lei J J.
2008. Study on flower bud differentiation and cloning and expression of BrcuFLC in Brassica campestris L. ssp.chiensis(L.) Makino var. utilis[J]. Acta Horticulturae Sini-ca, (6) : 827-832.] doi: 10.16420/j.issn.0513-353x.2008.06.010.
肖旭峰,雷建军,曹必好,陈国菊.2010.菜心BrcuFCA基因的克隆与表达分析[J].基因组学与应用生物学,29(1):31-36. [Xiao X F,Lei J J,Cao B H,Chen G J. 2010. Cloning and expression analysis of BrcuFCA of flowering Chinese cabbage [J]. Genomics and Applied Biology, 29 (1) : 3136.] doi: 10.3969/gab.029.000031.
肖旭峰,张祎,杨寅桂.2017.菜心组蛋白乙酰转移酶基因 BrcuHAC1克隆与表达分析[J].核农学报,31(12):2323- 2331. [Xiao X F,Zhang Y, Yang Y G. 2017. Cloning and expression analysis of histone acetyltransferase gene (Brcu- HAC1) in flowering Chinese cabbage[J]. Journal of Nu- clear Agricultural Sciences, 31 (12) : 2323-2331.] doi: 10.
11869/j.issn.100-8551.2017.12.2323.
原远,李光光,郑岩松,乔燕春,周贤玉,张华,雷建军.2018.基于主成分分析的菜心营养品质判定[J].南方农业学
报,49(8):1568-1574.[Yuan Y,Li G G,Zheng Y S,Qiao C Y, Zhou X Y, Zhang H, Lei J J. 2018. Evaluation of nutritional quality of Chinese flowering cabbage based on principal component analysis [J]. Journal of Southern Agri- culture, 49(8) : 1568-1574.] doi: 10.3969/j.issn.2095-1191.2018.08.15.
岳智臣,陶鹏,赵彦婷,雷娟利,李必元.2020.菜心光敏色素 B基因BcPHYB的鉴定与分析[J].分子植物育种,18(17): 5570-5575. [Yue Z C, Tao P, Zhao Y T, Lei J L, Li B Y.
2020. Identification and analysis of phytochrome B gene BcPHYB in Chinese flowering cabbage[J]. Molecular Plant Breeding, 18 (17) : 5570-5575.] doi: 10.13271/j.mpb.018.005570.
张帅威,周晓霞,梁雯雯,陈日远,宋世威.2023.菜心菜薹发 育生理研究进展[J].中国瓜菜,36(5):8-15.[Zhang S W, Zhou X X, Liang W W, Chen R Y, Song S W. 2023. Recent advances in stalk development physiology of flowe- ring Chinese cabbage[J]. China Cucurbits and Vegetables, 36(5):8-15.] doi:10.16861/j.cnki.zggc.2023.0086.
张雨萌,柴喜荣,康云艳,杨暹,毛妃凤,樊芳菲.2017.菜心的
养分吸收和分配规律研究[J].安徽农业科学,45(35):
55-59. [Zhang Y M,Chai X R,Kang Y Y,Yang X,Mao F F, Fan F F. 2017. Nutrient uptake and distribution law of flowering Chinese cabbage[J]. Journal of Anhui Agricultural Sciences, 45 (35) : 55-59.] doi: 10.13989/j.cnki.0517-6611.2017.35.018.
周贤玉,任海龙,孙艺嘉,邹集文,肖婉钰,张晶,许东林.
2022.光照时长对菜心生长特性的影响[J].中国种业,
(9):89-92. [Zhou X Y,Ren H L, Sun Y J,Zou J W,Xiao W Y, Zhang J, Xu D L. 2022. Effect of light duration on growth characteristics of flowering Chinese cabbage[J].
China Seed Industry, (9):89-92.] doi:10.19462/j.cnki.1671-895×.2022.09.042.
Anders S, Huber W G. 2010. Differential expression analysis for sequence count data[J]. Genome Biology, 11(10):R106.doi:10.1186/gb-2010-11-10-r106.
Ashburner M, Ball C A, Blake J A, Botstein D, Butler H, Cherry J M, Davis A P, Dolinski K, Dwight S S, Eppig J T,Harris M A, Hill D P, Issel-Tarver I,Kasarskis A,Lewis
S, Matese J C, Richardson J E, Ringwald M, Rubin G M, Sherlock G. 2000. Gene ontology: Tool for the unification of biology[J]. Nature Genetics,25(1):25-29. doi: 10.1038/
75556. Blazquez M A, Weigel D. 2000. Integration of floral inductive signals in Arabidopsis [J]. Nature, 404 (6780) : 889-892.
doi:10.1038/35009125.
Bouché F, Lobet G, Tocquin P, Périlleux C. 2016. FLOR-ID: An interactive database of flowering-time gene networks in Arabidopsis thaliana [J]. Nucleic Acids Research, 44(D1): 1167-1171. doi:10.1093/nar/gkv1054.
Chen S F, Zhou Y Q, Chen Y R, Gu J. 2018. fastp: An ultra-fast
all-in-one FASTQ preprocessor[J]. Bioinformatics,34(17): i884-i890. doi:10.1093/bioinformatics/bty560.
Huang X M,Lei Y L,Guan H L,Hao Y W,Liu H C,Sun G W, Chen R Y, Song S W. 2017. Transcriptomic analysis of the regulation of stalk development in flowering Chinese cabbage(Brassica campestris) by RNA sequencing[J]. Scientific Reports, 7 (1) : 15517. doi: 10.1038/s41598-017-15699-6.
Imaizumi T, Kay S A. 2006. Photoperiodic control of flowe-
ring: Not only by coincidence[J]. Trends in Plant Science, 11(11):550-558. doi:10.1016/j.tplants.2006.09.004.
Rieu I, Eriksson S, Powers S J, Gong F, Griffiths J, Woolley L, Benlloch R, Nilsson O, Thomas S G, Hedden P, Phillips A L 2008. Genetic analysis reveals that C19-GA 2-Oxidation is a major gibberellin inactivation pathway in Arabi-dopsis[J]. The Plant Cell,20(9):2420-2436. doi: 10.1105/tpc.108.058818.
Jung C, Muller A E. 2009. Flowering time control and applications in plant breeding[J]. Trends in Plant Science, 14(10):563-573. doi: 10.1016/j.tplants.2009.07.005.
Kanehisa M, Goto S. 2000. KEGG: Kyoto encyclopedia of genes and genomes[J]. Nucleic acids research, 28 (1) :2730. doi:10.1093/nar/28.1.27.
Kania T, Russenberger D, Peng S, Apel K, Melzer S. 1997. FPF1 promotes flowering in Arabidopsis [J]. Plant Cell,9(8):1327-1338. doi:10.1105/tpc.9.8.1327.
Lee J, Lee I. 2010. Regulation and function of SOC1, a flowering pathway integrator[J]. Journal of Experimental Botany, 61(9) :2247-2254. doi: 10.1093/jxb/erq098.
Liu W, Liu Y, Kleiber T. 2021. A review of progress in current research on Chinese flowering cabbage (Brassica campestris L. ssp. chinensis var. utilis Tsen et Lee)[J]. Journal of Elementology, 26 (1) : 149-162. doi: 10.5601/jelem.2020.25.4.2076.
Luo M, Tai R, Yu C W, Yang S G, Chen C Y, Lin W D, Schmidt W, Wu K Q. 2015. Regulation of flowering time by the histone deacetylase HDA5 in Arabidopsis [J]. The Plant Journal,82(6):925-936. doi:10.1111/tpj.12868.
Mandel M A, Yanofsky M F. 1995. The Arabidopsis AGL8 MADS box gene is expressed in inflorescence meristems and is negatively regulated by APETALA1 [J]. The Plant Cell,7(11): 1763-1771. doi:10.1105/tpc.7.11.1763.
Michaels S D, Amasino R M. 2001. Loss of FLOWERING LOCUS C activity eliminates the late-flowering phenotype of FRIGIDA and autonomous pathway mutations but not responsiveness to vernalization [J]. Plant Cell, 13 (4) : 935941. doi: 10.1105/tpc.13.4.935.
Mortazavi A, Williams B A, McCue K, Schaefer L, Wold B.
2008. Mapping and quantifying mammalian transcriptomes by RNA-Seq [J]. Nature Methods, 5 (7) : 621-628.doi:10.1038/nmeth.1226.
Teotia S, Lamb R S. 2009. The paralogous genes RADICALINDUCED CELL DEATH1 and SIMILAR TO RCD ONE1 have partially redundant functions during Arabidopsis development [J]. Plant Physiology, 151 (1) : 180-198.doi:10.1104/pp.109.142786.
Schönrock N,Bouveret R,Leroy O,Borghi L,Köhler,C,Gruis- sem W, Henning L. 2006. Polycomb-group proteins repress the floral activator AGL19 in the FLC-independent vernalization pathway [J]. Genes Development, 20 (12) : 1667-1678. doi:10.1101/gad.377206.
Song S W,Lei Y L,Huang X M,Su W,Chen R Y,Hao Y W.
2019. Crosstalk of cold and gibberellin effects on bolting and flowering in flowering Chinese cabbage [J]. Journal of Integrative Agriculture, 18 (5) : 992-1000. doi: 10.1016/S2095-3119(18)62063-5.
Srikanth A, Schmid M. 2011. Regulation of flowering time: All roads lead to Rome[J]. Cell Molecular Life Science, 68(12):2013-2037. doi:10.1007/s00018-011-0673-y.
Suarez-Lopez P, Wheatley K, Robson F, Onouchi H, Valverde F, Coupland G. 2001. CONSTANS mediates between the circadian clock and the control of flowering in Arabidopsis[J]. Nature,410(6832):1116-1120. doi:10.1038/35074138.
Xiao X F,Wu C J,Xu Z Y,Yang Y G,Fan S Y,Wang F. 2015. Molecular cloning, characterization and expression analysis of bolting-associated genes in flowering Chinese cabbage [J]. Genes Genomics, 37 (4) :357-363. doi: 10.1007/s13258-014-0264-z.
Yanovsky M J,Kay S A. 2001. Signaling networks in the plant circadian system[J]. Current Opinion in Plant Biology, 4(5):429-435. doi:10.1016/S1369-5266(00)00196-5.
Yoo S K,Wu X1, Lee J S,Ahn J H. 2011. AGAMOUS-LIKE 6
is a floral promoter that negatively regulates the FLC/MAF clade genes and positively regulates FT in Arabidopsis [J].
The Plant Journal,65(1):62-76. doi:10.1111/j.1365-313X.2010.04402.x.
Young M D, Wakefield M J, Smyth G K, Oshalack A. 2010. Gene ontology analysis for RNA-Seq: Accounting for selection bias [J]. Genome Biology, 11 (2) : R14. doi: 10.1186/gb-2010-11-2-r14.
Yu G C, Wang L G,Han Y Y,He Q Y. 2012. clusterProfiler:An R package for comparing biological themes among gene clusters [J]. OMICS–A Journal of Integrative Biology, 16(5):284-287.doi:10.1089/omi.2011.0118.
(责任编辑陈燕)
