柯萨奇病毒A 组16 型抗原ELISA 定量检测方法的建立与初步应用
2024-01-01张浩然姜莉刘鹏田华平刘碧云徐华曹明翔杨二霞
张浩然 姜莉 刘鹏 田华平 刘碧云 徐华 曹明翔 杨二霞
(艾美行动生物制药有限公司 江苏泰州 225300)
0 引言
手足口病(hand-foot-mouth disease,HFMD)是全球性传染病,已在全世界范围内暴发或流行[1]。我国自2008 年将其列入丙类传染病[2-3],2008—2019 年全国法定传染病疫情概况显示我国报告的HFMD 约2 248万例,平均年发病率为152/10 万,报告重症病例约16 万例,死亡超过3 600 人[4]。 柯萨奇病毒A 组16型(Coxsackievirus A16,CA16) 是引起HFMD 的主要病原体。CA16 与肠道病毒71 型(enterovirus 71,EV71)所致的HFMD 在临床上难区别, 但CA16 分布范围广,导致发病人数多,常占HFMD 发病率的60%以上[5-6],而且在近年也发生了CA16 感染导致重症的病例甚至引发死亡,例如致死性心肌炎、肺水肿等[7-9]。因此, 在已有EV71 疫苗上市的情况下, 研发针对CA16 的疫苗对预防HFMD 具有重大意义。在CA16疫苗产品工艺开发过程中,CA16 抗原含量是疫苗质量控制的关键指数。 本实验建立了CA16 抗原双抗体夹心定量ELISA 检测方法,为此过程提供了检测方法。
1 仪器与材料
1.1 仪器
AKTA pure 150 型蛋白纯化仪 (美国GE 公司);ST-36W 型全自动洗板机(上海科华公司);JCSY 型水浴锅(上海一恒公司);Multiskan 1510 型全波长酶标仪(美国Thermo 公司)。
1.2 材料
Vero 细胞和KMB17 细胞 (中国医学科学院医学生物学研究所);清洁级新西兰兔(雌性,体重3 kg,动物合格证号:SCXK(苏)2017-0001,南京青龙山动物繁殖场);CA16 抗原国家标准品(批号201507001,标示量2 000 U/mL,蛋白浓度2 μg/mL,中国药品食品检定研究院);BCA 蛋白定量试剂盒(北京康为世纪公司);Protein G 亲和层析柱(上海博格隆公司);单组分TMB 显色液(北京索莱宝公司);超滤浓缩管(100KD,美国Pall 公司);CA16 收获液(批号202103)、CA16 超滤浓缩液(批号202103)、CA16 纯化灭活液(批号202103)、CA16 原液(批号202103,2 000 U/ml)、EV71 原液(批号20210101,5 065 U/ml)、HAV 原液(批号20210303,6 400 EU/ml)、H1N1 流感病毒(批号20191009, 滴度5.25 log 每毫升细胞培养半数感染量)均来自艾美康淮生物制药(江苏)有限公司;弗氏完全佐剂、弗氏不完全佐剂、牛血清白蛋白、辣根过氧化物酶(horseradish peroxidase,HRP)均购自美国Sigma 公司。
2 方法
2.1 CA16-IgG 多克隆抗体(多抗)的制备
2.1.1 动物免疫
初免将CA16 纯化病毒液与弗氏完全佐剂等体积充分混合成乳膏状,经腋窝、背部、腹股沟皮下多点免疫新西兰兔,接种抗原剂量为4 000 U/只,每点注射0.2 mL。 初免后4 周以相同剂量与方法使用弗氏不完全佐剂加强免疫1 次。
2.1.2 血清分离与检测
兔耳缘静脉采血,分离血清,采用血清中和法监测其抗体效价。 当抗体效价较高时取兔全血,分离血清。
2.1.3 多抗纯化
按照Protein G 亲和层析产品说明书纯化免疫血清,获得多抗,将CA16-IgG 纯化液经100 KD 超滤浓缩管超滤浓缩,利用BCA 蛋白定量法测定其蛋白含量。
2.2 纯化CA16 多抗的评价
2.2.1 纯度分析
配制10%分离胶进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,银染后分析抗体纯度。
2.2.2 纯化抗体效价检测
采用ELISA 竞争法, 将抗体进行倍比系列稀释,10 μL/孔,加入HRP 标记的纯化多抗,90 μL/孔,混合后37℃孵育3 h,洗板后四甲基联苯胺显色,检测波长450 nm,参比波长630 nm,于酶标仪上读取吸光度值(A450/630nm)。 cut off 值为(阴性平均值-阳性平均值)/2。
2.3 酶标抗体的制备
采用高碘酸钠法将HRP 醛化后与纯化CA16多抗结合,使用乙二醇终止反应,使用硼氢化钠封闭多余醛基,使其还原成稳定态,利用硫酸铵沉淀后透析获得酶标抗体。
2.4 双抗体夹心ELISA 的建立
将CA16 多抗与酶标抗体进行系列稀释, 采用棋盘法确定两者最佳工作浓度,并对包被条件、封闭条件、样品稀释液、酶稀释液以及反应时间、孵育条件等进行优化,建立检测体系。
采用碳酸盐缓冲液将CA16 多抗浓缩液稀释到2.0 μg/mL,包被至96 孔酶标板上,100 μL/孔,置4℃12 h,洗板3 次,加入1.5% BSA 封闭液,置4℃12 h,洗板3 次,晾干后于箒20℃保存。
使用时将板室温平衡30 min, 加样100 μL/孔,用0.01 mol/L PBS 在板内进行对倍稀释, 设三孔阴性对照,两孔空白对照,37℃孵育2 h,洗板机洗板5次,1 min/次,300 μL/孔,拍干,加入HRP 标记的CA16多抗,100 μL/孔,37℃孵育1 h。 此CA16-IgG-HRP用酶稀释液(0.01 mol/L PBS 配制的1.5%BSA)稀释使用,经条件试验检测,稀释比例确定为1∶9 000。 洗板机洗板5 次,1 min/次,300 μL/孔,拍干,加入TMB单组分显色液,100 μL/孔,37℃孵育10 min,加入2 mol/L硫酸终止反应,50 μL/孔,10 分钟内用酶标仪读取结果,以A450/630nm作为检测结果。
2.5 方法验证
按照《中国药典》三部(2020 版)中《生物制品生物活性/效价测定方法验证指导原则》[10]的要求,对检测方法进行验证,对本试剂盒的线性、灵敏度、准确度、精密度、稳定性、专属性进行验证。
2.5.1 线性和最低检测下限
用0.01 mol/L PBS(pH 7.4)将CA16 抗原国家标准品(2μg/mL)分别稀释至90.91、45.45、22.73、11.36、5.68、2.84、1.42、0.71 ng/mL。 用建立的方法对各样品进行检测,双复孔上样,以不同浓度样品的A450/630nm和抗原含量进行线性拟合, 根据拟合直线的斜率及决定系数分析最佳线性范围,并确定最低检测下限。
2.5.2 精密度
2.5.2.1 日内精密度
使用该体系由3 位实验员于同一时间分别独立操作, 将CA16 国家标准品用0.01 mol/L PBS(pH 7.4)稀释至45.45 ng/mL(A450nm>1.0,代表强阳性)、11.36 ng/mL(A450nm=0.4~0.7,代表中阳性)、2.84 ng/mL(A450nm=0.1~0.25,代表弱阳性),用建立的方法进行测定, 计算不同浓度样品在不同操作人员间的变异系数(CV),即变异系数=标准差÷平均值×100%。
2.5.2.2 日间精密度
由3 位实验员于3 个不同时间点使用该检测体系分别独立操作,按2.5.2.1 方法稀释CA16 国家标准品,用建立的方法进行测定,计算CV。
2.5.3 准确度验证
按2.5.2.1 方法稀释CA16 国家标准品,用建立的方法进行检测, 计算实际测定值并根据理论值计算相对偏倚(RB),分析该方法的准确度。
2.5.4 特异性验证
用该方法检测流感病毒收获液、EV71 收获液、HAV 收获液,vero 细胞和KMB17 细胞裂解液等样品,分析该方法的特异性。
2.5.5 稳定性验证
将CA16 抗体包被板放于含干燥剂的铝箔袋中抽真空后置于37℃温箱,放置5 d 后测定,以-20℃保存的CA16 抗原包被板做对照,比较该保存条件下的线性、最低检测下限、特异性、精密度以分析其稳定性。
2.5.6 适用性分析
对3 批CA16 收获液、超滤浓缩液、纯化灭活液与原液进行抗原检测, 以监测CA16 抗原制备过程中的比活。
3 结果
3.1 兔抗CA16 多抗的制备及鉴定
利用血清中和的方法检测免疫前及免疫过程中的兔血清CA16 抗体效价,初免后28 d 内抗体效价相对较低, 初免28 d 进行二免后效价迅速升高,抗体效价最高达1∶20 480, 但在二免14 d 发现其有下降趋势,随即采集兔全血,分离较高效价兔血清。 利用SDS-PAGE 电泳及银染的方法检测CA16 多抗纯度,结果出现50 000 和23 000 这2 条带,无其他杂带(图1);使用超滤管对CA16-IgG 纯化液进行超滤浓缩,BCA 蛋白定量的方法测定CA16 多抗蛋白浓度为23.8 mg/mL。

图1 纯化的柯萨奇病毒A 组16 型多抗电泳图Fig.1 Electrophoretic map of purified Coxsackie virus group A type 16 polyclonal antibody
3.2 性能验证
3.2.1 线性和最低检测下限
采用建立的方法, 吸光度值与蛋白浓度拟合曲线作回归分析方程, 重复检测发现线性范围在0.71~45.45 ng/mL 之间, 与其吸光度值呈良好的线性关系,R2>0.997(图2);以阴性平均值的2.1 倍作为判定结果,其最低检测下限为2.84 ng/mL。

图2 柯萨奇病毒A 组16 型国家标准品的标准曲线Fig.2 Standard curve of national standard for Coxsackie virus group A type 16
3.2.2 精密度
计算日内精密度,高、中、低3 个浓度样品变异系数分别为3.86%、5.29%、7.83%, 均小于15%(见表1)。
表1 柯萨奇病毒A 型16 抗原ELISA 定量检测方法 (x±s)Table 1 Intraday Precision of ELISA Quantitative Detection Method for Coxsackie Virus Group A Type 16 Antigen ()
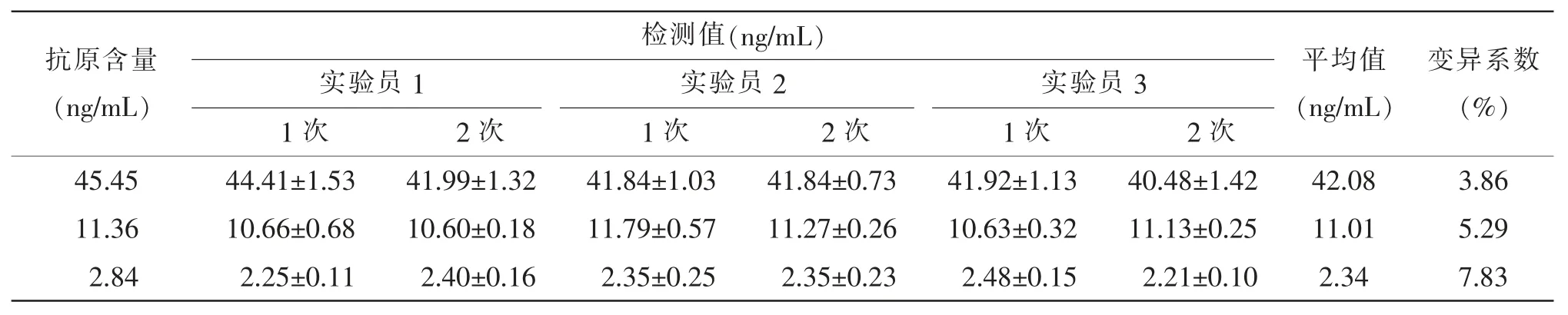
表1 柯萨奇病毒A 型16 抗原ELISA 定量检测方法 (x±s)Table 1 Intraday Precision of ELISA Quantitative Detection Method for Coxsackie Virus Group A Type 16 Antigen ()
?
计算日间精密度CV 值,在高、中、低3 个浓度样品变异系数分别为6.59%、12.55%、14.83%, 其变异系数有所上升,但同样小于15%。 表明该方法具有良好的精密度(见表2)。
表2 柯萨奇病毒A 组16 型抗原ELISA 定量检测方法的日间精度()Table 2 Daytime Precision of ELISA Quantitative Detection Method for Coxsackie Virus Group A Type 16 Antigen ()

表2 柯萨奇病毒A 组16 型抗原ELISA 定量检测方法的日间精度()Table 2 Daytime Precision of ELISA Quantitative Detection Method for Coxsackie Virus Group A Type 16 Antigen ()
?
3.2.3 准确度
如表3 所示,高、中、低3 个浓度样本的相对偏倚(RB)均不高于±12%,表明该方法准确度良好。
3.2.4 特异性试验结果
用该方法检测流感病毒收获液、EV71 收获液、HAV 收获液,vero 细胞对照和KMB17 细胞等样品,结果除CA16 收获液为阳性(A450nm大于cut off 值0.105)外,其余均为阴性,A450nm均小于0.105,表明该方法特异性良好(图3)。
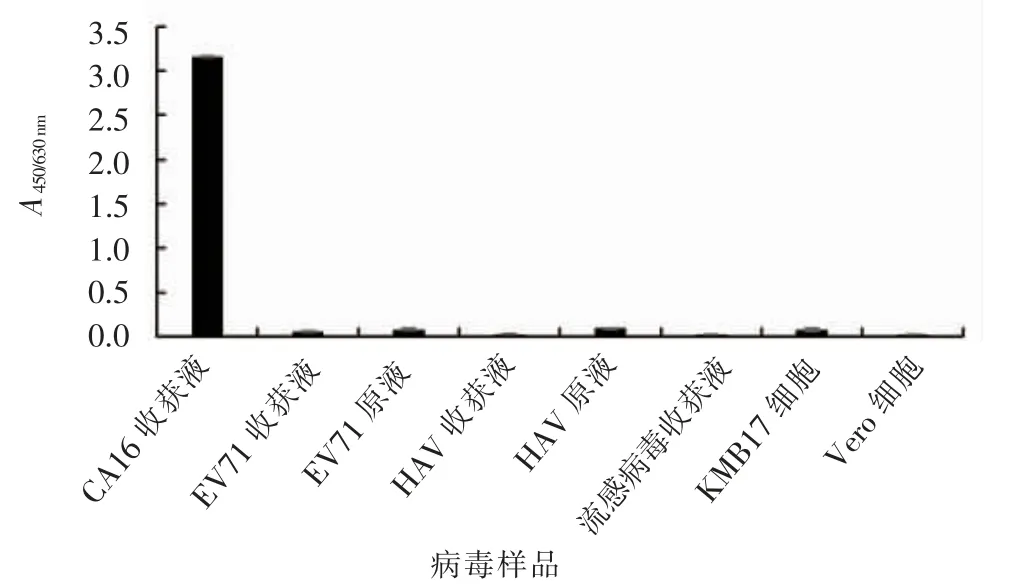
图3 柯萨奇病毒A 组16 型抗原ELISA 定量检测方法的特异性Fig.3 The specificity of the ELISA quantitative detection method for Coxsackie virus group A type 16 antigen
3.2.5 稳定性
稳定性考察结果显示决定系数为0.998; 最低检测下限有一个稀释度的浮动;特异性方面几种非CA16 的样品均为阴性;精密度检测方面高、中、低3个浓度样品日内精密度均小于15%。 证明该方法具有良好的稳定性(见表4)。

表4 稳定性试验结果Table 4 Stability Test Results
3.2.6 适用性结果
对CA16 灭活疫苗制备中的中间产物进行抗原浓度的检测,监测3 批CA16 抗原制备过程的比活,结果如图4 所示,比活持续上升,符合生产过程中比活持续升高的规律。利用该方法可指导工艺的探索,为CA16 疫苗研发奠定基础。

图4 CA16 灭活疫苗中间品的比活检测结果Fig.4 Specific Activity Test Results of Intermediate Products of CA16 Inactivated Vaccine
4 讨论
CA16 病毒与EV71 病毒是HFMD 的主要病原体[11]。 现在已有EV71 型HFMD 疫苗上市,而CA16型HFMD 疫苗均处于研发阶段[12]。在研发过程中,亟需一种特异性良好、灵敏度高、精密度、准确度及稳定性良好的检测体系。用该方法建立的体系,较好的达到了上述要求。在CA16 疫苗研发过程中,用该方法检测中间产物,用反馈回来的数据,改进工艺,为CA16 疫苗的研发奠定了基础。
在建立方法时发现抗血清效价受新西兰兔个体差异影响较大。随着免疫次数的增加,抗体效价先升后降,在二免10 天左右达到峰值后,提示需实时监测兔抗血清效价水平,取其峰值进行血清收集。
该方法在线性范围0.71~45.45 ng/mL,决定系数>0.997,即在这个范围内形成的复合物和检测抗原含量成较好的正比关系,且最低检测下限为2.84 ng/mL,体现了较高的灵敏度。综上所述,该体系建立的方法具有较高的灵敏度、精密度和稳定性。该方法能够较好的满足CA16 疫苗的研发工作, 为未来产业化发展奠定基础。
