与白蛋白结合的PSMA靶向分子[177Lu]Lu-DOTA-CPN-PSMA的制备及初步显像
2023-12-29罗田伟孙明月张文辉黄旭虎李洪玉
罗田伟,孙明月,张文辉,高 菲,王 宁,黄旭虎,陈 欢,李洪玉,*
1.原子高科股份有限公司,北京 102413;2.国家原子能机构核技术(放射性药物工程转化)研发中心,北京 102413;3.中国核工业集团有限公司 放射性药物工程技术研究中心,北京 102413
前列腺癌(prostate cancer, PCa)是男性最常见的恶性肿瘤之一,它是一种具有明显异质性的恶性实体肿瘤,起病隐匿,早期症状不明显且无特异性,但其较高的肿瘤转移性常会导致患者生存率降低,严重威胁中老年男性的健康[1-3]。国际癌症研究机构(International Agency for Research on Cancer, IARC)的统计数据显示,2020年全球前列腺癌发病率在男性所有恶性肿瘤中位居第2,死亡率占第5位,每年发病人数达到140万例,每年因患前列腺癌的死亡人数更是达到38万例[4]。我国前列腺癌患病率虽然低于欧美发达国家,但近年来也呈显著上升趋势。
前列腺特异性膜抗原(PSMA)是一种高表达于前列腺癌(PCa)的Ⅱ型跨膜蛋白,PSMA在90%以上的PCa病灶及相关的骨和淋巴结转移病灶中都高度过表达,表达水平随着肿瘤去分化程度、转移性和激素抵抗性的增加而增加,但在正常人体组织中低表达,表达水平仅为前列腺癌的1‰~1%[5-8]。
PSMA被认为是前列腺癌诊断和治疗的理想靶点,靶向PSMA的配体应具有高选择性,能够高效、靶向的与前列腺癌细胞表面的PSMA特异性结合[9-10]。谷氨酸-脲-赖氨酸(Glu-Urea-Lys)作为靶向PSMA的基团,能够高效、特异性地与PSMA结合,具有便于合成及纯化、易于连接其他分子、易溶于水、能稳定储存等特点,是近年来靶向PSMA放射性药物研究及开发的重点。PSMA-11、PSMA-617、PSMA-I&T就是基于该靶向基团的代表化合物[11-14]。
虽然靶向PSMA的配体在前列腺癌的诊断与治疗方面已取得了一定的进展[15-16],但目前仍存在一定的局限性,比如药物的生物半衰期较短,在生物体内代谢速度过快,造成肿瘤部位有效剂量较低、保留时间过短,需要使用高剂量(活度)才能达到治疗效果;此外,在肾脏、骨及唾液腺的高摄取还会引起不同程度的肾毒性、骨髓毒性及口干症等副作用,增加了不良反应的风险。为此,需要对该类药物进行持续的改进和优化,以改善药物的药代动力学特征,增强药物在肿瘤部位的摄取和滞留,进一步提高药物的有效性并降低不良反应,使其适合用作PSMA高表达肿瘤的核素治疗和显像,满足临床需求[17-19]。
研究发现,在小分子抑制剂的连接部位引入Even Blue(EB)、4-(对-碘苯基)丁酸(IP)或者4-(对-甲苯基)丁酸(CP)等白蛋白结合基团可以显著延长药物的血液循环时间,增加肿瘤摄取。2018年,文献[20-21]在PSMA-617的结构上引入了可以和白蛋白结合的基团EB,在注射到小鼠体内后,90Y和177Lu标记的 EB-PSMA-617与[177Lu]Lu-PSMA-617 相比表现出更长的血液半衰期、更高的肿瘤累积和更好的治疗效果。同年文献[22-24]报道4-(对-碘苯基)丁酸(IP)和4-(对-甲苯基)丁酸(CP)对白蛋白有很强的结合力,并能显著改善放射性药物的体内生物半衰期和肿瘤摄取。本研究拟选择1,4,7,10-四氮杂环十二烷-1,4,7,10-四羧酸(DOTA)为双功能螯合剂,以Glu-Urea-Lys为靶向基团,在抑制剂连接部位引入可以和白蛋白结合的 4-(对-甲苯基)丁酸基团及喹啉环[18],以延长靶向药物的生物半衰期,增加药物在肿瘤组织的摄取和滞留,并减少其在非靶组织的摄取。采用无载体177Lu核素进行标记,合成一种新型靶向PSMA的药物分子[177Lu]Lu-DOTA-CPN-PSMA,分别考察反应pH、反应时间、反应温度等因素对放射化学纯度的影响,确定最佳标记条件;在此基础上,对标记物的理化性质和体内生物活性进行评价,测定脂水分配系数、考察药物的体外稳定性、开展单光子发射及X射线计算机断层扫描(SPECT/CT)显像研究,并以[177Lu]Lu-PSMA-I&T为对照化合物对相关结果进行比对。
1 实验方法
1.1 材料和仪器
N6-(Fmoc)-N2-(((S)-1,5-二叔丁基-1,5-戊烷二酮)氨基甲酰)-L-赖氨酸(N6-(((9H-fluoren-9yl)methoxy)carbonyl)-N2-(((S)-1,5-di-tert-butoxy-1,5-dioxopentan-2-yl)car bamoyl)-L-lysine),纯度95%,浙江致新医药科技有限公司;Fmoc-3-(3-喹啉)-1-丙氨酸(Fmoc-3-(3-Quinolyl)-L-Ala-OH),纯度98%,吉尔生化(上海)有限公司;反式-4-(N-芴甲氧羰基氨基甲基)环己烷甲酸,纯度97%,苏州爱玛特生物科技有限公司;N-Fmoc-N′-[1-(4,4-二甲基-2,6-二氧代环己亚基)乙基]-L-赖氨酸(Fmoc-Lys-(Dde)-OH),纯度98%,吉尔生化(上海)有限公司;1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸三叔丁酯(DOTA-(0tBu)3),纯度97%,成都普康生物科技有限公司;4-(对-甲苯基)丁酸,纯度99.91%,乐研试剂。
无载体177LuCl3溶液,德国 ITM公司,放射性活度浓度40 GBq/mL,比活度3 609 GBq/mg,放射化学纯度100.0%;PSMA-I&T,浙江昂拓莱司生物技术有限公司;盐酸,赛默飞世尔科技(中国)有限公司;醋酸、醋酸钠,成都华邑药用辅料制造有限责任公司;龙胆酸,安徽山河药用辅料股份有限公司;灭菌注射用水,石家庄四药有限公司;乙腈(色谱纯),德国Merck公司;超纯水,德国Millipore纯水仪制造;异氟烷,纯度99.998%,深圳市瑞沃德生命科技有限公司。
CRC-55tW 活度计,美国Capintec公司;Vanquich Core高效液相色谱仪,默飞世尔科技(中国)有限公司;Advancebio peptide map色谱柱(φ4.6 mm×150 mm,填料粒径2.7 μm),安捷伦公司;γ-Cube/X-Cube小动物SPECT/CT影像设备,Molecubes NV公司;移液枪,Eppednorf公司;干式加热器,美国莱伯特(Labnet)公司;精密pH试纸,上海三爱思试剂有限公司;22RV1荷瘤裸鼠:由中国医学科学院医药生物技术研究所提供,采用雌性4~6周龄balb/c裸鼠(购自北京维通利华实验动物技术有限公司),右侧腋窝下接种22RV1肿瘤细胞(5×106),培养10~15 d左右待肿瘤体积达到要求,用于实验。
1.2 前体化合物DOTA-CPN-PSMA的合成和表征
1.2.1前体化合物DOTA-CPN-PSMA的合成 合成路线示于图1,具体反应步骤如下所述:
第一步:在反应器中加入CTC 树脂、化合物1、N-乙基二异丙胺(DIPEA)和N,N-二甲基甲酰胺(DMF)。将混合物鼓气3 h后,依次用三倍树脂床体积的DMF、甲醇洗涤3遍后真空抽干过夜,得到化合物2。该步收率约为62.5%。
第二步:将上述树脂加入反应器中,重新用DMF溶胀2 h。加入三倍树脂床体积的φ=20%六氢吡啶/DMF溶液鼓气30 min脱除芴甲氧羰基(Fmoc)保护基,用三倍树脂床体积的DMF洗5遍。随后加入Fmoc-3-(3-喹啉)-L-丙氨酸、2-(7-氮杂苯并三氮唑)-N,N,N′,N′-四甲基脲六氟磷酸酯(HATU)、N-甲基吗啡啉和0.5倍树脂床体积的DMF,鼓气1 h,取少量树脂进行茚三酮检测,显示阴性。将反应液滤除,用三倍树脂床体积的DMF洗涤3遍。重复脱除Fmoc以及氨基酸连接的步骤,将氨甲环酸、Lys(Dde)以及DOTA(tris tBu)接到树脂上,得到化合物3。收率接近100%。
第三步:在化合物3中加入三倍树脂床体积的φ=2%水合肼/DMF溶液,鼓气30 min后,滤除反应器内溶液,用三倍树脂床体积的DMF洗涤5遍,得到化合物4。收率为100%。
第四步:在反应器中加入2倍4-(对-甲苯基)丁酸、1.9倍HATU、4倍N-甲基吗啡啉和0.5倍树脂床体积的DMF,鼓气1 h,取少量树脂进行茚三酮检测,显示阴性。将反应液滤除,用三倍树脂床体积的DMF洗涤3遍、叔丁基甲醚洗涤3遍后真空抽干得到化合物5。收率接近100%。
第五步: 将树脂(化合物5)中加入φ=95%三氟乙酸(TFA)/水溶液,在25 ℃下搅拌3 h。过滤树脂,在滤液中加入-20 ℃的叔丁基甲醚,离心,倒掉上清液,加入叔丁基甲醚搅碎沉淀后再次离心,倒掉上清液后放入恒温干燥箱中16 h,抽干叔丁基甲醚(得到粗品)。用HPLC纯化和换盐后用冷冻干燥机冻干得到DOTA-CPN-PSMA的醋酸盐白色冻干粉(总收率为24.0%)。
1.2.2前体化合物DOTA-CPN-PSMA的表征 质谱条件:ESI正离子工作模式;循环时间为1.1 s,驻留时间0.1 s;离子源温度为120 ℃,脱溶剂温度为350 ℃;质量范围为200~2 000。色谱条件:色谱柱为安捷伦Advancebio peptide map色谱柱;流动相A为含φ=1‰TFA的超纯水,流动相B为含φ=1‰TFA的乙腈;流速为1.0 mL/min;柱温为30 ℃;检测波长为220 nm;进样量为10 μL;按表1条件进行梯度洗脱。

表1 梯度洗脱程序Table1 Gradient elution procedure
1.3 [177Lu]Lu-DOTA-CPN-PSMA标记条件的研究
[177Lu]Lu-DOTA-CPN-PSMA的结构式示于图2。为了保证药物的质量,防止其发生辐射自分解,在标记过程中加入了约1 mg的龙胆酸。
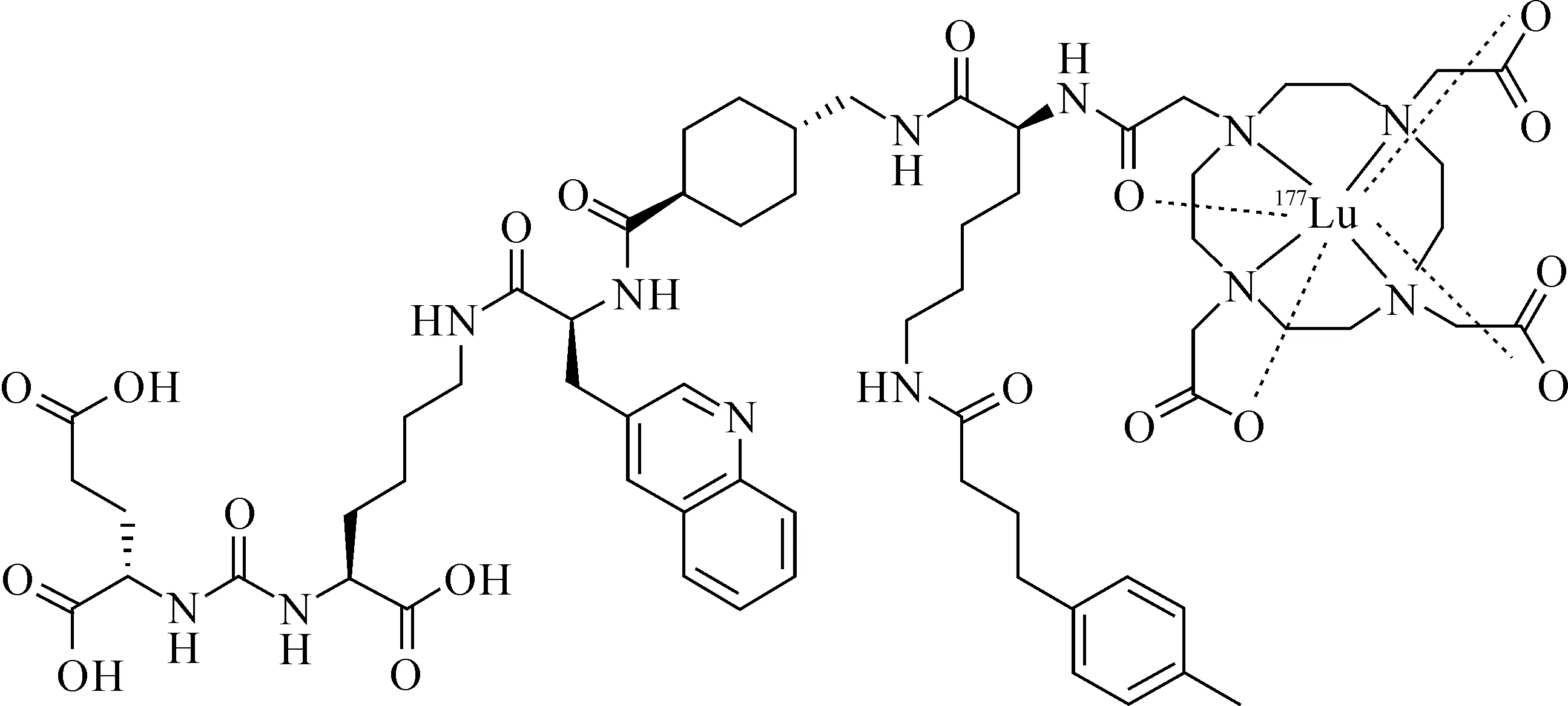
图2 [177Lu]Lu-DOTA-CPN-PSMA的结构式Fig.2 Structure of [177Lu]Lu-DOTA-CPN-PSMA
1.3.1反应体系pH的影响 取DOTA-CPN-PSMA前体,使用灭菌注射用水配制成1 g/L的溶液。移取10 μL上述溶液加入反应瓶中,随后依次加入含有龙胆酸的醋酸钠缓冲溶液、约370 MBq177LuCl3盐酸溶液和灭菌注射用水,摇匀后使用精密pH试纸测其pH值(使用醋酸钠缓冲溶液调节反应液的pH值为3.5~6.0)。将反应瓶置于干式加热器中94 ℃加热,冷却后取其溶液使用HPLC测试其放射化学纯度。
1.3.2反应温度的影响 移取10 μL PSMA溶液于反应瓶中,加入含有龙胆酸的醋酸钠缓冲溶液。随后加入灭菌注射用水和370 MBq177LuCl3盐酸溶液,摇匀后将反应瓶分别放置在室温、40、60、70、80、94 ℃加热,冷却后取其上层清液使用HPLC测试其放射化学纯度。
1.3.3反应时间的影响 移取10 μL PSMA溶液于反应瓶中,加入含有龙胆酸的醋酸钠溶液。随后加入灭菌注射用水和370 MBq177LuCl3盐酸溶液,摇匀后将反应瓶置于干式加热器中分别加热5、10、15 min,冷却后取其上层清液使用HPLC测试其放射化学纯度。
1.3.4177Lu/PSMA(mCi/μg,1 Ci=3.7×1010Bq)投料比的影响 分别移取2.5、5.0、10.0 μL PSMA溶液于10 mL西林瓶中,加入含有龙胆酸的醋酸钠溶液。随后加入灭菌注射用水和370 MBq177LuCl3盐酸溶液,使177Lu/PSMA的投料比分别为4∶1、2∶1、1∶1,摇匀后将反应瓶分别加热10 min,冷却后取其上层清液使用HPLC测试其放射化学纯度。
1.3.5[177Lu]Lu-DOTA-CPN-PSMA的质量控制 取适量样品在铅玻璃后目视观察本品外观。沾取适量样品至精密pH试纸上,立即观察试纸颜色并与比色板比较,记录pH值。放射化学纯度分析采用HPLC方法,色谱条件与前体化合物DOTA-CPN-PSMA的液相色谱条件相同,参见1.2.2节。
1.4 [177Lu]Lu-DOTA-CPN-PSMA体外稳定性的测定
[177Lu]Lu-DOTA-CPN-PSMA体外稳定性实验分别在生理盐水和牛血清两种体系中进行。生理盐水:将放射性标记物置于生理盐水中在37 ℃下分别孵育1、24、48、72 h 后,使用HPLC测定其放射化学纯度,以测定其体外稳定性;牛血清溶液:将放射性标记物置于小牛血清(BSA)溶液中,在37 ℃下分别孵育1、24、48、72 h后,使用HPLC测定其放射化学纯度。
1.5 脂水分配系数的测定
将[177Lu]Lu-DOTA-CPN-PSMA分别加入含有相同体积正辛醇和水(0.5 mL∶0.5 mL)的EP 管中,盖好后充分振荡5 min,在离心机中离心分层5 min,转速为2 000 r/min。分别取有机相和水相各100 μL于放免管中,在井型γ探测器中分别测量其放射性计数率,由有机相和水相放射性计数率的比值来计算脂水分配系数(P):
P= lg(NO/NW)
式中,NO和NW分别为有机相和水相样品的放射性计数率,s-1。重复操作3次,取平均值,计算出标记物的脂水分配系数。对照化合物[177Lu]Lu-PSMA-I&T采用同样的方法测试其脂水分配系数。
1.6 荷瘤鼠Micro-SPECT显像研究
取0.1 mL(约29.6 MBq)的[177Lu]Lu-DOTA-CPN-PSMA和[177Lu]Lu-PSMA-I&T(对照化合物)分别通过尾静脉注射到22RV1荷瘤小鼠体内。随后将用异氟烷麻醉的动物俯卧式固定在小动物SPECT和CT扫描仪上,分别在给药后1、4、24、72 h进行静态影像采集,扫描时间为20 min。扫描结束后,使用基于GPU的3D MLEM和ISRA算法分别对SPECT、CT图像进行重建,获得成像结果[25]。
2 结果与讨论
2.1 前体化合物DOTA-CPN-PSMA的结构表征
前体化合物DOTA-CPN-PSMA为白色或类白色冻干粉末或疏松块状物,相对分子质量为1 331,质谱图示于图3,其中m/z=1 332.8处为(M+H) 峰,m/z=666.4处为(M+2H)/2 峰,m/z=444.7处为(M+3H)/3峰,质谱确证合成的DOTA-CPN-PSMA结构正确。液相方法如1.3.5节所述,检测图谱示于图4,化学纯度>95%,紫外峰保留时间为 8.25 min,符合使用要求。

图3 前体化合物DOTA-CPN-PSMA的质谱图Fig.3 Mass spectrum of DOTA-CPN-PSMA
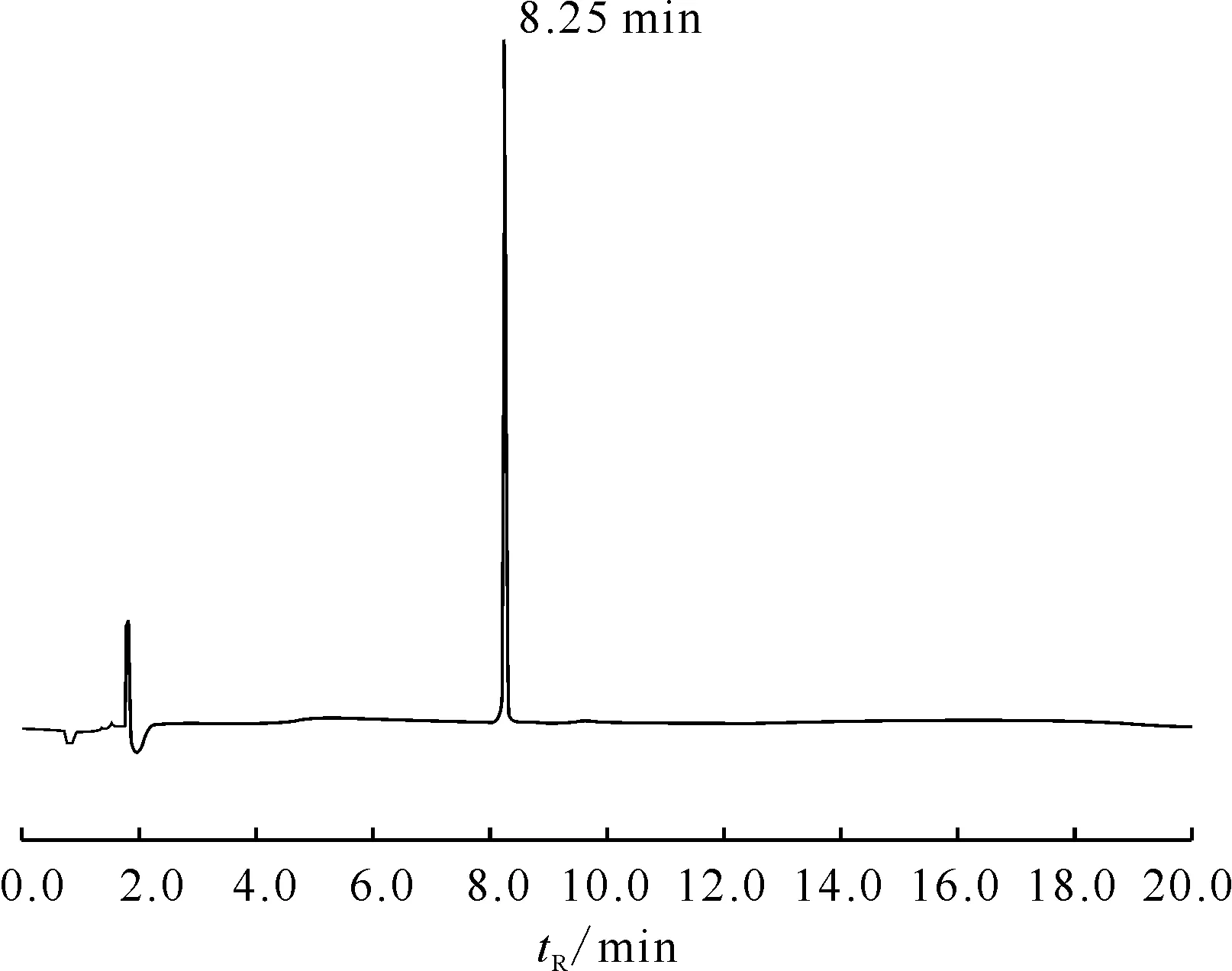
图4 前体化合物DOTA-CPN-PSMA的HPLC紫外图谱Fig.4 HPLC UV chromatogram of DOTA-CPN-PSMA
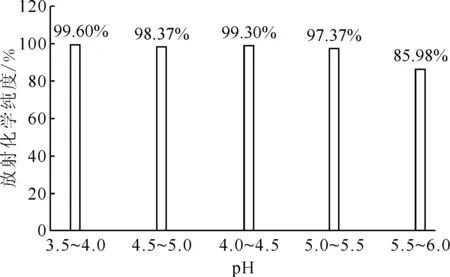
反应温度94 ℃,反应时间10 min,177Lu/PSMA(mCi/μg)投料比1∶1图5 反应pH对放射化学纯度的影响Fig.5 Influence of pH on radiochemical purity
2.2 [177Lu]Lu-DOTA-CPN-PSMA的标记条件
分别考察反应体系pH、反应温度、反应时间、177Lu/PSMA(mCi/μg)投料比等因素对放射化学纯度的影响,优化标记条件。
2.2.1反应体系pH的影响结果 在氯化镥[177Lu]配位PSMA靶向配体的过程中,反应pH将会对药物[177Lu]Lu-DOTA-CPN-PSMA的标记产生重要影响,因此必须将pH值控制在合理的范围内,pH值太小(pH<3),DOTA配体易被质子化,降低形成金属配合物的效率;而pH值太高(pH>7),氯化镥[177Lu]及产品容易形成胶体,影响产品质量。反应体系pH值对放射化学纯度的影响示于图5。图5结果表明,当反应温度为94 ℃、反应时间为10 min时,反应pH值为3.5~5.5,标记物的放射化学纯度均可达97%以上。当pH值为5.5~6.0时,放射化学纯度下降到约86%,远低于95%,不满足使用要求。因此,该反应体系pH范围为3.5~5.5。
2.2.2反应温度的影响结果 反应温度对放射化学纯度的影响示于图6。如图6所示,随着反应温度的升高,标记物的放射化学纯度逐渐升高。当反应温度为室温时,反应10 min,放射化学纯度为41%;当温度为40 ℃时,反应10 min,放射化学纯度约为81%;当反应温度高于60 ℃(60、70、80、94 ℃),同样的反应时间标记物的放射化学纯度均≥98%。因此,此体系反应温度范围较宽,为60~94 ℃。

pH=4.0~4.5,反应时间10 min,177Lu/PSMA(mCi/μg)投料比1∶1图6 反应温度对放射化学纯度的影响Fig.6 Influence of reaction temperature on radiochemical purity
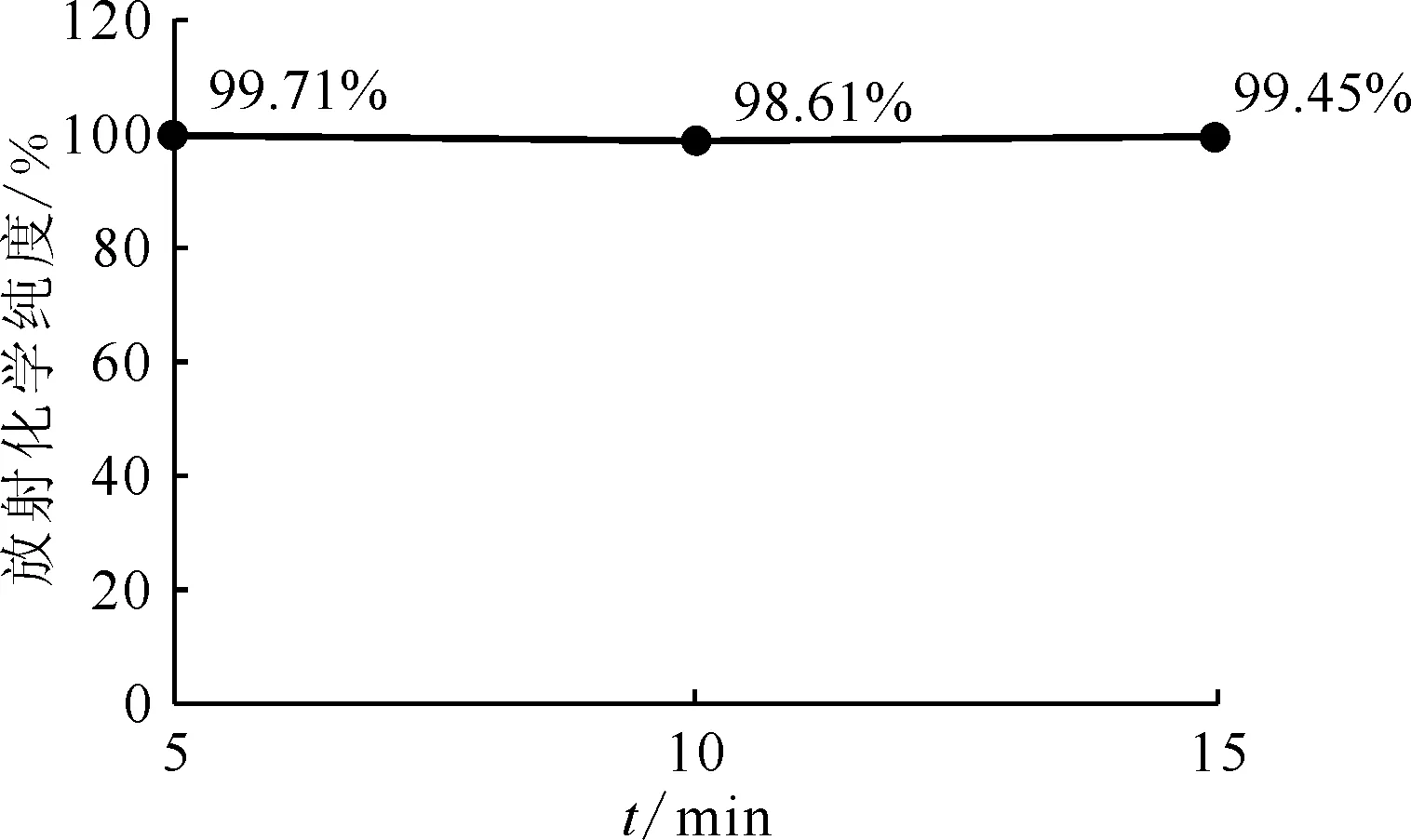
pH=4.0~4.5,反应温度70 ℃,177Lu/PSMA(mCi/μg)投料比1∶1图7 反应时间对放射化学纯度的影响Fig.7 Influence of reaction time on radiochemical purity
2.2.3反应时间的影响结果 反应时间对放射化学纯度的影响示于图7。图7结果表明,当反应pH值为4.0~4.5、反应温度为70 ℃时,反应时间在5~15 min,放射化学纯度均可达98%以上。即使在室温条件下反应,将反应时间从10 min延长到24 h后,放射化学纯度也可由41%提高到95%。
2.2.4投料比的影响结果 分别考察了177Lu/PSMA(mCi/μg)投料比分别为1∶1、2∶1、4∶1(摩尔比约为1∶10 、1∶5、1∶2.5)的情况下对放射化学纯度的影响,结果示于图8。如图8所示,当投料比分别为1∶1、2∶1时,放射化学纯度高于95%,达到98%以上;当投料比为4∶1时,放射化学纯度有所降低,下降到90.70%。
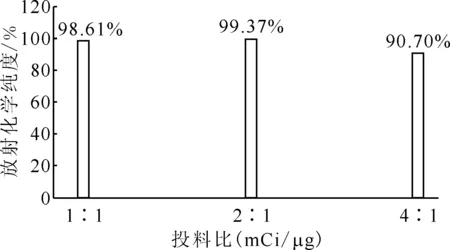
pH=3.5~5.5,反应温度60~94 ℃,反应时间为10 min图8 投料比对放射化学纯度的影响Fig.8 Influence of 177Lu/PSMA ratio on radiochemical purity
综上所述,确定了[177Lu]Lu-DOTA-CPN-PSMA的标记反应条件:在加入稳定剂的情况下,177Lu/PSMA(mCi/μg)投料比为1∶1~2∶1、反应pH值为3.5~5.5、反应温度为60~94 ℃、反应时间为5~15 min。在此条件下,产品的放射化学纯度符合要求(在95%以上)。
所制标记化合物[177Lu]Lu-DOTA-CPN-PSMA为无色澄明液体,pH为3.5~5.5,放射性比活度为3.7×1013Bq/g,放射化学纯度>95%,最高可达99%,说明制得的[177Lu]Lu-DOTA-CPN-PSMA无需使用C18小柱纯化,标记完成即可直接用于下一阶段实验。液相检测图谱示于图9。如图9所示,其放射性峰的保留时间为 8.15 min,游离177Lu3+的放射性峰保留时间为2.00 min,[177Lu]Lu-DOTA-CPN-PSMA与游离177Lu3+的放射性峰保留时间相差较大,可有效分开。
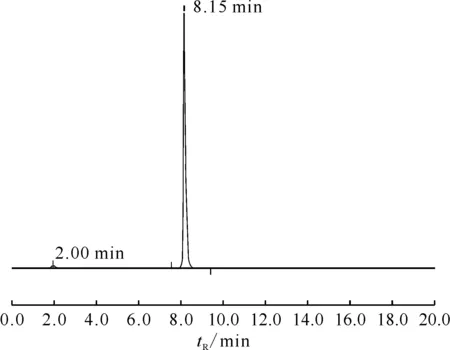
图9 标记化合物[177Lu]Lu-DOTA-CPN-PSMA的HPLC图谱Fig.9 Radio-HPLC chromatogram of [177Lu]Lu-DOTA-CPN-PSMA
2.3 体外稳定性
[177Lu]Lu-DOTA-CPN-PSMA体外稳定性在生理盐水和牛血清两种体系中进行,样品的放射性浓度为0.5 mCi/mL。37 ℃下标记物在生理盐水及牛血清中放置24 h后,放射化学纯度均有所下降,但仍大于95%;存放至72 h后,放射化学纯度均低于95%。在两种体系中[177Lu]Lu-DOTA-CPN-PSMA均可稳定存放24 h,稳定性良好。
2.4 脂水分配系数
对[177Lu]Lu-DOTA-CPN-PSMA和[177Lu]Lu-PSMA-I&T的脂水分配系数进行了检测,根据所测得的数据计算[177Lu]Lu-DOTA-CPN-PSMA的脂水分配系数为-2.02,与[177Lu]Lu-PSMA-I&T的脂水分配系数-3.15相比,具有更高的亲脂性,符合结构设计的预期。
2.5 荷瘤鼠的Micro-SPECT显像
[177Lu]Lu-DOTA-CPN-PSMA在荷22RV1前列腺癌裸鼠体内的SPECT/CT显像结果示于图10。由图10可知,[177Lu]Lu-DOTA-CPN-PSMA在荷瘤鼠体内靶向性好,在肿瘤组织中表现出放射性浓聚,说明肿瘤对[177Lu]Lu-DOTA-CPN-PSMA有高摄取。在4 h其肿瘤组织的放射性摄取达到6.2%ID/g,明显高于对照药物[177Lu]Lu-PSMA-I&T的值(2.9%ID/g)。此外[177Lu]Lu-DOTA-CPN-PSMA在肿瘤中的滞留时间长,72 h后在肿瘤组织中仍有摄取,而对照药物[177Lu]Lu-PSMA-I&T (图11)在72 h后已基本从荷瘤鼠体内完全清除,在肿瘤中也几乎没有摄取。[177Lu]Lu-DOTA-CPN-PSMA与[177Lu]Lu-PSMA-I&T一样主要通过肾脏代谢,且在肾脏中的摄取低于[177Lu]Lu-PSMA-I&T;除肿瘤组织和肾脏外,[177Lu]Lu-DOTA-CPN-PSMA在膀胱中有较高摄取,在其他组织中摄取均较低。
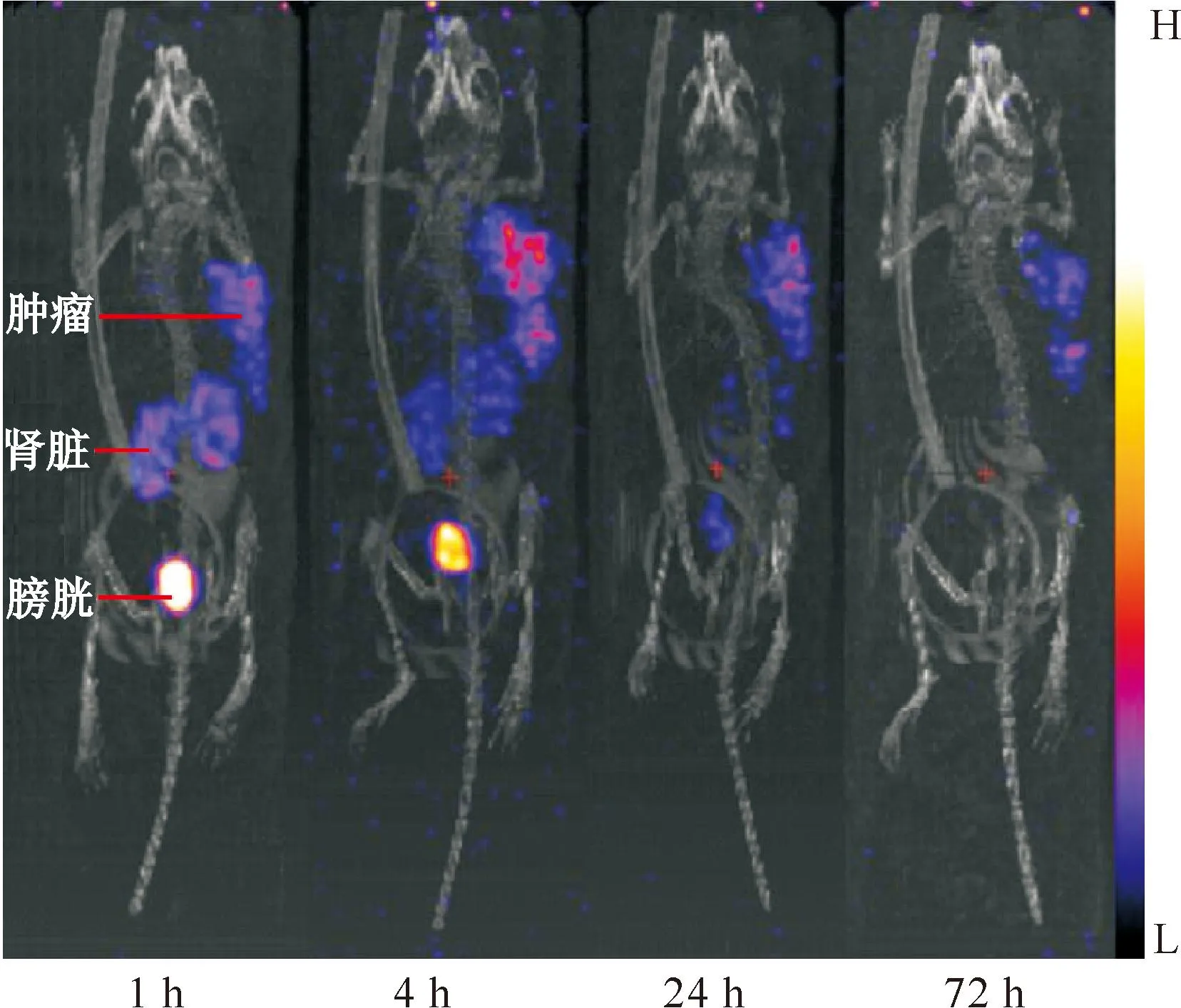
图10 荷瘤小鼠在注射[177Lu]Lu-DOTA-CPN-PSMA后的SPECT/CT显像图Fig.10 SPECT/CT images of [177Lu]Lu-DOTA-CPN-PSMA in nude mice bearing 22RV1 tumor after injection
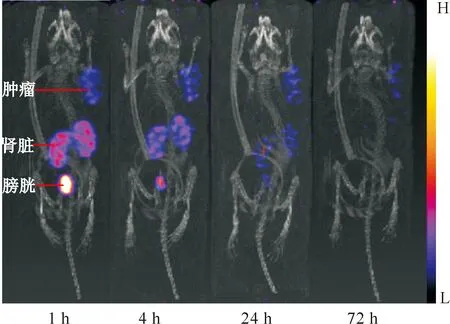
图11 荷瘤小鼠在注射[177Lu]Lu-PSMA-I&T后的SPECT/CT显像图Fig.11 SPECT/CT images of [177Lu]Lu-PSMA-I&T in nude mice bearing 22RV1 tumor after injection
显像结果表明,相较于对照药物[177Lu]Lu-PSMA-I&T,[177Lu]Lu-DOTA-CPN-PSMA表现出更好的药代动力学特征,具有更高的肿瘤摄取与滞留,更低的肾脏摄取。
3 结 论
对[177Lu]Lu-DOTA-CPN-PSMA的前体合成、核素标记、质量研究、体外稳定性、脂水分配系数及Micro-SPECT/CT显像进行了初步研究,结果表明:
(1)177Lu标记靶向PSMA配体DOTA-CPN-PSMA方法简便,反应时间短,放射化学纯度可达95%以上、最高可达99%以上,无需使用C18柱或者HPLC制备柱进行纯化;
(2) 标记物的体外稳定性较好,在生理盐水及牛血清中可以稳定存放24 h,放射化学纯度依然高于95%;
(3) [177Lu]Lu-DOTA-CPN-PSMA在荷瘤鼠体内靶向性好,滞留时间长,主要通过肾脏代谢;与目前国外正在开展临床Ⅲ期的药物[177Lu]Lu-PSMA-I&T相比,其具有更高的肿瘤摄取与滞留,而且肾脏摄取更低,提示其对肾脏的辐照毒性可能降低。
初步的研究结果表明,[177Lu]Lu-DOTA-CPN-PSMA值得作为治疗前列腺癌的候选药物开展进一步研究。
