高效液相色谱法同时测定乳酸菌发酵液中L/D-乳酸方法的建立与验证
2023-12-29陈文林刘冲于学健张露李婷姚粟
陈文林,刘冲,于学健,张露,李婷,姚粟
(中国食品发酵工业研究院有限公司,中国工业微生物菌种保藏管理中心,北京,100015)
乳酸广泛存在于人体、动植物、微生物的代谢过程,其分子骨架中羧基α位碳原子为不对称碳原子,可形成L(+)型和D(-)型2种旋光异构体。正常情况下,人体血液中乳酸主要为L-乳酸[1],其代谢成动态平衡[2],由于人体缺乏D-乳酸脱氢酶,D-乳酸代谢较慢而易在体内积累[3],当D-乳酸的产生/吸收超过消除速率,就可能在血液中积累[4],当血液D-乳酸浓度≥3 mmol/L时,则产生D-乳酸中毒,临床表现为精神错乱、嗜睡、记忆丧失、头痛和上肢运动障碍等症状[5]。乳酸代谢清除主要在肝脏及肾脏中,而婴幼儿因其肝肾功能不成熟导致对D-乳酸的代谢能力更低。人体中D-乳酸的来源主要由肠道微生物代谢产生,如Lactobacillusacidophilus,Lactobacillusfermentum,Lactobacillusdelbrueckiisubsp.lactis等微生物均可产生D-乳酸[6],食物、药物的外源性摄入[7]与丙酮醛途径代谢[3]产生的D-乳酸较少,肠道菌群的组成对D-乳酸的积累有重要影响[8],研究表明D-乳酸中毒与益生菌的摄入引起的肠道微生物群的改变有关,停用益生菌后症状得以缓解[9];并有儿童短肠综合征患者在服用含有嗜酸乳杆菌和婴儿双歧杆菌的益生菌产品后,反复出现D-乳酸中毒症状,血清D-乳酸水平高达11.4 mmol/L[10]。因此婴幼儿及肠胃消化不良人群应该选择适宜的益生菌。
联合国粮食及农业组织(Food and Agriculture Organization of the United Nations,FAO)/世界卫生组织(World Health Organization,WHO)提出一些GRAS批准菌株具有产D-乳酸的代谢活性[11],存在潜在风险。WHO也对D-乳酸摄取量进行了限制(100 mg/kg体重)。此外,CXS 72—1981《婴儿配方奶粉和婴儿专用配方奶粉标准》中指出在婴儿配方奶粉及特殊医疗目的的配方奶粉中单产L-乳酸的培养物可以被使用,并需证明在弱势群体中使用的安全性。但国内还未有法规标准对食品用菌种产D-乳酸情况提出明确限定。仅在《食品用菌种安全性评价程序(征求意见稿)》中提出直接添加到供1岁以下婴儿食用食品中的菌种,需按照国家标准规定的检验方法或其他等效方法进行D-乳酸的测定。因此食品用菌种产L/D-乳酸的检测与评价至关重要。
目前还未有适用于微生物发酵液中L/D-乳酸同时定性定量的标准检测方法,GB 1886.173—2016《食品安全国家标准 食品添加剂乳酸》采用液相色谱定性,滴定法定量,其适用范围为食品添加剂乳酸含量的测定。QB/T 5712—2022《发酵液中L-乳酸的测定酶电极法》是采用酶电极乳酸分析仪测定发酵液中L-乳酸含量,定量限为10.0 μg/mL,但不能进行D-乳酸的检测分析。ISO 8069—2005《奶粉-乳酸和乳酸盐含量的测定》,利用L-乳酸脱氢酶(L-lactate dehydrogenase,L-LDH)和D-乳酸脱氢酶(D-LDH)特异性反应,通过分光光度计可快速测定奶粉中L/D-乳酸含量,但此方法存在酶易失活、样品中内源性L-LDH与L-乳酸反应生成中产物造成实验误差的风险[12-13]。此外还有其他方法,如气相色谱法、毛细管电泳法、中和滴定法、EDTA定钙法、原子吸收光谱法等,均只能测定产品中乳酸总量不能区分其光学构型[14]。高效液相色谱法通过手性色谱柱可实现对样品中L/D-乳酸的分离,同时进行定性分析和定量检测,在测定D-乳酸时检测范围广,并具有良好的灵敏度、准确性和重复性,在微生物产D-乳酸评价具备良好应用前景[15-16]。
本研究采用高效液相色谱结合手性柱建立一种适用于乳酸菌发酵液中L/D-乳酸的定量检测方法,并对所建方法的专属性、精密度、准确性、定量限、线性范围及稳定性指标进行验证。利用该方法对乳酸菌类益生菌在特定培养条件下进行L/D-乳酸的定量检测,对不同种乳酸菌产D-乳酸情况系统分析,旨在为益生菌安全性评价等行业标准法规制定提供技术参考,对促进益生菌在食品行业更加安全和广泛的应用具有重要意义。
1 材料与方法
1.1 材料与试剂
1.1.1 实验菌株信息
实验所用菌株如表1所示,共收集18株乳酸菌菌株,包括可用于婴幼儿食品的菌株、酸奶发酵剂菌株以及自行分离自食品的菌株。
1.1.2 实验试剂
L-乳酸(色谱纯,98%纯度)、D-乳酸(色谱纯,90%纯度),Sigma公司;异丙醇,色谱纯,美国Fisher公司;甲醇(色谱纯),美国Fisher公司;CuSO4·5H2O(分析纯),国药集团化学试剂有限公司;MRS培养基、半胱氨酸盐酸盐,北京陆桥技术股份有限公司;厌氧产气袋,日本三菱化学公司。
1.2 仪器与设备
Thermo UltiMate 3000型高效液相色谱仪,ThermoFisher公司;CRS10 W手性柱(4.6 mm×50 mm,3 μm),日本三菱化学公司;微量可调移液器、小型台式冷冻离心机,德国Eppendorf公司;高压灭菌锅,日本HIRAYAMA公司;生物安全柜,新加坡ESCO公司;分析天平,梅特勒公司;隔水式培养箱,上海一恒科学仪器有限公司。
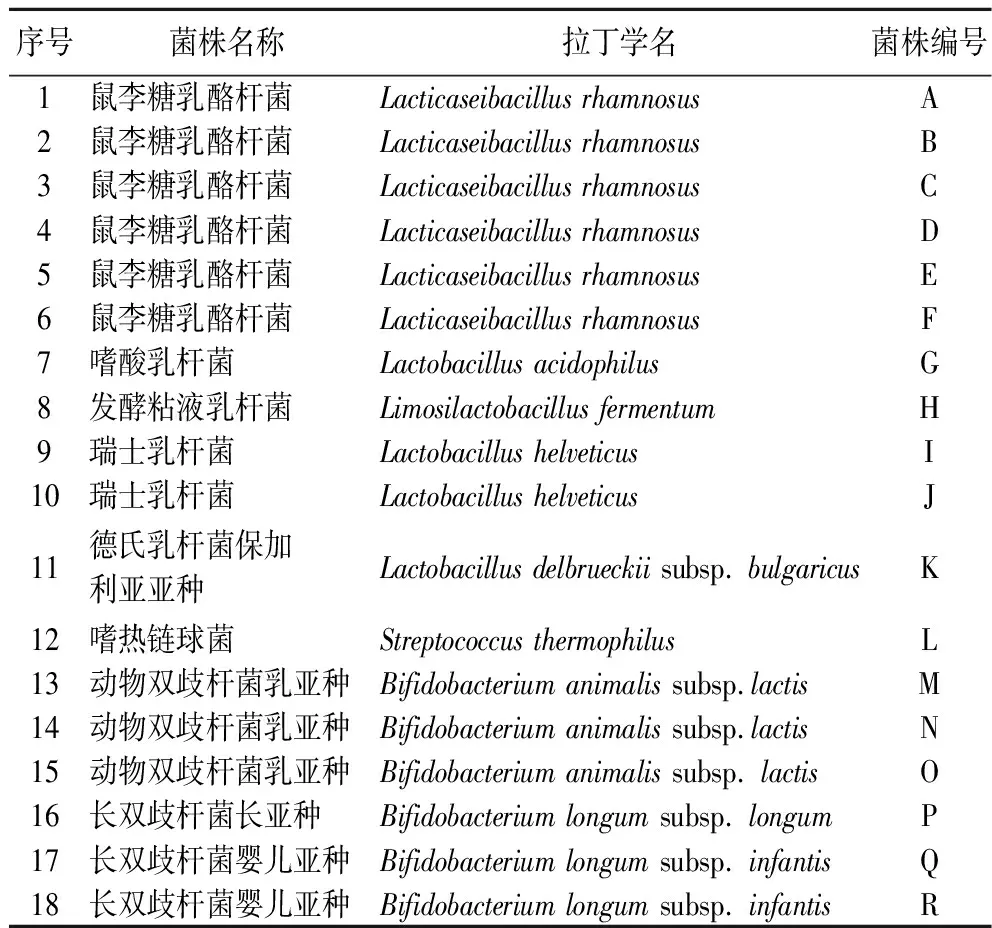
表1 菌株信息Table 1 Information of selected strains
1.3 实验方法
1.3.1 色谱条件
色谱柱:CRS10 W(4.6 mm×50 mm,3 μm);流动相:2 mmol/L CuSO4·5H2O水溶液;流速:0.5 mL/min;柱温:25 ℃;紫外检测器,检测波长254 nm;进样量:10 μL。
1.3.2 标准曲线制作
准确称取L-乳酸标准品和D-乳酸标准品,用超纯水溶解并定容至100 mL容量瓶中,配制成质量浓度4.0 mg/mL的L-乳酸、D-乳酸标准品溶液。并将其稀释为不同质量浓度的L/D-乳酸混合标准溶液,分别为1.0、5.0、10.0、20.0、40.0、80.0、160.0、320.0、400.0 μg/mL。经水系0.22 μm微孔滤膜过滤后上机检测,根据检测结果绘制峰面积及质量浓度的标准曲线。
1.3.3 乳酸菌发酵液样品制备
选择广泛适用于乳酸菌生长的MRS培养基,并添加还原剂半胱氨酸盐酸盐改善厌氧乳酸菌生长,提高菌株生长活力[17]。将乳酸菌菌株转接至0.05%半胱氨酸盐酸盐改良MRS培养基中,37 ℃培养48 h,双歧杆菌属在厌氧条件下培养。发酵液离心收集上清液,稀释适当倍数后经水系0.22 μm微孔滤膜过滤后用于HPLC检测。
1.3.4 专属性验证
将L/D-乳酸标准品溶液、空白培养基样品和菌株发酵液样品分别进行HPLC检测,按1.3.1节色谱条件进行测定,记录色谱图。
1.3.5 检出限及定量限测定
将L/D-乳酸混合标准品溶液逐级稀释后进行HPLC检测,通过信噪比(S/N=3)得出本方法中L/D-乳酸的最低检出限(limit of detection,LOD),并通过信噪比(S/N=10)得出L/D-乳酸的定量限(limit of quantitation,LOQ)[18]。
1.3.6 精密度验证
选取菌株L.rhamnosusA和L.helveticusI为验证菌株,每株菌株按照1.3.3节方法制备发酵液,并进行10次重复实验,得到的发酵液进行HPLC检测,计算相对标准偏差(relative standard deviation,RSD)。
1.3.7 准确度验证
以菌株L.rhamnosusA和L.helveticusI为验证菌株,根据菌株发酵液中的L/D-乳酸含量,在发酵液中添加5种不同浓度的L/D-乳酸标准品溶液,检测并计算加标后的发酵液中L-乳酸、D-乳酸含量及回收率,每个浓度下进行3次重复实验。
回收率计算如公式(1)所示:

(1)
1.3.8 发酵液线性范围验证
将菌株L.rhamnosusA和L.helveticusI发酵液进行系列梯度稀释,检测不同浓度发酵液中L-乳酸、D-乳酸的含量,以检测结果为因变量,样品的预期浓度为自变量进行线性回归分析,计算相关系数R2。
1.3.9 稳定性试验
选取菌株L.rhamnosusA和L.helveticusI的发酵液,在样品制备0、8、16、24、32、48 h后进行HPLC检测,通过标准曲线计算发酵液中L-乳酸和D-乳酸的含量,计算不同贮藏时间检测结果的相对标准偏差。
1.3.10 样品测定
将18株乳酸菌菌株按照1.3.3节方法制备发酵液,并按照1.3.1节色谱条件检测发酵液中的L-乳酸、D-乳酸含量。
1.3.11 数据处理
所有实验进行3次平行实验,采用SPSS 25.0的单因素方差分析(One-way AVONA)和Duncan′s多重比较法进行数据统计(P<0.05)。
2 结果与分析
2.1 L/D-乳酸的标准曲线
参照GB/T 35655—2017选取不同浓度范围的L/D-乳酸标准品溶液建立回归方程,以峰面积为纵坐标,质量浓度为横坐标,回归方程及相关系数见表2。不同浓度范围的L-乳酸和D-乳酸标准品溶液的检测响应值呈良好的线性关系,未发现明显的离群值或异常值。因此得到L-乳酸和D-乳酸在1.0~ 400.0 μg/mL范围内的标准曲线分别为:y=0.148 6x+0.022和y=0.086 1x+0.018 9,用于乳酸菌发酵液中L/D-乳酸的定量分析。
2.2 专属性验证结果
在建立的色谱条件下,L/D-乳酸色谱图如图1所示,混合标准品溶液中D-乳酸的保留时间为13.68 min,L-乳酸的保留时间为17.92 min,根据保留时间对样品进行定性分析。空白培养基样品在L/D-乳酸位置处无干扰峰,在2株菌株发酵液中L/D-乳酸两组分的分离度为4.0~6.0,可实现L-乳酸和D-乳酸的完全分离。
2.3 最低检出限及定量限测定结果
通过将L/D-乳酸混合标准品溶液逐级稀释,并结合信噪比计算得出本方法中L/D-乳酸的最低检出限为0.25 μg/mL,以及L/D-乳酸的定量限为0.80 μg/mL。
2.4 精密度验证结果
对菌株L.rhamnosusA和L.helveticusI进行10次重复实验,测得发酵液中L/D-乳酸含量如表3所示,在2株乳酸菌的发酵液样品中L/D-乳酸的RSD值均在3.5%以下,表明此方法的精密度、重复性良好。

表3 精密度验证结果 单位:mg/mL
2.4 准确度验证结果
在菌株L.rhamnosusA和L.helveticusI发酵液中进行加标回收率检测,实验结果如表4所示,结果表明不同浓度的L-乳酸标准品溶液在2株乳酸菌发酵液中的回收率为94.0%~103.7%;不同浓度的D-乳酸标准品溶液在2株乳酸菌发酵液中的回收率为90.0%~99.3%,因此检测结果准确,具有可靠性。

表4 菌株发酵液加标回收率结果Table 4 Results of standard recovery of fermentation broth of strains
2.5 线性范围验证结果
将菌株L.rhamnosusA和L.helveticusI发酵液样品进行逐步稀释,将不同稀释度下测得结果与预期浓度进行线性回归分析。结果如表5所示,2株菌株发酵液在进行50~3 200倍的稀释过程中,L/D-乳酸的检测结果与预期结果的R2均在0.999以上,因此菌株发酵液在较大的稀释范围内,L/D-乳酸检测结果具有良好线性关系。

表5 菌株发酵液线性范围验证结果Table 5 Results of linear range verification of fermentation broth
2.6 稳定性验证结果
测定存储0、8、16、24、32、48 h后的L.rhamnosusA和L.helveticusI菌株发酵液样品,检测结果如表6所示,在2株菌株发酵液中L/D-乳酸含量的RSD值均小于5.0%。实验结果表明,在样品制备48 h内L-乳酸和D-乳酸含量检测值变化差异不显著,在检测时间范围内,L/D-乳酸在微生物发酵液中均可以稳定存在。

表6 稳定性验证结果 单位:mg/mL
综上,以上验证指标结果符合《中国药典》(2020版)0512高效液相色谱法方法学及9201药品微生物检验替代方法验证的要求,发酵液中L/D-乳酸两组分的分离度>1.5、加标回收率≥70%、精密度RSD≤35%、线性范围回归曲线R2≥0.98。
2.7 乳酸菌发酵液样品检测结果
乳酸的2种异构体形式D(-)和L(+)可以通过不同的立体特异性NAD-依赖型乳酸脱氢酶(D-LDH或L-LDH),还原丙酮酸形成。乳酸菌(lactic acid bacteria,LAB)根据L/D-乳酸产物的比例不同,可分为L-LAB、D-LAB和DL-LAB[19]。涵盖4个属8个种的18株乳酸菌菌株在改良MRS培养基中培养,测得发酵液中L-乳酸和D-乳酸的含量如图2所示,菌株S.thermophilusL和B.longumP~R发酵液中的L-乳酸光学纯度均为100%,菌株在此条件下只产生L-乳酸。L.delbrueckiisubsp.bulgaricusK发酵液中的D-乳酸光学纯度为100%,菌株在此条件下只产生D-乳酸。鼠李糖乳酪杆菌L.rhamnosusA~F发酵液中L-乳酸含量占比均在80%以上。B.animalisM~O同样以产L-乳酸为主。L.acidophilusG、L.fermentumH、L.helveticusI呈现相似趋势,产生的D-乳酸含量比例均在50%以上。
不同种乳酸菌产L/D-乳酸的情况具有显著差异,同种乳酸菌产L/D-乳酸比例相近,而株间产L/D-乳酸的含量也具有差异,具有菌株特异性。6株L.rhamnosus产生少量D-乳酸,含量均在3.0 mg/mL以下,L-乳酸含量为12.5~14.7 mg/mL;2株L.helveticus的L-乳酸含量基本相同,D-乳酸含量具有显著差异;3株B.animalis发酵液中D-乳酸在5%以内,L-乳酸含量具有显著差异,为5.9~15.2 mg/mL。3株B.longum均不产D-乳酸,但其L-乳酸含量也具有显著差异。同种乳酸菌具有相似的代谢模式,在18株菌株中Ld.subsp.bulgaricusK单产D-乳酸,并且D-乳酸量最高,为17.5 mg/mL,S.thermophilusL只产L-乳酸。研究表明S.thermophilus在发酵过程中只产生L-乳酸,S.thermophilus的基因组缺乏编码D-LDH基因[20],L.delbrueckiisubsp.bulgaricus在生长过程中90%以上的丙酮酸通过糖酵解途径转化为D-乳酸,其D-LDH基因表达水平或酶活性较高[21],很少或不产生L-乳酸。本实验建立的HPLC方法检测范围广、准确性较好,适用于多种乳酸菌发酵液样品中L/D-乳酸含量的分析。

图2 发酵液中L/D-乳酸含量Fig.2 Content of L/ D-lactic acid in fermentation broth
3 结论与讨论
目前已有研究利用高效液相色谱法和手性柱同时检测白酒和药物原料中L-乳酸和D-乳酸的含量,检测结果准确度高、重现性好[22-23]。乳酸菌类食品用菌种合成D-乳酸的代谢活性已受到关注,因此对乳酸菌发酵液中L/D-乳酸的准确检测具有重要意义。
本研究采用高效液相色谱结合手性柱建立了一种适用于乳酸菌发酵液中L/D-乳酸同时定性定量的检测方法。所建方法中L/D-乳酸质量浓度为1.0~ 400.0 μg/mL范围内具有良好线性关系,L/D-乳酸检出限为0.25 μg/mL,定量限为0.80 μg/mL。基于2株乳酸菌L.rhamnosus和L.helveticus的发酵液验证表明,该方法专属性、精密度、准确性、线性相关性和稳定性指标良好,适用于乳酸菌发酵液中L/D-乳酸的定量检测。并对不同种乳酸菌产L/D-乳酸情况系统分析,利用该方法检测18株乳酸菌菌株在改良MRS培养基中产生L/D-乳酸情况,结果表明,乳酸菌产L/D-乳酸含量及比例具有菌株特异性,因此对于乳酸菌产L/D-乳酸的评价需在菌株基础上。此外,发酵条件如培养基种类、碳氮源、温度、pH值、溶解氧含量等均可影响乳酸菌的生长,从而影响乳酸的产生,如在不同初始乳糖浓度下生长L.delbrueckii产D-乳酸的量随乳糖增加而增加,由4.95到19.20 mg/mL[24]。因此未来基于此方法可进一步分析多种乳酸菌在不同培养条件下、不同应用场景中产L/D-乳酸情况。本研究所建立方法为食品用菌种安全性评价中菌株代谢产物D-乳酸的评价提供了有效数据支撑和实践参考,以及为适用于婴幼儿的益生菌资源的开发提供一定的技术参考,对促进益生菌在食品行业更加安全和广泛的应用具有重要意义。
