堇叶碎米荠富硒多肽对乙醇诱导THLE-2肝细胞损伤的保护作用
2023-12-29凌荣瑞丛欣陈尚卫朱松
凌荣瑞,丛欣,陈尚卫,朱松*
1(江南大学,食品科学与技术国家重点实验室,江苏 无锡,214122) 2(恩施德源硒材料工程科技有限公司,湖北 恩施,445000)
酒精性肝病(alcoholic liver disease,ALD)是指长期过量饮酒而引起的肝脏损害,近年来,ALD发病率在我国迅速上升,成为除病毒性肝炎的第二大肝病[1]。肝脏是乙醇代谢的主要场所[2],通过多种途径将乙醇转化为毒性较小的乙酸盐,其中伴随乙醛和大量活性氧(reactive oxygen species,ROS)生成。肝细胞具有由酶(如超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化物酶)、肽(谷胱甘肽)和蛋白(硫氧还蛋白)组成的内源性抗氧化防御机制[3],乙醛[4]作为乙醇代谢的中间产物和一种剧毒物质,直接结合并降低谷胱甘肽活性,另外,乙醇摄入也会降低抗氧化酶活性[5],ROS生成增加以及抗氧化能力的减弱造成ROS在细胞内过度积累,过量的ROS引起细胞内氧化还原状态变化,这种乙醇诱导的氧化应激目前被认为是ALD的主要致病途径[6]。因此,降低细胞内ROS含量是预防ALD发生的有效方法。
硒是具有抗氧化防御,维持氧化还原平衡[7]的重要微量元素,但在人体内不能自主合成,现有的硒补充剂多为无机硒和微生物来源,研究表明植物源有机硒对机体的安全阈值更高且生物利用度好[8]。堇叶碎米荠是十字花科碎米荠属草本植物,对硒有超富集能力,2021年被国家卫建委批准为全新的食品原料[9],可将95%以上的无机硒转化为有机硒[10]。利用富硒堇叶碎米荠制备的[11]碎米荠碱提物、堇叶碎米荠富硒蛋白(selenium-enriched protein ofCardamineviolifolia,SPR)和堇叶碎米荠富硒多肽(selenium-enriched peptide ofCardamineviolifolia,SPE)可清除DPPH自由基、羟自由基和超氧阴离子自由基等自由基,相同硒浓度下,清除能力均强于无机硒,其中,SPE的清除率最高。进一步研究发现,堇叶碎米荠中的硒主要以硒代半胱氨酸形式[9]存在,并结合于蛋白中,硒代半胱氨酸是硫氧还蛋白还原酶、谷胱甘肽过氧化物酶等一系列硒酶的活性中心[12],这些酶参与人体内脂质过氧化氢和过氧化氢的分解,保护细胞免受氧化损伤,因而推测SPR/SPE能够清除生物体内ROS。在饲料中添加碎米荠硒蛋白[13]提高了正常小鼠血液及肝组织的硒水平,促进血液及肝脏的超氧化物歧化酶(superoxide dismutase, SOD)和谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)活性并降低丙二醛含量,增强机体的抗氧化功能,促进小鼠的生长发育,但在发生氧化应激情况下,堇叶碎米荠富硒多肽抑制氧化损伤的研究较少。因此本研究基于乙醇损伤肝细胞模型,利用不同硒浓度的SPE处理THLE-2细胞,通过测定细胞损伤相关指标及THLE-2细胞内ROS和抗氧化酶系含量,考察SPE的抗氧化功能及SPE缓解乙醇诱导肝损伤的能力。
1 材料与方法
1.1 材料与试剂
普通堇叶碎米荠干粉、富硒堇叶碎米荠干粉,恩施德源健康科技发展有限公司;盐酸、氢氧化钠、硫酸、硫酸铜、硫酸钾,国药集团化学试剂有限公司;碱性蛋白酶、中性蛋白酶,上海麦克林生化科技股份有限公司;人肝永生化细胞THLE-2,青旗(上海)生物技术发展有限公司;DMEM培养基、青霉素链霉素溶液(双抗),胰蛋白酶,美国赛默飞公司;胎牛血清,江苏恩莫阿塞生物技术有限公司;磷酸盐缓冲液(phosphate-buffered saline,PBS),北京索莱宝科技有限公司;噻唑蓝溴化四唑[3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl,MTT]、苯甲基磺酰氟、Western及IP细胞裂解液、细胞周期与细胞凋亡检测试剂盒、活性氧检测试剂盒,碧云天生物技术研究所;谷草转氨酶(glutamic oxalacetic transaminase,AST)、谷丙转氨酶(glutamic-pyruvic transaminase,ALT)、乳酸脱氢酶(lactate dehydrogenase,LDH)、SOD、过氧化氢酶(catalase,CAT)、GSH-Px、谷胱甘肽(glutathione reduction,GSH)检测试剂盒,南京建成生物工程研究所。
1.2 仪器与设备
TDL-40B台式低速离心机,上海安亭科学仪器厂;SCIENTZ-10 N冷冻干燥机,宁波新芝生物科技股份有限公司;iCAP TQ三重四极杆电感耦合等离子质谱仪、Multiskan FC酶标仪,赛默飞世尔(上海)仪器有限公司;HYP-304消化炉、KDN-103F自动定氮仪,上海纤检仪器有限公司;BPN-80CW二氧化碳培养箱,上海一恒科学仪器有限公司;XDS-8KY倒置生物显微镜,上海启步生物科技有限公司;Moflo XDP流式细胞分选仪,美国贝克曼库尔特公司;Axio Vert A1倒置荧光显微镜,德国蔡司公司。
1.3 实验方法
1.3.1 堇叶碎米荠蛋白/多肽制备
SPR和堇叶碎米荠普通蛋白(protein ofCardamineviolifolia,CPR)采取相同的提取方式[11],将2种干粉分别与去离子水以1∶40(g∶mL)的料液比混合,在50 ℃水浴条件下搅拌提取4 h,4 000 r/min离心20 min,保留上清液,沉淀与0.1 mol/L的NaOH溶液混合,继续提取6 h,离心保留上清液,将2次提取的上清液混合,用0.1 mol/L的HCI溶液调节pH至等电点(pH 2.9),4 ℃静置过夜,离心,沉淀复溶,经截留分子质量为100 Da的透析袋进行脱盐处理,之后冷冻干燥,得到碎米荠蛋白。1 g碎米荠蛋白中加入10 mg比活力为1×106U/g的碱性蛋白酶,以1∶30(g∶mL)的料液比与去离子水混合,在pH 8.5、49.6 ℃水浴条件下酶解2 h,90 ℃灭酶10 min,冷却后调节pH值至7.0,加入10 mg比活力为1×106U/g的中性蛋白酶继续酶解2 h,90 ℃灭酶10 min,酶解液经截留分子质量为100 Da的透析袋进行脱盐处理,后经冷冻干燥得到SPE或堇叶碎米荠普通多肽(peptide ofCardamineviolifolia,CPE)。
1.3.2 蛋白、总硒含量和硒形态测定
4种堇叶碎米荠制品的蛋白含量测定参考葛敏等[14]的方法。总硒含量参考叶梅等[9]的方法,称取0.15 g制品于微波消解管中,加3 mL硝酸,冷消化过夜后加入5 mL水,于微波消解仪中消解2 h,将消解后的溶液定容,上机测定。硒形态测定参考叶梅等[9]的方法,称取0.1 g制品,经5%碱性蛋白酶-胰蛋白酶-蛋白酶K酶解后,上清液经0.22 μm微孔滤膜过滤后进样。
1.3.3 细胞培养
THLE-2人肝永生化细胞,使用添加10%胎牛血清和1%双抗的DMEM培养基,于37 ℃、5% CO2条件的细胞培养箱中孵育。
1.3.4 乙醇损伤肝细胞模型的建立
THLE-2细胞接种于96孔板(1.2×104个/孔)中,细胞贴壁后,弃去原培养基,加入100 μL不同浓度的乙醇溶液(0、400、600、800、1 000、1 200 mmol/L)孵育12 h,MTT法测定细胞活力,获得合适的乙醇浓度。
1.3.5 堇叶碎米荠制品对乙醇损伤THLE-2细胞存活率的影响
将THLE-2细胞接种于96孔板中,细胞贴壁后,设置空白组,损伤组和不同硒浓度的堇叶碎米荠制品组,空白组指仅受培养基处理的细胞,损伤组指仅受乙醇处理的细胞,堇叶碎米荠制品组指细胞与不同硒浓度(当涉及SPR或SPE的硒浓度时,指SPR或SPE溶液的硒浓度与该浓度一致,当涉及CPR或CPE的硒浓度时,指CPR溶液的蛋白含量与该硒浓度下SPR溶液中蛋白含量一致,CPE溶液的蛋白含量与该硒浓度下SPE溶液中蛋白含量一致)的SPE、SPR、CPE和CPR制品溶液孵育24 h,之后更换为乙醇溶液孵育12 h,孵育结束后测定细胞活力,选择能够有效提高细胞存活率的堇叶碎米荠制品作进一步研究。
1.3.6 不同孵育方式对细胞存活率的影响
碎米荠制品预孵育:THLE-2细胞首先与保护效果最好的堇叶碎米荠制品(6、12、18 μmol/L硒浓度)孵育24 h,之后与乙醇溶液孵育12 h,结束后测定细胞活力。
乙醇预孵育:THLE-2细胞首先与乙醇溶液孵育12 h,之后与碎米荠制品(6、12、18 μmol/L硒浓度)培养24 h,测定细胞活力。
共同孵育:将碎米荠制品(6、12、18 μmol/L硒浓度)和乙醇同时加入细胞中孵育12 h,培养结束后,MTT法测定细胞活力。比较不同孵育方式的细胞存活率。
1.3.7 ALT、AST和LDH水平测定
THLE-2细胞接种于96孔板中,设置空白组、损伤组、白藜芦醇组(阳性对照,白藜芦醇浓度为12.5 μmol/L)和不同浓度的碎米荠制品组(选择保护效果最好的堇叶碎米荠制品,并设置6、12、18 μmol/L硒浓度),通过合适的孵育方式培养细胞,孵育结束后,按照试剂盒说明书进行操作,测定各组上清液中ALT、AST和LDH水平。
1.3.8 ROS含量检测
细胞按5×105个/孔密度接种于6孔板中,培养结束后弃去上清液,将DCFH-DA按1∶1 000的比例用无血清培养基稀释,每孔加入2 mL混合液,37 ℃避光孵育20 min,之后替换为无血清培养基,在倒置荧光显微镜下观察各组细胞内ROS含量情况。
1.3.9 SOD、CAT、GSH-Px和GSH水平测定
细胞以1×106个/皿密度接种于6 cm皿中,培养结束后弃去上清液,收集、裂解细胞,在4 ℃、10 000 r/min条件下离心。取上清液,根据SOD、CAT、GSH-Px和GSH检测试剂盒进行测定。
1.3.10 流式细胞仪检测细胞凋亡
利用6孔板培养细胞,孵育结束后,弃去上清液,加入1 mL胰酶,在37 ℃下消化,消化时间不宜过长,防止过度消化引起的早期细胞凋亡,缓慢吹落细胞,之后收集细胞,染色,上流式细胞仪检测细胞凋亡。
1.3.11 JC-1染色观察线粒体膜电位(mitochondrial membrane potential,MMP)
细胞按5×105个/孔密度接种于6孔板中,培养结束后,根据说明书配制染色工作液,用PBS轻洗各孔一遍,加入1 mL染色工作液和无血清培养基,37 ℃避光孵育20 min,之后用染色缓冲液小心清洗,通过倒置荧光显微镜观察细胞内线粒体膜电位情况。
1.4 数据处理
使用Origin 2018和ZEN处理数据和绘图,并使用IBM SPSS Statistics 22进行显著性分析(P<0.05),所有试验均重复3次。
2 结果与分析
2.1 堇叶碎米荠制品蛋白、总硒含量及硒形态
研究表明,植物蛋白和多肽[15]也可清除体内ROS,减少细胞死亡,因此为确定有机硒在抑制细胞损伤中的作用,制备SPR、SPE、CPR和CPE 4种不同有机硒含量的堇叶碎米荠制品。如表1所示,CPR和CPE的硒含量分别为87.33 mg/kg和83.04 mg/kg,富硒处理的大豆蛋白[16]硒含量仅为61.52 mg/kg,表明堇叶碎米荠作为新食品原料强大的富硒能力,利用富硒堇叶碎米荠干粉制备的SPR和SPE,其总硒含量分别为3 890.22 mg/kg和3 400.03 mg/kg,并且大部分硒以硒代半胱氨酸形式存在,表明堇叶碎米荠对硒极强的耐受性,与其他富硒植物相比,对土壤中无机硒的利用率更高。
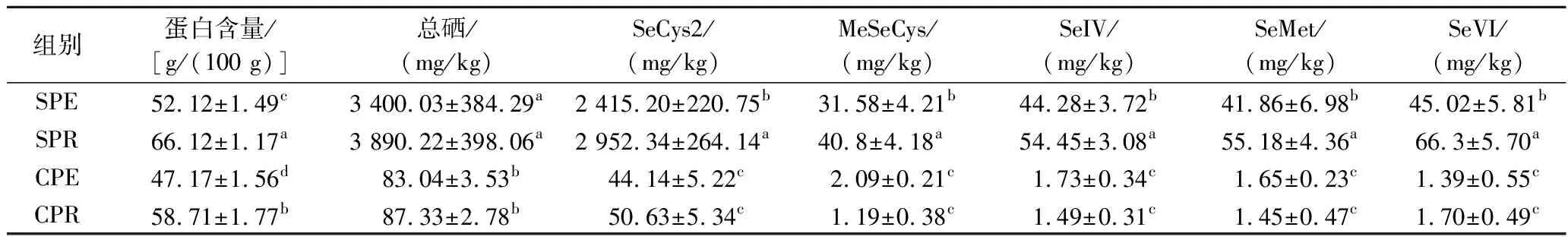
表1 堇叶碎米荠制品中总硒、蛋白含量及硒形态Table 1 Total selenium, protein content and selenium speciation in cardamine violifolia products
2.2 乙醇损伤肝细胞模型的建立
为探究乙醇损伤肝细胞模型合适的乙醇浓度,将细胞与不同浓度乙醇溶液孵育12 h,结果显示,在400~1 200 mmol/L乙醇浓度范围内,相同的孵育时间下,随着乙醇浓度的增大,细胞存活率逐渐下降(图1),一般情况下,选定细胞存活率为50%左右的浓度或者孵育时间构建细胞氧化损伤模型,当乙醇浓度为1 000 mmol/L时,THLE-2细胞的存活率为50.95%,因此将该浓度确定为乙醇损伤肝细胞模型的乙醇浓度。
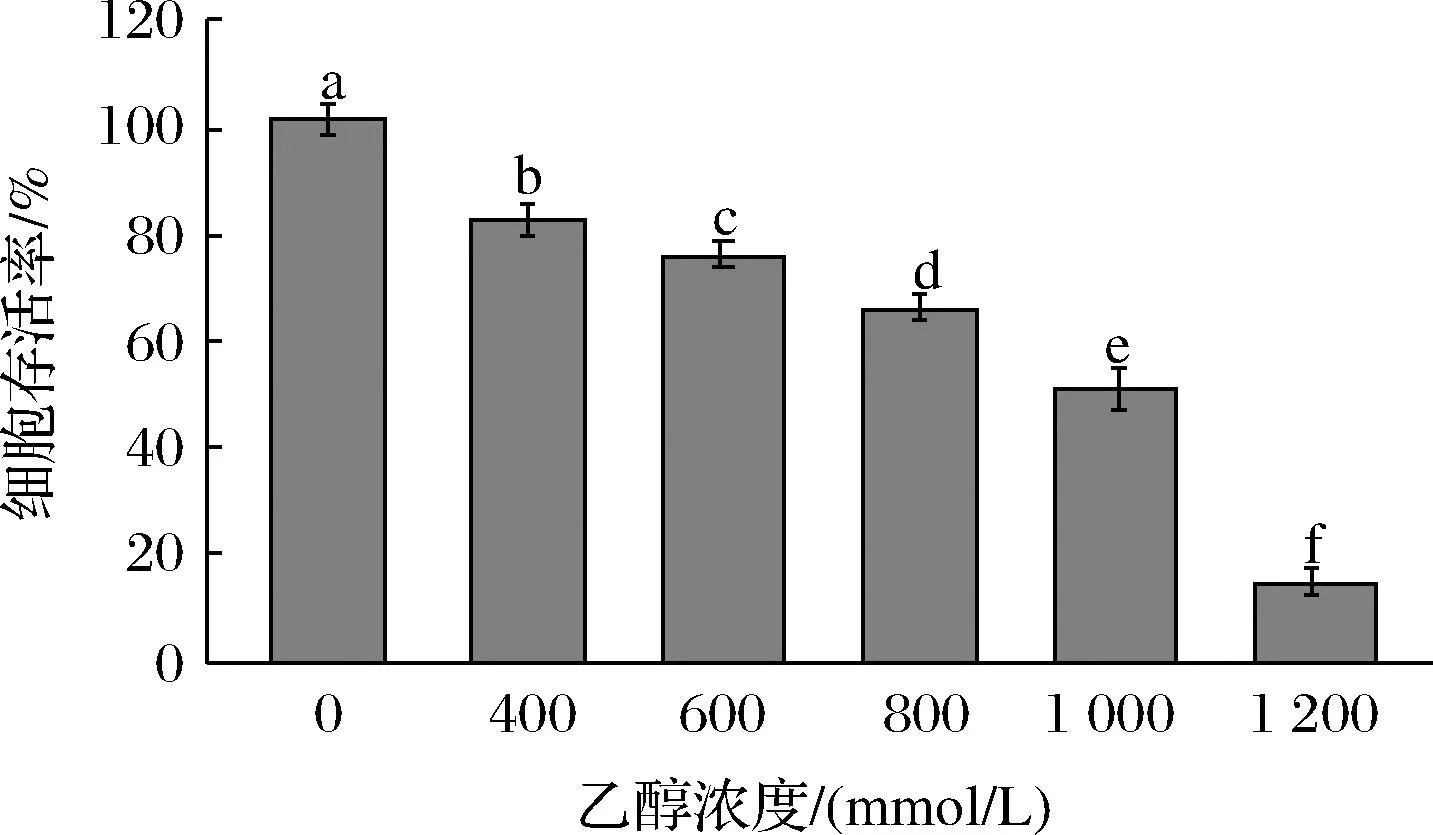
图1 乙醇对THLE-2细胞存活率的影响Fig.1 Effect of ethanol on THLE-2 cells survival rate注:图中不同小写字母表示差异显著(P<0.05)(下同)。
2.3 堇叶碎米荠制品对乙醇损伤THLE-2细胞存活率的影响
将SPE、SPR、CPE及CPR分别加入细胞中,比较细胞存活率。结果显示,经过4种堇叶碎米荠制品处理后,乙醇对THLE-2细胞的损伤程度不同(图2)。CPR组和CPE组的细胞存活率与损伤组相似,说明CPR和CPE无明显的保护能力,但部分植物蛋白或多肽具备一定的抗氧化能力,可能是因为CPR和CPE本身不具备抗氧化功能,也可能因为加入细胞的CPR/CPE溶液中蛋白或多肽浓度过低所致;SPR组和SPE组的细胞存活率最高分别为62.24%和78.01%,高于损伤组,表明有机硒的存在是抑制乙醇诱导细胞损伤的主要因素。相同硒浓度下,SPE组的细胞存活率高于SPR组,可能因为多肽更易吸收,进入细胞的有机硒更多,增强了对细胞的保护作用,表现出更高的生物利用率。另外,SPE 18 μmol/L组的细胞活力小于SPE 12 μmol/L组,这可能与有机硒过量有关,尽管有机硒毒性低于无机硒,但硒浓度过高时,也会对细胞造成损伤。总的来说,SPE的保护效果最佳,有机硒利用率最高,适合作为后续实验的研究对象。

A-空白组;B-损伤组;C-SPE 6 μmol/L组;D-SPE 12 μmol/L组; E-SPE 18 μmol/L组;F-SPR 6 μmol/L组;G-SPR 12 μmol/L组; H-SPR 18 μmol/L组;I-CPE 6 μmol/L组;J-CPE 12 μmol/L组; K-CPE 18 μmol/L组;L-CPR 6 μmol/L组;M-CPR 12 μmol/L组; N-CPR 18 μmol/L组图2 堇叶碎米荠制品对乙醇损伤THLE-2细胞存活率的影响Fig.2 Effects of Cardamine violifolia products on the survival rate of THLE-2 cells injured by ethanol
2.4 不同孵育方式对细胞存活率的影响
不同孵育方式的细胞保护效果不同,部分天然抗氧化剂如α-生育酚、抗坏血酸[17]等属于自由基吸收剂,通常在氧化剂造成损伤后加入细胞,以清除ROS,或者与氧化剂共同加入细胞中,也可达到抗氧化目的。另外一部分天然抗氧化剂如花青素[18]和对香豆酸[19]等则通过预防的方式起抗氧化作用,这些天然产物预先激活细胞内Nrf2/ARE信号通路,增加下游血红素加氧酶1、SOD、CAT和GSH-Px等抗氧化酶生成,增强抗氧化能力。为探究SPE有效的孵育方式,采用SPE预孵育、乙醇预孵育及共孵育3种方法培养细胞,SPE预孵育的结果如图3所示,3种硒浓度均可提高细胞存活率,采用乙醇预孵育和共孵育的培养方式,SPE组和损伤组的细胞存活率无明显差异(P<0.05),结果表明,SPE预孵育可能预先激活了细胞保护相关通路,减少了乙醇诱导的损伤,因此,SPE预孵育是SPE发挥保护功能的合适的作用方式。
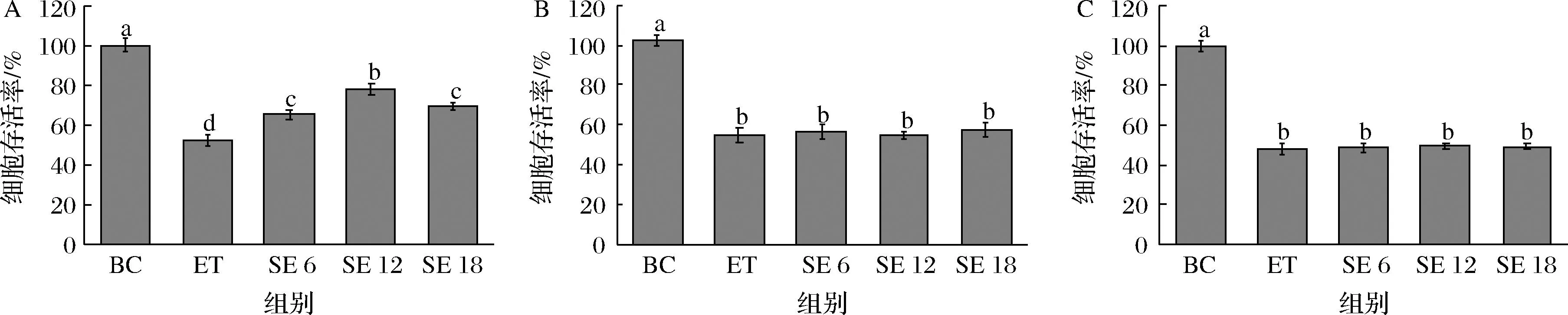
A-SPE预孵育;B-乙醇预孵育;C-共孵育图3 不同加样方式对细胞存活率的影响Fig.3 Effects of different sampling methods on cell viability注:BC-空白组;ET-损伤组;SE 6-SPE 6 μmol/L组;SE 12-SPE 12 μmol/L组;SE 18-SPE 18 μmol/L组(下同)。
2.5 ALT、AST和LDH水平测定
ALT位于肝细胞浆内,而AST位于肝细胞浆和线粒体内,是反映肝功能的主要指标,LDH是一种细胞质定位酶[20],当细胞受到损伤时,细胞膜被破坏导致三者从细胞内释放到培养基中,上清液中3种酶含量可以用于评估被处理的细胞变化,为进一步反映SPE对THLE-2肝细胞的保护作用,测定各组上清液中的ALT、AST和LDH含量。孵育结束后,损伤组上清液中AST、ALT和LDH活力分别为6.72、9.47、406.76 U/L(图4),明显高于空白组(P<0.05),表明乙醇使破损细胞数量增多,引起肝功能损伤。经过白藜芦醇和SPE预孵育的THLE-2肝细胞,3种酶释放量显著降低(P<0.05),最低分别为3.42、4.84、268.89 U/L,趋于正常水平,表明SPE减少了乙醇导致的细胞破裂。

A-AST;B-ALT;C-LDH图4 SPE对细胞AST、ALT和LDH释放量的影响Fig.4 The effect of SPE on the release of AST, ALT and LDH in cells注:RV-白藜芦醇组(下同)。
2.6 SPE降低细胞内ROS积累
在L-02[20]和HepG2[19]肝细胞建立的乙醇损伤肝细胞模型中,加入乙醇引起细胞内大量ROS积累,破坏生物膜,导致细胞死亡。为研究SPE的保护作用是否与ROS积累有关,利用DCFH-DA荧光探针检测细胞内ROS水平。细胞ROS荧光染色图如图5所示,空白组细胞几乎没有绿色荧光产生,损伤组的绿色荧光明显增强,相对平均荧光强度是空白组的5.6倍,表明THLE-2肝细胞代谢乙醇的过程中积累了大量ROS,进一步诱导细胞死亡。相较于损伤组,阳性对照组和SPE处理组的荧光强度明显减弱,SE 6、SE 12和SE 18组的相对平均荧光强度分别为空白组的3.8、2.7和3.5倍,说明SPE减少了肝细胞内ROS积累,从而抑制了细胞死亡。

A-BC;B-ET;C-RV;D-SE 6;E-SE 12;F-SE 18;G-THLE-2ROS相对平均荧光强度图5 SPE处理组细胞内的ROS水平Fig.5 ROS level of cells in SPE treatment groups
2.7 细胞内SOD、CAT、GSH-Px和GSH水平测定
乙醇诱导的细胞死亡部分由氧化应激介导,为了减轻氧化应激负担,细胞通常利用抗氧化防御机制来清除活性氧[21]。SOD、CAT、GSH-Px和GSH是抵御氧化应激的第一道防线[22],可以阻止自由基的形成,防止细胞受到活性氧的氧化损伤。SOD能够将超氧自由基转化为过氧化氢,CAT存在于过氧化物酶体中,促进过氧化氢转化为水和分子氧,GSH-Px是一种硒依赖性酶,可催化氢原子从GSH转移到过氧化氢,从而产生水和氧化型谷胱甘肽,就抗氧化能力而言,GSH-Px可能是所有硒酶中最重要的[23],在本研究中,为了确定SPE对乙醇诱导的损伤的保护作用是否通过抗氧化酶介导,测定各组THLE-2细胞中抗氧化酶的活性。经过乙醇损伤后,预处理组细胞内的SOD、GSH-Px、CAT和GSH含量均明显高于损伤组(P<0.05),最高分别为34.68 U/mg、974.75 nmol/g、1.76 U/mg和55.58 μmol/g(图6),其中,SOD、GSH和GSH-Px高于空白组,以GSH-Px变化程度最大,SE12组的细胞内GSH-Px含量是空白组的4倍,是损伤组的5.6倍,这可能由于GSH-Px以硒代半胱氨酸为活性中心,SPE为细胞提供硒离子,可进一步提高硒酶的活性。
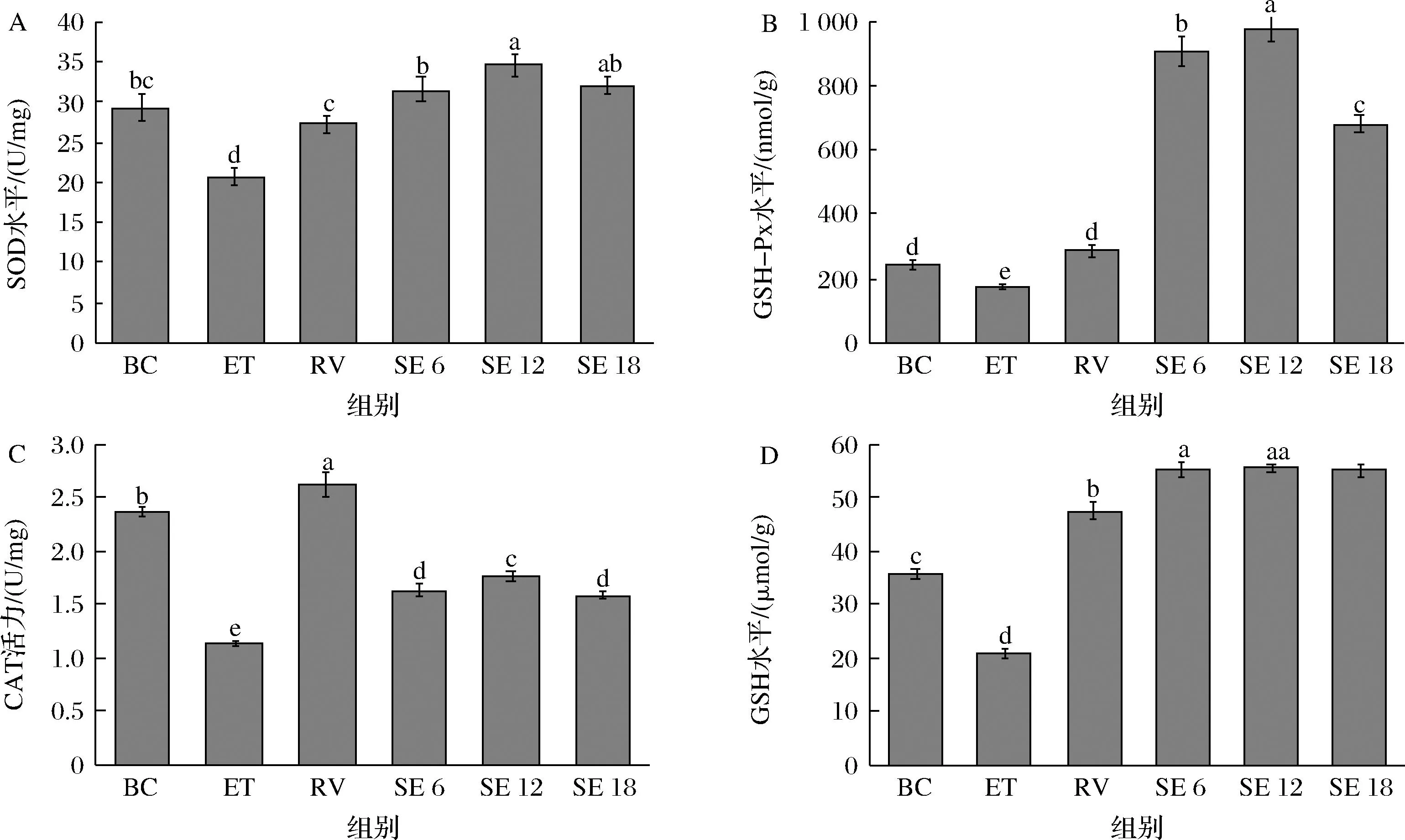
A-SOD;B-GSH-Px;C-CAT;D-GSH图6 SPE对细胞内SOD、GSH-Px、CAT和GSH含量影响Fig.6 The effect of SPE on intracellular SOD, GSH-Px, CAT and GSH content
2.8 SPE减轻乙醇诱导的细胞凋亡
细胞的死亡类型包括细胞凋亡和细胞坏死[24],细胞凋亡指细胞受特定的细胞外信号或细胞内信号的诱导,死亡途径被激活,于是在有关基因的调控下发生死亡,细胞凋亡是细胞的主动死亡,细胞皱缩是其主要形态学特征;细胞坏死指细胞受到物理、化学等环境因素的影响,如机械损伤、毒物、微生物、辐射等,引起细胞死亡,是细胞的被动死亡过程,坏死的特点是细胞肿胀,溶解。为确定THLE-2细胞的死亡类型以及SPE是否介导乙醇诱导的THLE-2细胞凋亡或坏死,使用Annexin V和PI双染法检测,该方法可区分凋亡细胞和坏死细胞,活细胞不能被Annexin V或PI染色(Q4),早期凋亡呈Annexin V染色阳性和PI染色阴性(Q3),中晚期凋亡/坏死细胞呈Annexin V和PI染色双阳性(Q2)。图7是各组细胞凋亡图,与空白组相比,损伤组的凋亡率增加(44.4%),早期凋亡细胞增加了10%,表明乙醇诱导细胞以凋亡形式死亡。与损伤组相比,损伤前加入白藜芦醇和SPE处理细胞降低了凋亡率,3种浓度的SPE组分别降低了15.3%、20.8%和16.3%,表明SPE减弱了乙醇引起的细胞凋亡。

A-BC;B-ET;C-RV;D-SE 6;E-SE 12;F-SE 18图7 SPE对乙醇诱导THLE-2细胞凋亡的影响Fig.7 Effect of SPE on apoptosis of THLE-2 cells induced by ethanol
2.9 细胞线粒体膜电位分析
线粒体不仅是细胞呼吸链和氧化磷酸化的中心,而且是细胞凋亡调控中心,多数促凋亡刺激因子通过线粒体激活细胞凋亡[25]。乙醇使THLE-2细胞内ROS大量积累,线粒体是过量ROS主要的促凋亡靶[26],因此,本实验使用JC-1染料评价THLE-2细胞的凋亡是否与线粒体有关,JC-1是一种对线粒体有高度特异性的阳离子荧光染料。当细胞线粒体膜电位较高时,JC-1聚集在线粒体的基质中,形成可以产生红色荧光的聚合物,而当细胞线粒体膜电位较低时,JC-1将产生绿色荧光的单体。通过观察细胞中红绿荧光的变化,可以评价细胞内线粒体膜电位水平。如图8所示,与空白组相比,损伤组呈现绿色荧光的细胞数量有所增加,红绿荧光比值降至1.01,说明了乙醇对线粒体膜的损伤,乙醇可能通过线粒体途径引发细胞凋亡,与损伤组相比,阳性对照组和SPE组的红色荧光增多,3种硒浓度的SPE组的红绿荧光比值分别升高至4.24、5.64和5.49,表明SPE通过线粒体途径调节了细胞凋亡。

A-BC;B-ET;C-RV;D-SE 6;E-SE 12;F-SE 18;G-各组THLE-2细胞JC-1红绿荧光比值图8 SPE对乙醇诱导THLE-2细胞线粒体膜电位影响Fig.8 Effect of SPE on mitochondrial membrane potential in THLE-2 cells induced by ethanol
3 结论与讨论
为探究植物源有机硒的抗氧化功能,利用堇叶碎米荠制备不同有机硒含量的蛋白或多肽,处理乙醇诱导的THLE-2肝细胞,结果表明,富含有机硒的堇叶碎米荠蛋白或多肽可明显保护细胞免受乙醇导致的氧化损伤,其中SPE的保护效果最好,SPE处理可增加细胞内抗氧化酶和GSH含量,降低细胞内ROS积累,从而减少乙醇引发的细胞凋亡,因此,SPE通过减少氧化应激缓解乙醇导致的肝损伤。
乙醇诱导THLE-2细胞线粒体膜电位降低,表明细胞的死亡类型可能为细胞凋亡,还需测定控制线粒体通透性的Bcl-2家族蛋白,以及凋亡程序的标志性水解酶确定,另外,SPE缓解酒精性肝损伤的作用机理需进一步研究,结果显示,SPE预孵育对细胞有明显的保护作用,这可能与生物体内应对氧化应激的中心途径-Nrf2通路有关。值得注意的是,GSH-Px酶经过SPE孵育后高度表达,表明SPE除激活Nrf2通路外,还可能为GSH-Px合成提供了原材料,因此,还需检测细胞内的硒转运系统,机理部分的探明有助于了解SPE抗氧化功能的运作过程,为SPE进一步应用提供理论基础。
