饲粮纤维水平对猪肠道屏障功能、结肠微生物及代谢产物的影响
2023-12-29刘畅崔子旭左周贠红梅牛瑾杨阳郭晓红李步高高鹏飞赵燕曹果清
刘畅,崔子旭,左周,贠红梅,牛瑾,杨阳,郭晓红,李步高,高鹏飞,赵燕,曹果清
饲粮纤维水平对猪肠道屏障功能、结肠微生物及代谢产物的影响
刘畅1,崔子旭1,左周1,贠红梅2,牛瑾1,杨阳1,郭晓红1,李步高1,高鹏飞1,赵燕1,曹果清1
1山西农业大学动物科学学院,太谷 030801;2山西省畜牧技术推广服务中心,太原 030001
【目的】添加纤维原料是降低饲料成本的有效方法之一,通过探讨不同纤维水平饲粮对马身猪和杜长大猪肠道健康的影响,为纤维的合理利用提供依据。【方法】初始体重为(20±0.5)kg的马身猪(MS)和杜×长×大三元杂交猪(DLY)各80头,品种内随机分为4组,每组5个重复,每个重复4头猪(公母各半)。试验饲粮分别在玉米-豆粕基础日粮中添加0%、9.35%、18.64%和28.03%的大豆皮,日粮中中性洗涤纤维(NDF)含量分别为9% (9N)、13.5% (13.5N)、18% (18N)和22.5% (22.5N)。试验期30 d。【结果】对于马身猪,18N组回肠IL-10含量、13.5N和22.5N组盲肠TNF-α含量均显著降低(<0.05);空肠、回肠、盲肠杯状细胞数目随纤维水平的提高而增加,结肠杯状细胞数量和表达水平在13.5N和18N组均显著增加(<0.05);18N和22.5N组、、、的表达量显著增加(<0.05);13.5N、18N和22.5N组的大肠杆菌志贺氏菌丰度显著降低(<0.05);13.5N组的乳酸杆菌属、18N组的普雷沃氏菌科_NK3B31属、22.5N组的甲烷杆菌属的丰度均显著提高(<0.05);13.5N、18N和22.5N组的棕榈酸、硬脂酸、月桂酸、癸酸均显著上调(<0.05),石胆酸、胆酸均显著下调(<0.05);差异代谢物主要富集在脂质代谢和碳水化合物消化吸收相关通路上。对于杜长大猪,22.5N组盲肠TNF-α含量显著提高(<0.05);13.5N、18N、22.5N组的各肠段的杯状细胞数量显著高于9N组(<0.05),结肠表达水平在13.5N、18N组显著增加(<0.05),在22.5N组则显著下降(<0.05);18N、22.5N组的、、表达水平显著降低(<0.05);13.5N的甲烷杆菌属、18N组的链球菌属、22.5N组的毛螺菌属丰度均显著提高(<0.05);L-酪氨酸、L-谷氨酸、L-焦谷氨酸、苯丙氨酸等羧酸及其衍生物在13.5N、18N组中显著上调,而在22.5N组中显著下调;差异代谢产物主要富集在氨基酸代谢通路上。马身猪和杜长大猪的微生物区系与肠道屏障相关基因及色氨酸和胆汁酸代谢产物之间均表现出较强的相关性。【结论】提高饲粮纤维水平能够增强猪肠道屏障功能,提高有益菌的丰度,降低有害菌丰度,调节结肠脂质代谢和氨基酸代谢,通过微生物途径影响短链脂肪酸、色氨酸和胆汁酸代谢,可促进肠道健康。
饲粮纤维水平;肠道屏障;微生物;代谢产物;猪
0 引言
【研究意义】为了降低饲料成本和拓宽饲料来源,越来越多富含纤维的农副产品被应用到猪饲料生产中。饲粮纤维无法被体内消化酶消化,最终由后肠中的微生物发酵,产生包括短链脂肪酸(SCFAs)在内的代谢产物[1]。纤维来源、纤维含量、品种等因素都会影响猪肠道对纤维的发酵[2]。与其他谷物副产品或植物性饲料成分相比,大豆皮含有大量的纤维素和半纤维素且木质素含量较少,能够在肠道内得到充分发酵,是一种良好的纤维原料[3]。越来越多的研究发现饲粮纤维除了能提高生产性能和营养消化率,还具有在一定程度上增强动物免疫能力和改善肠道健康的积极作用[4-6]。通过营养手段调节动物肠道健康是无抗时代预防疾病的重要措施,合理利用纤维对猪养殖过程中降本增效具有重大意义。探究改善猪免疫力和肠道健康的最适饲粮纤维含量,可为纤维高效利用提供科学依据。【前人研究进展】肠黏膜中的免疫细胞和细胞因子通过参与固有和适应性免疫来维持局部和全身的稳态[7-8]。有研究表明,燕麦麸皮能够提高猪回肠免疫因子IL-10的含量,在一定程度上提高了肠道的抗炎能力[9];共发酵脱脂米糠也提高了猪血清中IgG、抗炎细胞因子(IL-22、IL-23)的水平,降低了促炎细胞因子(TNF-α、IL-1β和INF-γ)的水平[10]。补充大麦不溶性膳食纤维能够提高小鼠结肠紧密连接蛋白(occludin)的基因表达,有效缓解小鼠的结肠炎[11]。麦麸和豌豆壳纤维通过增加杯状细胞数量来提高猪远端小肠黏蛋白基因的表达和黏蛋白的分泌[12]。研究表明饲粮纤维水平的提高能够增加空肠及盲肠中的螺旋体门、纤维菌门及普雷沃氏菌属的丰度,证明纤维成分能够提高纤维发酵菌的繁殖率[13]。肠道微生物能够发酵纤维产生短链脂肪酸,从而降低肠腔内的pH来抑制有害菌的生长[14]。高纤维饮食会间接影响能量、氨基酸和其他营养物质的消化代谢。研究表明在高纤维处理组中,琥珀酸、高龙胆酸等代谢物的浓度均有所提高,证明了饲粮纤维能够提高机体的能量代谢和氨基酸代谢[14-16]。【本研究切入点】目前,人们大多采用单一品种猪或单一饲粮纤维水平来研究纤维对猪的影响,运用梯度饲粮纤维水平研究纤维对不同猪种的影响仍较为少见。本研究利用微生物组及非靶代谢组学来进一步探究饲粮纤维对猪肠道微生物、营养物质代谢的影响,并通过关联分析研究猪营养代谢的微生物途径及其作用。【拟解决的关键问题】本研究以我国地方品种马身猪与商品猪杜长大猪为研究对象,探究不同饲粮纤维水平对猪肠道屏障功能、肠道微生物及代谢产物的影响,阐明纤维对肠道健康的积极作用,为饲粮中纤维的合理利用提供科学依据。
1 材料与方法
1.1 试验时间与地点
试验于2020年12月5日至2021年1月5日在山西农业大学动物科学学院试验猪场进行。
1.2 试验设计
试验选取初始体重为(20±0.5)kg的80头马身猪(MS)和80头杜×长×大三元杂交猪(DLY)为试验动物,品种内随机分为4组,每组5个重复,每个重复4头(公母各半,公猪已去势)。不同组别分别饲喂在基础日粮中添加不同含量大豆皮部分替代玉米和豆粕的试验日粮,即9N组(9%NDF,不添加大豆皮),13.5N组(13.5%NDF,添加9.35%大豆皮)、18N组(18%NDF,添加18.64%大豆皮)和22.5N组(22.5%NDF,添加28.03%大豆皮)。预试期7 d,试验期30 d。试验饲粮组成及营养水平见表1。试验前所有个体按常规程序进行驱虫,每天7:00、12:00、17:00各饲喂一次,每次加料1 h后清除剩料,自由饮水。饲养期间各组饲喂方式、试验环境及管理模式均相同。
1.3 样品采集
饲养试验结束后,每个处理组随机挑选3头接近该处理组平均体重的个体进行前腔静脉采血,静置30 min后,3 000 r/min,4℃离心15 min分离血清,分装后置于-80℃保存。屠宰后立即分离肠道,各肠段取2—3 cm中段样品,固定在4%多聚甲醛中备用;采集各肠段组织样品及结肠内容物,置于冻存管中,液氮速冻后-80℃保存备用。
1.4 检测指标及方法
1.4.1 肠道免疫指标的检测 肠道组织中白介素10(IL-10)、肿瘤坏死因子(TNF-α)、分泌性免疫球蛋白A(sIgA)均采用酶联免疫吸附法测定。将回肠、盲肠、结肠组织剪碎,加入预冷的1×PBS缓冲液,使用匀浆机充分匀浆后5 000 r/min低温离心10 min,取上清进行检测。所有试剂盒均购自上海酶联生物科技有限公司,按照试剂盒说明书进行,通过全功能微孔板检测仪(BioTek, Vermont, USA)进行测定。
1.4.2 肠道屏障基因mRNA表达量的测定 使用TRIzol RNA提取试剂(Thermo Scientific, Wilmington, USA)提取结肠组织样品的总RNA,用核酸蛋白测定仪测定RNA浓度。用TransScript® Uni All-in-One First-Strand cDNA Synthesis SuperMix for qPCR,20 µL反应体系进行反转录。用NCBI Primer-BLAST设计引物,由生工生物工程(上海)股份有限公司合成,引物序列见表2。以为内参基因,采用qRT-PCR方法检测肠道黏液蛋白基因及紧密连接蛋白基因、、和的相对表达量。采用2-ΔΔCt方法对qRT-PCR结果进行分析。
1.4.3 肠道杯状细胞染色及紧密连接蛋白免疫组化分析 肠道组织在4%多聚甲醛中固定24 h后,用乙醇和二甲苯梯度脱水,石蜡包埋后用切片机(Leica,M60,Germany)制作切片。切片进行AB-PAS染色后检测杯状细胞数量。切片使用EVOS FL Auto成像系统进行拍摄。每组切片在高倍镜下选择15根长度相近的小肠绒毛或大肠腺,使用Image-Pro Plus 6.0统计小肠绒毛和大肠腺的杯状细胞数目。
使用ZO-1兔多克隆抗体(1﹕200,北京博奥森生物技术有限公司)或Occludin兔多克隆抗体(1﹕200,北京博奥森生物技术有限公司),进行免疫组化切片染色,具体方法参照即用型SABC-POD(兔IgG)试剂盒(武汉博士德生物工程有限公司)说明书进行。切片用苏木精染色、酒精梯度脱水、封片。使用ImageJ软件的IHC Profiler插件评估染色强度和每种强度下染色细胞的百分比。评分方法参照JIN的研究[17],免疫染色强度从0(无染色)到3(最强强度),将细胞百分比(0至100)乘以相应的染色强度(0至3)以获得免疫组化分数。
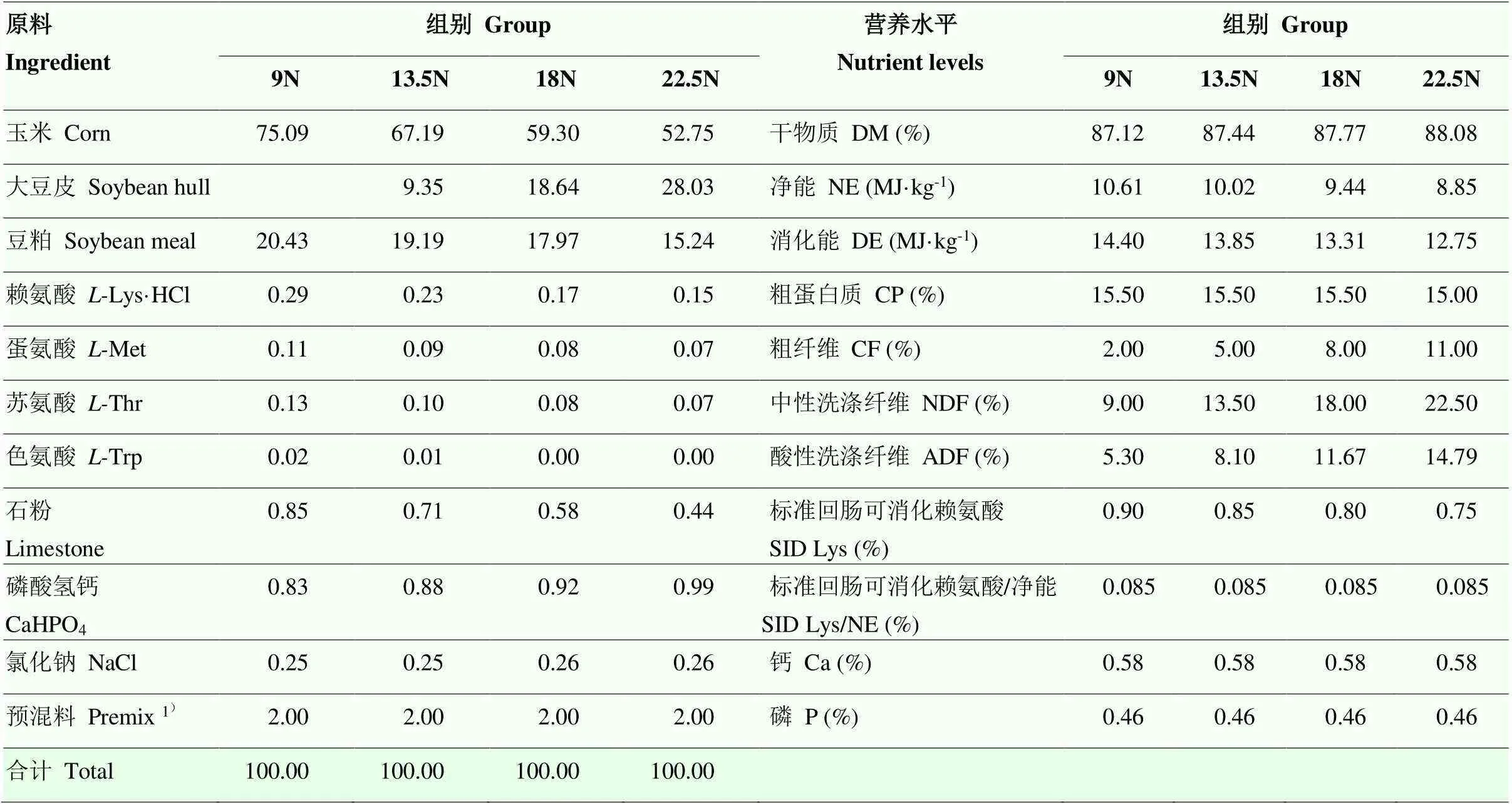
表1 试验日粮组成及营养水平(干物质基础)
1)预混料为每千克饲粮提供: VA 9000 IU,VB1 5 mg,VB210 mg,VB6 6 mg,VB12 0.05 mg,VD3 2000 IU,VE 50 IU,VK 6 mg, 生物素0.4 mg,泛酸钙15 mg,烟酸30 mg,Cu 30 mg,Fe 70 mg,Mn 30 mg,Zn 65 mg,I 0.5 mg,Se 0.3 mg。2)营养水平为计算值,即某一营养成分水平为各原料所占比例与该原料中这种营养成分的乘积之和
1)The premix provided the following per kg of the diet: VA 9000 IU, VB1 5 mg, VB210 mg, VB6 6 mg, VB12 0.05 mg, VD3 2000 IU, VE 50 IU, VK 6 mg, Biotin 0.4 mg, Calcium pantothenate 15 mg, Nicotinic acid 30 mg, Cu 30 mg, Fe 70 mg, Mn 30 mg, Zn 65 mg, I 0.5 mg, and Se 0.3 mg.2)Nutrient levels were calculated values. The level of a certain nutrient component in diet was the sum of the product of the proportion of each raw material in diet and its certain nutrient component in the raw material
1.4.4 结肠内容物微生物组分析 使用TIANamp细菌DNA试剂盒对结肠内容物进行总DNA的提取。PCR扩增16S rRNA基因V3—V4区,引物为341F(5′-CCTACGGGNGGCWGCAG-3′)和806R(5′- GGACTACHVGGGTATCTAAT-3′)。使用AMPure XP Beads试剂盒对PCR扩增产物回收并纯化,在Illumina Hiseq2500平台上进行16S扩增子测序。使用FASTP(version 0.18.0)对微生物组原始数据进行质量过滤,使用UPARSE(version 9.2.64)在97%水平下进行OUT聚类,使用UCHIME算法去除所有嵌合标签。基于UNITE数据库(version 8.0),使用RDPclassifier(version 2.2)进行物种注释,置信阈值为0.8。利用R语言包(psych,version 1.8.4)计算微生物丰度和基因表达量之间的spearman相关系数,使用Omicsmart在线平台生成热图(http://www. omicsmart.com)。
1.4.5 结肠内容物代谢组分析 使用Vanquish UHPLC系统(Thermo Fisher Scientific Inc., Germany)和Orbitrap Q ExactiveTM HF-X质谱仪(Thermo Fisher Scientific Inc., Germany)对结肠内容物进行UHPLC-MS/MS分析。使用Compound Discoverer 3.1(Thermo Fisher Scientific Inc., Germany)处理UHPLC-MS/MS生成的原始数据文件,对每种代谢物进行峰对齐、峰拾取,同时对峰面积进行定量,再整合目标离子。通过分子离子峰和碎片离子进行分子式的预测并与mzCloud(https://www.mzcloud. org/)、mzVault和Masslist数据库进行比对,用blank样本去除背景离子,并对定量结果进行归一化,最后得到数据的鉴定和定量结果。正离子模式和负离子模式下的代谢产物根据目标代谢物筛选后组合成一组新的混合模式代谢集,然后进行下一步分析。利用R语言包(psych,version 1.8.4)计算物种丰度和代谢物丰度之间的spearman相关系数,并绘制相关性热图。

表2 基因引物序列
1.5 数据统计分析
肠道免疫因子及杯状细胞数据采用SPSS 22.0软件中的一般线性模型(GLM)进行两因素方差分析,分析模型包括品种、饲粮纤维水平及二者之间的互作效应;肠道屏障指标、微生物及代谢物丰度数据采用SPSS 22.0软件中的单因素方差分析。各处理组间利用Duncan氏法进行多重比较,<0.01表示差异极显著,<0.05表示差异显著,0.05<<0.10表示有差异显著趋势。
2 结果
2.1 肠道免疫因子含量
回肠、盲肠和结肠组织的IL-10、TNF-α、sIgA浓度如表3所示。对于MS猪,回肠IL-10含量在18N组显著低于9N组,盲肠TNF-α含量在13.5N和22.5N组中显著降低(<0.05);对于DLY猪,盲肠TNF-α含量在13.5N组显著降低(<0.05),但在22.5N组则显著增加(<0.05)。结肠免疫指标未发现显著变化。盲肠TNF-α的饲粮主效应、品种主效应及其交互效应显著(<0.01)。
2.2 肠道杯状细胞数量
十二指肠、空肠、回肠、盲肠、结肠杯状细胞数量如表4所示。对于MS猪,空肠、回肠、盲肠中13.5N、18N、22.5N组的杯状细胞数量均显著高于9N组(<0.01),结肠中13.5N、18N组的杯状细胞数量显著高于9N组(<0.01);对于DLY猪,十二指肠、空肠、盲肠中各处理组的杯状细胞数量显著高于9N组(<0.01),回肠、结肠中18N、22.5N组杯状细胞数量显著高于9N组(<0.01)。各肠段的杯状细胞数量的品种效应显著(<0.01)。饲粮和品种的互作效应对回肠和结肠杯状细胞数量影响显著(<0.01)。
2.3 肠道黏蛋白基因及紧密连接蛋白基因mRNA表达
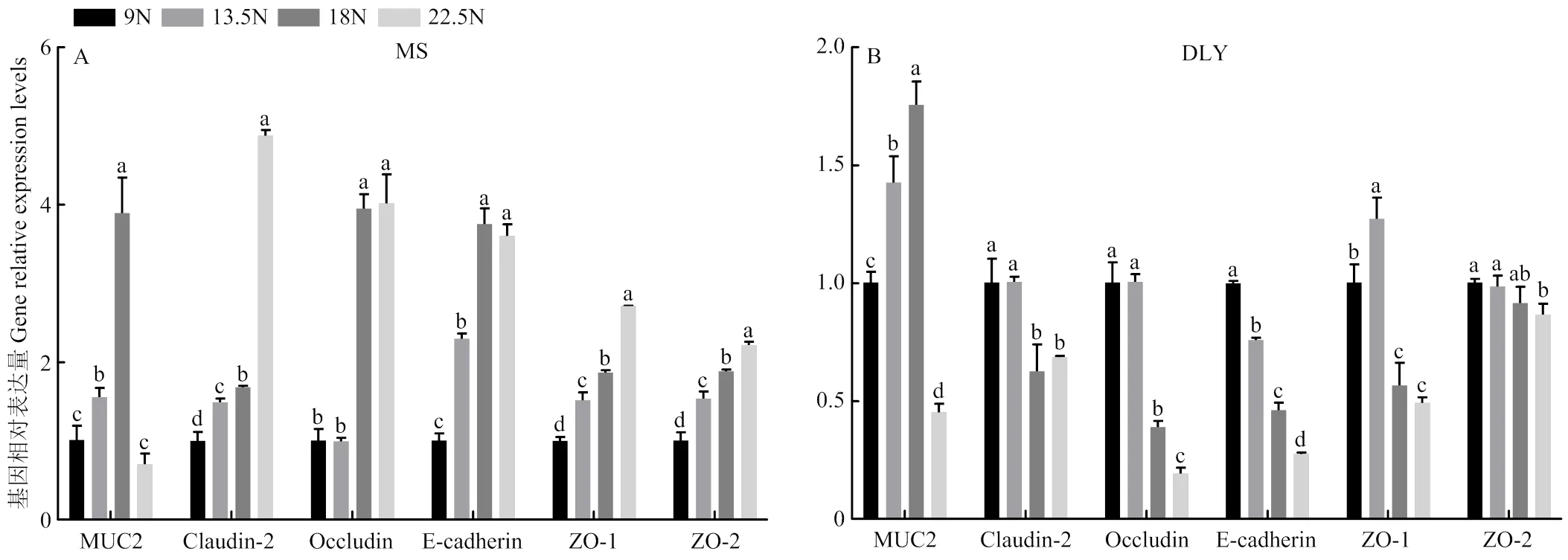
由图1可知,在MS猪和DLY猪中,与9N相比,13.5N和18N组结肠表达水平显著提高,而22.5N组显著降低了DLY的表达水平(<0.05),MS猪和DLY猪均在18N组表达水平最高。对于MS猪,与9N组相比,各大豆皮处理组显著提升了结肠的、、、表达水平(<0.05),18N、22.5N组显著提高了表达水平(<0.05)。对于DLY猪,与9N组相比,、的表达水平在18N、22.5N组显著降低,表达水平在大豆皮处理组中均显著降低(<0.05),表达水平仅在22.5N组显著降低(<0.05)。对于MS猪,18N、22.5N组的紧密连接蛋白基因表达水平相对较高;对于DLY猪,9N和13.5N组的紧密连接蛋白基因表达水平相对较高。

表3 饲粮纤维水平对猪肠道黏膜免疫因子含量的影响
同行数据标字母相同或无字母表示差异不显著(0.05),不同小写字母表示差异显著(<0.05)。下同
In the same row, values without letter or with the same letters meant no significant difference (>0.05), while with different small letters meant significant difference (<0.05). The same as below
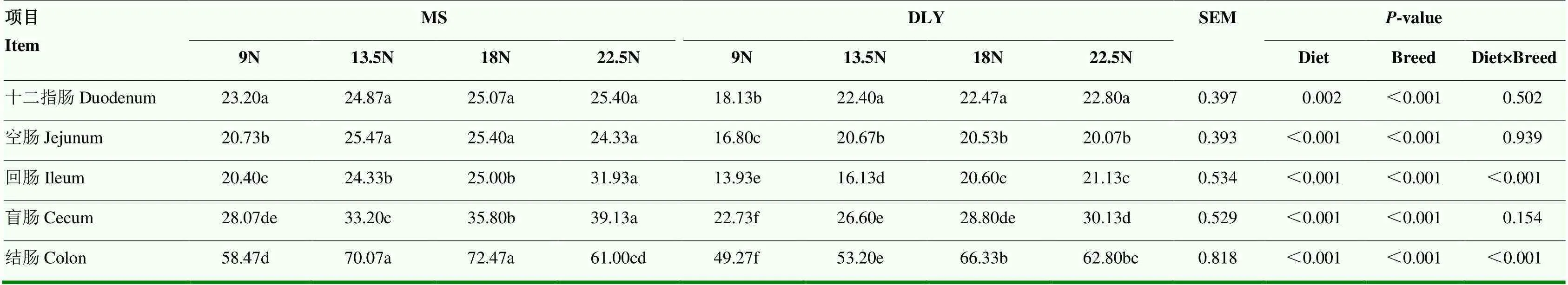
表4 饲粮纤维水平对猪肠道杯状细胞数量的影响
免疫组化结果显示了Occludin和ZO-1蛋白在MS和DLY结肠中的分布(图2-A,B),免疫组化评分反映了该蛋白的表达情况(图2-C,D)。由图可见,MS猪在18N和22.5N组免疫评分显著升高,而DLY猪在18N和22.5N组免疫评分显著降低。
2.4 结肠内容物微生物组分析
2.4.1 物种组成分析 在保留至少1个样本中物种丰度大于0.1%的条件下,MS和DLY猪分别筛选出90和86个属分类水平下的物种,在MS猪和DLY猪不同纤维水平处理中丰度排名前20的属水平物种如表5、6所示。对于MS猪,与MS_9N组相比,MS_13.5N、MS_18N、MS_22.5N组的大肠埃希菌-志贺氏菌属丰度显著降低(<0.05),分别降低了98.28%、98.18%、82.20%;MS_13.5N组中乳酸杆菌属、MS_18N组中的普雷沃氏菌科_NK3B31属、MS_22.5N组中的甲烷短杆菌属的丰度显著提高(<0.05),且均成为该组的优势菌属。对于DLY猪,与DLY_9N组相比,DLY_13.5N组的甲烷短杆菌属、密螺旋体_2属丰度显著提高(<0.05);DLY_18N组的链球菌属、瘤胃菌科UCG-014属、拟普雷沃菌属丰度均显著提高(<0.05);DLY_22.5N组的毛螺菌属丰度显著提高(<0.05);4个纤维水平组的优势菌属均为乳酸杆菌属。
不同小写字母表示不同纤维水平组差异显著(P<0.05)。下同
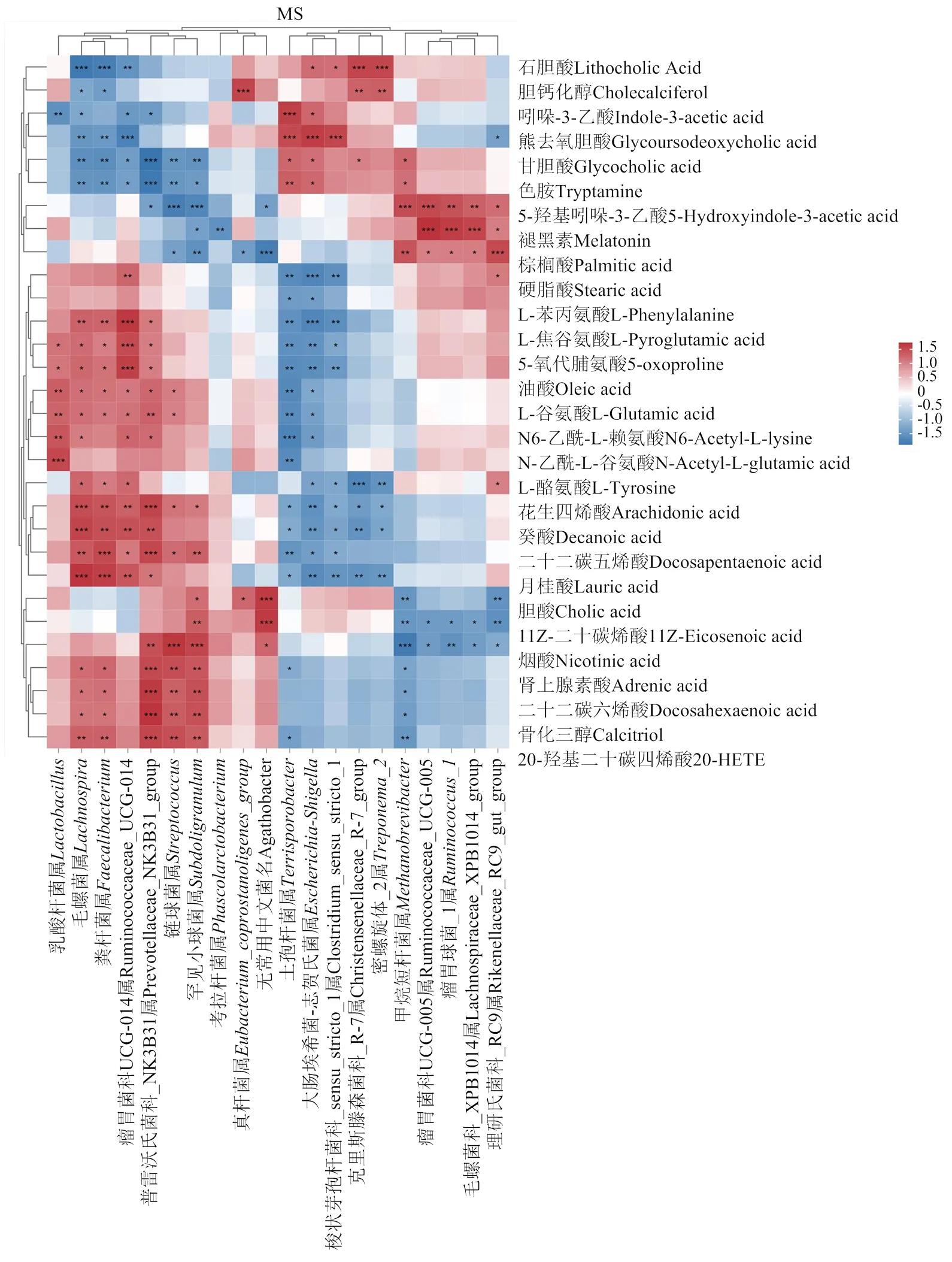
2.4.2 结肠微生物与肠道屏障基因表达量关联分析 由图3-A可知,对于MS猪来说,普雷沃氏菌科_NK3B31属、粪杆菌属、毛螺菌属、罕见小球菌属、瘤胃菌科UCG-014属、链球菌属与表达量呈显著正相关(<0.05);考拉杆菌属与表达量、毛螺菌属与表达量呈显著正相关(<0.05);而大肠埃希菌-志贺氏菌属、甲烷短杆菌属、土孢杆菌属与的表达量呈显著负相关(<0.05);真杆菌属、克里斯滕森菌科_R-7属、密螺旋体_2属乳酸杆菌属、与紧密连接蛋白基因表达量呈显著负相关(<0.05)。由图3-B可知,对于DLY来说,链球菌属、真杆菌属、密螺旋体_2属、克里斯滕森菌科_R-7属与表达量呈显著正相关(<0.05),而乳酸杆菌属、瘤胃菌科UCG-005属、巨型球菌与MUC2表达量呈显著负相关(<0.05);瘤胃菌科UCG-002属、甲烷杆菌属、梭状芽孢杆菌科_sensu_stricto_1属、毛螺菌科_XPB1014属、艾克曼菌属与紧密连接蛋白基因呈显著正相关(<0.05),毛螺菌属、粪杆菌属、瘤胃菌科UCG-014属、拟普雷沃菌属、瘤胃球菌_1属与紧密连接蛋白基因呈显著负相关(<0.05)。

表5 马身猪不同纤维水平组丰度排名前20的属
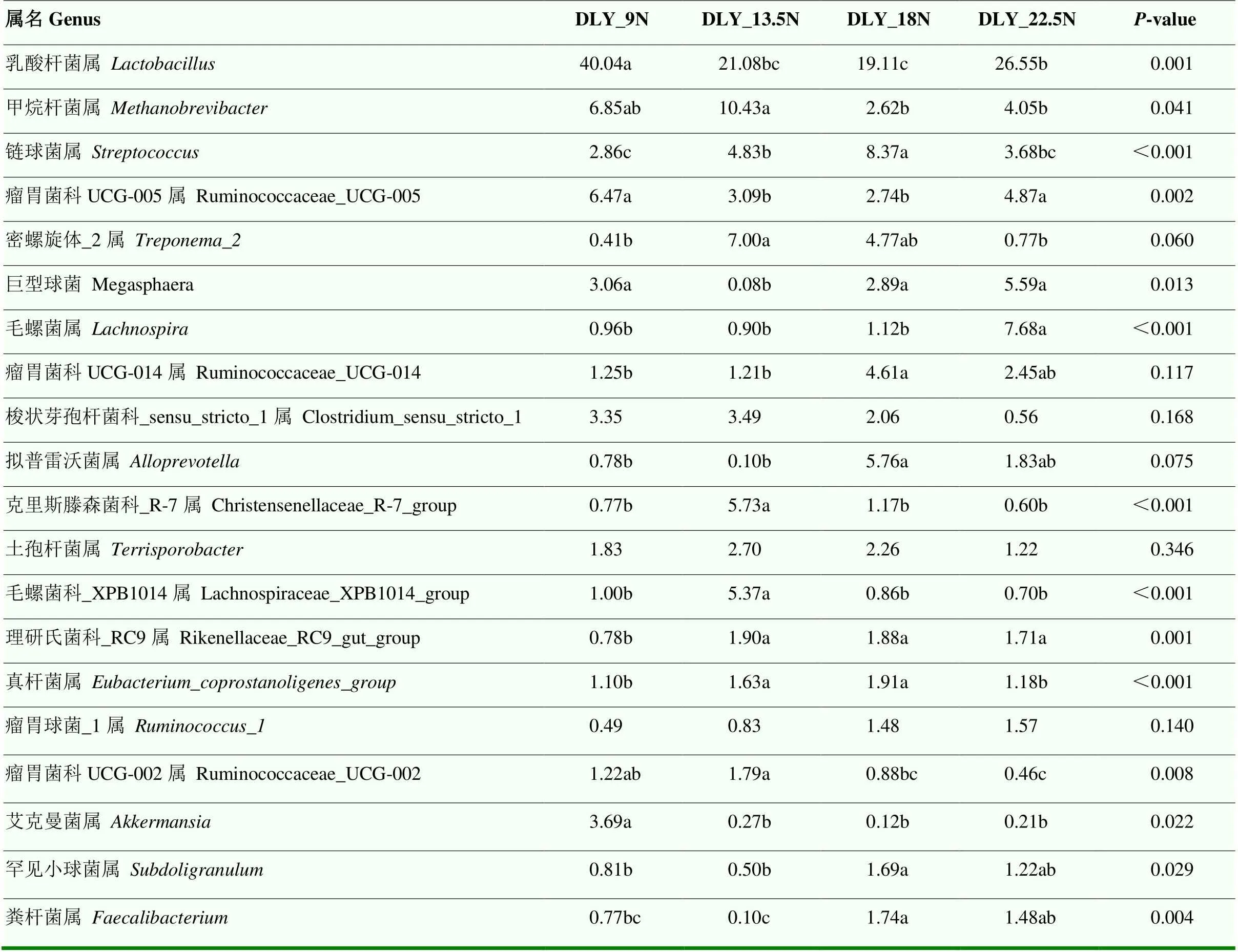
表6 杜长大猪不同纤维水平组丰度排名前20的属
2.5 结肠内容物代谢组学分析
2.5.1 PLS-DA分析 笔者将正、负离子模式下的代谢物合并生成了新的代谢集,对所有代谢物进行了PLS-DA分析。由图4可知,在MS猪和DLY猪中,13.5N、18N、22.5N均与9N之间有明显分离,各比较组的R2Y值和Q值均接近于1,表示模型具有良好的解释能力和预测能力。
2.5.2 差异代谢物分析 笔者以PLS-DA模型中VIP>1和T检验<0.05为标准来筛选不同比较组间的差异代谢物。结果表明,MS_13.5N-vs-MS_9N、MS_18N-vs-MS_9N、MS_22.5N-vs-MS_9N比较组中分别有49、44、118种显著上调的差异代谢物,有109、105、78种显著下调的差异代谢物;DLY_13.5N-vs-DLY_9N、DLY_18N-vs-DLY_9N、DLY_22.5N-vs-DLY_9N比较组中分别有50、42、71种差异代谢物显著上调,有72、135、68种差异代谢物显著下调。差异代谢物主要包括脂肪酰基类、类固醇和类固醇衍生物、羧酸及其衍生物等物质。
MS猪和DLY猪不同比较组部分差异代谢物及差异倍数如表7、8所示。对于MS猪,与MS_9N组相比,棕榈酸、硬脂酸、月桂酸、癸酸等脂肪酰类物质在MS_13.5N、MS_18N、MS_22.5N组中均显著上调,其中月桂酸、癸酸在MS_18N组中上调倍数达到了16.22和24.33倍;石胆酸、胆酸在MS_13.5N、MS_18N、MS_22.5N组中均显著下调;熊去氧胆酸、脱氧胆酸、甘胆酸在MS_13.5N、MS_18N组中均显著下调,但在MS_22.5N组中显著上调;L-酪氨酸、L-苯丙氨酸、5-氧代脯氨酸在3个处理组中均显著上调,L-谷氨酸、N6-乙酰-L-赖氨酸、L-焦谷氨酸在MS_13.5N、MS_18N组中均显著上调,但在MS_22.5N组中显著下调。对于DLY猪,与DLY_9N组相比,石胆酸在DLY_13.5N、DLY_18N、DLY_22.5N组中均显著上调;脱氧胆酸、胆酸在DLY_13.5N、DLY_18N组中显著下调;L-酪氨酸、L-谷氨酸、L-焦谷氨酸、苯丙氨酸、5-氧代脯氨酸、L-赖氨酸、L-哌啶酸、N-乙酰-L-谷氨酸在DLY_13.5N、DLY_18N组中显著上调,而在DLY_22.5N组中显著下调。
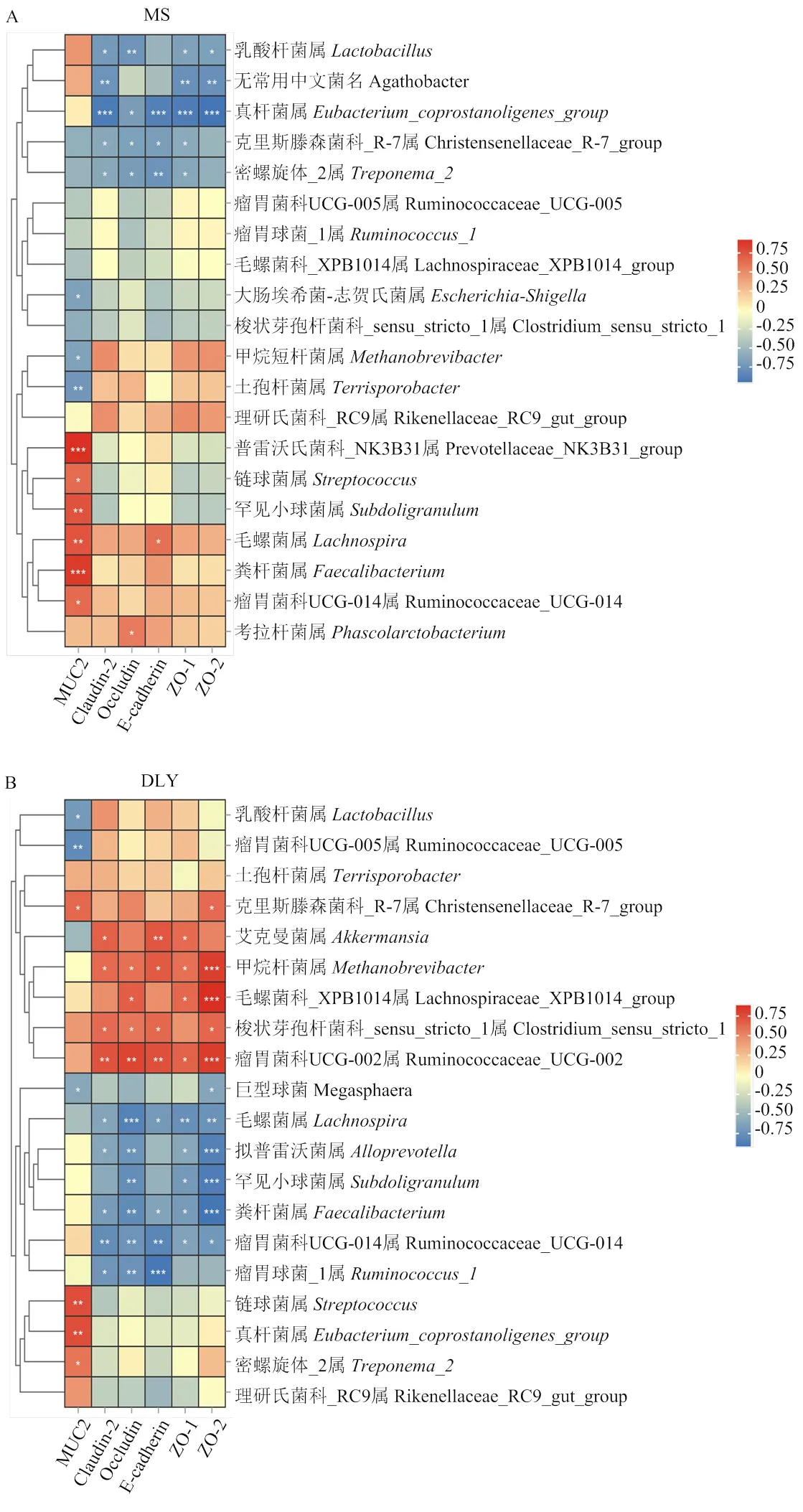
图3 结肠微生物丰度与肠道屏障相关基因表达量的相关性分析
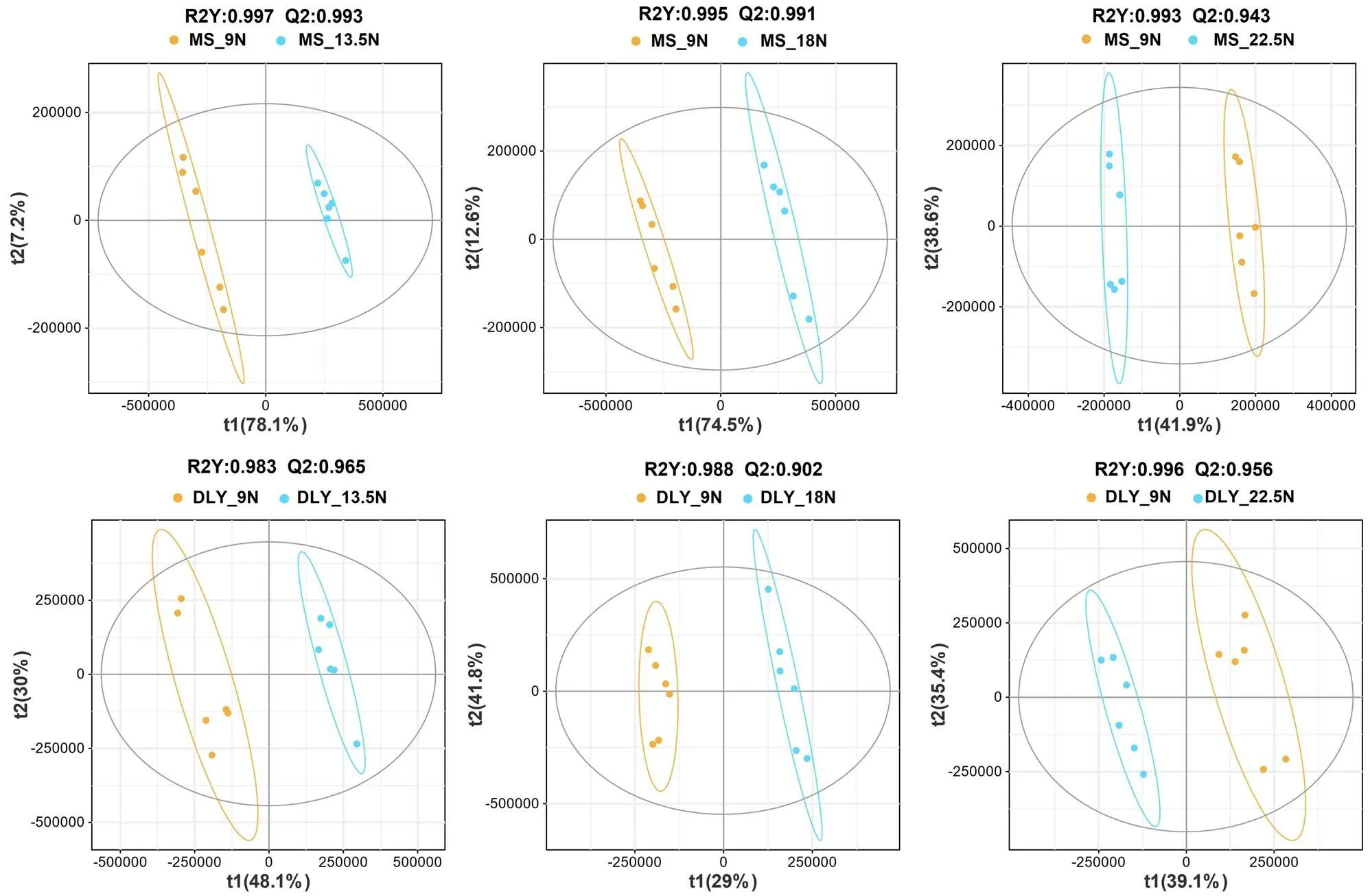
图4 不同纤维水平组间的偏最小二乘判别分析(PLS-DA)
2.5.3 KEGG富集通路分析 图5展示了各比较组的差异显著的代谢通路(<0.05)。对于MS猪,在MS_13.5N-vs-MS_9N中发现的差异代谢物显著富集在脂肪酸生物合成、脂肪酸降解、脂肪酸代谢等通路;在MS_18N-vs-MS_9N比较组中,不饱和脂肪酸的生物合成是差异代谢物主要富集的通路;在MS_22.5N- vs-MS_9N比较组中,胆汁分泌和碳水化合物消化和吸收这两个通路显著富集。对于DLY猪,苯丙氨酸代谢是DLY_13.5N-vs-DLY_9N比较组富集的代谢途径;在DLY_18N-vs-DLY_9N比较组中,差异代谢物富集在唾液分泌和脂肪酸生物合成;碳水化合物消化和吸收是DLY_22.5N-vs-DLY_9N比较组代谢物显著富集的通路。
免疫系统和免疫疾病通路上的差异代谢产物如表9所示,不同纤维水平组的代谢物的丰度如图6所示。结果表明MS猪的环化GMP、花生四烯酸在MS_18N组的丰度最高,而胆钙化醇在MS_18N组的丰度最低,这些代谢物主要富集在血小板活化、FcγR介导的吞噬作用、FcεRI信号通路、类风湿性关节炎代谢通路上;对于DLY猪,环化GMP和前列腺素H2均在DLY_18N丰度最高。
2.5.4 微生物组与代谢组关联分析 图7展示了马身猪和杜长大猪前20个微生物菌属与差异代谢产物的Spearman相关分析结果。在MS猪中,石胆酸与梭状芽孢杆菌科_sensu_stricto_1属和克里斯滕森菌科_R-7属呈显著正相关,脱氧胆酸、熊去氧胆酸和甘胆酸与土孢杆菌属、大肠埃希菌-志贺氏菌属呈显著正相关,吲哚-3-乙酸与梭状芽孢杆菌科_sensu_ stricto_1属和大肠埃希菌-志贺氏菌属呈显著正相关。对于DLY猪,脱氧胆酸和胆酸与乳酸杆菌属、瘤胃菌科UCG-005属呈显著正相关,3-(2-羟乙基)吲哚[3-(2-Hydroxyethyl)indole]与梭状芽孢杆菌科_sensu_stricto_1属呈显著正相关。
3 讨论
3.1 饲粮纤维水平对猪肠道屏障功能的影响
在无抗养殖的大环境下,维持畜禽的肠道健康是提高其生产性能及自身免疫力的关键。由肠道上皮、黏液层、肠道微生物等组成的肠道屏障能够防止肠内的有害物质如细菌和毒素穿过肠黏膜进入体内,紧密连接蛋白是决定肠黏膜通透性和物理屏障功能的关键性因素[18]。肠道屏障受损会影响动物对营养物质的消化吸收,造成微生物失调,肠道通透增强,致病菌入侵体内的概率增大,容易引起肠道炎症[19]。膳食纤维在预防肠道疾病(腹泻、便秘和肠易激综合征)和改善人类和动物的肠道健康方面发挥了重要作用[20]。对于高精料饲粮造成的结肠上皮屏障功能破坏的山羊模型来说,饲喂大豆皮能够促进结肠上皮中、、和等的表达,说明大豆皮纤维能够逆转高精料饮食对结肠上皮细胞的损伤[21]。饲粮中添加燕麦麸皮明显改善了猪回肠IL-10等免疫相关指标,促进了结肠黏蛋白等基因表达[9]。本研究中MS猪的肠道免疫因子水平基本保持在平衡状态,13.5N、18N组的结肠表达水平均显著提高,紧密连接蛋白的表达水平也在各纤维添加组有所提高,说明饲粮纤维对MS猪肠道屏障功能起到促进作用。DLY猪盲肠TNF-α含量在22.5N组显著升高,这表明22.5N组盲肠上皮可能发生了轻微炎症,这与前人研究中饲喂高谷物饲料造成山羊胃肠道上皮损伤,促炎细胞因子TNF-a、IL-1β和IL-6的基因表达水平上调的结果相似[22-24],这说明过高的纤维水平可能会导致胃肠道内出现炎症。此外DLY猪结肠紧密连接蛋白在18N和22.5N组表达降低,表明高纤维饲粮可能导致DLY猪结肠紧密连接屏障功能受损及通透性增加,其原因可能是由于高纤维日粮在DLY肠道内发酵不充分,为DLY猪提供的能量及养分不足,造成了肠道营养摄入异常,这与LI等[25]研究中提到的高纤维水平饲粮对猪肠道屏障功能造成的负面影响一致,因此利用纤维调节猪肠道健康时要注意纤维含量及猪品种等因素。
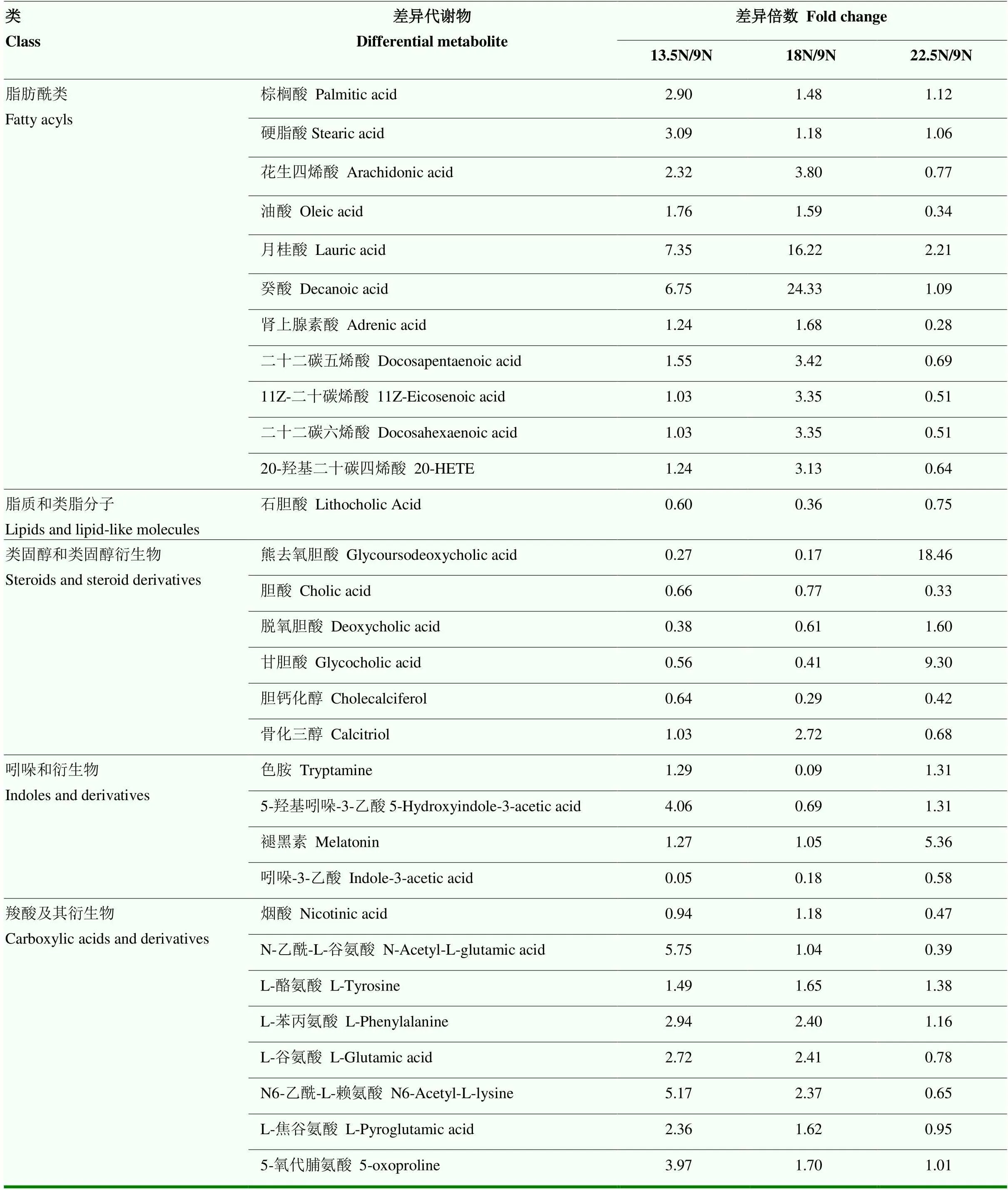
表7 马身猪不同比较组部分差异代谢物及差异倍数
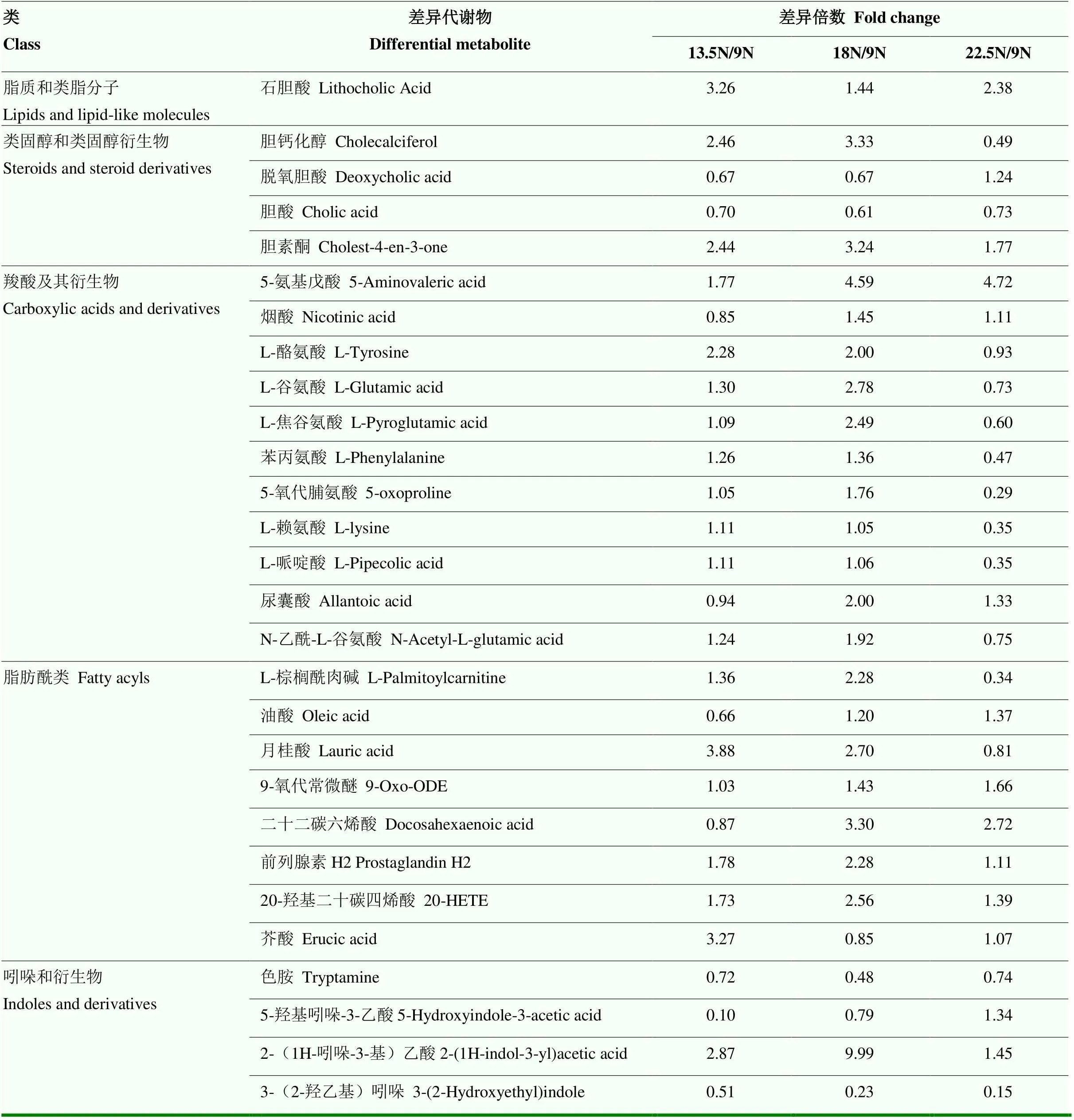
表8 杜长大猪不同比较组差异代谢产物及差异倍数
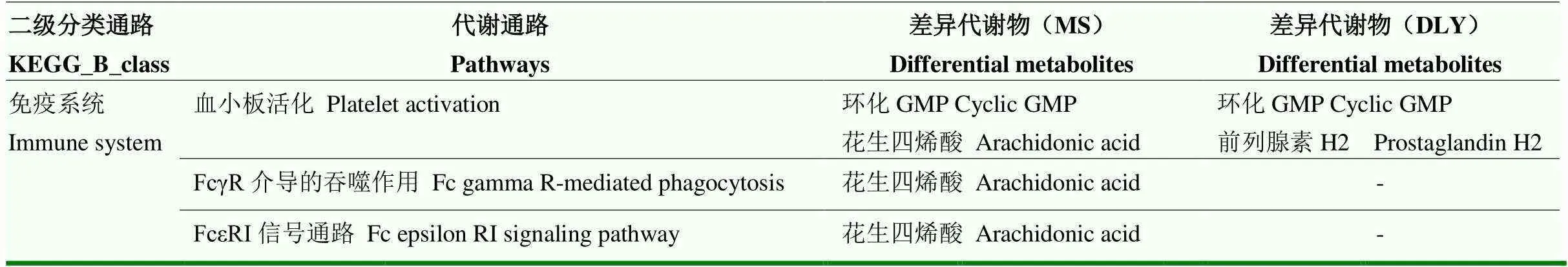
表9 马身猪和杜长大猪富集在免疫系统通路上的差异代谢产物
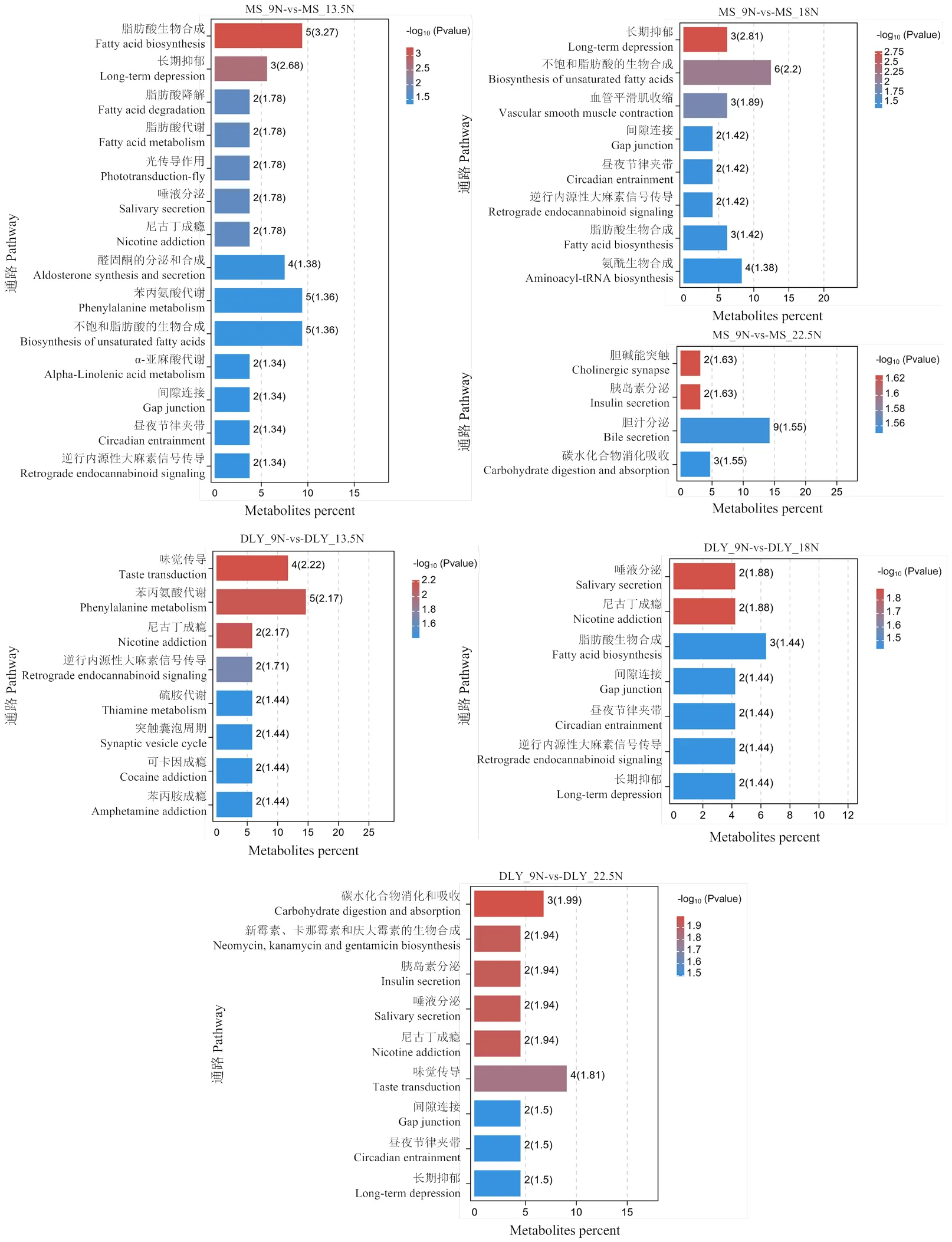
图5 不同纤维水平组的差异KEGG富集通路分析
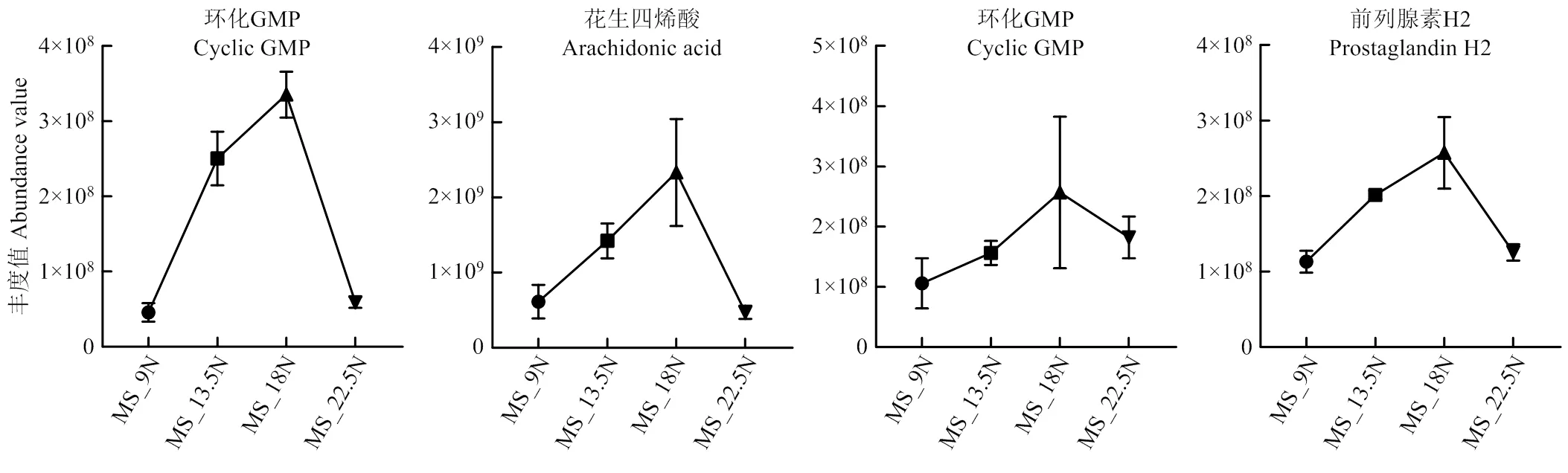
图6 免疫通路相关代谢物在不同纤维水平组的丰度值
3.2 饲粮纤维水平对结肠微生物的影响
肠道内的微生物区系通过发酵利用饲粮中的营养物质,协助宿主进行消化代谢,为肠道上皮细胞提供充足的能量和营养[26]。饲粮纤维能够优化微生物群落结构,促进有益菌的增殖,抑制有害菌的生长。MS_13.5N、MS_18N和MS_22.5N组有害菌大肠埃希菌-志贺氏菌属和梭状芽孢杆菌科_sensu_stricto_1属的丰度显著降低。大肠埃希菌-志贺氏菌属可引起动物的严重腹泻,NDF水平提高到13.5%和18%时,能够有效降低致病菌的丰度。梭状芽孢杆菌科_sensu_ stricto_1属是伪膜性肠炎和抗生素相关性腹泻的致病菌,在肠道内过多繁殖并释放毒素,导致肠道感染[27]。MS_18N组的普雷沃氏菌科_NK3B31属、MS_22.5N组和DLY_13.5N组的甲烷短杆菌属、理研氏菌科_RC9属、DLY_13.5N组的克里斯滕森菌科_R-7属的丰度均显著升高。瘤胃菌科UCG-005属、理研氏菌科_RC9属、普雷沃氏菌科_NK3B31属均是与纤维发酵有关的菌群,有益菌克里斯滕森菌科_R-7属广泛存在于肠道中,对维护肠道健康起重要作用[28-29]。甲烷短杆菌属是氢营养型甲烷生成途径中最重要的产甲烷菌,饲粮纤维可增加猪后肠甲烷短杆菌,细菌产生的氢被甲烷细菌消耗,进而促进纤维的降解[30]。宿主与肠道微生物的相互作用对肠道健康具有重要意义。本研究中在结肠微生物与结肠屏障相关基因的关联分析,发现部分肠道菌群与肠屏障相关基因呈现正相关。MS猪的瘤胃菌科UCG-014属及粪杆菌属、DLY猪的理研氏菌科_RC9属均与表达量呈显著正相关。研究表明瘤胃菌科,粪杆菌属及理研氏菌科_RC9属均可通过促进丁酸的产生[31],进而促进黏蛋白的分泌来维持黏液屏障[32]。
3.3 饲粮纤维水平对结肠代谢产物的影响
不同纤维水平处理对结肠代谢产物有较大的影响。对于MS猪,13.5N、18N、22.5N与9N相比,差异代谢物大多为脂肪酰基类、类固醇和类固醇衍生物、羧酸及其衍生类物质,主要富集到的代谢通路也大多在脂肪酸代谢通路上。这与前人研究中膳食纤维调节脂质代谢的结果是一致的[13,33]。其次在MS猪各处理组中2-羟基苯丙氨酸、D-半乳糖均发生富集,这两种物质均参与碳水化合物消化和吸收。碳水化合物的消化和吸收对机体能量代谢具有重要意义[34],因此饲粮中添加纤维能够促进MS猪机体的能量代谢。对于DLY猪,差异代谢物大多富集在苯丙氨酸代谢、唾液分泌、脂肪酸生物合成、碳水化合物消化和吸收通路。甲基咪唑乙酸和氢化肉桂酸分别是组氨酸和苯丙氨酸代谢的主要代谢产物[35-36],说明在高纤维组中DLY猪的氨基酸代谢较为活跃。与免疫系统相关的代谢通路上发现了环化GMP、花生四烯酸及前列腺素H2等3种差异代谢产物,且这3种代谢产物在18N组丰度最高。研究表明血小板除止血作用外,也是免疫系统的组成部分,活化的血小板产生可溶性因子并直接与免疫细胞相互作用,进而调控炎症与免疫反应[37]。由FcγR产生的刺激或抑制信号会导致共刺激分子和细胞因子的调节,从而进一步调节对抗原的反应[38]。以上结果表明MS和DLY猪均在18N组的免疫反应较强。
宿主与肠道微生物的相互作用对肠道健康具有重要意义,肠道微生物参与肠道代谢物的合成、消化、发酵和次级代谢过程[39]。已有研究表明除了由肠道菌群发酵纤维产生的短链脂肪酸,胆汁酸和色氨酸在被肠道微生物转化后产生的代谢物也在肠道健康中发挥着重要作用[40-41],因此笔者在代谢组学中筛选了色氨酸代谢和胆汁酸代谢通路上富集到的代谢产物,通过关联分析发现这些代谢物与结肠微生物之间均存在很强的相关性。MS猪的色氨酸代谢产物吲哚-3-乙酸与梭状芽孢杆菌科_sensu_stricto_1属和大肠埃希菌-志贺氏菌属呈正相关,DLY猪的3-(2-羟乙基)吲哚也与梭状芽孢杆菌属呈正相关。研究表明梭状芽孢杆菌在氧化还原过程中生成吲哚乙酸[42],大肠杆菌表达的色氨酸酶可以将色氨酸转化为吲哚[43],而吲哚-3-乙酸和吲哚作为芳香烃受体的配体,以芳香烃受体依赖性方式调节肠道屏障完整性[44-45],说明肠道菌群能够参与色氨酸代谢的吲哚途径进而维持肠道稳态。对于MS猪和DLY猪的胆汁酸代谢产物,如石胆酸、脱氧胆酸、甘胆酸和胆酸等,与拟杆菌属、乳酸菌属、大肠杆菌属、消化性链球菌属及瘤胃球菌呈显著正相关。拟杆菌、乳酸菌等参与胆汁酸去结合过程,梭状芽孢杆菌、大肠杆菌、消化性链球菌属及瘤胃球菌参与C3、C7和C12羟基的氧化和差向异构化等生物转化过程[46],通过水解脱羟作用将牛磺胆酸转化为脱氧胆酸,将甘氨鹅脱氧胆酸脱羟转化成石胆酸,结合已发表的研究中胆汁酸及其受体对肠屏障功能的改善作用[47],表明微生物可能会通过参与胆汁酸代谢来影响肠道屏障功能。本试验结果提示改变饲粮纤维水平能够通过微生物途径调节肠道内色氨酸及胆汁酸代谢进而影响肠道免疫屏障功能,但具体的作用效果及调节机制仍需进一步研究。
4 结论
饲粮纤维能够改善肠道健康,18% NDF和13.5% NDF饲粮分别对马身猪和杜×长×大三元杂交猪的肠道免疫功能和肠道屏障功能有促进作用。对于马身猪,18N组的肠道免疫因子含量降低,及紧密连接蛋白基因表达量升高,普雷沃氏菌科_NK3B31属等有益菌丰度提高,大肠埃希菌-志贺氏菌属等有害菌丰度降低。对于杜长大猪,13.5N组的促炎因子TNF-α含量降低,表达量升高,克里斯滕森菌科_R-7属等有益菌丰度提高。其次,肠道微生物丰度与肠道屏障基因表达量以及与胆汁酸和色氨酸代谢通路上的关键代谢物丰度之间均表现出较强的相关性,说明饲粮纤维水平通过影响肠道微生物对短链脂肪酸、胆汁酸及色氨酸代谢产物的调节来增强肠道屏障功能。因此,饲粮中纤维的添加量应根据猪品种及特性进行调整,才能充分发挥纤维对肠道的积极作用。
[1] BAI Y, ZHOU X J, ZHAO J B, WANG Z Y, YE H, PI Y, CHE D, HAN D D, ZHANG S, WANG J J. Sources of dietary fiber affect the SCFA production and absorption in the hindgut of growing pigs. Frontiers in Nutrition, 2022(8):719935.
[2] YANG P, ZHAO J B. Variations on gut health and energy metabolism in pigs and humans by intake of different dietary fibers. Food Science & Nutrition, 2021, 9(8): 4639-4654.
[3] 曲强. 猪饲料中大豆皮营养价值探析. 中国畜禽种业, 2018, 14(12): 38-39.
QU Q. Analysis on nutritional value of soybean skin in pig feed. The Chinese Livestock and Poultry Breeding, 2018, 14(12): 38-39. (in Chinese)
[4] JHA R, FOUHSE J M, TIWARI U P, LI L G, WILLING B P. Dietary fiber and intestinal health of monogastric animals. Frontiers in Veterinary Science, 2019, 6: 48.
[5] LI H, YIN J, TAN B, CHEN J S, ZHANG H H, LI Z Q, MA X K. Physiological function and application of dietary fiber in pig nutrition: a review. Animal Nutrition (Zhongguo Xu Mu Shou Yi Xue Hui), 2021, 7(2): 259-267.
[6] 郭飞, 李爱军, 杨明华, 潘洪彬, 赵红业, 魏红江, 赵素梅. 日粮纤维调节猪生产性能及肠道健康的研究进展. 饲料研究, 2021, 44(22): 117-122.
GUO F, LI A J, YANG M H, PAN H B, ZHAO H Y, WEI H J, ZHAO S M. Research progress of dietary fiber for regulating production performance and intestinal health of pigs. Feed Research, 2021, 44(22): 117-122. (in Chinese)
[7] PENG J, TANG Y M, HUANG Y H. Gut health: the results of microbial and mucosal immune interactions in pigs. Animal Nutrition (Zhongguo Xu Mu Shou Yi Xue Hui), 2021, 7(2): 282-294.
[8] SLIFER Z M, BLIKSLAGER A T. The integral role of tight junction proteins in the repair of injured intestinal epithelium. International Journal of Molecular Sciences, 2020, 21(3): 972.
[9] LUO Y H, LIU Y, LI H, ZHAO Y, WRIGHT A D G, CAI J Y, TIAN G, MAO X B. Differential effect of dietary fibers in intestinal health of growing pigs: outcomes in the gut microbiota and immune-related indexes. Frontiers in Microbiology, 2022, 13: 843045.
[10] SU W F, JIANG Z P, WANG C, ZHANG Y, GONG T, WANG F Q, JIN M L, WANG Y Z, LU Z Q. Co-fermented defatted rice bran alters gut microbiota and improves growth performance, antioxidant capacity, immune status and intestinal permeability of finishing pigs. Animal Nutrition, 2022, 11: 413-424.
[11] TIAN M L, LI D T, MA C, FENG Y, HU X S, CHEN F. Barley leaf insoluble dietary fiber alleviated dextran sulfate sodium-induced mice colitis by modulating gut microbiota. Nutrients, 2021, 13(3): 846.
[12] EL KAOUTARI A, ARMOUGOM F, GORDON J I, RAOULT D, HENRISSAT B. The abundance and variety of carbohydrate-active enzymes in the human gut microbiota. Nature Reviews Microbiology, 2013, 11(7): 497-504.
[13] WU G F, TANG X J, FAN C, WANG L, SHEN W J, REN S E, ZHANG L Z, ZHANG Y M. Gastrointestinal tract and dietary fiber driven alterations of gut microbiota and metabolites in durco × bamei crossbred pigs. Frontiers in Nutrition, 2021, 8: 806646.
[14] VERSPREET J, DAMEN B, BROEKAERT W F, VERBEKE K, DELCOUR J A, COURTIN C M. A critical look at prebiotics within the dietary fiber concept. Annual Review of Food Science and Technology, 2016, 7: 167-190.
[15] WU W, XIE J, ZHANG H. Dietary fibers influence the intestinal SCFAs and plasma metabolites profiling in growing pigs. Food & Function, 2016, 7(11): 4644-4654.
[16] TANES C, BITTINGER K, GAO Y, FRIEDMAN E S, NESSEL L, PALADHI U R, CHAU L, PANFEN E, FISCHBACH M A, BRAUN J, XAVIER R J, CLISH C B, LI H Z, BUSHMAN F D, LEWIS J D, WU G D. Role of dietary fiber in the recovery of the human gut microbiome and its metabolome. Cell Host & Microbe, 2021, 29(3): 394-407.e5.
[17] JIN J S, YU C P, SUN G H, LIN Y F, CHIANG H, CHAO T K, TSAI W C, SHEU L F. Increasing expression of fascin in renal cell carcinoma associated with clinicopathological parameters of aggressiveness. Histology and Histopathology, 2006, 21(12): 1287-1293.
[18] 李彦军, 牛骁麟, 张千, 王国秀, 李发弟, 李飞, 李冲, 庞鑫, 贾莉, 樊海苗. 代乳粉水平对羔羊血液指标和肠道屏障功能的影响. 中国农业科学, 2020, 53(2): 409-417.
LI Y J, NIU X L, ZHANG Q, WANG G X, LI F D, LI F, LI C, PANG X, JIA L, FAN H M. Effects of milk replacer feeding level on hematology index and gut barrier function in lambs. Scientia Agricultura Sinica, 2020, 53(2): 409-417. (in Chinese)
[19] YANG Y, JIANG X M, CAI X L, ZHANG L J, LI W T, CHE L Q, FANG Z F, FENG B, LIN Y, XU S Y, LI J, ZHAO X L, WU D, ZHUO Y. Deprivation of dietary fiber enhances susceptibility of piglets to lung immune stress. Frontiers in Nutrition, 2022, 9: 827509.
[20] BEUKEMA M, FAAS M M, DE VOS P. The effects of different dietary fiber pectin structures on the gastrointestinal immune barrier: impact via gut microbiota and direct effects on immune cells. Experimental & Molecular Medicine, 2020, 52(9): 1364-1376.
[21] ZHANG K, TU Y L, GAO L P, MENG M J, BAI Y F. Replacement of grains with soybean hulls ameliorates SARA-induced impairment of the colonic epithelium barrier function of goats. BMC Veterinary Research, 2018, 14(1): 376.
[22] ZHANG R Y, YE H M, LIU J H, MAO S Y. High-grain diets altered rumen fermentation and epithelial bacterial community and resulted in rumen epithelial injuries of goats. Applied Microbiology and Biotechnology, 2017, 101(18): 6981-6992.
[23] ZHANG R Y, JIN W, FENG P F, LIU J H, MAO S Y. High-grain diet feeding altered the composition and functions of the rumen bacterial community and caused the damage to the laminar tissues of goats. Animal: an International Journal of Animal Bioscience, 2018, 12(12): 2511-2520.
[24] YE H M, LIU J H, FENG P F, ZHU W Y, MAO S Y. Grain-rich diets altered the colonic fermentation and mucosa-associated bacterial communities and induced mucosal injuries in goats. Scientific Reports, 2016, 6(1): 1-13.
[25] LI Q Y, GABLER N K, LOVING C L, GOULD S A, PATIENCE J F. A dietary carbohydrase blend improved intestinal barrier function and growth rate in weaned pigs fed higher fiber diets. Journal of Animal Science, 2018, 96(12): 5233-5243.
[26] KUMAR J, RANI K, DATT C. Molecular link between dietary fibre, gut microbiota and health. Molecular Biology Reports, 2020, 47(8): 6229-6237.
[27] 邓富丽, 申丹, 钟儒清, 张顺芬, 李滔, 孙曙东, 陈亮, 张宏福. 体外法优化玉米: 杂粕型饲粮的非淀粉多糖酶谱及其对育肥猪肠道微生物的影响. 中国农业科学, 2022, 55(16): 3242-3255.
DENG F L, SHEN D, ZHONG R Q, ZHANG S F, LI T, SUN S D, CHEN L, ZHANG H F. Non-starch polysaccharide enzymes cocktail of corn-miscellaneous meal-based diet optimization bymethod and its effects on intestinal microbiome in finishing pigs. Scientia Agricultura Sinica, 2022, 55(16): 3242-3255. (in Chinese)
[28] GAO Q T, SUN G M, DUAN J J, LUO C Z, YANGJI C D, ZHONG R Q, CHEN L, ZHU Y B, WANGDUI B S, ZHANG H F. Alterations in gut microbiota improve SCFA production and fiber utilization in Tibetan pigs fed alfalfa diet. Frontiers in Microbiology, 2022, 13: 969524.
[29] TAO S Y, BAI Y, ZHOU X J, ZHAO J B, YANG H J, ZHANG S, WANG J J.fermentation characteristics for different ratios of soluble to insoluble dietary fiber by fresh fecal microbiota from growing pigs. ACS Omega, 2019, 4(12): 15158-15167.
[30] LUO Y H, CHEN H, YU B, HE J, ZHENG P, MAO X B, TIAN G, YU J, HUANG Z Q, LUO J Q, CHEN D W. Dietary pea fiber increases diversity of colonic methanogens of pigs with a shift fromto-like genus and change in numbers of three hydrogenotrophs. BMC Microbiology, 2017, 17(1): 17.
[31] SHANG Q H, LIU S J, LIU H S, MAHFUZ S, PIAO X S. Impact of sugar beet pulp and wheat bran on serum biochemical profile, inflammatory responses and gut microbiota in sows during late gestation and lactation. Journal of Animal Science and Biotechnology, 2021, 12(1): 54.
[32] LIU Y, YU X J, ZHAO J X, ZHANG H, ZHAI Q X, CHEN W. The role of MUC2mucin in intestinal homeostasis and the impact of dietary components on MUC2expression. International Journal of Biological Macromolecules, 2020, 164: 884-891.
[33] HE B K, NOHARA K, AJAMI N J, MICHALEK R D, TIAN X J, WONG M, LOSEE-OLSON S H, PETROSINO J F, YOO S H, SHIMOMURA K, CHEN Z. Transmissible microbial and metabolomic remodeling by soluble dietary fiber improves metabolic homeostasis. Scientific Reports, 2015, 5(1): 1-12.
[34] ZHANG F, ZHENG W J, XUE Y Q, YAO W. Suhuai suckling piglet hindgut microbiome-metabolome responses to different dietary copper levels. Applied Microbiology and Biotechnology, 2019, 103(2): 853-868.
[35] DING L, REN S, SONG Y X, ZANG C G, LIU Y C, GUO H, YANG W Q, GUAN H, LIU J C. Modulation of gut microbiota and fecal metabolites by corn silk among high-fat diet-induced hypercholesterolemia mice. Frontiers in Nutrition, 2022, 9: 935612.
[36] XU H, PAN L B, YU H, HAN P, FU J, ZHANG Z W, HU J C, YANG X Y, KERANMU A, ZHANG H J, BU M M, JIANG J D, WANG Y. Gut microbiota-derived metabolites in inflammatory diseases based on targeted metabolomics. Frontiers in Pharmacology, 2022, 13: 919181.
[37] 章凡, 王哲, 胡琨, 向倩, 崔一民. 血小板在炎症中的作用: 促血栓形成与免疫功能. 中国临床药理学杂志, 2022, 38(17): 2089-2093.
ZHANG F, WANG Z, HU K, XIANG Q, CUI Y M. The role of platelets in inflammation: Thrombogenesis and immune function. The Chinese Journal of Clinical Pharmacology, 2022, 38(17): 2089-2093. (in Chinese)
[38] JUNKER F, GORDON J, QURESHI O. Fc gamma receptors and their role in antigen uptake, presentation, and T cell activation. Frontiers in Immunology, 2020, 11: 1393.
[39] GHOSH S, WHITLEY C S, HARIBABU B, JALA V R. Regulation of intestinal barrier function by microbial metabolites. Cellular and Molecular Gastroenterology and Hepatology, 2021, 11(5): 1463-1482.
[40] 王宗伟, 付建中, 李洪涛, 李艳青. 丁酸梭菌对肠道屏障的影响机制及其在畜禽养殖中应用的研究进展. 动物营养学报, 2022, 34(6): 3519-3528.
WANG Z W, FU J Z, LI H T, LI Y Q. Research progress on mechanism ofaffecting intestinal barrier and its application in livestock and poultry breeding. Chinese Journal of Animal Nutrition, 2022, 34(6): 3519-3528. (in Chinese)
[41] 王荣蛟, 莫苏, 袁再美, 和世春, 和少英, 郭太情, 刘萍, 毛华明. 肠道微生物的色氨酸代谢物对宿主肠道健康影响的研究进展. 中国畜牧杂志, 2022, 58(3): 7-12.
WANG R J, MO S, YUAN Z M, HE S C, HE S Y, GUO T Q, LIU P, MAO H M. Research progress on the effects of tryptophan metabolites from intestinal microorganisms on host health. Chinese Journal of Animal Science, 2022, 58(3): 7-12. (in Chinese)
[42] DODD D, SPITZER M H, VAN TREUREN W, MERRILL B D, HRYCKOWIAN A J, HIGGINBOTTOM S K, LE A, COWAN T M, NOLAN G P, FISCHBACH M A, SONNENBURG J L. A gut bacterial pathway metabolizes aromatic amino acids into nine circulating metabolites. Nature, 2017, 551(7682): 648-652.
[43] HUBBARD T D, MURRAY I A, PERDEW G H. Indole and tryptophan metabolism: endogenous and dietary routes to ah receptor activation. Drug Metabolism and Disposition: the Biological Fate of Chemicals, 2015, 43(10): 1522-1535.
[44] SCOTT S A, FU J J, CHANG P V. Microbial tryptophan metabolites regulate gut barrier function via the aryl hydrocarbon receptor. Proceedings of the National Academy of Sciences of the United States of America, 2020, 117(32): 19376-19387.
[45] WANG X, YONG C C, OH S. Metabolites ofBYB3and indole activate aryl hydrocarbon receptor to attenuate lipopolysaccharide-induced intestinal barrier dysfunction. Food Science of Animal Resources, 2022, 42(6): 1046-1060.
[46] JIA W, XIE G X, JIA W P. Bile acid–microbiota crosstalk in gastrointestinal inflammation and carcinogenesis. Nature Reviews Gastroenterology & Hepatology, 2018, 15(2): 111-128.
[47] ZENG H W, UMAR S, RUST B, LAZAROVA D, BORDONARO M. Secondary bile acids and short chain fatty acids in the colon: a focus on colonic microbiome, cell proliferation, inflammation, and cancer. International Journal of Molecular Sciences, 2019, 20(5): 1214.
Effects of Dietary Fiber Level on Intestinal Barrier Function, Colonic Microbiota and Metabolites in Pigs
LIU Chang1, CUI ZiXu1, ZUO Zhou1, YUN HongMei2, NIU Jin1, YANG Yang1, GUO XiaoHong1, LI BuGao1, GAO PengFei1, ZHAO Yan1, CAO GuoQing1
1College of Animal Science, Shanxi Agricultural University, Taigu 030801, Shanxi;2Shanxi Animal Husbandry Technology Extension Service Center, Taiyuan 030001, Shanxi
【Objective】Adding fiber raw materials is one of the effective methods to reduce the feed costs. The aim of this study was to investigate the effects of different fiber level diets on the intestinal health of Mashen (MS) pig and Duroc × Landrace × Large (DLY) pig, so as to provide the basis for the rational use of fiber. 【Method】In this study, 80 MS pigs and 80 DLY pigs with an initial body weight of (20 ± 0.5) kg were used as test objects (half of the sows and half of the boars). MS and DLY pigs were divided into four groups each assigned to different diets, with five replicates per treatment and four pigs per replicate. When 0%, 9.35%, 18.64% and 28.03% soybean hulls were added to the corn soybean meal basal diet, the NDF content was 9% (9N), 13.5% (13.5N), 18% (18N) and 22.5% (22.5N), respectively. The test lasted for 30 days. 【Result】 For MS pigs, the content of IL-10 in ileum of 18N group and TNF-α in cecum of 13.5N and 22.5N groups was significantly decreased (<0.05). The number of goblet cells in jejunum, ileum and caecum was increased with the increase of fiber level. In colon, the number of goblet cells and the expression level ofwere significantly increased in 13.5N and 18N groups (<0.05). The expressions of,,,, andof 18N and 22.5N groups were increased significantly (<0.05). The abundance ofin 13.5N, 18N and 22.5N groups were decreased significantly (<0.05), while the abundance ofin 13.5N group,in 18N group andin 22.5N group were increased significantly (<0.05). Palmitic acid, stearic acid, lauric acid and capric acid in 13.5N, 18N and 22.5N groups were significantly increased (<0.05), while lithocholic acid and cholic acid were significantly decreased (<0.05). Differential metabolites were mainly concentrated in the pathways related to lipid metabolism and carbohydrate digestion and absorption. For DLY pigs, the TNF-α content in cecum of 13.5N group was significantly increased (<0.05). The number of goblet cells in each intestinal segment of 13.5N, 18N and 22.5N groups was significantly higher than those of 9N group (<0.05). The expression level of colonicwas increased significantly in 13.5N and 18N groups (<0.05) and decreased significantly in 22.5N group (<0.05). The expression levels of,andsignificantly (<0.05). The abundance ofin 13.5N group,in 18N group andin 22.5N group was significantly increased (<0.05). L-tyrosine, L-glutamic acid, L-pyroglutamic acid, phenylalanine and other derivatives in 13.5N, 18N group were significantly increased (<0.05), while significantly decreased (<0.05) in 22.5N group. Differential metabolites were mainly concentrated in amino acid metabolism pathway. In MS pigs and DLY pigs, there was a strong correlation between microflora and intestinal barrier related genes, as well as tryptophan and bile acid metabolites. 【Conclusion】 Improving the dietary fiber level could strengthen the intestinal barrier function of pigs, increase the abundance of beneficial bacteria, reduce the abundance of harmful bacteria, regulate the metabolism of lipid and amino acids in the colon, affect the metabolism of short-chain fatty acids, tryptophan and bile acids through the microbial pathway, and promote intestinal health.
dietary fiber level; intestinal barrier; microbiota; metabolites; pig

10.3864/j.issn.0578-1752.2023.22.014
2023-02-12;
2023-04-13
山西省高等学校科学研究优秀成果培育项目、山西省研究生创新项目(2021Y345)、山西农业大学生物育种工程项目(YZGC128)、三晋学者支持计划专项经费资助(2016;2017)、山西省现代农业产业技术体系建设专项
刘畅,E-mail:lc53857983@163.com。通信作者曹果清,E-mail:anniecao710502@aliyun.com。通信作者赵燕,E-mail:zhaoyan@sxau.edu.cn
(责任编辑 林鉴非)
