玉米腐霉茎腐病生防木霉菌株的筛选、鉴定及防治效果分析
2023-12-29郭宁孙华马红霞刘树森张海剑石洁郑晓娟董跃广
郭宁,孙华,马红霞,刘树森,张海剑,石洁,郑晓娟,董跃广
玉米腐霉茎腐病生防木霉菌株的筛选、鉴定及防治效果分析
郭宁,孙华,马红霞,刘树森,张海剑,石洁,郑晓娟,董跃广
河北省农林科学院植物保护研究所/农业农村部华北北部作物有害生物综合治理重点实验室/河北省农业有害生物综合防治技术创新中心/河北省作物有害生物综合防治国际科技联合研究中心,河北保定 071000
【目的】筛选对玉米腐霉茎腐病病原菌具有抑制作用的木霉(spp.)菌株,明确其分类地位以及对腐霉茎腐病的防治效果和抑菌机理,为腐霉茎腐病生防制剂的研发提供菌种资源。【方法】采用菌丝生长速率法测试候选木霉菌株对肿囊腐霉()、强雄腐霉()和芒孢腐霉()的抑制作用,筛选拮抗菌株;通过形态学和分子生物学特性确定Tr21菌株的分类地位;采用常规抑菌方法观察Tr21对腐霉菌丝形态的影响;采用溴化丙啶(PI)染液检测法及对不同处理时间菌丝上清液中蛋白和核酸吸光值的检测,分析Tr21发酵液对腐霉菌细胞膜通透性的影响;通过不同浓度Tr21发酵滤液浸种试验,检测Tr21发酵滤液对玉米种子发芽性状的影响;通过温室盆栽试验和田间人工接种试验,明确Tr21对腐霉茎腐病的防治效果。【结果】从实验室保存的109株木霉菌中,筛选到7株木霉菌对肿囊腐霉、强雄腐霉和芒孢腐霉具有拮抗活性,抑制率均>60%,其中Tr21菌株对3种腐霉菌的抑制率达到100%,其5×、10×和20×稀释液对3种腐霉菌的抑制率均达到100%。50×稀释液对3种腐霉菌的最低抑制率也达到55.56%。经形态学和分子生物学鉴定,Tr21为非洲哈茨木霉()。显微镜观察显示Tr21发酵滤液能够造成腐霉菌菌丝变粗、菌丝分枝增多、节点缩短、断裂、内含物溢出等畸形现象。PI荧光染色试验显示Tr21发酵滤液导致3种腐霉菌的细胞膜受损,PI染液更易穿透受损的细胞膜进入到菌丝体内,使菌丝染成红色。核酸、蛋白泄露试验发现发酵滤液处理过的菌丝吸光值变化较大,处理5 h后,肿囊腐霉、芒孢腐霉和强雄腐霉菌丝的OD260均增加了0.08,OD280分别增加了0.10、0.11和0.10,表明腐霉菌菌丝细胞膜受损或其完整性被破坏,导致菌丝内含物外溢。不同浓度Tr21发酵滤液对玉米种子的发芽性状无影响,且当Tr21发酵滤液浓度为20×稀释液时对玉米种子的萌发和生长促进效果最好。盆栽试验结果表明,Tr21发酵滤液浓度为5×稀释液时,对3种腐霉茎腐病的室内防治效果最佳,分别为60.67%、63.15%和59.66%。用Tr21的5×稀释液进行种子处理,当药种质量比例为1﹕100时,对腐霉茎腐病的防治效果最高,达82.25%。【结论】获得一株有效防治玉米腐霉茎腐病的木霉菌株Tr21,经鉴定该菌为非洲哈茨木霉,该菌株发酵滤液可导致腐霉菌菌丝畸形、断裂、细胞膜受损、内含物溢出等,是一株具有开发前景的生防微生物。
腐霉菌;茎腐病;玉米;非洲哈茨木霉;生物防治
0 引言
【研究意义】玉米茎腐病(stalk rot)是世界玉米产区普遍发生的一种重要病害,在我国各玉米种植区均有发生,不仅造成严重的产量损失,该病害造成的倒伏玉米还会增加穗腐病发生机率[1],严重影响玉米品质。玉米茎腐病的病原菌种类繁多,目前已报道的有30种[2],这些病原菌单独或复合侵染导致玉米茎腐病发生[3]。我国茎腐病主要病原菌为镰孢菌(spp.)和腐霉菌(spp.)[4]。腐霉茎腐病发生在玉米生育后期,受环境影响较大,病害一旦发生,没有有效的田间控制措施,一般发生年份腐霉茎腐病田间发病率为5%—10%,重发年份田间发病率可达20%—30%,部分感病品种的发病率可高达40%—80%[5-6],因此,针对腐霉茎腐病的防治工作至关重要。目前防治方法主要为种植抗病品种、化学防治和生物防治。种植抗病品种是最经济、有效的措施,但玉米品种间对腐霉茎腐病的抗性差异较大,高抗品种稀缺。同时生产中针对腐霉茎腐病的化学药剂防治效果欠佳,目前主要采取含精甲霜灵成分的化学种衣剂和增施钾肥来减少病害发生。随着化学农药的长期和大量使用而引起的环境和抗药性等问题日益凸显。因此,开发高效、安全的生物防治产品是防治腐霉茎腐病的重要途径。【前人研究进展】生物防治是以具有防病和促生作用的微生物作为生防因子来防治植物病害。近年来,以其安全、高效的优势逐渐受到重视,成为替代化学防治的重要措施。目前报道的生防微生物主要包括木霉菌(spp.)[7]、芽孢杆菌(spp.)[8]、假单胞菌(spp.)[9]和链霉菌(spp.)[10]等。但在腐霉茎腐病的防治中可应用的生防资源较少,陈捷等[7,11]利用假单胞菌P6拌种和绿色木霉()T3穴施+假单胞菌P6拌种进行室内盆栽试验,发现这两个处理对玉米苗期腐霉茎腐病的防治效果分别为52.87%和58.15%。李红磊等[12]分离到的生防细菌K3-3对禾生腐霉()引起的茎腐病的室内盆栽防治效果为54.29%;生防细菌K18-5对肿囊腐霉()引起的茎腐病的盆栽防治效果为35.71%。任学祥等[13]用产酶溶杆菌()菌株OH11制备种衣剂,药种比为1﹕200时对玉米茎基腐病的室内盆栽防治效果达93.55%,1﹕500时防治效果达80.51%。郭成等[14]分离鉴定出短密木霉()菌株GAS1-1,对肿囊腐霉的平板抑制率为100%。【本研究切入点】目前,对腐霉茎腐病的防治研究主要集中于玉米抗病品种和种质资源筛选、基因挖掘及种质创新等方面[5-6,15-21],关于腐霉茎腐病生物防治的研究报道较少,对该病害生防资源的发掘及防病、促生潜力的研究较为缺乏,而用木霉代谢物防治腐霉茎腐病的研究几乎没有被涉及。引起腐霉茎腐病的病原较多[3,22],单一病原菌的防治会出现地域局限性以及病原菌产生抗性的风险,目前,未见对多种腐霉茎腐病病原菌同时开展生物防治的研究报道。【拟解决的关键问题】以肿囊腐霉、强雄腐霉()和芒孢腐霉()为靶标,筛选对腐霉茎腐病菌具有拮抗作用的木霉菌株,明确其分类地位,评价其对由3种腐霉菌引起的茎腐病的室内、大田防治效果,浅析防病机理,为该病害生防菌剂的研发提供理论依据。
1 材料与方法
试验于2022年3月至2023年7月在河北省农林科学院植物保护研究所和河北省衡水市饶阳实验基地完成。
1.1 试验材料
供试菌株:供试木霉菌株和芒孢腐霉由河北省农林科学院植物保护研究所玉米综合防治研究室分离保存,肿囊腐霉和强雄腐霉由中国农业科学院作物科学研究所段灿星老师惠赠。
供试玉米品种为郑单958;S红成膜剂由北农(海利)涿州种衣剂有限公司提供。
供试培养基:马铃薯葡萄糖琼脂(PDA)培养基:马铃薯200 g、葡萄糖15 g、琼脂粉12 g、蒸馏水1 L;玉米粒培养基:玉米粒清洗,水泡12 h后,装入灭菌袋中高压灭菌30 min。
腐霉菌玉米粒培养物的制备:将肿囊腐霉、强雄腐霉和芒孢腐霉3种腐霉菌分别在PDA平板上培养5 d,用灭菌的手术刀将带菌的培养基划成小块,置于250 mL无菌水中,摇匀后按3%(v/w)比例将3种腐霉菌液分别接种于玉米粒培养基中,28 ℃,黑暗条件下培养7—10 d,即为腐霉菌玉米粒培养物。
1.2 木霉拮抗菌株的筛选
采用菌丝生长速率法测试木霉菌株对玉米腐霉茎腐病病原菌的抑制作用。将活化后的木霉菌、肿囊腐霉、强雄腐霉和芒孢腐霉分别在PDA平板上培养5 d至菌落生长充分,在木霉菌边缘用直径0.5 cm的打孔器打取菌饼10个,接种于含有100 mL PD液体培养基的250 mL三角瓶中,置于28 ℃、180 r/min摇床中振荡培养5 d,用灭菌的纱布过滤菌丝体,得到的液体经0.22 μm微孔滤膜二次过滤,得到木霉菌发酵滤液备用。将得到的发酵滤液按10%的体积比加入到PDA培养基中,制成平板,平板中心接种肿囊腐霉、强雄腐霉和芒孢腐霉的新鲜菌饼(直径0.5 cm),以添加等量PD的PDA平板为对照,每处理重复3次。28 ℃培养箱中黑暗培养,待对照平板布满菌丝后,用十字交叉法测量各处理菌落直径,并计算抑制率。
抑制率(%)=100×(对照病原菌的菌落直径-处理病原菌的菌落直径)/(对照病原菌的菌落直径-0.5 cm)。
1.3 不同浓度Tr21发酵滤液对腐霉菌的抑制作用
按1.2方法得到Tr21发酵滤液。将发酵滤液按不同体积比加入到PDA培养基中,制成平板,使平板中发酵液的终浓度为5×、10×、20×、50×和100×稀释液。平板中心接种肿囊腐霉、强雄腐霉和芒孢腐霉的新鲜菌饼(直径0.5 cm),以添加等量PD的PDA平板为对照,每处理重复3次。将接种后的平板置于28 ℃培养箱中黑暗培养,待对照平板布满菌丝后,用十字交叉法测量各处理菌落直径,并计算抑制率。
1.4 Tr21菌株的种类鉴定
形态鉴定:用打孔器在Tr21菌落边缘打取直径为0.5 cm的菌饼置于PDA平板上,于28 ℃黑暗条件下培养。每天观察培养皿上菌落的生长速度、颜色变化等特征。待菌落培养3—5 d后,挑取菌株Tr21菌丝,在光学显微镜下观察菌丝、分生孢子以及孢子梗的颜色、形状、数量、大小等特征。
分子鉴定:采用CTAB法提取Tr21的总DNA。分别利用引物EF1-728F(5′-CATCGAGAAGTT CGAGAAGG-3′)[23]/TEF1LLErev(5′-AACTTGCAGG CAATGTGG-3′)[24],引物5F(GAYGAYMGWG ATCAYTTYGG)[25]/7CR(CCCATRGCTTGYTTRC CCAT)[25]进行PCR扩增。PCR反应体系为25 μL:DNA 1 μL,2×Es Taq MasterMix 12.5 μL,10 μmol·L-1的上下游引物各0.5 μL,ddH2O补足至25 μL。PCR反应程序:95 ℃预变性5 min;95 ℃变性1 min,退火温度分别为53 ℃(引物EF1-728F和TEF1LLErev)和51 ℃(引物5F和7CR),时间均为30 s,72 ℃延伸1 min,35个循环;72 ℃延伸10 min,于4 ℃保存扩增产物。将PCR扩增产物送至生工生物工程(上海)股份有限公司进行测序。测序结果在GenBank中进行同源性比对,同时选取与该序列同源性较高的已知序列信息,利用MEGA 5.2软件构建系统发育树,确定病原菌的分类地位。
1.5 Tr21发酵滤液对腐霉菌菌丝生长的影响
按1.3方法制备Tr21发酵滤液平板,使发酵液在PDA中的终浓度为50×稀释液,将培养5 d的肿囊腐霉、强雄腐霉和芒孢腐霉菌饼(直径0.5 cm)接种于平板中心,28 ℃培养箱中黑暗培养,3 d后观察Tr21无菌发酵液50×稀释液对3种腐霉菌丝生长的影响。
1.6 Tr21发酵滤液对腐霉菌细胞膜通透性的影响
采用溴化丙啶(PI)染液检测法[26]:将肿囊腐霉、强雄腐霉和芒孢腐霉的菌饼(直径0.5 cm)接于无菌培养皿中央,加入10 mL PDB培养液,置于28 ℃培养箱中培养24 h;用生理盐水轻轻冲洗菌丝2—3次,加入用生理盐水稀释50×的Tr21发酵滤液于28 ℃培养箱中处理4 h;轻轻吸出Tr21稀释液,加入10 mL 2.5 μg·mL-1的PI染液,在避光条件下染色15 min,然后用生理盐水冲洗菌丝表面的染液,立即于荧光显微镜下观察菌丝的染色情况。以不含Tr21无菌发酵液的生理盐水为对照。
1.7 Tr21发酵滤液对腐霉菌核酸、蛋白泄露的影响
根据核酸和蛋白分别在260和280 nm处有最大吸收值的原理进行菌丝上清液中核酸和蛋白浓度的检测,检测分析参照李明通等[26]的方法:按1.6的方法获得用生理盐水清洗过的腐霉菌菌丝,置于含Tr21无菌发酵液50×稀释液(用生理盐水稀释)中处理,在0、1、2、3、4、5 h时分别取样,整个过程需在低温下操作,用酶标仪检测各处理在260和280 nm处吸光值。
1.8 Tr21发酵滤液对玉米种子生长性状的影响
按1.2方法得到Tr21发酵滤液。对玉米种子生长性状的影响参照张婷[27]的方法,具体如下:将Tr21发酵滤液用无菌水分别稀释成2×、5×、10×、20×、50×、100×、200×、500×后备用。挑选大小一致、健康的郑单958种子,75%酒精消毒30 s,2%次氯酸钠消毒10 min,无菌水洗涤3次后用灭菌滤纸吸取种子表面水分,然后将消毒后的种子加入到上述不同稀释倍数的发酵液中浸泡3 h,取出后于超净工作台中自然晾干,置于铺有灭菌滤纸的培养皿中,于28 ℃中培养48 h后加入适量无菌水,然后置于28 ℃培养箱中继续培养,每个处理3次重复,每个重复10颗玉米种子。待发芽后,测量不同处理的发芽率。7 d后,测量胚芽、胚根长度以及根的数量。
1.9 Tr21发酵滤液对苗期腐霉茎腐病的抑制效果
按1.2方法得到Tr21发酵滤液,并将其稀释5×、20×、100×备用。将土、草炭和蛭石按照7﹕2﹕1体积比混合均匀,121 ℃湿热灭菌2 h得无菌基质。按1.8的方法进行玉米种子消毒。将Tr21不同浓度的发酵滤液浸泡消毒的种子3 h,以浸泡在无菌水中的郑单958种子为对照,晾干后备用。接种方法:每盆中放入腐霉菌玉米粒30—40 g,然后在含病菌的基质上覆盖3 cm的无菌基质,再置入5粒浸泡过的玉米种子,最后覆土。20 d后调查各处理发病级别,计算防治效果。苗期腐霉菌茎腐病分级标准参照晋齐鸣等[28]的方法。病情指数及防治效果的计算方法如下:病情指数=100×∑(各级病株数×各级代表值)/(调查总株数×最高级代表值);防治效果(%)=100×(对照病情指数-处理病情指数)/对照病情指数。
1.10 Tr21发酵滤液对腐霉茎腐病的田间防治效果
菌株Tr21田间防效试验在河北省衡水市饶阳县温室大棚进行,试验于2023年3月中旬播种,5月份撤去盖棚塑料膜,其他管理与田间一致。按1.2方法得到Tr21发酵滤液,将Tr21发酵滤液稀释5×,按发酵滤液与成膜剂4﹕1比例,将成膜剂加入到发酵滤液中,混合均匀后得到Tr21包衣剂备用。试验设4个处理,将包衣剂与玉米种子按药种质量比1﹕50、1﹕100和1﹕200进行包衣,以不包衣玉米为空白对照。试验小区采取随机排列,小区平均面积30 m2,每处理3次重复。采用根埋法进行人工接种,具体方法:在接种当天,将提前制备的3种腐霉菌的玉米粒培养物按质量比1﹕1﹕1进行混合均匀备用,在玉米11—12叶期,刨开植株根部表土,在近根部处撒放20—30 g混合后的带菌玉米粒后覆土。于玉米乳熟期调查发病株数,计算发病率和防治效果。发病率(%)=100×发病株数/调查总株数;防治效果(%)=100×(对照发病率-处理发病率)/对照发病率。
2 结果
2.1 玉米腐霉茎腐病拮抗木霉菌株的筛选
将保存的109株木霉菌株编号为Tr1—109。通过菌丝生长速率法测试候选木霉菌株对腐霉茎腐病菌的抑制作用,结果表明只有7株木霉对3种腐霉菌同时具有拮抗活性,抑制率均>60%(结果未列出)。其中菌株Tr21的抑菌效果最好,对3种腐霉菌的抑制率均达到100%。
2.2 不同浓度Tr21发酵滤液对腐霉菌的抑制作用
Tr21不同稀释倍数发酵滤液对腐霉菌的抑制效果如图1所示。Tr21菌株发酵滤液的5×、10×和20×稀释液对3种腐霉菌的抑制率均达到100%(表1)。50×稀释液对3种腐霉菌的抑制率也达到50%以上,分别为69.11%、76.00%和55.56%。100×稀释液的抑制率有所下降,其中对强雄腐霉的抑制率最高,为50.22%,表明Tr21发酵滤液中存在的拮抗物质活性较高。

表1 Tr21不同浓度发酵滤液对3种腐霉菌的抑制率
数据后不同小写字母表示处理间差异显著Different lowercases after the data indicate significantly different among the treatments (<0.05)。下同The same as below
2.3 Tr21菌株的种类鉴定
2.3.1 形态鉴定 Tr21菌株在PDA培养基上活化后,气生菌丝生长迅速。菌落圆形,初期为白色,逐渐变成绿色。菌丝丝状,较细长,呈棉絮状,从中心向四周辐射状生长。分生孢子梗呈烧瓶形至安瓿形,中间膨大,顶端最细并可产孢,瓶梗细胞单生或2—5个轮生。分生孢子呈球形或椭球形,单细胞,表面光滑,淡绿色,老熟后呈深绿色(图2)。通过以上菌种的形态学特征,初步鉴定其为木霉菌属中的一种。
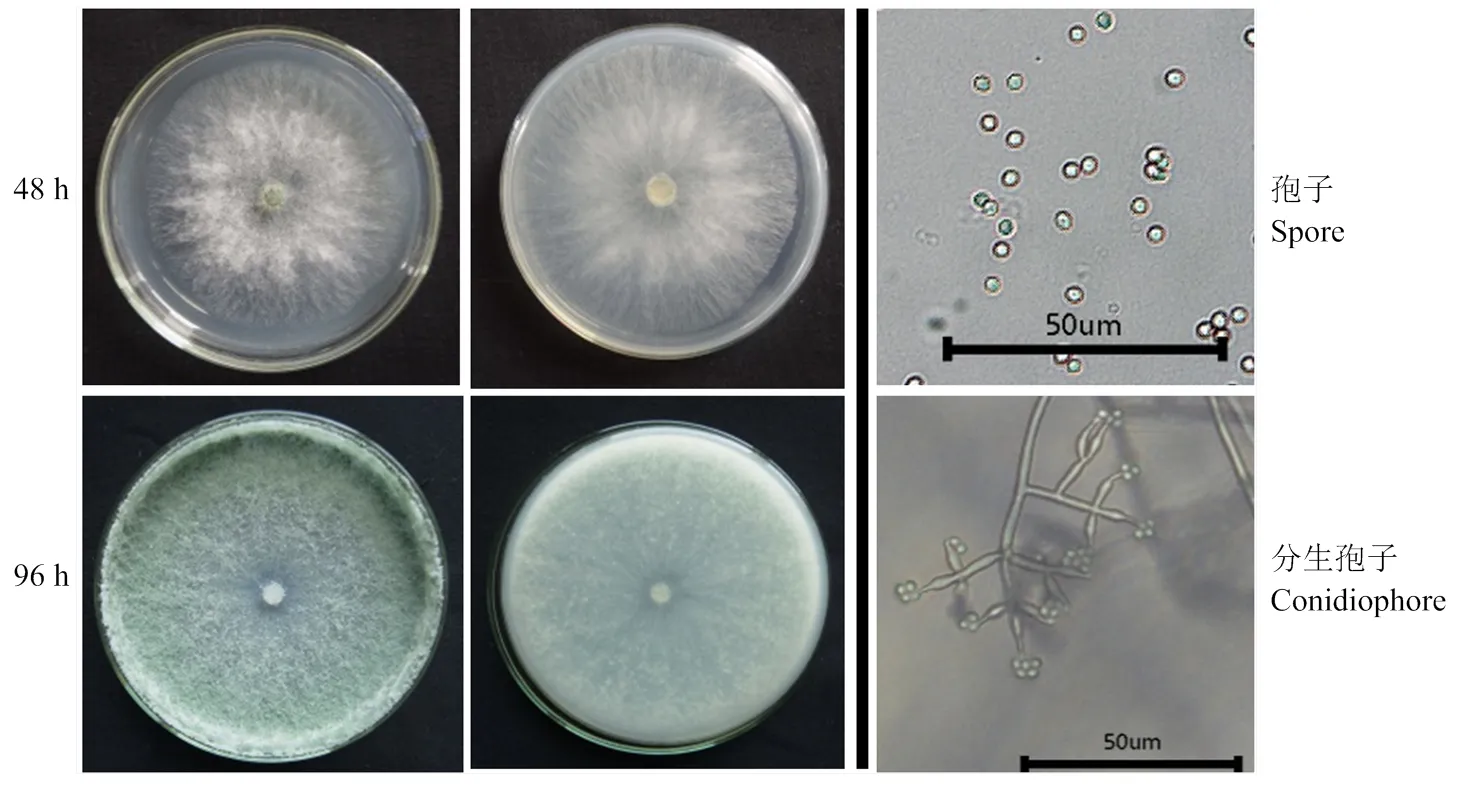
图2 Tr21菌株形态
Fig 2 morphology of Tr21 strain
2.3.2 分子鉴定 对Tr21菌株的和进行PCR扩增,扩增产物大小分别为1 280和1 143 bp。将获得的Tr21序列和序列在GenBank中进行同源性比较,结果发现Tr21与非洲哈茨木霉()菌株Z19的基因序列亲缘关系最近(图3),同源性为99.84%;与非洲哈茨木霉菌株Tri-1的序列的亲缘关系最近(图4),同源性为99.74%。利用MEGA 5.2软件构建系统发育树,结果显示,Tr21与非洲哈茨木霉聚合到一起,说明Tr21属于木霉属非洲哈茨木霉。
根据Tr21菌株的培养性状、形态特征、序列和序列分析结果,将其鉴定为半知菌亚门、丝孢纲、丝孢目、黏孢菌类的木霉属真菌非洲哈茨木霉。
2.4 Tr21发酵滤液对腐霉菌菌丝生长的影响
通过显微镜观察发现,50×稀释液处理的腐霉菌菌丝明显增粗、菌丝分枝增多、节点缩短,部分菌丝外壁粗糙、扭曲,部分菌丝断裂导致内含物溢出。对照组菌丝光滑均匀,生长正常(图5)。
2.5 Tr21发酵滤液对腐霉菌细胞膜通透性的影响
肿囊腐霉、强雄腐霉和芒孢腐霉菌丝经Tr21发酵滤液50×稀释液处理后,经过PI染液染色,结果如图6所示,3种腐霉菌的菌丝均被染成红色,染色面积与明场视野下菌丝的面积几乎相同,而空白对照则只有少量菌丝被染成红色。表明非洲哈茨木霉Tr21发酵滤液可造成腐霉菌菌丝的细胞膜损伤,导致其通透性增强,甚至破坏其完整性,从而使PI染液更易穿透受损的细胞膜进入到菌丝体内。
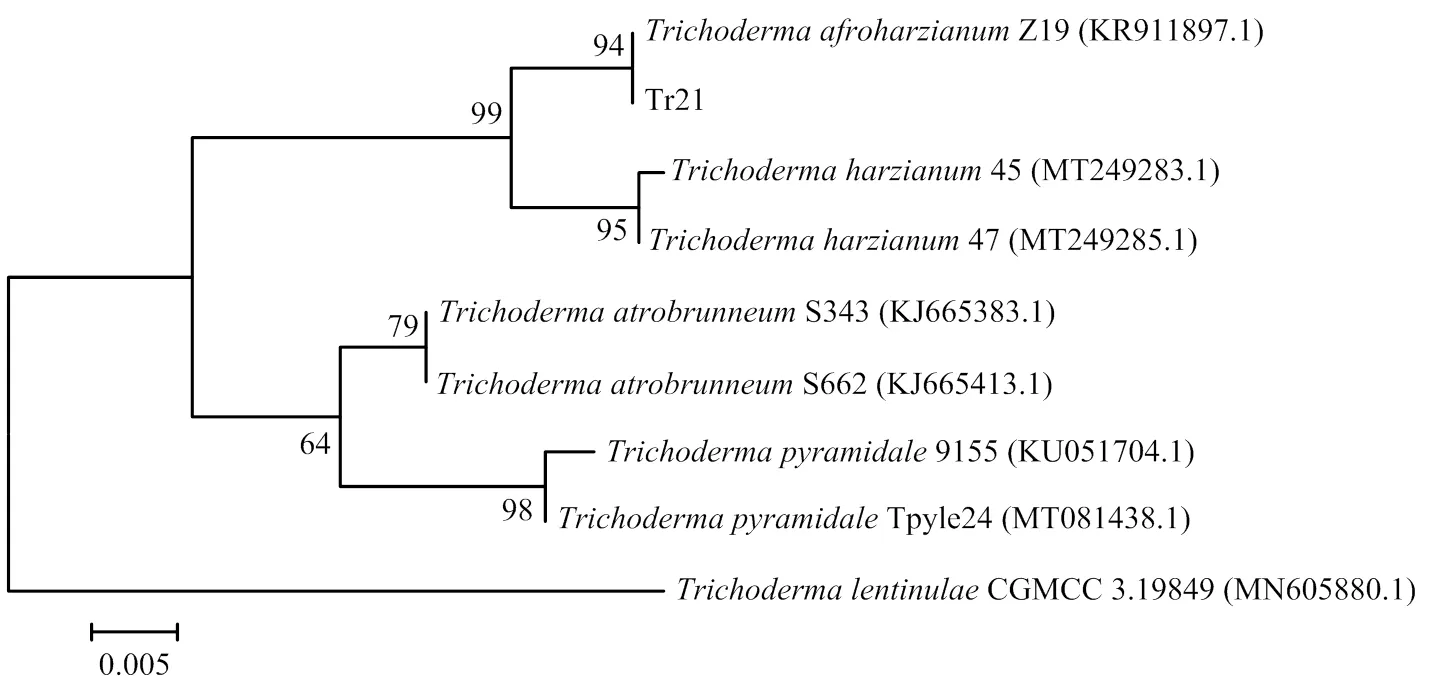
图3 根据Ef-1α序列获得的Tr21菌株系统发育树
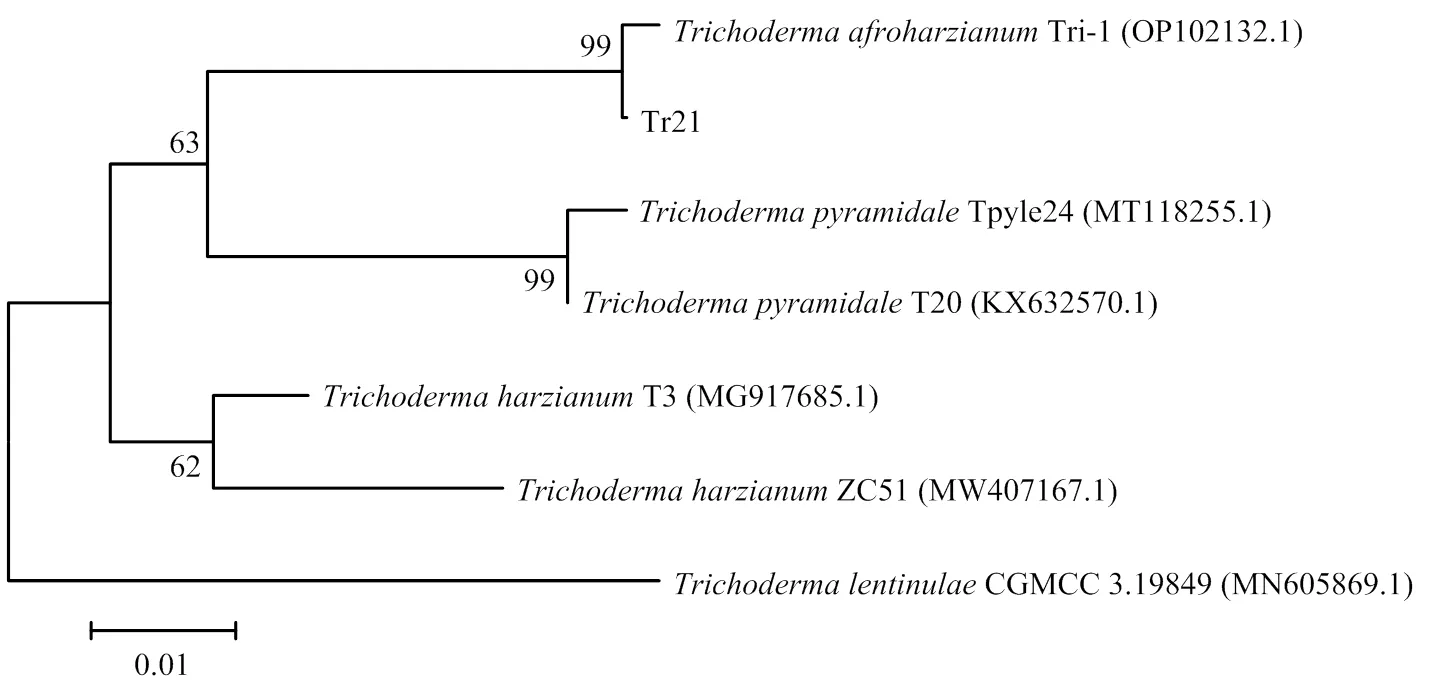
图4 根据RPB2序列获得的Tr21菌株系统发育树

A:菌丝畸形Mycelial deformity;B:菌丝断裂,黑色箭头指示菌丝断裂,内含物溢出Mycelial rupture, the black arrow indicatesthe mycelia rupture, and overflow of mycelia contents

图6 Tr21发酵滤液对腐霉菌细胞膜通透性的影响
2.6 Tr21发酵滤液对腐霉菌核酸、蛋白泄露的影响
为进一步验证Tr21发酵滤液对腐霉菌细胞膜通透性的影响,检测了3种腐霉菌菌丝经Tr21发酵滤液50×稀释液处理不同时间的核酸和蛋白浓度,结果如图7所示,随着处理时间的延长,肿囊腐霉、芒孢腐霉和强雄腐霉空白对照组结果比较平稳,处理5 h后OD260分别增加了0.03、0.02和0.02;OD280分别增加了0.03、0.02和0.03。而用发酵液处理过的菌丝吸光值变化较大,处理5 h后,肿囊腐霉菌丝OD260和OD280分别增加0.08和0.10,芒孢腐霉菌丝OD260和OD280分别增加0.08和0.11,强雄腐霉菌丝OD260和OD280分别增加0.08和0.10。
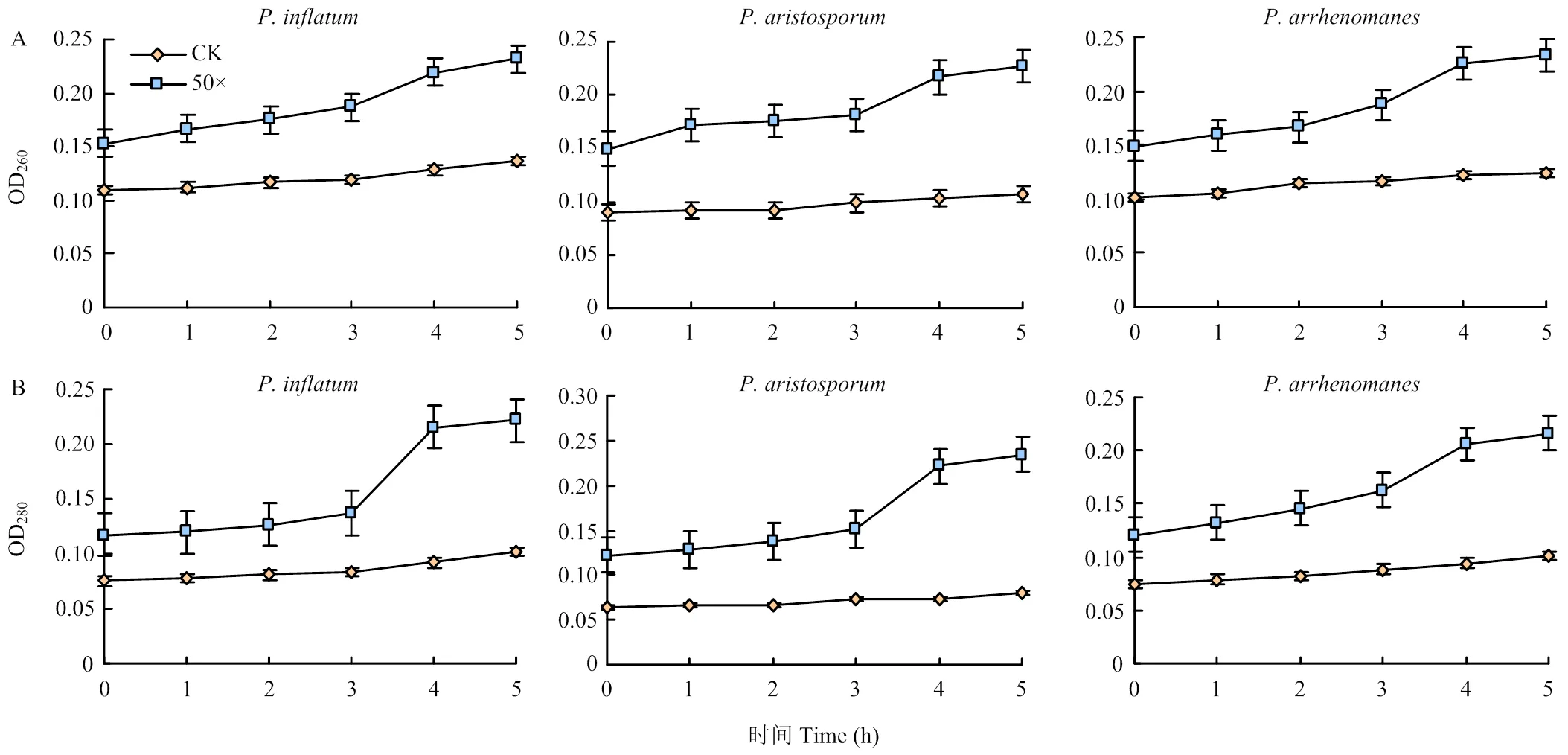
图7 Tr21发酵滤液对腐霉菌核酸(A)和蛋白(B)泄露的影响
2.7 Tr21发酵滤液对玉米种子发芽性状的影响
由表2可知,不同浓度Tr21发酵滤液浸泡的玉米种子的发芽率、胚芽和胚根长度以及根系数量均高于对照,表明Tr21发酵滤液对玉米种子发芽生长无影响,对玉米具有较高的安全性。从表中可以看出,当Tr21发酵滤液稀释倍数为20×时,对玉米种子的发芽和生长效果最佳,其胚芽长度、胚根长度和根总数分别较CK提高了38.82%、70.53%和57.84%,选用该浓度进行防效试验,同时结合2.2试验结果,选用高浓度5×稀释液和低浓度100×稀释液为对照进行防效试验。
2.8 Tr21发酵滤液对苗期腐霉茎腐病的室内防治效果
在温室条件下测定了Tr21发酵滤液5×、20×和100×稀释液对苗期腐霉茎腐病的防治效果,结果表明(表3)Tr21不同浓度发酵液对肿囊腐霉、强雄腐霉和芒孢腐霉引起的苗期茎腐病均有一定的防治效果,其中浓度为5×稀释液时,对3种腐霉菌茎腐病的防治效果最好,分别为60.67%、63.15%和59.66%。
2.9 Tr21发酵滤液对腐霉茎腐病的田间防治效果
用Tr21发酵滤液的5×稀释液按不同比例包衣玉米,田间调查发现,对照田玉米全株叶片变黄、变枯,果穗下垂,茎基部1—3节茎秆变成黄褐色,手捏变软(图8);统计结果表明(表4),3个包衣比例腐霉茎腐病的发病率均低于对照,对腐霉茎腐病均有一定的防治效果,其中包衣比例为1﹕100时,植株仍为绿色,仅边缘变黄,果穗正常,茎基部茎秆绿色、坚硬(图8),其对腐霉茎腐病的防治效果最高,为82.25%,另外两个包衣比例对该病的防治效果差异不明显,分别为43.97%和49.13%。

表3 Tr21发酵滤液对苗期腐霉茎腐病的室内防治效果

表4 Tr21发酵滤液不同包衣比例对腐霉茎腐病的田间防治效果
3 讨论
3.1 发掘腐霉茎腐病生防资源的重要性
腐霉茎腐病具有突发性强和防治困难等特点,尤其在玉米生长后期,如果雨水较多,可在极短的时间内导致病害流行,从而给农业生产带来毁灭性的经济损失,因此该病的预防工作极其重要。木霉菌作为重要的生防资源,已广泛应用于多种作物的病害防治,在玉米茎腐病的生物防治中也发挥了极其重要的作用,但由于茎腐病的病原菌组成复杂,木霉菌大都以镰孢菌作为防治对象[29],以腐霉菌为靶标菌的研究报道甚少。由于腐霉菌茎腐病病原菌种类较多[22],本研究在筛选生防菌的过程中,以肿囊腐霉、强雄腐霉和芒孢腐霉为靶标,筛到一株非洲哈茨木霉Tr21,发现其发酵滤液对3种腐霉菌均具有较强的抑制活性,证实了非洲哈茨木霉Tr21对腐霉茎腐病的防治效果较为明显,丰富了腐霉茎腐病生防种质资源,也拓展了非洲哈茨木霉的应用领域。
3.2 非洲哈茨木霉Tr21的拮抗作用
木霉菌能产生丰富的代谢产物,包括多种非挥发性和挥发性的代谢产物,可抑制多种病原菌的生长[30],分泌抑菌性代谢产物是其发挥生防作用的重要机制之一。这些抗菌物质主要包括胶霉毒素、吡喃酮、萜类化合物和抗菌肽等。如绿木霉()TY009产生的代谢物胶霉毒素,不仅对水稻纹枯病菌()菌丝和菌核萌发有显著的抑制作用,对稻瘟病菌()孢子萌发、附着胞形成和稻曲病菌()孢子萌发、次生孢子形成均有显著的抑制作用[31]。绿色木霉()LTR-2产生的吡喃酮类物质5,6-二氢-6-戊基-2H-吡喃-2-酮在20 mg·L-1的浓度下对禾谷丝核菌()和立枯丝核菌()等11种植物病原菌均有抑制作用[32]。哈茨木霉()可产生抗菌肽,对水稻纹枯病菌、黄瓜立枯菌、稻瘟病菌的抑制效果较好[33]。同种木霉菌可以产生多种抗生物质,如苇状木霉()3199菌株可通过产生对植物无毒性的倍半萜类化合物哈茨木霉素抑制多种病原真菌生长[34],可产生聚酮类物质抑制灰霉病菌()[35],还可产生抑菌的活性肽阿拉霉素[36]。研究表明,同种而不同来源的木霉菌株可产生不同的拮抗化合物[37],如哈茨木霉可以产生聚酮类、抗菌肽等物质[33,38]。不同生防菌中产生的同一化合物对病原菌的拮抗效果也不一样,如渐绿木霉()[37]、哈茨木霉[38]、绿色木霉[39]、康宁木霉(.)[40]均能产生6-戊基-2H-吡喃酮,该化合物对许多子囊菌和担子菌有抑制活性,但抑菌效果存在差异。本研究中非洲哈茨木霉Tr21的发酵液对3种腐霉菌均有较好的抑制效果,其发酵液5×、10×和20×稀释液的抑制率均达到100%,表明发酵液中的次生代谢产物对病原菌生长有抑制作用,但抗生性代谢物种类仍需进一步探究。
用Tr21的发酵滤液处理腐霉菌菌丝,发现腐霉菌菌丝畸形、细胞壁受损导致通透性增强以及内含物溢出等现象。据报道,木霉菌可产生多种细胞壁降解酶,导致其细胞壁溶解,如几丁质酶、葡聚糖酶、纤维素酶以及蛋白酶等[41]。但造成这一现象的原因,是细胞壁降解酶还是代谢物发挥作用,还需进一步研究。
3.3 应用前景
目前国内登记的24种木霉菌菌剂的有效成分均为菌株孢子,为活体制剂,生物活体制剂对环境条件要求较高,在田间应用经常受到土壤中土著微生物群落及土壤温度、湿度、pH等外界因素的影响。施入土壤后,部分木霉菌活力会下降甚至死亡,从而导致定殖数量下降[42-43],影响其生防作用的发挥。而利用微生物次级代谢产物抑菌,可以减轻对环境的依赖,保证生防效果的稳定发挥,是生物防治中控制植物病害的有效手段,也是实现农业绿色发展的有效策略。本研究发现非洲哈茨木霉Tr21的发酵液包衣玉米对腐霉茎腐病有很好的防治效果,田间防效达到82.25%,是一株具有开发应用潜力的生防菌株,今后的工作中应研发以Tr21代谢产物为主要成分的种衣剂,为腐霉茎腐病新型杀菌剂的研发提供技术支撑。
4 结论
从109份木霉菌株中筛选到对肿囊腐霉、强雄腐霉和芒孢腐霉均具有较高活性的菌株Tr21,该菌株的发酵滤液可导致腐霉菌菌丝畸形、断裂、细胞膜受损、内含物溢出等,经鉴定Tr21为非洲哈茨木霉。室内防治试验和田间人工接种试验均表明该菌株发酵液包衣玉米可有效抑制腐霉茎腐病的发生。
[1] 王振营, 王晓鸣. 我国玉米病虫害发生现状、趋势与防控对策. 植物保护, 2019, 45(1): 1-11.
WANG Z Y, WANG X M. Current status and management strategies for corn pests and diseases in China. Plant Protection, 2019, 45(1): 1-11. (in Chinese)
[2] 王晓鸣, 段灿星. 玉米病害和病原名称整理及其汉译名称规范化探讨. 中国农业科学, 2020, 53(2): 288-316.doi: 10.3864/j.issn.0578-1752.2020.02.006.
WANG X M, DUAN C X. Reorganization of maize disease and causal agent names and disscution on their standardized translation of Chinese names. Scientia Agricultura Sinica, 2020, 53(2): 288-316. doi: 10.3864/j.issn.0578-1752.2020.02.006. (in Chinese)
[3] 刘树森, 马红霞, 郭宁, 石洁, 张海剑, 孙华, 金戈. 黄淮海夏玉米主产区茎腐病主要病原菌及优势种分析. 中国农业科学, 2019, 52(2): 262-272.doi: 10.3864/j.issn.0578-1752.2019.02.006.
LIU S S, MA H X, GUO N, SHI J, ZHANG H J, SUN H, JIN G. Analysis of main pathogens and dominant species of maize stalk rot in the main summer maize producing areas of Huang-Huai-Hai. Scientia Agricultura Sinica, 2019, 52(2): 262-272. doi: 10.3864/j.issn.0578-1752.2019.02.006. (in Chinese)
[4] 徐书法, 陈捷, 高增贵, 邹庆道, 纪明山, 刘海南. 中国玉米茎基腐病和穗腐病研究进展. 植物病理学报, 2006, 36(3): 193-203.
XU S F, CHEN J, GAO Z G, ZOU Q D, JI M S, LIU H N. Maize stalk rot and ear rot in China. Acta Phytopathologica Sinica, 2006, 36(3): 193-203. (in Chinese)
[5] 段灿星, 王晓鸣, 武小菲, 杨知还, 宋凤景, 赵立萍, 孙素丽, 朱振东. 玉米种质和新品种对腐霉茎腐病和镰孢穗腐病的抗性分析. 植物遗传资源学报, 2015, 16(5): 947-954.
DUAN C X, WANG X M, WU X F, YANG Z H, SONG F J, ZHAO L P, SUN S L, ZHU Z D. Analysis of maize accessions resistance to Pythiumstalk rot and Fusarium ear rot. Journal of Plant Genetic Resources, 2015, 16(5): 947-954. (in Chinese)
[6] 段灿星, 曹言勇, 董怀玉, 夏玉生, 李红, 胡清玉, 杨知还, 王晓鸣. 玉米种质资源抗腐霉茎腐病和镰孢茎腐病精准鉴定. 中国农业科学, 2022, 55(2): 265-279. doi: 10.3864/j.issn.0578-1752.2022.02.003.
DUAN C X, CAO Y Y, DONG H Y, XIA Y S, LI H, HU Q Y, YANG Z H, WANG X M.Precise characterization of maize germplasm for resistance to Pythium stalk rot and Gibberella stalk rot.Scientia Agricultura Sinica, 2022, 55(2): 265-279. doi: 10.3864/j.issn.0578-1752.2022.02.003. (in Chinese)
[7] 陈捷, 宋佐衡, 梁知洁, 咸洪泉. 玉米茎腐病生物防治初步研究. 植物保护, 1994, 20(3): 6-8.
CHEN J, SONG Z H, LIANG Z J, XIAN H Q. Preliminary study on biocontrol of corn stalk rot. Plant Protection, 1994, 20(3): 6-8. (in Chinese)
[8] 陈志谊. 芽孢杆菌类生物杀菌剂的研发与应用. 中国生物防治学报, 2015, 31(5): 723-732.
CHEN Z Y. Research and application of bio-fungicide withspp.. Chinese Journal of Biological Control, 2015, 31(5): 723-732. (inChinese)
[9] 张望月, 高健, 张超, 张友明, 胡胜标, 李岚岚, 孙运军, 丁学知, 夏立秋. 五种假单胞菌的分离鉴定及其生物活性. 微生物学报, 2013, 53(9): 957-965.
ZHANG W Y, GAO J, ZHANG C, ZHANG Y M, HU S B, LI L L, SUN Y J, DING X Z, XIA L Q. Isolation, identification and characterization of fivestrains. Acta Microbiologica Sinica, 2013, 53(9): 957-965. (in Chinese)
[10] 王炫栋, 宋振, 兰赫婷, 江樱姿, 齐文杰, 刘晓阳, 蒋冬花. 杨梅园土壤优势放线菌的分离及其防病促生功能. 中国农业科学, 2023, 56(2): 275-286. doi: 10.3864/j.issn.0578-1752.2023.02.006.
WANG X D, SONG Z, LAN H T, JIANG Y Z, QI W J, LIU X Y, JIANG D H. Isolation of dominant actinomycetes from soil of waxberry orchards and its disease prevention and growth-promotion function. Scientia Agricultura Sinica, 2023, 56(2): 275-286.doi: 10.3864/j.issn.0578-1752.2023.02.006. (in Chinese)
[11] 吴晓儒, 陈硕闻, 杨玉红, 王永宏, 刘艳, 陈捷. 木霉菌颗粒剂对玉米茎腐病防治的应用. 植物保护学报, 2015, 42(6): 1030-1035.
WU X R, CHEN S W, YANG Y H, WANG Y H, LIU Y, CHEN J. Application ofgranules in the control of corn stalk rot. Journal of Plant Protection, 2015, 42(6): 1030-1035. (in Chinese)
[12] 李红磊, 刘二平, 李萍. 玉米青枯病生防细菌的筛选. 河南农业科学, 2010(7): 66-69.
LI H L, LIU E P, LI P. Screening of biocontrol bacteria against corn stalk rot. Journal of Henan Agricultural Sciences, 2010(7): 66-69. (in Chinese)
[13] 任学祥, 苏贤岩, 闫学梅, 迟雨, 李钊, 叶正和. 含OH11发酵液玉米种衣剂的研制及其对茎基腐病的效果评价. 中国生物防治学报, 2022, 38(6): 1566-1571.
REN X X, SU X Y, YAN X M, CHI Y, LI Z, YE Z H. Development of corn seed coating agent containing OH11 fermentation broth and effect evaluation on stalk base rot. Chinese Journal of Biological Control, 2022, 38(6): 1566-1571. (in Chinese)
[14] 郭成, 张小杰, 张有富, 王春明, 周天旺, 李敏权. 短密木霉菌株GAS1-1的分离鉴定、拮抗作用及其生物学特性. 植物保护学报, 2019, 46(2): 305-312.
GUO C, ZHANG X J, ZHANG Y F, WANG C M, ZHOU T W, LI M Q. Isolation, identification, antagonistic effect and biological characteristics ofstrain GAS 1-1. Journal of Plant Protection, 2019, 46(2): 305-312. (in Chinese)
[15] 宋燕春, 裴二芹, 石云素, 王天宇, 黎裕. 玉米重要自交系的肿囊腐霉茎腐病抗性鉴定与评价. 植物遗传资源学报, 2012, 13(5): 798-802.
SONG Y C, PEI E Q, SHI Y S, WANG T Y, LI Y. Identification and evaluation of resistance to stalk rot (Matthews) in important inbred lines of maize. Journal of Plant Genetic Resources, 2012, 13(5): 798-802. (in Chinese)
[16] 杨洋, 郭成, 孙素丽, 陈国康, 朱振东, 王晓鸣, 段灿星. 玉米抗腐霉茎腐病种质标记基因型鉴定与遗传多样性分析. 植物遗传资源学报, 2019, 20(6): 1418-1427.
YANG Y, GUO C, SUN S L, CHEN G K, ZHU Z D, WANG X M, DUAN C X. Marker-assisted identification and genetic diversity analysis of maize germplasm resources with resistance to Pythium stalk rot. Journal of Plant Genetic Resources, 2019, 20(6): 1418-1427. (in Chinese)
[17] 丁新华, 宋子硕, 杨杰, 高国文, 付开赟, 贾尊尊, 吐尔逊·阿合买提, 郭文超. 玉米种质对腐霉茎腐病和镰孢茎腐病抗性鉴定与评价. 新疆农业科学, 2022, 59(12): 3047-3056.
DING X H, SONG Z S, YANG J, GAO G W, FU K Y, JIA Z Z, TURSUN A, GUO W C. Identification and evaluation of maize germplasm resistance to pythium stem rot and Fusarium stem rot. Xinjiang Agricultural Sciences, 2022, 59(12): 3047-3056. (in Chinese)
[18] 宋凤景. 玉米对腐霉茎腐病抗病性研究[D]. 北京: 中国农业科学院, 2015.
SONG F J. Resistance of maize toPythium stalk rot[D]. Beijing: Chinese Academy of Agricultural Sciences, 2015. (in Chinese)
[19] 侯梦薇. 玉米芒孢腐霉茎腐病抗性鉴定与全基因组关联分析[D]. 郑州: 河南农业大学, 2022.
HOU M W. Precise characterization and genome wide association analysis of maize for resistance tostalk rot[D]. Zhengzhou: Henan Agricultural University, 2022. (in Chinese)
[20] SONG F J, XIAO M G, DUAN C X, LI H J, ZHU Z D, LIU B T, SUN S L, WU X F, WANG X M. Two genes conferring resistance to Pythiumstalk rot in maize inbred line Qi319. Molecular Genetics and Genomics, 2015, 290(4): 1543-1549.
[21] DUAN C X, SONG F J, SUN S L, GUO C, ZHU Z D, WANG X M. Characterization and molecular mapping of two novel genes resistant to Pythium stalk rot in maize. Phytopathology, 2019, 109(5): 804-809.
[22] 王晓鸣, 吴全安, 刘晓娟, 马国忠. 寄生玉米的6种腐霉及其致病性研究. 植物病理学报, 1994, 24(4): 343-346.
WANG X M, WU Q A, LIU X J, MA G Z. Identification and pathogenicity ofspp. isolated from maize. Acta Phytopathologica Sinica, 1994, 24(4): 343-346. (in Chinese)
[23] CARBONE I, KOHN L M. A method for designing primer sets for speciation studies in filamentous ascomycetes. Mycologia, 1999, 91(3): 553-556.
[24] JAKLITSCH W M, KOMON M, KUBICEK C P, DRUZHININA I S.sp. nov. from the Austrian Alps represents a new phylogenetic clade in/. Mycologia, 2005, 97(6): 1365-1378.
[25] VISAGIE C, HOUBRAKEN J, FRISVAD J, HONG S B, KLAASSEN C H W, PERRONE G, SEIFERT K A, VARGA J, YAGUCHI T, SAMSON R A. Identification and nomenclature of the genus. Studies in Mycology, 2014, 78(3): 343-371.
[26] 李明通, 孟凡强, 周立邦, 陈美容, 陆兆新. 生姜根腐病的病原菌鉴定及抗菌脂肽的防治效果. 南京农业大学学报, 2020, 43(6): 1134-1142.
LI M T, MENG F Q, ZHOU L B, CHEN M R, LU Z X. Identification of the pathogen of ginger root rot and the control efficiency of antifungal lipopeptides. Journal of Nanjing Agricultural University, 2020, 43(6): 1134-1142. (in Chinese)
[27] 张婷. 木霉菌生物种衣剂的创制与应用[D]. 上海: 上海交通大学, 2012.
ZHANG T. Creation and application ofbio-seed coating agent[D]. Shanghai: Shanghai Jiaotong University, 2012. (in Chinese)
[28] 晋齐鸣, 卢宗志, 潘顺法, 姜晶春. 玉米茎腐病病原对玉米苗期致病性研究. 玉米科学, 1994, 2(1): 73-75.
JIN Q M, LU Z Z, PAN S F, JIANG J C. Study on pathogenicities of pathogenic fungi of corn stalk rot in corn seedling stage. Journal of Maize Sciences, 1994, 2(1): 73-75. (in Chinese)
[29] LU Z X, TU G P, ZHANG T, LI Y Q, WANG X H, ZHANG Q G, SONG W, CHEN J. Screening of antagonisticstrains and their application for controlling stalk rot in maize. Journal of Integrative Agriculture, 2020, 19(1): 145-152.
[30] GHISALBERTI E L, SIVASITHAMPARAM K. Antifungal antibiotics produced byspp.. Soil Biology and Biochemistry, 1991, 23(11): 1011-1020.
[31] 刘路宁, 屠艳拉, 张敬泽. 绿木霉菌株TY009防治纹枯病等水稻主要真菌病害的潜力. 中国农业科学, 2010, 43(10): 2031-2038. doi: 10.3864/j.issn.0578-1752.2010.10.008.
LIU L N, TU Y L, ZHANG J Z. Biocontrol potential ofstrain TY009 against rice sheath blight and other main fungal diseases. Scientia Agricultura Sinica, 2010, 43(10): 2031-2038. doi: 10.3864/j.issn.0578-1752.2010.10.008. (in Chinese)
[32] 陈凯, 杨合同, 李纪顺, 扈进冬, 张广志. 绿色木霉菌LTR-2孢子提取物的抑菌活性及化学成分分析. 微生物学通报, 2007, 34(3): 455-458.
CHEN K, YANG H T, LI J S, HU J D, ZHANG G Z. Analysis of chemical components and antifungal activity of extraction from conidia ofLTR-2. Microbiology China, 2007, 34(3): 455-458. (in Chinese)
[33] 潘顺, 刘雷, 王为民. 哈茨木霉发酵液中peptaibols抗菌肽的鉴定及活性研究.中国生物防治学报, 2012,28(4): 528-536.
PAN S, LIU L, WANG W M. Identification of antibiotic peptaibols from fermentation broth of. Chinese Journal of Biological Control, 2012, 28(4): 528-536. (in Chinese)
[34] LINDO L, MCCORMICK S P, CARDOZA R E, BUSMAN M, ALEXANDER N J, PROCTOR R H, GUTIERREZ S. Requirement of two acyltransferases for 4-O-acylation during biosynthesis of harzianum A, an antifungal trichothecene produced by. Journal of Agricultural and Food Chemistry, 2019, 67(2): 723-734.
[35] MALMIERCA M G, BARUA J, MCCORMICK S P, IZQUIERDO- BUENO I, CARDOZA R E, ALEXANDER N J, HERMOSA R, COLLADO I G, MONTE E, GUTIERREZ S. Novel aspinolide production bywith a potential role inantagonistic activity and plant defence priming. Environmental Microbiology, 2015, 17(4): 1103-1118.
[36] LEITGEB B, SZEKERES A, MANCZINGER L, VAGVOELGYI C, KREDICS L. The history of alamethicin: a review of the most extensively studied peptaibol. Chemistry & Biodiversity, 2007, 4(6): 1027-1051.
[37] 张量, 张敬泽. 渐绿木霉抑菌物质的分离纯化及其对植物病原菌的抑制作用. 中国农业科学, 2015, 48(5): 882-888. doi: 10.3864/j.issn.0578-1752.2015.05.06.
ZHANG L, ZHANG J Z. Isolation and purification of active compound fromand its inhibitory activities against phytopathogens. Scientia Agricultura Sinica, 2015, 48(5): 882-888. doi: 10.3864/j.issn.0578-1752.2015.05.06. (in Chinese)
[38] CLAYDON N, ALLAN M, HANSON J R, AVENT A G. Antifungal alkyl pyrones of. Transactions of the British Mycological Society, 1987, 88(4): 503-513.
[39] COLLINS R P, HALIM A F. Characterization of the major aroma constituent of the fungus(Pers.). Journal of Agricultural and Food Chemistry, 1972, 20(2): 437-438.
[40] SIMON A, DUNLOP R W, GHISALBERTI E L, SIVASITHAMPARAM K.produces a pyrone compound with antibiotic properties. Soil Biology and Biochemistry, 1988, 20(2): 263-264.
[41] 杨萍, 杨谦. 木霉重寄生过程分子机制的研究进展. 中国农学通报, 2012, 28(27): 163-166.
YANG P, YANG Q. Research progress on molecular mechanism ofmycoparasitism. Chinese Agricultural Science Bulletin, 2012, 28(27): 163-166. (in Chinese)
[42] 贺字典, 宋士清, 高玉峰,石延霞, 李宝聚. 棘孢木霉在土壤中定殖量的荧光定量PCR检测. 植物保护学报, 2016, 43(4): 552-558.
HE Z D, SONG S Q, GAO Y F, SHI Y X, LI B J. Detection ofcolonization in soils by real-time fluorescent quantitative PCR. Journal of Plant Protection, 2016, 43(4): 552-558. (in Chinese)
[43] 王永阳. 防治苦瓜枯萎病的木霉菌株分离鉴定、定殖检测及其防病促生机理[D]. 泰安: 山东农业大学, 2018.
WANG Y Y. Isolation, identification, detection of colonization ofstrains for bitter gourd wilt and their mechanism of disease control and growth promotion[D]. Taian: Shandong Agricultural University, 2018. (in Chinese)
Screening, identification and control efficacy analysis ofstrains against Maize Pythium stalk rot
GUO Ning, SUN Hua, MA HongXia, LIU ShuSen, ZHANG HaiJian, SHI Jie, ZHENG XiaoJuan, DONG YueGuang
Plant Protection Institute, Hebei Academy of Agriculture and Forestry Sciences/Key Laboratory of Integrated Pest Management on Crops in Northern Region of North China, Ministry of Agriculture and Rural Affairs/IPM Innovation Center of Hebei Province/ International Science and Technology Joint Research Center on IPM of Hebei Province, Baoding 071000, Hebei
【Objective】The objective of this study is to screenstrains which have inhibitory effect on thespp. causing maize stalk rot, and to clarify their taxonomic status, control efficacy and antifungal mechanism. This study will provide important resources for the research and development of biocontrol agent against Pythium stalk rot.【Method】For the antagonistic strains screening, the inhibitory effect ofstrains on,andwas tested by measuring the mycelia growth. The taxonomic status of Tr21 was determined by morphological and molecular characteristics. The effect of Tr21 on the mycelia morphology ofspp. was observed in the laboratory. In order to analyze the effect of Tr21 fermentation broth on the membrane permeability ofspp., propyridine bromide (PI) dye solution was used to stain, and the absorbance values of protein and nucleic acid in mycelia supernatant at different treatment times were detected. The effect of Tr21 fermentation broth on germination characteristics of maize seeds was tested by seed soaking with different concentrations of fermentation broth. The control efficacy of Tr21 on stalk rot was confirmed through greenhouse pot and field inoculation experiments.【Result】From the 109 strains ofspp., seven strains were screened with antagonistic activity against,and, and the inhibition rate was above 60%. The inhibition rate of Tr21 to threespecies reached 100%, the inhibition rate of 5×, 10× and 20× diluent to threespecies reached 100%, andthe inhibition rate of 50× diluent to threespecies was also more than 55.56%. Tr21 strain was identified by morphological and molecular biology as. The results of microscopic observation showed that the fermentation broth of Tr21 could cause mycelial malformations, such as rough mycelia, increased mycelial branching, shortened nodes, and overflow of mycelia contents. The result of PI fluorescence stainshowed that the cell membrane of threespecies was damaged by Tr21 fermentation broth, and the PI dye was more likely to penetrate the damaged cell membrane into the mycelium and stain the mycelia red. The results of nucleic acid and protein leakage showed that the absorbance values of the mycelia treated by the fermentation broth changed greatly. After treatment for 5 h, the OD260increased by 0.08 and OD280increased by 0.10, 0.11 and 0.10, respectively, indicating that the membrane of the mycelia was damaged, leading to the overflow of mycelia contents. The different concentrations of Tr21 fermentation broth had no effect on the germination characteristics of maize seeds, and the 20× diluent had the best effect on germination and growth of seeds. The results of pot experiment showed that 5× diluted fermentation broth of Tr21 had the best control efficacy on Pythium stalk rot caused by threespecies, which was 60.67%, 63.15% and 59.66%, respectively. The control efficacy on Pythium stalk rot of 5× diluent was the highest, reaching 82.25%, with a mass ratio of 1﹕100 (5× diluent to seed).【Conclusion】An effectivestrain Tr21 was obtained for preventing and controlling of maize Pythium stalk rot. The fermentation broth of Tr21 can lead to mycelia malformation, breakage, cell membrane damage and contents leakage, etc. In conclusion, thestrain Tr21 is a promising biocontrol microbial.
; stalk rot; maize;; biological control
10.3864/j.issn.0578-1752.2023.22.008
2023-08-02;
2023-08-27
河北省省级科技计划(20326516D)、国家现代农业产业技术体系(CARS-02)
郭宁,E-mail:guoning433@163.com。通信作者石洁,E-mail:shij99@163.com
(责任编辑 岳梅)
