基于PI3K/AKT/mTOR信号通路探讨井穴放血对急性高原低氧脑损伤的保护作用*
2023-12-28李梦馨洒玉萍任延明李永平
李梦馨,王 超,童 丽,洒玉萍,任延明,李永平
(青海大学医学部中医系,青海省糖脂代谢疾病防控中医药重点实验室 西宁 810001)
高原环境会造成机体内许多重要脏器的损伤,其中大脑生理功能的正常运转需要氧气与能量的不间断供应,对缺氧耐受性极差。当机体急进高原低氧环境中时,脑组织首当其冲受到缺氧损伤[1]。缺氧环境下线粒体呼吸链复合物活性遭到破坏,电子传递链运输障碍,氧化磷酸化能力异常,能量合成不足,活性氧(Reactive oxygen species,ROS)大量生成,激活线粒体自噬[2]。线粒体自噬作为机体一种自我保护的适应性机制可以清除受损线粒体,维持线粒体功能稳定,减轻急性高原低氧脑损伤。
井穴位于肢体末端,为脏腑、经气生发之源,所选取的手十二井穴所属经脉与脑联系密切,具有醒脑开窍、活血祛瘀、振奋阳气之功效。临床使用井穴治疗脑病由来已久,本课题组的前期实验表明井穴放血通过调控线粒体自噬水平保护急性高原低氧脑损伤[3],近年来许多研究也表明井穴放血对不同类型的脑损伤起到保护作用[4-6]。但目前对急性高原低氧脑损伤研究较少,且井穴放血保护急性高原低氧脑损伤的具体作用机制仍未完全明确,需要进一步探索。因此本研究使用低压氧舱减压至6000 m 海拔高度,将实验大鼠低压低氧处理72 h 复制急性高原低氧脑损伤大鼠模型,对比不同处理方法对急性高原低氧脑损伤大鼠脑组织形态结构、海马组织超微结构、自噬体形成、海马组织细胞凋亡情况及PI3K/AKT/mTOR 通路相关分子表达的影响来探究井穴放血对急性高原低氧脑损伤的保护作用机制,为实验研究及临床防治急性高原低氧脑损伤提供新思路及理论支持。
1 实验材料
1.1 实验动物
成年雄性SD 大鼠60 只,体质量(200±20)g,购自西安交通大学医学部实验动物中心,适应性饲养1天。
1.2 实验药品及试剂
HE 染液:武汉塞维尔生物科技有限公司;812 环氧树脂包埋套装、醋酸双氧铀、柠檬酸铅染液:北京中镜科仪技术有限公司;四氧化锇:徕卡;DAPI 染色液:北京雷根生物有限公司;柠檬酸盐修复液:北京中杉金桥生物技术有限公司;TUNEL试剂盒:Roche Group;BCA 蛋白浓度测定试剂盒、细胞裂解液:Beyotime;预染蛋白Marker、AKT 抗体:ABClone;ECL 发光试剂盒:Affinity;Glycine、SDS、Tris for molecular biology:德国Biofroxx;RNA TRIzol Reagent:合肥博美生物科技有限公司;Prime Script RT reagent Kit、TB GreenTMPremix Ex TaqTMⅡ:北京宝日医生物技术有限公司;PI3K、mTOR抗体:Abcam。
1.3 实验设备
低压氧舱(中航风雷),RS36型全自动染色机(常州派斯杰),数码三目摄像显微镜(Panthera,麦克奥迪),透射电子显微镜(JEM-1400FLASH,日本电子JEOL),数字切片扫描仪(Pannoramic 250,3DHISTECH(Hungary)),电泳仪(JY200C,北京君意),化学发光凝胶成像仪(5200,上海天能),实时荧光定量仪(PIKORed 96,ThermoFisher),全功能酶标仪(MK3,ThermoFisher)。
2 实验方法
2.1 分组与操作
2.1.1 动物分组
随机分为对照组(Control 组)和实验组,实验组随机分为模型组(Model 组)、井穴放血组(BAJP 组)、非穴位放血组(BANA组),每小组15只。
2.1.2 操作方法
BAJP 组大鼠用采血针按少商、商阳、中冲、关冲、少冲、少泽的顺序,先左前肢,后右前肢,点刺穴位放血。依照中国针灸学会实验针灸研究会制定的“动物针灸穴位图谱”定位。BANA 组大鼠剪尾尖放血,两组放血量均为15-20 μL。Control 组、Model 组大鼠抓取10秒。以上操作均每日1次,连续7天。
2.2 急性高原低氧脑损伤大鼠造模方法
将低压氧舱减压至6000 m 海拔高度,实验组大鼠经过低压低氧处理72 h 后取出,期间动物自由饮水及进食。
2.3 取材及指标检测
2.3.1 取材
对照组大鼠分组后即取材,实验组大鼠低压低氧72 h 出舱后立刻取材。实验组大鼠腹腔注射20%乌拉坦麻醉后取脑,2 只大鼠全脑组织固定于10%多聚甲醛中;3 只大鼠在冰台上分离海马,固定于3%戊二醛溶液中。余大鼠取全脑组织保存于-80℃冰箱中,用于后续Western blot、PCR相关指标检测。
2.3.2 脑组织形态结构的变化
标本常规石蜡包埋,切片后脱蜡至水,苏木精染色,盐酸酒精分化后返蓝,伊红染色后脱水、透明,中性树胶封固,光镜观察。
2.3.3 海马组织超微结构变化、神经元细胞损伤及自噬体形成情况
样品经3%戊二醛预固定,1%四氧化锇再固定,丙酮逐级脱水,Ep812包埋,醋酸铀、枸橼酸铅染色,透射电镜观察。
2.3.4 海马组织细胞凋亡情况
标本常规石蜡包埋,切片后脱蜡至水,柠檬酸微波修复,PBS 充分清洗后于暗处入荧光TUNEL 孵育液37℃孵育1 h,DAPI染核,甘油明胶封片,镜检。
2.3.5 PI3K、AKT、mTOR、p-PI3K、p-AKT、p-mTOR蛋白表达情况
按1:10 质量比将样本与RIPA 裂解液放入研磨管,研磨后入4℃冰箱裂解30 min,12000 r·min-1离心10 min,取上清液用BCA 法测定样品蛋白浓度。取样本进行电泳、转膜、封闭,加入1:2000 稀释过的PI3K、AKT、mTOR、p-PI3K、p-AKT、p-mTOR 和1:100000 的β-actin 4℃孵育过夜,TBST 洗膜,放二抗(1:5000),室温孵育2 h,TBST洗膜,加ECL发光液,曝光扫描,计算目的蛋白相对表达量。
2.3.6 AKT、mTOR mRNA相对表达量
样本总RNA 使用TRIzol 法常规提取,反转录完成后加入荧光定量PCR 试剂扩增,反应条件:95℃预变性30 s;95℃变性5 s,55℃退火30 s,72℃延伸30 s,45个循环。以β-actin为内参,通过2-△△CT计算mTOR、AKT相对mRNA表达量。引物序列见表1。

表1 RT-PCR引物序列表
2.4 统计学方法
使用SPSS17.0 软件进行统计分析,结果以均值±标准差(±s)的方式表示,组间采用单因素方差分析,多重两两比较方差齐时使用LSD-t检验,方差不齐时使用Tamhane’s T2检验。检验水准α=0.05。
3 实验结果
3.1 井穴放血对大鼠脑组织形态结构的影响
HE 染色观察大鼠海马CA1 区的病理变化。常氧状态下大鼠海马CA1 区未见明显细胞坏死,锥体细胞层排列正常。低压低氧处理72 h 后的大鼠海马CA1区可见锥体细胞大量变性坏死,正常细胞数量显著减少,排列紊乱。经过井穴放血治疗后,AHH 大鼠海马CA1 区的坏死锥体细胞数量明显减少,非穴位放血组治疗后的AHH 大鼠海马CA1 区的锥体细胞坏死情况无明显改善。具体见图1。
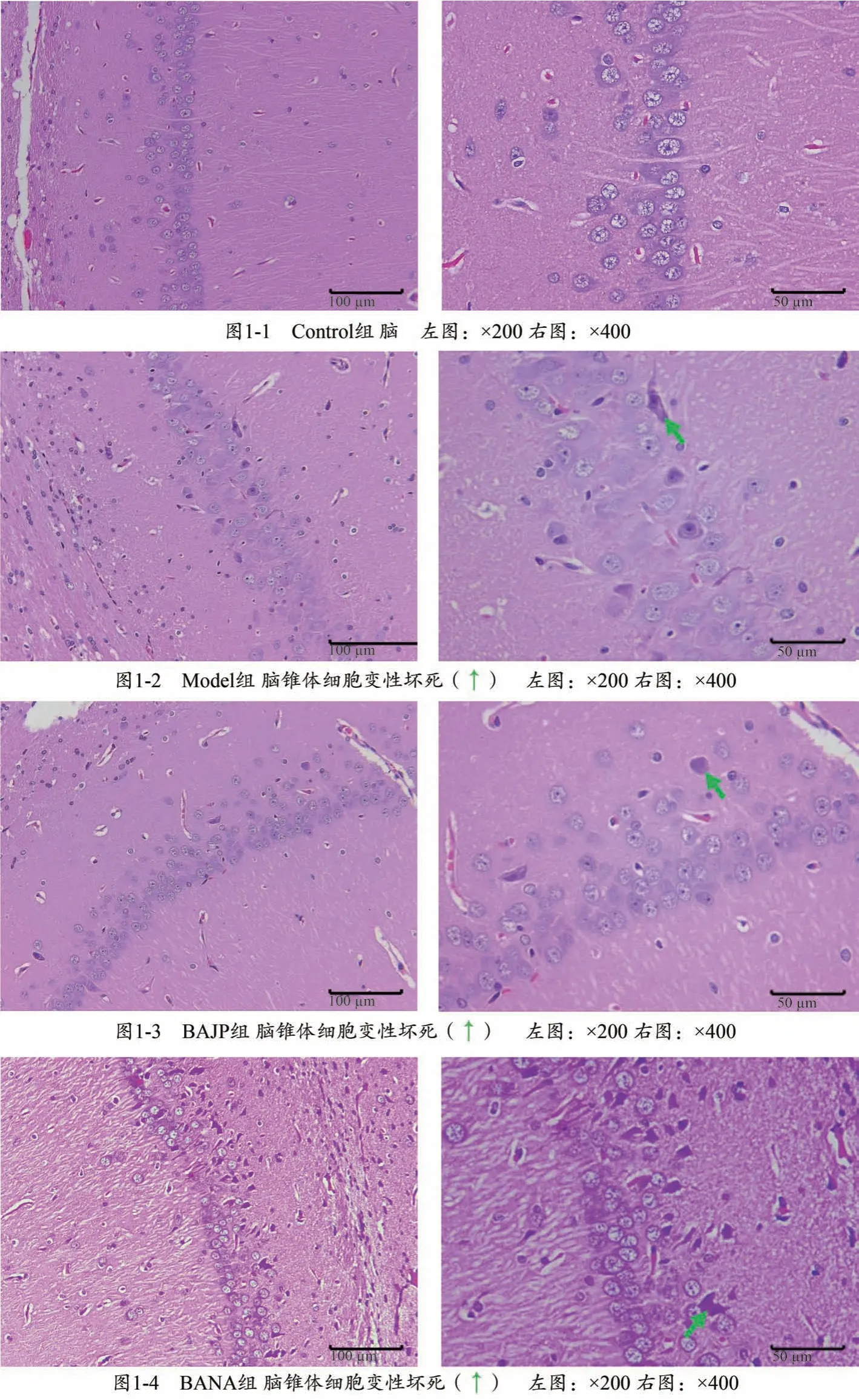
图1 脑锥体细胞变性坏死
3.2 井穴放血对大鼠海马神经元超微结构及线粒体自噬体形成情况的影响
海马组织损伤主要表现为神经细胞凋亡、线粒体肿胀和胞浆内出现自噬,按照严重程度的趋势为:Model组、BANA 组>BAJP 组>Control组,按照自噬体数量的趋势为:BAJP 组>Model 组、BANA 组>Control 组。具体见图2。
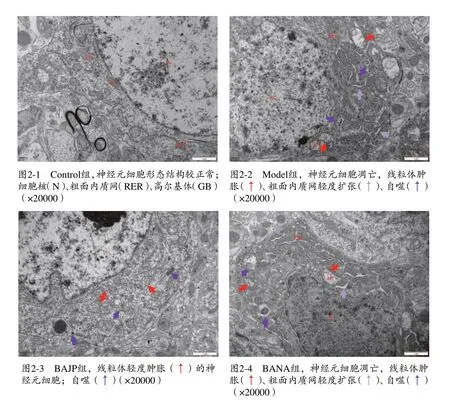
图2 大鼠海马神经元细胞超微结构的改变及线粒体自噬体的形成情况
3.3 井穴放血对大鼠海马组织细胞凋亡情况的影响
分析图3,其中绿色为凋亡细胞核,蓝色为正常细胞核。可以看出细胞凋亡比率由高到底分别为Model组>BANA组>BAJP组>Control组。与Control组大鼠相比,Model 组大鼠海马CA1 区的凋亡细胞数量增加;井穴放血治疗后,AHH 大鼠的凋亡细胞数量明显减少;非穴位放血治疗对AHH 大鼠的细胞凋亡没有明显作用。具体见图3。
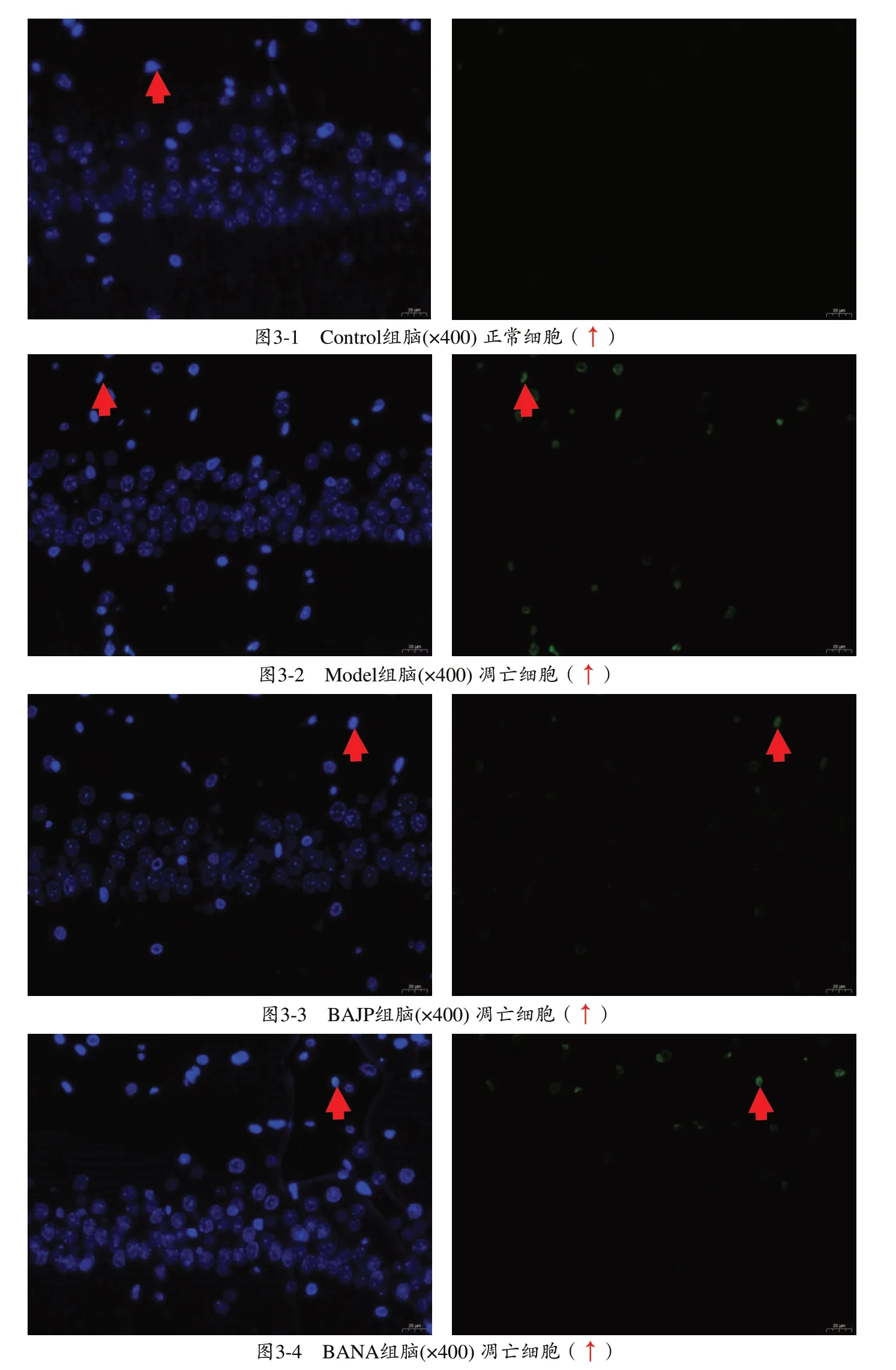
图3 大鼠海马组织细胞凋亡情况
3.4 井穴放血对大鼠海马PI3K/AKT/mTOR 信号通路各分子表达水平的影响
相较于常氧状态下的大鼠,急性高原低氧脑损伤大鼠海马组织细胞内PI3K、AKT、mTOR分子的磷酸化水平显著降低(P<0.01),井穴放血治疗进一步降低了AHH 大鼠这些分子的磷酸化水平(P<0.01),非穴位放血疗法对各分子磷酸化水平并未产生明显作用,与BAJP 组结果存在明显差异(P<0.01),以上趋势通过PCR 检测AKT、mTOR mRNA 获得了进一步的证实。具体见图4。

图4 各组大鼠海马组织PI3K、AKT、mTOR蛋白表达及AKT、mTOR mRNA相对表达量的比较
4 讨论
机体急进高原低氧环境会损伤脑、肺、胃肠等许多重要脏器[7-8],不耐缺氧的脑组织会出现神经元细胞膜钠泵异常、血脑屏障受损、脑血流量增加、脑组织形态结构破坏、机体炎症反应等改变,导致急性高山病、高原性头痛、高原性脑水肿等高原脑病。主要观察的海马CA1 区作为脑部对氧气状态最敏感的区域,又称为易损区,随着海拔升高、缺氧暴露时间的延长,其受损伤程度加重[9]。脑毛细血管内皮细胞中含有大量线粒体,为脑功能正常运转及神经元细胞中神经递质的合成、有氧代谢等生理活动提供了能量支持,受到缺氧损害时会出现电子运输链障碍,氧化磷酸化功能异常,导致能量供应不足、ROS 大量产生,机体出现记忆力下降、认知功能受损等脑损伤表现[10]。线粒体自噬是异常状态下受损线粒体膜电位发生变化,在细胞一些机制的作用下被识别后包裹入自噬体内,与溶酶体结合后降解成营养成分供给细胞循环利用,以此来控制线粒体数量与质量,保证能量的正常供应及机体功能的正常运转[11]。线粒体自噬作为细胞自我调节的适应性机制维持着细胞稳态,但其保护急性高原低氧脑损伤的分子机制未完全明确,需进一步探索。
急性高原低氧脑损伤在中医学中并无对应的病名,根据其临床表现,可归属于“头痛”、“眩晕”等范畴。在中医学认识中,由于高原地区氧气稀薄、气候寒冷、大风干燥等特点,导致宗气不足、气虚运血无力;寒性凝滞、血运不畅;燥邪伤津耗气,津血同源,血脉不充,产生瘀血,因此我们将急性高原低氧脑损伤辨证为“气虚血瘀证”。《针灸大成》曰:“凡初中风跌倒,卒暴昏沉,痰涎壅滞,不省人事,……急以三棱针,刺手十指十二井穴,当去恶血。”表明手十二井穴可用来急救脑卒中昏迷,有效保护脑损伤。本课题组前期研究表明井穴放血可以通过调节HIF-1α/BNIP3 通路促进线粒体自噬水平升高,保护急性高原低氧脑损伤[6]。众多研究[12-16]亦表明井穴放血可以调节神经功能,清除脑组织中过量产生的氧自由基,减轻氧化应激损伤,增强大脑耐缺氧能力,抗神经元细胞凋亡,改善认知功能,改善脑组织的缺血缺氧状态,且对脑血流量具有双向调节作用。因此,我们结合中医学对高原环境的认识,以“治未病”思想为指导,结合经络学说、标本根结理论及现代研究结果等,探究活血祛瘀、醒脑开窍、振奋阳气之手十二井穴对急性高原低氧脑损伤的保护作用。
磷脂酰肌醇3-激酶(Phosphatidylinositol 3 kinase,PI3K)与其下游分子蛋白激酶B(Protein kinase B,AKT)、哺乳动物雷帕霉素靶蛋白(Mammalian target of rapamycin,mTOR)对细胞的增殖、自噬、凋亡起着重要的调控作用。近些年一些研究表明,PI3K/AKT/mTOR通路与应激状态下线粒体稳态有着密不可分的联系,对线粒体自噬起着负向调控作用[17-18]。研究发现,27-P-CAUA可以抑制HER2/PI3K/AKT信号通路诱发线粒体自噬[19]。激活PI3K/AKT 信号通路可以抑制细胞凋亡,减轻神经元细胞氧化损伤和海马组织萎缩,改善阿尔茨海默病大鼠的学习认知功能[20],亦可以通过调节内质网应激来影响细胞自噬与凋亡[21-22]。这些结果表明PI3K/AKT/mTOR 通路可能与脑损伤中线粒体自噬调控有着重要关系,有进一步研究的价值。
本研究结果显示,低压氧舱模拟6000 m 高原环境对实验大鼠低压低氧处理72 h,大鼠脑组织形态结构受损,海马组织显微结构出现显著损伤,神经元细胞凋亡、线粒体肿胀、自噬体出现,证明成功构建了急性高原低氧脑损伤大鼠模型。观察到井穴放血治疗后的AHH 大鼠海马CA1 区变性坏死的锥体细胞及海马组织凋亡细胞数量明显减少、线粒体肿胀减轻、自噬体数量显著增多,而非穴位放血疗法对AHH大鼠脑损伤无明显改善作用,这表明井穴放血保护急性高原低氧脑损伤具有穴位特殊性。AHH 大鼠海马组织细胞内PI3K、AKT、mTOR3 个分子磷酸化水平明显下降,PI3K/AKT/mTOR 通路在缺氧环境中被抑制,结合电镜观察到线粒体肿胀、自噬体数量增多,说明线粒体自噬作为机体自我保护机制被激活了。经过井穴放血治疗后,3 个分子磷酸化水平进一步下降,同时观察到海马组织内变性坏死锥体细胞和海马组织凋亡细胞数量明显减少、线粒体肿胀程度减轻、自噬体数量进一步增加,表明井穴放血可以通过抑制PI3K/AKT/mTOR通路促进线粒体自噬水平升高,改善线粒体生理,维持线粒体的动态平衡,抗神经元细胞凋亡,保护急性高原低氧脑损伤。非穴位放血疗法对3个分子磷酸化水平没有明显影响,进一步说明井穴放血保护急性高原低氧脑损伤存在穴位特殊性。以上趋势通过PCR 中AKT、mTOR mRNA表达水平也可进一步获得证实。
实验结果趋势表明,机体急进高原缺氧环境中时,海马组织神经元细胞损伤,线粒体电子传递链障碍,氧化磷酸化能力受到影响,无法为机体提供足量ATP,过量氧自由基产生,对细胞内环境的稳定造成极大的破坏,细胞为维护其稳态,PI3K/AKT/mTOR 通路被抑制,线粒体自噬激活。十二井穴刺络放血疗法进一步抑制PI3K/AKT/mTOR信号通路各分子表达,促进线粒体自噬水平升高,清除过量产生的ROS,增强机体抗细胞凋亡、耐缺氧的能力,从而保证细胞生理功能的正常运转。
综上所述,井穴放血可以对急性高原低氧脑损伤起到保护作用,具有穴位特殊性,其机制可能是通过抑制PI3K/AKT/mTOR 信号通路促进线粒体自噬水平升高实现的。本研究为防治急性高原低氧脑损伤提供了有效靶点及新思路,为井穴放血的临床使用提供了理论支持。本实验仅将井穴放血与非穴位放血作对比,后续实验将考虑加入穴位对照组,并从多组学角度探究不同穴位对急性高原低氧脑损伤保护作用的差异。
