豚鼠被动皮肤过敏试验条件研究*
2023-12-28董建欣李水仙祝清芬
张 娟,董建欣,李水仙,赵 岩,祝清芬
(山东省食品药品检验研究院·国家药品监督管理局仿制药研究与评价重点实验室·山东省仿制药一致性评价工程技术研究中心,山东 济南 250101)
药物的临床前安全性评价是决定药物研发成败的关键步骤及用药安全评估的重要内容。随着上市新药的增多,尤其是注射途径药物的广泛应用,药物过敏反应发生率大幅提升,因此,临床前过敏反应评价已成为新药研发中安全性评价的重要组成部分[1-2]。被动皮肤过敏(PCA)试验是利用与同种或异种动物组织有结合性的抗体所引起的局部过敏反应,来检验抗体或抗原的高敏感度方法[3-4]。国家药品监督管理局药品审评中心在《药物刺激性、过敏性和溶血性研究技术指导原则》中规定了PCA 试验可选的动物、致敏阳性物质、致敏给药方法及时间。但由于不同种属动物接受免疫球蛋白E(IgE)抗体血清后直至应答抗原攻击产生过敏反应的时间不同,需注意激发时间选择的合理性。目前存在的问题是过敏指导原则均为原则性描述,缺乏具体操作。大鼠在PCA 中反应性差,常需用佐剂配合试验。有研究表明,即使在不加佐剂的情况下,豚鼠也是一种PCA 试验效果较好的模型动物[5-6]。因此,也常选用豚鼠进行PCA 试验,但豚鼠的反应强度远强于大鼠,如何选择合适的观察时间测量蓝斑大小是影响试验质量的重要因素。本试验中采用目前常用的卵白蛋白(ova)和牛血清白蛋白(BSA)作为PCA 试验抗原,研究不同激发时间对不同厂家豚鼠PCA 中ova 和BSA 2 种阳性对照物发生过敏反应程度的影响,从而寻找最适宜的评价时间。现报道如下。
1 材料与方法
1.1 仪器、试药与动物
仪器:XSR-205DU型电子天平(瑞士Mettler Toledo公司,精度为±0.01 g);BS400S 型电子天平(赛多利斯科学仪器<北京>有限公司,精度为±0.01 g)。
试药:ova(批号为SLBB5992V)、BSA(批号为WXBD2626V),均购自美国Sigma Aldrich 公司;(0.9%)氯化钠注射液(河北天成药业股份有限公司,批号为1161104101);依文思兰(上海化学试剂采购供应站分装厂,Fluka进口分装,批号为82-11-02)。
动物:普通级Hartley 健康成年白化豚鼠,抗体血清制备9 只(雌5 只、雄4 只),被动致敏36 只(雌雄各半),均购自潍坊圣诺实验动物养殖有限公司(简称圣诺),动物生产许可证号SCXK(鲁)2018 0002。SPF 级Hartley健康成年白化豚鼠,抗体血清制备9 只(雌5 只、雄4只),被动致敏36 只(雌雄各半),均购自青岛康大生物科技有限公司(简称康大),动物生产许可证号SCXK(鲁)2021 0003。普通级Hartley健康成年白化豚鼠,抗体血清制备9只(雌5 只、雄4 只),被动致敏36 只(雌雄各半),均购自济南金丰实验动物有限公司(简称金丰),动物生产许可证号SCXK(鲁)2018 0006。豚鼠体质量均为300~400 g,喂饲豚鼠生长繁殖饲料(北京科澳协力饲料有限公司,饲料生产许可证号:京饲征2018 06073),置普通级动物室[试验许可证号:SYXK(鲁)2021 0037]。温度20~26 ℃,相对湿度40%~70%,光照每天12 h,自由饮水。本试验方案经研究院动物伦理委员会批准。
1.2 实验方法
分组:检疫合格后,抗体血清制备阶段,取各厂家豚鼠,分别随机分为3组,各3只,即为圣诺阴性对照(NC)组、圣诺ova组、圣诺BSA 组,康大NC 组、康大ova组、康大BSA 组,金丰NC 组、金丰ova 组、金丰BSA 组。被动致敏阶段,取各厂家豚鼠,分别随机分为3 组,各6 只,即为圣诺NC组(4 h)、圣诺ova组(4 h)、圣诺BSA组(4 h)、圣诺NC组(24 h)、圣诺ova组(24 h)、圣诺BSA组(24 h),康大NC组(4 h)、康大ova组(4 h)、康大BSA组(4 h)、康大NC 组(24 h)、康大ova 组(24 h)、康大BSA 组(24 h),金丰NC组(4 h)、金丰ova组(4 h)、金丰BSA组(4 h)、金丰NC组(24 h)、金丰ova组(24 h)、金丰BSA组(24 h)。
抗体血清制备:NC 组、ova 组、BSA 组豚鼠分别予腹腔注射0.9% 氯化钠注射液、0.4% ova 溶液、1%BSA 溶液(均为0.5 mL),隔日给药,每日1 次,连续3次。末次致敏后第10天,腹腔注射4.5%戊巴比妥钠(1 mL/kg)后腹主动脉取血,2 000 r/min 离心10 min,分离,得血清,组内各动物血清合并备用;-20 ℃贮藏,2周内使用。
被动致敏:在豚鼠背中线两侧距脊柱1.5 cm 处去毛,每侧可剪2 点,点间间隔2~3 cm,备4 块去毛区(见图1),每块面积约为3 cm × 3 cm。取各组相应抗体血清,用0.9%氯化钠注射液稀释不同的倍数(1∶2、1∶4、1∶8、1∶16,V/V),各组豚鼠按抗体血清浓度由大到小依次在去毛区1,2,3,4皮内注射抗体血清0.1 mL。
图1 豚鼠皮肤去毛区位置示意图Fig.1 Location diagram of skin hair removal area in guinea pigs
激发:分别于被动致敏4 h 或24 h 时,各组豚鼠右后肢小隐静脉注射与致敏剂量相同的激发抗原加等量的1%依文思兰染料共1.0 mL,进行激发。激发30 min后,以二氧化碳吸入法处死豚鼠,剪取背部皮肤,测量皮肤内层的斑点大小,直径>5 mm判定为阳性。不规则斑点的直径为长径与短径之和除以2[5,7-8]。
1.3 统计学处理
2 结果
2.1 ova 致敏下的豚鼠过敏反应程度
试验期,各组豚鼠一般状态良好,未发现明显异常状况。3 个生产厂家的ova 组(4 h)抗体血清各稀释倍数下形成的蓝斑分界清晰且直径均大于5.0 mm;3 个生产厂家的ova组(24 h)抗体血清各稀释倍数下形成的蓝斑已混在一起、分界不清,无法测量,但蓝斑直径均大于5.0 mm,被动皮肤过敏反应发生率均为100%;3个厂家ova 组蓝斑直径无显著差异。各NC 组(4 h 和24 h)豚鼠激发后均未见明显蓝斑,过敏反应均呈阴性。详见表1。
表1 豚鼠ova血清致敏的蓝斑直径(,mm,n=6)Tab.1 Diameter of blue spots sensitized by ova serum in guinea pigs(,mm,n = 6)
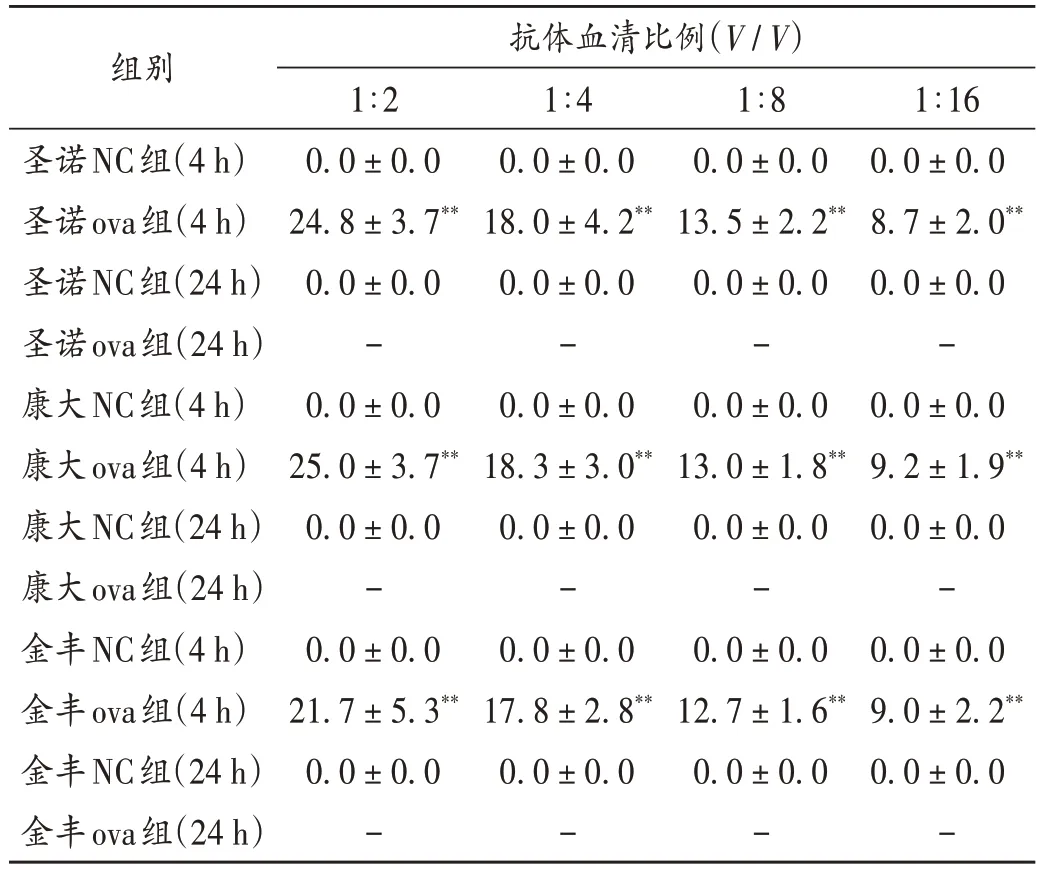
表1 豚鼠ova血清致敏的蓝斑直径(,mm,n=6)Tab.1 Diameter of blue spots sensitized by ova serum in guinea pigs(,mm,n = 6)
注:与同一稀释倍数、同一厂家的NC 组比较,*P < 0.05,**P < 0.01。- 为无法测量,表2同。Note:Compared with those in the NC group sensitized by the same dilution ratio of serum containing antibodies and from the same manufacturer,*P < 0.05,**P < 0.01. - indicates that the diameter cannot be measured(for Tab.1 - 2).
1∶16 0.0±0.0 8.7±2.0**0.0±0.0-0.0±0.0 9.2±1.9**0.0±0.0-0.0±0.0 9.0±2.2**0.0±0.0-组别圣诺NC组(4 h)圣诺ova组(4 h)圣诺NC组(24 h)圣诺ova组(24 h)康大NC组(4 h)康大ova组(4 h)康大NC组(24 h)康大ova组(24 h)金丰NC组(4 h)金丰ova组(4 h)金丰NC组(24 h)金丰ova组(24 h)抗体血清比例(V/V)1∶2 0.0±0.0 24.8±3.7**0.0±0.0-0.0±0.0 25.0±3.7**0.0±0.0-0.0±0.0 21.7±5.3**0.0±0.0-1∶4 0.0±0.0 18.0±4.2**0.0±0.0-0.0±0.0 18.3±3.0**0.0±0.0-0.0±0.0 17.8±2.8**0.0±0.0-1∶8 0.0±0.0 13.5±2.2**0.0±0.0-0.0±0.0 13.0±1.8**0.0±0.0-0.0±0.0 12.7±1.6**0.0±0.0-
2.2 BSA 致敏下的豚鼠过敏反应程度
圣诺和康大的BSA 组(4 h)抗体血清各稀释倍数下形成的蓝斑分界清晰且直径均大于5.0 mm,被动皮肤过敏反应发生率均为100.00%;与圣诺BSA 组(4 h)比较,金丰BSA 组(4 h)抗体血清4 个稀释倍数的蓝斑直径显著减小(P<0.05),且该组仅含抗体血清1∶2、1∶4(V/V)的蓝斑直径大于5.0 mm。圣诺和康大的BSA 组(24 h)抗体血清各稀释倍数形成的蓝斑已混在一起、分界不清,无法测量,但蓝斑直径均大于5.0 mm,被动皮肤过敏反应发生率均为100.00%;各NC 组(4 h和24 h)豚鼠激发后均未见明显蓝斑,过敏反应呈阴性。详见表2。相同条件(稀释倍数和生产厂家)下,与BSA组比较,ova组的蓝斑直径明显更大。
表2 豚鼠BSA血清致敏的蓝斑直径(,mm,n=6)Tab.2 Diameter of blue spots sensitized by BSA serum in guinea pigs(,mm,n = 6)
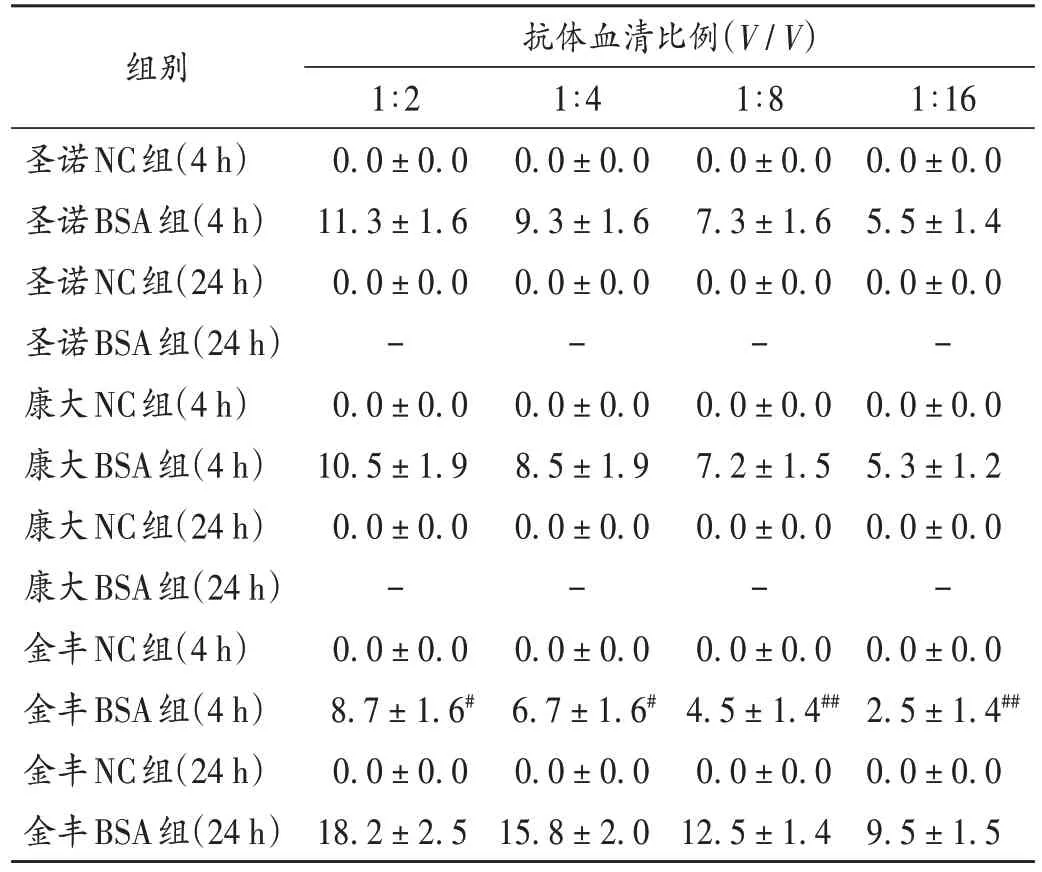
表2 豚鼠BSA血清致敏的蓝斑直径(,mm,n=6)Tab.2 Diameter of blue spots sensitized by BSA serum in guinea pigs(,mm,n = 6)
注:与圣诺BSA组(4 h)比较,#P < 0.05,##P < 0.01。Note:Compared with those in the Shengnuo BSA group (4 h),#P < 0.05,##P < 0.01.
抗体血清比例(V/V)1∶16 0.0±0.0 5.5±1.4 0.0±0.0-0.0±0.0 5.3±1.2 0.0±0.0-0.0±0.0 2.5±1.4##0.0±0.0 9.5±1.5组别圣诺NC组(4 h)圣诺BSA组(4 h)圣诺NC组(24 h)圣诺BSA组(24 h)康大NC组(4 h)康大BSA组(4 h)康大NC组(24 h)康大BSA组(24 h)金丰NC组(4 h)金丰BSA组(4 h)金丰NC组(24 h)金丰BSA组(24 h)1∶2 0.0±0.0 11.3±1.6 0.0±0.0-0.0±0.0 10.5±1.9 0.0±0.0-0.0±0.0 8.7±1.6#0.0±0.0 18.2±2.5 1∶4 0.0±0.0 9.3±1.6 0.0±0.0-0.0±0.0 8.5±1.9 0.0±0.0-0.0±0.0 6.7±1.6#0.0±0.0 15.8±2.0 1∶8 0.0±0.0 7.3±1.6 0.0±0.0-0.0±0.0 7.2±1.5 0.0±0.0-0.0±0.0 4.5±1.4##0.0±0.0 12.5±1.4
3 讨论
PCA是一个错综复杂的试验过程[7],其结果受动物种属、致敏剂量、致敏次数、致敏途径、抗体血清制备时间、是否添加佐剂等多种因素的影响[8]。有文献报道,豚鼠对蛋白类抗原的免疫应答明显强于大鼠[9]。有研究发现,抗体制备阶段致敏效果与致敏次数无相关性,末次致敏后第10天制备抗体血清的阳性反应优于末次致敏后第14 天制备抗体血清的阳性反应[8,10]。由于指导原则中相关规定不够具体,国内虽已有学者对PCA 动物种属、佐剂、假阴性试验结果等影响因素进行了探讨[9-15],但目前关于PCA 被动致敏的评价时间及使用不同厂家的豚鼠的影响因素未见报道,值得进一步探讨。本研究中选取3 个厂家的豚鼠作为实验动物进行PCA 试验条件的研究,以便在预测受试物(主要是注射剂)的免疫原性时,采用更敏感的试验条件,从而取得更好的结果。
本研究中,ova 被动致敏适宜的激发时间为4 h,不同厂家豚鼠产生的蓝斑直径未见明显差异;BSA被动致敏激发时间与豚鼠的生产厂家有关,不同来源的豚鼠PCA 试验的激发时间不同,提示应用BSA 作为试验抗原时应根据不同厂家的豚鼠选择合适的激发时间;同时发现相同条件下ova 比BSA 更易产生被动皮肤过敏反应。本实验室已将所建立的方法应用到苯甲醇注射液等品种的非临床安全性评价的被动皮肤过敏试验中。
综上所述,0.4% ova 溶液与前期主动全身过敏试验研究中能产生典型阳性症状的ova 剂量相同[2],在进行新药PCA 的安全性评价时,首选ova 作为试验抗原,并确定了豚鼠PCA 中ova 适宜的激发时间为4 h,该研究为提高试验稳定性和更好地评价新药奠定了基础。
