芍药耐热性评价及其鉴定指标筛选
2023-12-28侯赵玉龚亦钊钱祎程卓雅陶俊赵大球
侯赵玉,龚亦钊,钱祎,程卓雅,陶俊,赵大球
芍药耐热性评价及其鉴定指标筛选
侯赵玉,龚亦钊,钱祎,程卓雅,陶俊,赵大球
扬州大学园艺园林学院,江苏扬州 225009
【目的】采用多元统计分析方法评价不同芍药品种的耐热能力、筛选芍药耐热性鉴定指标,建立更加全面可靠的芍药耐热性评价体系。【方法】本研究以140个芍药品种为材料,采用田间试验,在芍药经过夏季高温胁迫后于8月份测定热害指数、株高、冠幅、叶绿素相对含量(SPAD)等8个形态结构指标以及丙二醛(MDA)、相对电导率(REC)等13个生理指标。采用相关性分析、隶属函数分析、主成分分析、聚类分析和逐步回归分析对芍药耐热性进行综合评价并筛选耐热性鉴定指标。【结果】21个指标之间存在不同程度的变异,变异系数范围为6.66%—78.02%,变异系数具体表现为:过氧化氢酶(CAT)>过氧化物酶(POD)>净光合速率(Pn)>非光化学猝灭系数(qN)>超氧化物歧化酶(SOD)>气孔密度>栅栏/海绵组织>可溶性糖含量(SSC)>可溶性蛋白含量(SPC)>热害指数>SPAD>实际光合效率(Y(Ⅱ))>色相(b)>丙二醛(MDA)>非调节性能量耗散(Y(NO))>冠幅>叶片厚度>株高>相对电导率(REC)>有效光化学量子产量(Fv/Fm)>色度角(h),其中变异系数最大的为CAT,变异系数最小的为h;通过对各项指标进行相关性分析发现,X1(热害指数)与X2(株高)、X3(冠幅)、X4(SPAD)、X7(Fv/Fm)、X12(叶片厚度)、X17(SSC)呈极显著负相关,与X6(Pn)、X8[Y(Ⅱ)]、X13(气孔密度)、X20(CAT)呈显著负相关,与X5(REC)、X9[Y(NO)]、X16(MDA)、X18(SPC)呈极显著正相关,各指标之间存在不同程度的相关性,较为复杂;通过主成分分析法将21个指标提取为7个主成分因子,贡献率分别为20.50%、11.66%、8.24%、7.24%、7.06%、5.31%和4.85%,累计贡献率达到64.87%;利用隶属函数分析法计算出140个芍药品种的综合得分值(W),在此基础之上采用聚类分析将芍药品种分为“优”“良”“中”“差”4个耐热等级,其中“优”占比14.3%,“良”占比26.4%,“中”占比46.4%,“差”占比12.9%;进一步利用逐步回归分析建立最优线性回归方程W=0.228-0.166X1+0.002X4+0.325X7-0.257X9+0.112X10+ 0.00028X13+ 0.002X17+0.00015X19+0.001X20,从21个指标中筛选出X1(热害指数)、X4(SPAD)、X7(Fv/Fm)、X9[Y(NO)]、X10(qN)、X13(气孔密度)、X17(SSC)、X19(SOD)、X20(CAT)这9个指标作为芍药耐热性的鉴定指标。【结论】采用多元统计分析的方法评价芍药耐热性,将140个芍药品种分为4类(优、良、中、差),筛选出热害指数、SPAD值等9个指标作为芍药耐热性鉴定指标,快速评价芍药的耐热能力,从而显著提高芍药耐热性鉴定的效率。
芍药;耐热性;主成分分析;隶属函数分析;综合评价体系
0 引言
【研究意义】芍药(Pall.)是中国的传统名花,栽培历史悠久,有“百花之中,其名最古”之说。芍药喜阳光充足的环境,忌夏季炎热,耐寒性强,多在北方栽培[1]。随着人民生活水平的不断提高,长江中下游及以南地区芍药的引种栽培也逐步进入大众的视野[2]。然而这些地区具有夏季高温持续时间长、强度大等特点,严重抑制部分观赏芍药的生长发育。因此,建立科学、系统的芍药耐热性评价体系、筛选耐热性鉴定指标对于在长江中下游及以南地区进一步推广芍药种植具有重要意义。【前人研究进展】目前有关芍药耐热性评价的研究报道较少。刘林艳[3]以3个芍药品种为材料,采用因子分析法和隶属函数法对测定的8个指标进行统计分析,从而筛选出耐热性品种;赵大球等[4]以30个芍药品种为材料,通过相关性分析和逐步回归分析筛选出热害指数、相对电导率、叶绿素相对含量(soil and plant analysis development,SPAD)、光合速率作为芍药耐热性鉴定指标;张佳平等[5]对浙江省杭州和湖州地区的‘杨妃出浴’‘春晓’等10个品种进行观测,采用隶属函数分析法与主成分分析法进行耐热性综合评价,将它们划分为3个等级,同时发现耐热性越弱的芍药品种丙二醛(malondiadeyde,MDA)含量积累越高;抗坏血酸过氧化物酶(ascorbate peroxidase,APX)活性随着高温胁迫的上升逐渐增大;张方静等[6]采用主成分分析法对‘月月红’和‘月月粉’两个月季品种进行耐热性评价以及耐热性鉴定指标的筛选,选取最大荧光产量(Fm)、光化学猝灭系数(qP)、光合电子传递速率(ETR)、有效光化学量子产量(Fv/Fm)、固定荧光(Fo)、非光化学猝灭系数(qN)及相对电导率(REC)、可溶性糖含量(soluble sugar,SS)、叶绿素含量、超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondiadeyde,MDA)含量作为月季耐热性鉴定指标;余炳伟等[7]以11个性状稳定的黄瓜自交系为材料,测定SOD、过氧化物酶(peroxidase,POD)等生理指标发现,耐热的黄瓜幼苗相对电导率低于不耐热的黄瓜幼苗、谷胱甘肽(GSH)含量高于不耐热的黄瓜幼苗;对黄瓜幼苗叶片的显微结构进行观察发现耐热的黄瓜幼苗组织细胞结构完整性好,栅栏组织和海绵组织厚度大、结构紧密,而不耐热的黄瓜幼苗叶片降解程度大,结构遭到破坏;毛静等[8]对16个德国鸢尾品种进行耐热性评价,通过主成分分析筛选出叶绿素含量、超氧化物歧化酶(superoxide,SOD)、脯氨酸含量作为鸢尾耐热性鉴定指标。【本研究切入点】目前评价芍药耐热性研究所采用的供试材料较少,测定指标单一,未采用多元统计分析方法,难以全面、准确地反映不同芍药品种的耐热性。【拟解决的关键问题】本研究选取140个芍药品种为材料,基于所测定的相关形态指标和生理指标,采用多元统计分析方法进行分析,最终建立芍药耐热性评价体系;筛选芍药耐热性鉴定指标,为高效选育芍药耐热性品种及芍药耐热性机理研究奠定基础。
1 材料与方法
1.1 试验材料
供试材料为140个芍药品种(表1),均在2009年引种保存并于2017年分株栽植,田间管理同大田水平。
1.2 试验方法
试验于2022年8月在扬州大学国家芍药种质资源库进行。芍药适宜生长温度为15—25℃,从6月开始芍药便经受高温胁迫(2022年江苏省扬州市6月白天平均温度为32.6 ℃,最高温度37 ℃;7月白天平均温度为34.8 ℃,最高温度40 ℃;8月白天平均温度为35.2 ℃,最高温度为41 ℃)。株高、冠幅、热害指数等指标在8月上旬进行测定;于8月15日取不同品种芍药叶片,液氮速冻后置于-80 ℃冰箱保存,用于生理生化指标的测定。
1.3 测定指标及方法
1.3.1 植株形态 芍药株高、冠幅用卷尺进行测量,每个指标随机选取3株植株进行重复测定并取平均值。
1.3.2 叶色 使用手持色差仪(X-rite RM200QC,美国)测定叶色,选取芍药4—5叶位的叶片为测定对象,进行色相(b)与色度角(h)指标测定,重复3次。
1.3.3 热害指数 根据芍药枝叶在夏季高温胁迫下的伤害情况,将耐热能力级别分为5级,具体标准如下[9]:0级,所有枝条无高温伤害症状;1级,单个枝条有少于1/4的叶片出现枯萎斑点;2级,单个枝条有1/4—1/2的叶片出现焦边;3级,单个枝条有1/2—3/4的叶片出现枯焦或穿孔;4级,单个枝条有3/4以上叶片枯焦;5级,整株叶片枯萎或死亡。每个品种观测3株及以上。热害指数通过公式计算:
热害指数=Σ(级别株数×级别数)/(最高级数×总株数)。
1.3.4 SPAD值 选取每株芍药4—5叶位的叶片,避开主叶脉,使用SPAD-502便携式叶绿素仪(Koinca Minolia sensing,日本)测定SPAD值,每3张叶片为一组重复,重复3次,取平均值。
1.3.5 相对电导率(REC) 用去离子水清洗新鲜叶片,使用直径1 cm的打孔器在叶片上打孔,称取0.1 g样品放入含有少许去离子水的注射器中。抽真空后将样品转移到盛有20 mL去离子水的离心管中静置4 h,用电导率仪(DDS-307,中国雷磁仪器有限公司)测定初始溶液电导率(A1);随后,在沸水浴中加热离心管30 min,冷却至室温,测定电导率(A2)。
REC(%)=A1/A2×100
1.3.6 气体交换参数和叶绿素荧光参数 采用Li-6400光合作用测定仪(Li-cor,美国)在7:00—8:00测定基部第3对真叶净光合速率(Pn)。利用双通道调制叶绿素荧光仪PAM-2500(WALZ,德国)测定叶片叶绿素荧光参数,用叶片夹夹住叶片,暗适应30 min后分别测定荧光参数有效光化学量子产量(Fv/Fm)、实际光合效率(Y(Ⅱ))、非调节性能量耗散(Y(NO))、非光化学猝灭系数(qN)。每个指标随机选取3株植株进行测定,并取平均值。
1.3.7 气孔密度 在高温胁迫后选取长势良好的植株采集样品,从植株顶部往下数的第2—6片叶取样,每个品种取3片完整叶片,用于叶片气孔特征观察。采用指甲油撕取法制成临时片,将刚采集下来的气孔用清水洗净后用滤纸吸干表面水分,用指甲油均匀涂抹在载玻片上,然后叶片的下表面贴在载玻片上,自然晾干后用镊子将上表皮和叶肉层轻轻撕取下来,保持叶片的完整,用显微镜(ZEISS Imager.z 2)在10×10倍的显微镜下观察叶片下表皮气孔并拍照,采用Image J 64软件测量气孔密度,并计算[10]。每个指标取3个视野,统计数据后取平均值。
1.3.8 叶片横切结构 取不同品种长势良好的新鲜叶片,每个品种各取3片,选取叶片中部最宽处。用徒手切片的方式制作叶片横截面的临时装片[11]。在普通的光学显微镜上进行观察,利用荧光显微镜以及cellSens Standard软件在20倍镜下进行叶片横切结构的观察与测量。测量内容为芍药的栅栏组织、海绵组织及叶片厚度。每个指标测量3次,计算平均值。
1.3.9 生理生化指标 丙二醛含量(MDA)、可溶性糖含量(SSC)、可溶性蛋白含量(SPC)、超氧化物歧化酶(SOD)活性、过氧化物酶(POD)活性、过氧化氢酶(CAT)活性的测定均参照试剂盒(苏州科铭生物有限公司)说明进行操作。
1.4 数据处理
采用Excel进行数据处理,采用SPSS25.0进行主成分分析、隶属函数分析、聚类分析、逐步回归分析,使用Origin2021进行相关性分析。使用SPSS25.0将不同芍药品种测定指标进行数据标准化[12-13]。
(1)隶属函数值U(xi)=(Xi-Xmin)/(Xmax-Xmin);i=1,2,3,…,n。
(2)Vp=λp/∑pp=1λp,Vp表示提取的第p个主成分的权重,λp表示提取的主成分所对应的贡献率。
(3)W=∑pp=1(wp×μxi),W表示高温处理响应因子综合值,以W值进行聚类统计,划分耐高温等级。
2 结果
2.1 芍药相关指标的遗传变异分析
从表2可以看出,高温胁迫对不同芍药品种影响较大。芍药品种间的21个性状变异丰富,变异系数具体表现为:CAT>POD>Pn>qN>SOD>气孔密度>栅栏/海绵组织>SSC>SPC>热害指数>SPAD>Y(Ⅱ)>b>MDA>Y(NO)>冠幅>叶片厚度>株高>REC>Fv/Fm>h;其中变异系数最大的为CAT,变异系数最小的为h,不同指标间的变异幅度较大。根据单一性状指标直接判断芍药品种的耐热性过于片面和缺乏可靠性,因此,需进一步对各指标相关性进行分析和评价。
2.2 高温胁迫下各指标间的相关性分析
通过对21个指标进行相关性分析可知(图1),X1(热害指数)与X2(株高)、X3(冠幅)、X4(SPAD)、X7(Fv/Fm)、X12(叶片厚度)、X17(SSC)呈极显著负相关,与X6(Pn)、X8[Y(Ⅱ)]、X13(气孔密度)、X20(CAT)呈显著负相关,与X5(REC)、X9[Y(NO)]、X16(MDA)、X18(SPC)呈极显著正相关,其他各指标之间也存在着不同的相关性,各个指标之间的关系存在重叠、交叉的现象。可以看出芍药的耐热性是一个复杂的、综合的性状,受环境和遗传等共同影响,需要将各单项指标进行综合考虑进而得到准确的信息量,从而消除使用单一的指标评价耐热性所造成的不确定性和不足。因此,需要进一步运用多元化的方式进行评价。
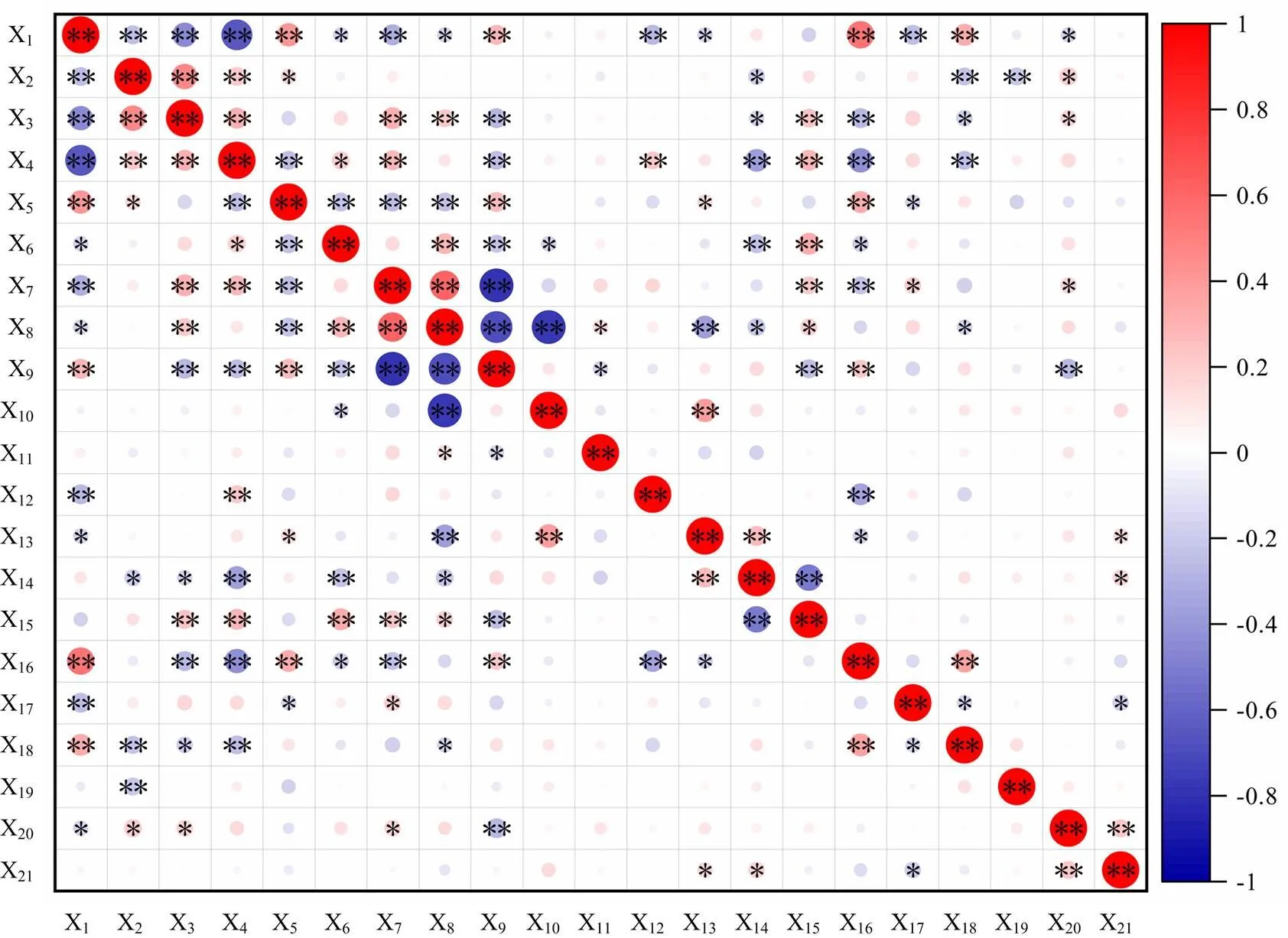
*:<0.05; **:<0.01
不同颜色表示相关性的强度,越接近红色(正)或蓝色(负)说明相关性越高,圆形直径越大说明相关系数越大
Different colors indicate the intensity of the significant, and the closer to red (plus) or blue (minus), the higher for the significant, the larger the circular diameter, the greater the correlation coefficient
图1 芍药不同指标间的相关性分析
Fig. 1 Correlation analysis of different indices of herbaceous peony
2.3 高温胁迫下不同芍药品种测定指标的主成分分析
通过主成分分析法对不同芍药品种的测定指标进行分析,根据特征值大于1的准则提取了7个主因子,从而将21个单项指标提取为7个新的相互独立的综合指标,分别用主成分C1、C2、C3、C4、C5、C6、C7表示,其特征值分别为4.31、2.45、1.73、1.52、1.48、1.12、1.02,贡献率分别为20.50%、11.66%、8.24%、7.24%、7.06%、5.31%、4.85%,累计贡献率达到64.87%,说明这7个主成分因子具有较强的信息代表性。依据表3特征向量的绝对值可以看出,第一主成分主要包括X1、X3、X4、X5、X6、X7、X8、X9、X15、X16、X18,第二主成分主要包括X10、X13,第三主成分主要包括X2、X14、X19,第四主成分主要包括X11、X20,第六主成分主要包括X17、X21,第七主成分主要包括X12。表明通过主成分分析取得的7个独立性综合指标可以全面地反映出原始的21个指标包含的信息。
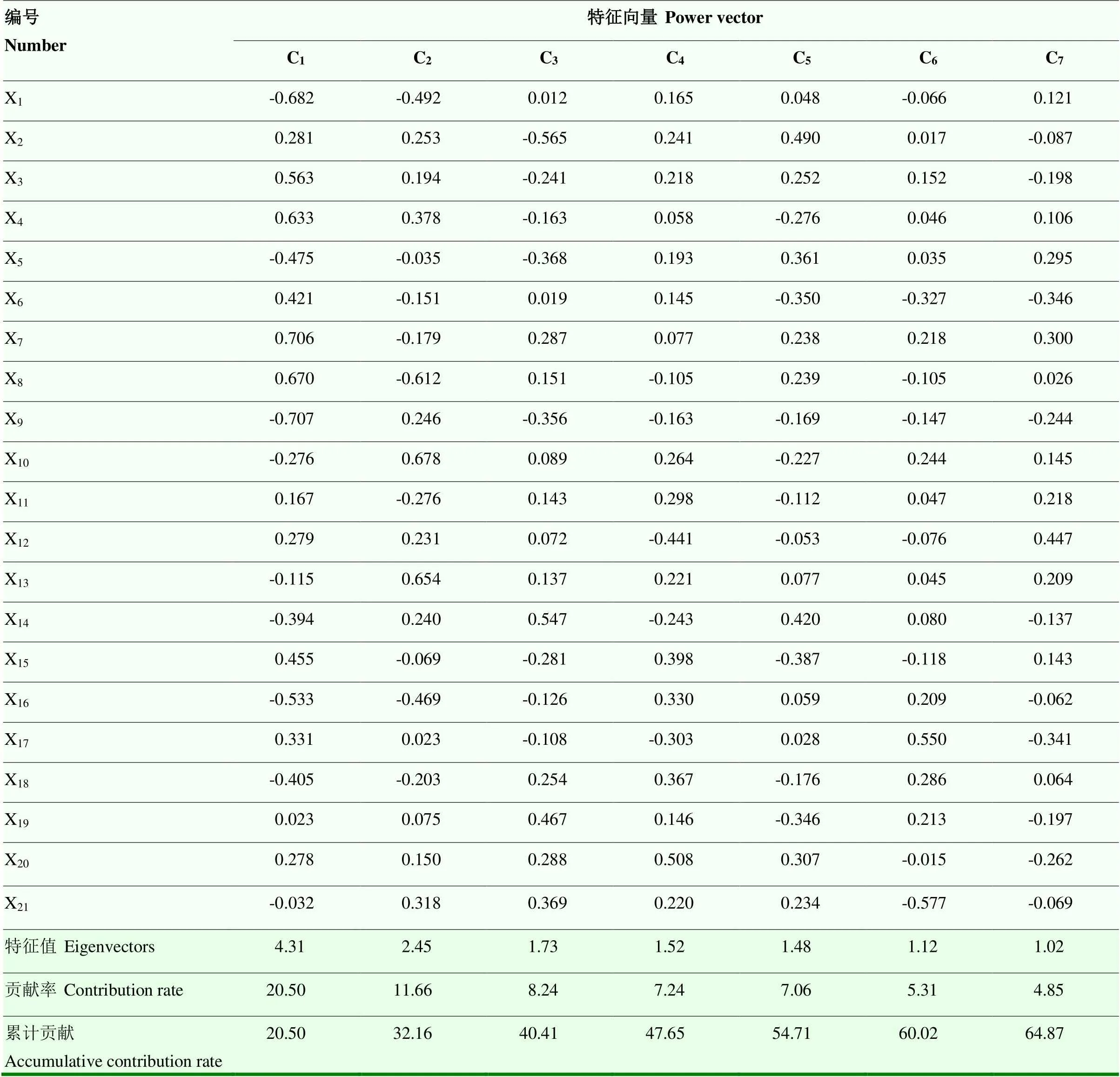
表3 各性状主成分特征向量、特征值、贡献率
2.4 不同芍药品种的综合得分
利用SPSS22.0对各单项指标进行标准化数据处理,标准化后的数据和通过主成分分析得到的各主成分综合指标的系数进行乘积,计算出每个芍药品种的7个综合指标得分值(表4)。根据公式(1)将综合指标的得分值进行计算得出各试验材料的隶属函数值U(xi),然后根据公式(2)计算出7个主成分综合指标所占的权重,分别为0.32、0.18、0.13、0.11、012、0.08、0.07,利用公式(3)计算出各芍药品种的综合评价值(W),W值即为每个品种的耐热能力,即W值越大,耐热能力越强。
2.5 不同芍药品种耐热能力聚类分析
基于不同芍药品种的综合得分值(W)对其进行分类,使用平方欧式距离法采用组间连接的方式进行聚类分析,将140个芍药品种耐热能力分为优、良、中、差4个等级(图2),即I、II、III、IV组群,其中第I组群包括SY101(‘碧天晴空’)、SY12(‘桃花系金’)、SY6(‘粉珠盘’)等20个品种,占比为14.3%;第II组群包括:SY126(‘佛光珠影’)、SY100(‘莲台’)、SY53(‘紫羽球’)等37个品种,占比为26.4%;第III组群包括SY46(‘紫袍’)、SY15(‘晚妆粉’)、SY94(‘奇丽’)等65个品种,占比为46.4%;第IV组群包括SY64(‘湖水荡漾’)、SY136(‘红楼显贵’)、SY131(‘红绫’)等18个品种,占比为12.9%。
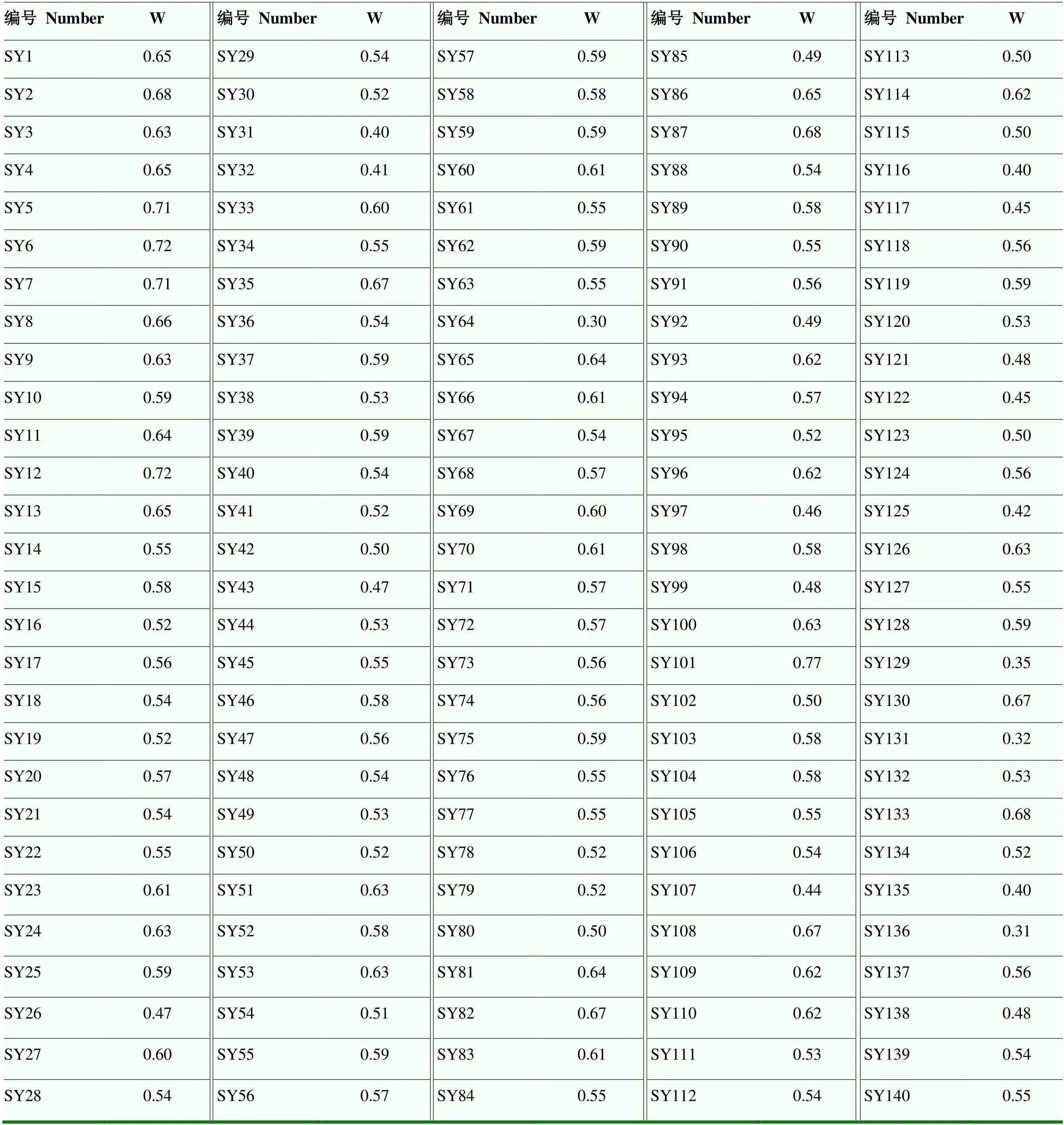
表4 不同芍药品种的综合得分
2.6 回归模型建立及耐热性指标的筛选
为了进一步分析21个测定指标与不同芍药品种耐热性之间的关系,通过逐步回归分析法,以综合评价值(W)为因变量,以不同芍药品种测定的各指标为自变量建立最优化线性回归方程:
W=0.228-0.166X1+0.002X4+0.325X7-0.257X9+0.112X10+0.00028X13+0.002X17+0.00015X19+0.001X20。
该方程决定系数2=0.977,Durbin-Watson统计量d=1.959。由方程可知,上述9个指标与综合评价值(W)呈显著性相关(<0.05),筛选X1(热害指数)、X4(SPAD)、X7(Fv/Fm)、X9[Y(NO)]、X10(qN)、X13(气孔密度)、X17(SSC)、X19(SOD)、X20(CAT)这9个指标作为芍药耐热性的鉴定指标具有可靠性。使用该方程对不同芍药品种的耐热能力进行综合评价值预测,其预测值(PV,表5)与评价值(W)呈极显著相关(表6),表明使用该回归方程对不同芍药品种的耐热能力进行预测具有很高的准确性。
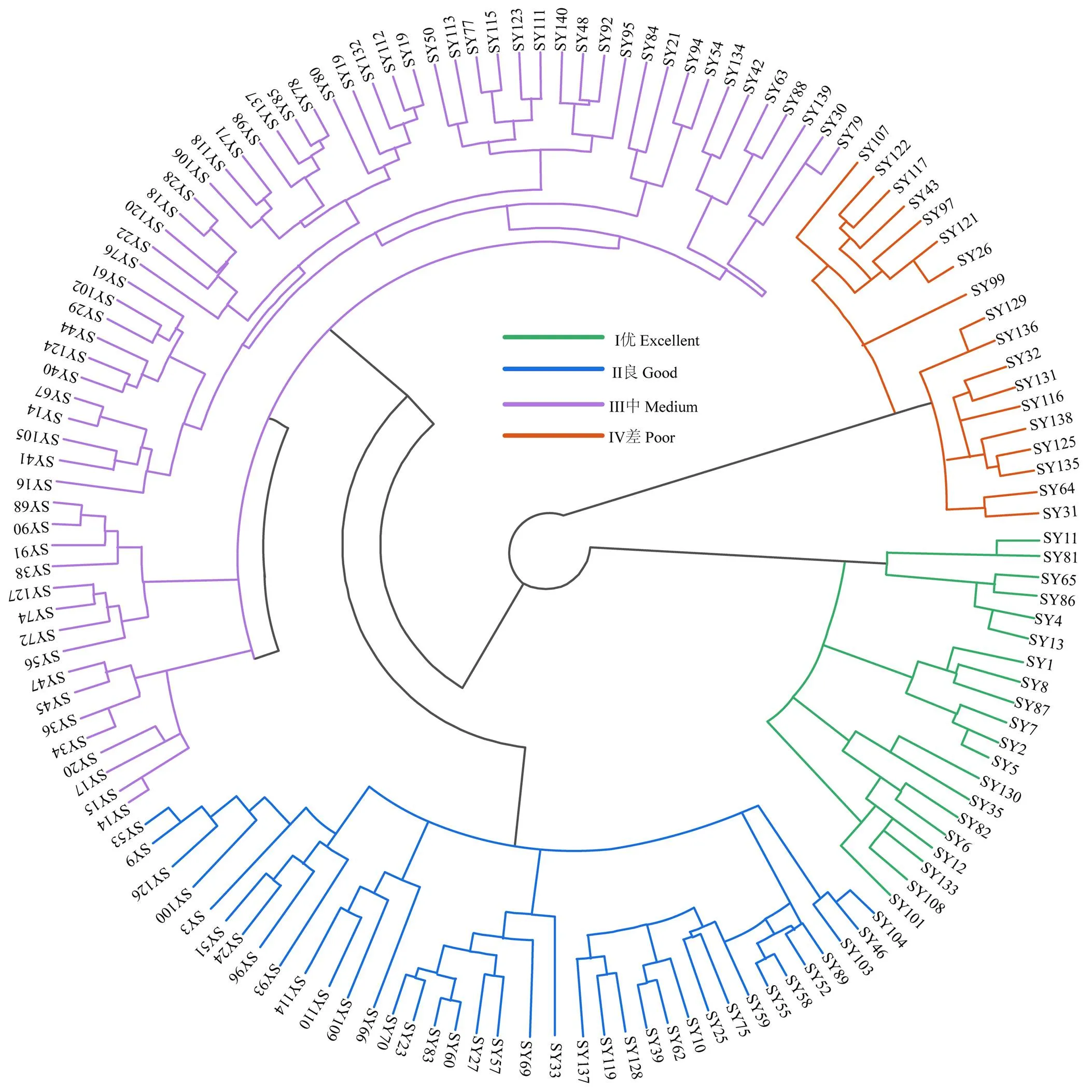
图2 基于W值的芍药耐热能力聚类分析
2.7 不同耐热能力芍药品种的特征分析
依据不同耐热能力芍药品种的各形态、生理指标平均值(表7,图3),对方程的9个耐热性鉴定指标进行不同芍药品种表现特征的比较。结果表明,随着不同芍药品种耐热能力的逐渐降低,热害指数逐渐增大,SPAD值逐渐变小,芍药叶片萎蔫、植株枯萎程度不断加深;通过对不同耐热能力芍药品种SSC含量及SOD、CAT活性的测定发现,耐热能力强的芍药品种SSC含量及SOD、CAT活性均高于耐热能力弱的芍药品种;随着不同芍药品种耐热能力的逐渐降低,Fv/Fm、qN值逐渐变小,Y(NO)值逐渐增大,气孔密度逐渐变小。
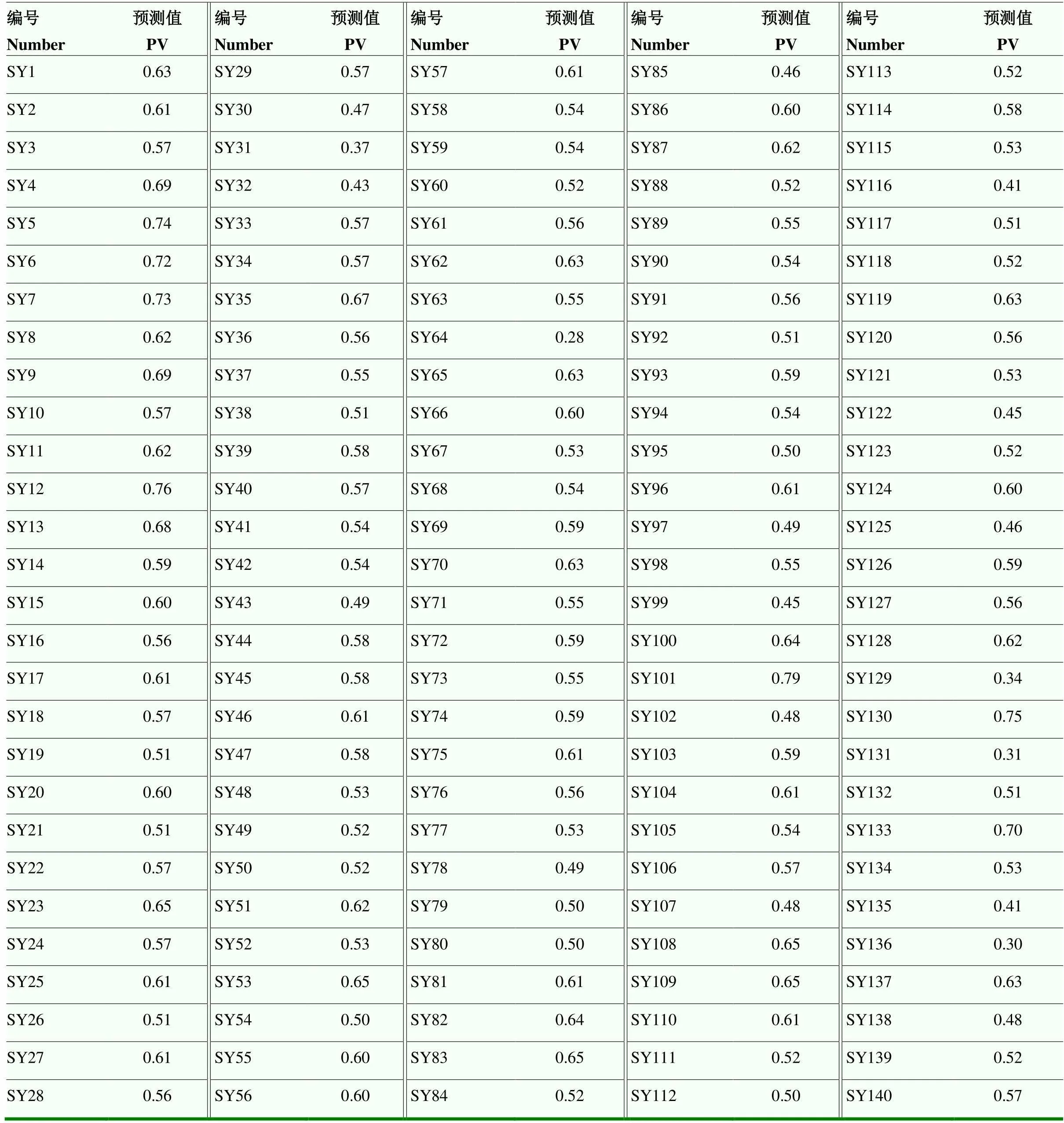
表5 不同芍药品种的预测值得分
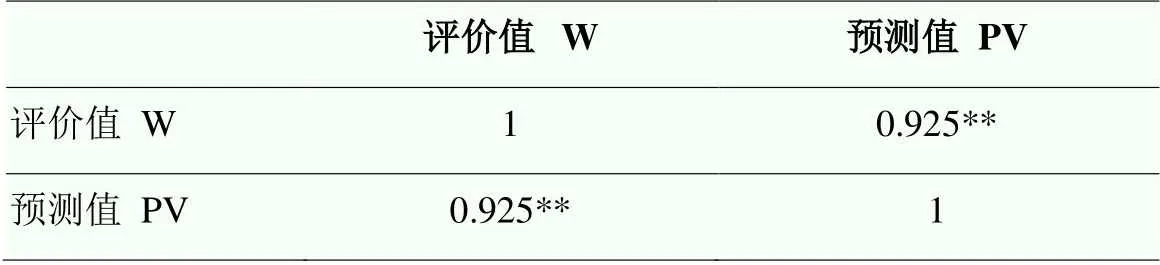
表6 W值与PV值相关性分析
**:<0.01
2.8 芍药品种耐热能力与耐热性鉴定指标关系
综合聚类分析和逐步回归方程的结果,分析聚类结果中不同耐热能力芍药品种与耐热性鉴定指标之间的关联程度以及主成分分析。耐热能力评价结果为“优”的芍药品种与SPAD、qN、气孔密度、CAT这4个耐热性鉴定指标之间存在较强的关联性;耐热能力评价结果为“良”“中”的芍药品种与各耐热性鉴定指标之间有较为均衡的关联性;耐热能力评价结果为“差”的芍药品种与热害指数、Y(NO)关联性较强(图4-A)。此结果在耐热性鉴定指标PCA图中也得到了良好的验证(图4-B),同时,不同耐热能力的芍药品种与耐热性鉴定指标之间存在着复杂的关系,进一步表明在芍药耐热性评价过程中,采用多元统计分析的方法更加合理。此外,热害指数、Y(NO)、qN分布在第二与第三象限,并与其他指标呈负相关。
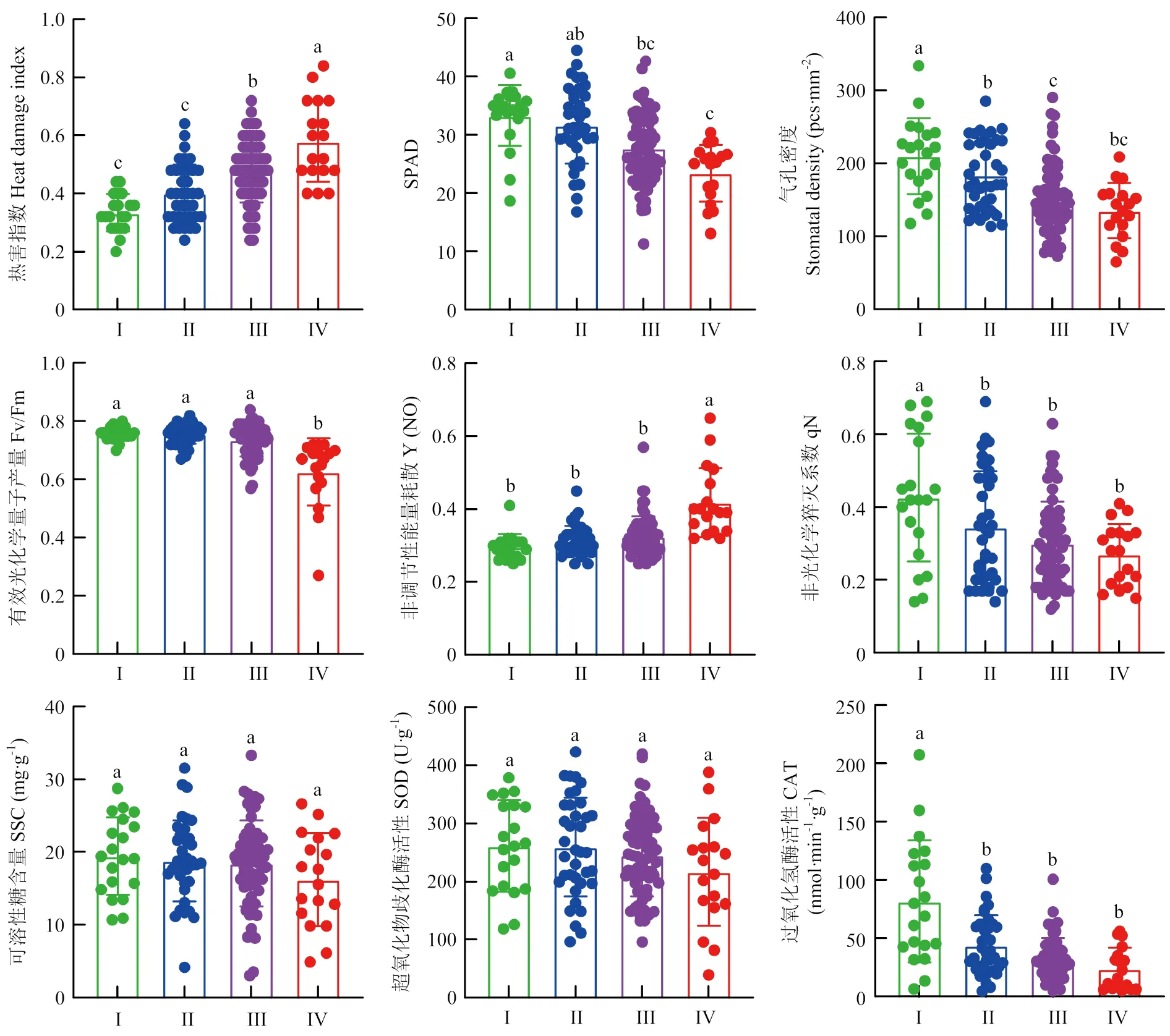
图3 聚类结果中不同耐热能力类型芍药品种的形态及生理表现特征
3 讨论
3.1 高温胁迫对芍药的影响
高温是制约植物正常生长发育的环境因素之一。随着温室效应的加剧,夏季极端高温天气的出现频率也在不断增加,轻则造成植物萎蔫,重则对植物细胞造成不可逆转的损害、代谢途径造成破坏、膜结构和蛋白质受到永久性损伤等[14-16]。前期研究表明,植物在受到高温胁迫后会降低体内叶绿素合成的速率,加快叶绿素的降解,同时会造成体内活性氧的积累[17-20]。此外,芍药叶片在受到高温胁迫后会呈现黄绿色、小而密集的晒伤穿孔以及大面积的黑褐色斑块,进而造成植株枯萎死亡[21]。本研究发现,耐热能力强的芍药品种在经历高温胁迫后,热害指数、SPAD值、叶绿素荧光参数指标均优于耐热能力差的芍药品种。同时,耐热性弱的芍药品种叶片黄化、枯萎程度明显高于耐热性强的芍药品种。Wu等[22]通过对芍药高温胁迫的生理生化和分子响应研究发现,耐热性强的芍药品种抗氧化酶活性水平更高,以此来确保植株在高温胁迫下的正常生长。在本研究中,与活性氧清除相关的抗氧化酶SOD和CAT活性以及SSC含量在耐热品种中均明显高于耐热能力差的芍药品种,这与Wu等[22]的研究结果一致。上述结果表明,植物在经历高温胁迫后会通过提高抗氧酶活性等酶促防御系统以及可溶性糖含量等非酶促防御系统来缓解高温胁迫所带来的伤害[23]。

图4 芍药品种耐热能力类型与耐热性鉴定指标关系(A)与耐热性指标主成分分析(B)
3.2 芍药耐热性评价方法的确定
关于植物耐热性评价与品种筛选的研究早有报道,前期人们多提出使用热害指数来鉴定多个植物品种的耐热能力[24-25]。前人基于热害指数筛选芍药耐热性品种并以热害指数为因变量、测定指标为自变量建立最优化线性回归方程,筛选出热害指数、相对电导率、光合速率、SPAD值作为芍药耐热性鉴定指标[4],这种方法虽简单易行,但是仅凭热害指数这单一的指标去筛选耐热性品种却忽略了芍药耐热性受多方面的影响。本研究中,随着不同芍药品种耐热能力的逐渐降低,热害指数均值不断升高,但是单个芍药品种的热害指数也会出现与综合评价不符的情况。因此,以热害指数为主因素去评价芍药的耐热性是否具有可靠性还有待商榷。
高温对植物的影响是一个复杂的过程,受环境、生理、遗传等多种因素的影响[26-30],仅依靠一个或几个指标去评价植物的耐热能力、筛选耐热品种具有局限性。多元统计分析方法可以将多个指标转化成几个指标,将复杂的问题简单化,增加评价的高效性[31]。蔡继鸿等[32]在自然高温胁迫下,利用主成分分析将8个测定指标提取为3个主成分进行综合评价,并对18个杜鹃品种的耐热性进行排序;凌瑞等[33]通过测定8个绣球品种的14个指标,利用主成分分析法将其转化为4个综合指标,通过隶属函数法计算出的综合评价值进行聚类分析,划分出3个耐热等级,筛选出游离脯氨酸含量、叶绿素a+叶绿素b含量、类胡萝卜素含量、SOD活性、相对含水量(RWC)与可溶性糖(SS)作为耐热性鉴定指标;付丽军等[34]对12个黄瓜品种进行耐热性评价,利用主成分分析法将12个测定指标转化为3个主成分,使用隶属函数分析法计算综合评价值并进行聚类分析,建立黄瓜耐热性综合评价体系。前期研究表明,使用主成分分析法、隶属函数分析法等多元统计方法评价植物的耐热性具有一定的可靠性与准确性。本研究采用多元统计分析的方法对芍药的耐热性进行评价;同时建立芍药耐热性评价体系,避免了单一指标评价所造成的片面性,这种评价方法更加科学合理。
3.3 芍药耐热性品种筛选
赵大球等[4]筛选出‘红绫簪’‘碧天晴空’‘紫凤羽’等品种具有较强的耐热性;张佳平等[5]筛选出强耐热性品种‘杭白芍’‘杨妃出浴’‘春晓’。本研究筛选出等级为“优”的品种中:‘碧天晴空’‘杨妃出浴’与前人的研究结果一致,均对高温具有较强的抗性;而‘红绫簪’‘紫凤羽’等品种在本研究中尚未进行观测,后续仍需对部分未涉及到的品种进行夏季高温的观测,补充其耐热性评价。另外,本研究还发现不同芍药品种在经历高温胁迫后的生理指标差异较大,这主要是由于植物受到胁迫后的生理生化反应是一个动态的过程,同时植物也会通过不同的生理生化反应进行自愈[35],因此,在后续的研究中应该继续对评价为“优”的芍药品种进行连续多年观测,测定耐热性指标,进行综合评价,这样才能更有利于选育耐热性品种。
4 结论
本研究将140个芍药品种按其综合评价值(W)分为4个耐热能力不同的等级,筛选出‘碧天晴空’‘桃花系金’‘粉珠盘’等20个耐热能力为“优”的芍药品种;采用逐步回归法建立了最优线性回归方程,并从21个测定指标中筛选出热害指数、叶绿素相对含量(SPAD)、有效光化学量子产量(Fv/Fm)、非调节性能量耗散(Y(NO))、非光化学猝灭系数(qN)、气孔密度、可溶性糖含量(SSC)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)作为评价芍药耐热性的指标。
[1] 吕长平, 刘林艳. 高温胁迫对芍药部分生理生化指标的影响. 湖南农业大学学报(自然科学版), 2008, 34(6): 664-667.
Lü C P, LIU L Y. Effects of high temperature on physiological and biochemical characteristics of. Journal of Hunan Agricultural University (Natural Sciences), 2008, 34(6): 664-667. (in Chinese)
[2] 于莎莎, 张楠. 中国观赏园艺产业现状与发展趋势. 中国观赏园艺产业现状与发展趋势. 现代农业科技2020(17): 112-113.
YU S S, ZHANG N. Present situation and development trend of ornamental horticulture industry in China. Modern Agricultural Science and Technology, 2020(17): 112-113. (in Chinese)
[3] 刘林艳. 几个芍药品种的耐湿热生理生化特性研究[D]. 长沙: 湖南农业大学, 2008.
LIU L Y. Study on physiological and biochemical characteristics of severalvarieties in humid heat tolerance[D]. Changsha: Hunan Agricultural University, 2008. (in Chinese)
[4] 赵大球, 韩晨霞, 陶俊. 不同芍药品种耐热性鉴定. 扬州大学学报(农业与生命科学版), 2015, 36(4): 105-109.
ZHAO D Q, HAN C X, TAO J. Heat tolerance identification of different herbaceous peony (Pall.) cultivars. Journal of Yangzhou University (Agricultural and Life Science Edition), 2015, 36(4): 105-109. (in Chinese)
[5] 张佳平, 李丹青, 聂晶晶, 夏宜平. 高温胁迫下芍药的生理生化响应和耐热性评价. 核农学报, 2016, 30(9): 1848-1856.
ZHANG J P, LI D Q, NIE J J, XIA Y P. Physiological and biochemical responses to the high temperature stress and heat resistance evaluation ofpall. cultivars. Journal of Nuclear Agricultural Sciences, 2016, 30(9): 1848-1856. (in Chinese)
[6] 张方静, 罗峰, 谭殷殷, 张旻桓, 邢文, 金晓玲. 高温胁迫对月季生理特性和叶绿素荧光参数的影响. 河南农业科学, 2019, 48(4): 108-115.
ZHANG F J, LUO F, TAN Y Y, ZHANG M H, XING W, JIN X L. Effects of high temperature stress on the physiological characteristics and chlorophyll fluorescence parameters of Chinese rose. Journal of Henan Agricultural Sciences, 2019, 48(4): 108-115. (in Chinese)
[7] 余炳伟, 董日月, 雷建军, 陈长明, 周火燕, 曹必好. 黄瓜耐热材料的筛选与鉴定. 分子植物育种, 2017, 15(11): 4695-4705.
YU B W, DONG R Y, LEI J J, CHEN C M, ZHOU H Y, CAO B H. Screening and identification of heat resistance cucumber. Molecular Plant Breeding, 2017, 15(11): 4695-4705. (in Chinese)
[8] 毛静, 董艳芳, 周媛, 童俊, 徐冬云, 方林川. 十六个德国鸢尾品种的耐热性评价. 北方园艺, 2019(3): 94-100.
MAO J, DONG Y F, ZHOU Y, TONG J, XU D Y, FANG L C. Physiological characteristics of different iris germanica cultivars to high temperature stress and evaluation of their heat tolerance. Northern Horticulture, 2019(3): 94-100. (in Chinese)
[9] 韩晨霞. 芍药耐热生理机制的初步研究[D]. 扬州: 扬州大学, 2005.
HAN C X. Preliminary study on physiological mechanism of heat tolerance of[D]. Yangzhou: Yangzhou University, 2005. (in Chinese)
[10] 楼柏丹, 姚岚. 几种观察植物表皮气孔方法的比较. 生物学教学, 2015(9): 42-43.
LOU B D, YAO L. Comparison of several methods for observing stomata in plant epidermis. Biology Teaching, 2015(9): 42-43. (in Chinese)
[11] 邓绮雯, 刘志霞, 张强, 高云, 江奕君, 郑奕雄, 胡巍. 水稻叶片徒
手切片的荧光显微镜观察. 仲恺农业工程学院学报, 2020, 33(1): 24-27.
DENG Q W, LIU Z X, ZHANG Q, GAO Y, JIANG Y J, ZHENG Y X, HU W. Fluorescence microscopic observation and free-hand section techniques for rice leaves. Journal of ZhongKai University of Agriculture and Technology, 2020, 33(1): 24-27. (in Chinese)
[12] 武晓玲, 梁海媛, 杨峰, 刘卫国, 佘跃辉, 杨文钰. 大豆苗期耐荫性综合评价及其鉴定指标的筛选. 中国农业科学, 2015, 48(13): 2497-2507.doi: 10.3864/j.issn.0578-1752.2015.13.002.
WU X L, LIANG H Y, YANG F, LIU W G, SHE Y H, YANG W Y. Comprehensive evaluation and screening identification indexes of shade tolerance at seedling in soybean. Scientia Agricultura Sinica, 2015, 48(13): 2497-2507. doi: 10.3864/j.issn.0578-1752.2015.13.002. (in Chinese)
[13] 李春红, 姚兴东, 鞠宝韬, 朱明月, 王海英, 张惠君, 敖雪, 于翠梅, 谢甫绨, 宋书宏. 不同基因型大豆耐荫性分析及其鉴定指标的筛选. 中国农业科学, 2014, 47(15): 2927-2939. doi: 10.3864/j.issn. 0578-1752.2014.15.003.
LI C H, YAO X D, JU B T, ZHU M Y, WANG H Y, ZHANG H J, AO X, YU C M, XIE F T, SONG S H. Analysis of shade-tolerance and determination of shade-tolerance evaluation indicators in different soybean genotypes. Scientia Agricultura Sinica, 2014, 47(15): 2927-2939. doi: 10.3864/j.issn.0578-1752.2014.15.003. (in Chinese)
[14] GUPTA S K, VERMA K, KUMAR R, SARKAR B, MANTHA A K, KUMAR S. Priming alleviates high temperature induced oxidative DNA damage and repair using Apurinic/apyrimidinic endonuclease (Ape1L) homologue in wheat (L.). Plant Physiology and Biochemistry, 2020, 156: 304-313.
[15] LOKA D A, OOSTERHUIS D M, BAXEVANOS D, NOULAS C, HU W. Single and combined effects of heat and water stress and recovery on cotton (L.) leaf physiology and sucrose metabolism. Plant Physiology and Biochemistry, 2020, 148: 166-179.
[16] HASANUZZAMAN M, NAHAR K, ALAM M, ROYCHOWDHURY R, FUJITA M. Physiological, biochemical, and molecular mechanisms of heat stress tolerance in plants. International Journal of Molecular Sciences, 2013, 14(5): 9643-9684.
[17] DUTTA S, MOHANTY S, TRIPATHY B C. Role of temperature stress on chloroplast biogenesis and protein import in pea. Plant Physiology, 2009, 150(2): 1050-1061.
[18] ASHRAF M, HARRIS P J C. Photosynthesis under stressful environments: An overview. Photosynthetica, 2013, 51(2): 163-190.
[19] INZÉ D, VAN MONTAGU M. Oxidative stress in plants. Current Opinion in Biotechnology, 1995, 6(2): 153-158.
[20] NADEEM M, LI J J, WANG M H, SHAH L, LU S Q, WANG X B, MA C X. Unraveling field crops sensitivity to heat stress: Mechanisms, approaches, and future prospects. Agronomy, 2018, 8(7): 128.
[21] ZHANG J P, WANG X B, ZHANG D, QIU S, WEI J F, GUO J, LI D Q, XIA Y P. Evaluating the comprehensive performance of herbaceous peonies at low latitudes by the integration of long-running quantitative observation and multi-criteria decision making approach. Scientific Reports, 2019, 9(1): 15079.
[22] WU Y Q, ZHAO D Q, HAN C X, TAO J. Biochemical and molecular responses of herbaceous peony to high temperature stress. Canadian Journal of Plant Science, 2016, 96(3): 474-484.
[23] 李璇, 岳红, 王升, 黄璐琦, 马炯, 郭兰萍. 影响植物抗氧化酶活性的因素及其研究热点和现状. 中国中药杂志, 2013, 38(7): 973-978.
LI X, YUE H, WANG S, HUANG L Q, MA J, GUO L P. Research Of different effects on activity of plant antioxidant enzymes. China Journal of Chinese Materia Medica, 2013, 38(7): 973-978. (in Chinese)
[24] 徐如强, 孙其信, 张树榛. 春小麦耐热性的筛选方法与指标. 华北农学报, 1997, 12(3): 22-29.
XU R Q, SUN Q X, ZHANG S Z. Screening methods and indices of heat tolerance in spring wheat. Acta Agriculturae Boreall-Sinica, 1997, 12(3): 22-29. (in Chinese)
[25] 陈希勇, 孙其信, 孙长征. 春小麦耐热性表现及其评价. 中国农业大学学报, 2000, 5(1): 43-49.
CHEN X Y, SUN Q X, SUN C Z. Performance and evaluation of spring wheat heat tolerance. Journal of China Agricultural University, 2000, 5(1): 43-49. (in Chinese)
[26] BHUSAL N, SHARMA P, SAREEN S, SARIAL A K. Mapping QTLs for chlorophyll content and chlorophyll fluorescence in wheat under heat stress. Biologia Plantarum, 2018, 62(4): 721-731.
[27] DIAS A S, LIDON F C. Evaluation of grain filling rate and duration in bread and durum wheat under heat stress after anthesis. Journal of Agronomy and Crop Science, 2009, 195(2): 137-147.
[28] Lü X K, HAN J, LIAO Y C, LIU Y. Effect of phosphorus and potassium foliage application post-anthesis on grain filling and hormonal changes of wheat. Field Crops Research, 2017, 214: 83-93.
[29] KUMAR R R, GOSWAMI S, GUPTA R, VERMA P, SINGH K, SINGH J P, KUMAR M, SHARMA S K, PATHAK H, RAI R D. The stress of suicide: Temporal and spatial expression of putative heat shock protein 70 protect the cells from heat injury in wheat ().Journal of Plant Growth Regulation, 2016, 35(1): 65-82.
[30] VAN INGHELANDT D, FREY F P, RIES D, STICH B. QTL mapping and genome-wide prediction of heat tolerance in multiple connected populations of temperate maize. Scientific Reports, 2019, 9: 14418.
[31] 李敏, 苏慧, 李阳阳, 李金鹏, 李金才, 朱玉磊, 宋有洪. 黄淮海麦区小麦耐热性分析及其鉴定指标的筛选. 中国农业科学, 2021, 54(16): 3381-3392.doi: 10.3864/j.issn.0578-1752.2021.16.002.
LI M, SU H, LI Y Y, LI J P, LI J C, ZHU Y L, SONG Y H. Analysis of heat tolerance of wheat with different genotypes and screening of identification indexes in Huang-Huai-Hai region. Scientia Agricultura Sinica, 2021, 54(16): 3381-3392. doi: 10.3864/j.issn.0578-1752.2021.16.002. (in Chinese)
[32] 蔡继鸿, 陈远华, 赖金莉, 郑薇, 胡江涛, 刘淑媛, 罗素梅, 刘小平, 郭荣生. 18个杜鹃品种耐热性评价. 现代园艺, 2022, 45(17): 6-9, 26.
CAI J H, CHEN Y H, LAI J L, ZHENG W, HU J T, LIU S Y, LUO S M, LIU X P, GUO R S. Evaluation on heat tolerance of 18varieties. Xiandai Horticulture, 2022, 45(17): 6-9, 26. (in Chinese)
[33] 凌瑞, 戴中武, 代晓雨, 吴春梅, 翟俊文, 郑泽新, 吴沙沙. 8个绣球品种耐热性综合评价与耐热指标筛选. 热带作物学报, 2021, 42(8): 2209-2218.
LING R, DAI Z W, DAI X Y, WU C M, ZHAI J W, ZHENG Z X, WU S S. Evaluation of heat tolerance and screening the index for the assessment of heat tolerance in cultivars of. Chinese Journal of Tropical Crops, 2021, 42(8): 2209-2218. (in Chinese)
[34] 付丽军, 李聪晓, 苏胜宇, 李玉华, 周禹. 黄瓜苗期耐热种质筛选与耐热性评价体系构建. 植物生理学报, 2020, 56(7): 1593-1604.
FU L J, LI C X, SU S Y, LI Y H, ZHOU Y. Screening of cucumber germplasms in seedling stage and the construction of evaluation system for heat tolerance. Plant Physiology Journal, 2020, 56(7): 1593-1604. (in Chinese)
[35] 胡江龙, 郭林涛, 王友华, 周治国. 棉花渍害恢复的生理指示指标探讨. 中国农业科学, 2013, 46(21): 4446-4453.doi: 10.3864/j.issn.0578-1752.2013.21.006.
HU J L, GUO L T, WANG Y H, ZHOU Z G. Physiological indicator of cotton plant in recovery from waterlogging damage. Scientia Agricultura Sinica, 2013, 46(21): 4446-4453. doi: 10.3864/j.issn.0578-1752.2013.21.006. (in Chinese)
Evaluation of Heat Tolerance of Herbaceous Peony and Screening of Its Identification Indices
HOU ZhaoYu, GONG YiZhao, QIAN Yi, CHENG ZhuoYa, TAO Jun, ZHAO DaQiu
College of Horticulture and Landscape Architecture, Yangzhou University, Yangzhou 225009, Jiangsu
【Objective】The multivariate statistical analysis method was used to evaluate the heat-tolerance of different herbaceous peonyPall.) varieties, to screen the heat-tolerance identification indexes of peony, and finally to establish a more comprehensive and reliable heat-tolerance evaluation system of peony. 【Method】In this study, 140 peony varieties were used as materials, and field experiments were used to measure 8 morphological and structural indexes, including heat damage index, plant height, crown width, and SPAD value;at the same time, 13 physiological indexes, such as malondialdehyde and relative electrical conductivity, were measured in August after high-temperature stress in summer. Correlation analysis, subordination function method, principal component analysis, cluster analysis and stepwise regression analysis were used to comprehensively evaluate the peony heat-toleranceand to screen the identification indexes of heat-tolerance.【Result】There were different degrees of variation among the 21 indicators, and the variation coefficient ranged from 6.66% to 78.02%. The variation coefficient was shown as follows: Catalase (CAT)>POD>Pn>qN>SOD>stomatal density>barrier tissue thickness/sponge tissue thickness>SSC>SPC>heat damage index>SPAD>Y(Ⅱ)>b>MDA>Y(NO)>crown width>leaf thickness>plant height>REC>Fv/Fm>Hue angle (H), among which, CATwas the largest coefficient of variation, and H was the smallest coefficient of variation;through the correlation analysis of each index, it was found that X1(heat damage index) and X2(plant height), X3(crown width), X4(SPAD), X7(Fv/Fm), X12(leaf thickness), X17(SSC ) were extremely significantly negatively correlated, which were significantly negatively correlated with X6(Pn), X8[Y(Ⅱ)], X13(stomatal density), X20(CAT), while they were extremely significantly positively correlated with X5(REC), X9[Y(NO)], X16(MDA) and X18(SPC) . There were different degrees of correlation among the indicators, which was relatively complicated; 21 indicators were extracted into 7 principal component factors through the principal component analysis method, and the contribution rates were 20.50%, 11.66%, 8.24%, 7.24%, 7.06%, 5.31%, and 4.85%, respectively, while the cumulative contribution rate reached 64.87%; the comprehensive score (W) of 140 peony varieties were calculated by the membership function analysis method. On this basis, cluster analysis was used to classify the peony cultivars into four types of heat resistance: “excellent” “good” “medium” and “poor”. The “excellent” type accounted for 14.3%, “good” type accounted for 26.4%, “medium” type accounted for 46.4%, and “poor” type accounted for 12.9%; the stepwise regression analysis was further used to establish the optimal linear regression equation: W=0.228-0.166X1+0.002X4+0.325X7-0.257X9+0.112X10+0.00028X13+0.002X17+0.00015X19+0.001X20, and 9 indicators were selected from 21 indicators (heat damage index), including X1(heat damage index), X4(SPAD), X7(Fv/Fm), X9[Y(NO)], X10(qN), X13(pore density), X17(SSC), X19(SOD), and X20(CAT) , which were used as identification peony indicators of heat-resistance. 【Conclusion】By using multivariate statistical analysis method to evaluate the heat resistance of peony, 140 peony varieties were divided into 4 categories (excellent, good, medium, and poor). 9 indexes including heat damage index and SPAD value were screened as identification indexes of heat-resistance of peony, to quickly evaluate the heat-resistant ability of peony, thereby significantly improving the efficiency of heat-resistant identification of peony.
herbaceous peony; heat-tolerance; principal component analysis; subordination function methods; comprehensive evaluation system

10.3864/j.issn.0578-1752.2023.23.015
2023-04-12;
2023-06-14
江苏省种业振兴揭榜挂帅项目[JBGS(2021)020]、扬州市科技计划(现代农业)项目(YZ2022053)、国家林草科技创新发展研究项目(2023132012)、江苏省现代农业(花卉)产业技术体系[JATS(2023)489]
侯赵玉,E-mail:1148570156@qq.com。通信作者陶俊,E-mail:taojun@yzu.edu.cn。通信作者赵大球,E-mail:dqzhao@yzu.edu.cn
(责任编辑 赵伶俐)
