神经外科术后颅内感染Nomogram模型的建立与验证
2023-12-26马小菊李松琴黄慧萍陈友鹏张永祥张卫红李占结
马小菊,俞 英,卢 岩,李松琴,刘 娟,王 峥,臧 凤,黄慧萍,陈友鹏,4,张永祥,张卫红,李占结
(1.中山大学附属第七医院院感与公卫管理处,广东 深圳 518107; 2.南通大学附属常熟医院医院感染管理处,江苏 苏州 215500; 3.南京医科大学第一附属医院感染管理处,江苏 南京 210029; 4.中山大学附属第七医院感染性疾病科,广东 深圳 518107)
颅内感染的发生会增加患者的治疗难度、住院费用[1-2],延长患者的住院时间,导致患者再入院或再次手术[1-3],带来严重的神经系统后遗症[4],并增加患者死亡风险[5]。国内外研究[1,6-9]显示,神经外科手术术后颅内感染的发病率达2.2%~25%。因此,及早识别神经外科手术部位感染高风险因素,正确诊断颅内感染,规范治疗,对患者的预后及降低死亡风险起着重要作用[10-11]。然而,因神经外科手术患者自身疾病所致的神经功能受损、发热及脑脊液改变等非感染性脑膜炎的表现较多,术后颅内感染临床表现易被掩盖,准确诊断颅内感染难度较大[12]。为解决该问题,已有多项研究探讨颅内感染危险因素,并构建预测模型进行感染预测,但在不同研究[9,13-16]中,颅内感染的危险因素存在差异。此外,目前已发表的颅内感染预测模型,主要针对特定区域或特定操作人群,且纳入的部分因素在临床实际工作中可获得性欠佳,实际应用存在一定的局限性,难以应用于国内神经外科手术后全人群颅内感染的预测。因此,本研究采取回顾性研究方法,收集术后已进行脑脊液检查的神经外科患者相关数据,探究神经外科手术患者颅内感染的危险因素,同时考虑脑脊液检查对颅内感染判定的重要性[17],构建适用于国内当前临床实际的颅内感染预测模型,为准确识别神经外科手术患者颅内感染并指导临床及时规范地治疗提供参考依据。
1 对象与方法
1.1 研究对象 非选择性、连续地收集南京某医院2019年1月1日—2022年12月31日收治的8 990例接受神经外科手术的患者资料,从中筛选出术后有脑脊液检查结果的患者,根据神经外科手术后是否发生颅内感染(器官腔隙感染)分为感染组(n=293)和非感染组(n=685)。纳入标准:(1)接受神经外科手术的患者;(2)年龄≥18岁;(3)术后至少进行脑脊液检查1次。排除资料记录不全导致变量数据缺失过多的患者。
1.2 研究方法 采取回顾性研究,使用“杏林医院感染实时监控系统”导出神经外科手术患者感染相关的基本信息,由两名感染控制专职人员通过医院信息系统(hospital information system,HIS)和检验系统(laboratory information system,LIS)逐一查询患者相关信息,记录并核对。共纳入26个自变量,对感染组和非感染组病例进行人口统计学对比分析,单因素和多因素logistic回归分析,Lasso回归分析,建立预测模型,验证预测模型,输出列线图(Nomogram),并评价预测模型效果。
1.2.1 疾病种类 本研究中疾病种类分为五类:(1)颅内和椎管内肿瘤,主要包括弥漫性胶质瘤、脑膜瘤、垂体腺瘤、颅咽管瘤、髓母细胞瘤、室管膜瘤等;(2)脑血管病,主要包括蛛网膜下腔出血、颅内动脉瘤、颅内和椎管内血管畸形、脑底异常血管网症、缺血性脑卒中、脑内出血等;(3)颅脑外伤,主要包括颅骨骨折、脑震荡、脑挫裂伤、脑水肿、脑肿胀和颅内血肿等;(4)神经系统功能性疾病,主要包括面肌痉挛、三叉神经痛、癫痫等;(5)其他,主要包括脑积水、颅骨缺损、脑脊液漏等。
1.2.2 颅内感染诊断标准 参照卫生部2001年颁布的《医院感染诊断标准(试行)》[18]进行术后颅内感染诊断。
1.2.3 变量选择 结合神经外科术后颅内感染相关规范、专家共识[19-20]和临床经验,选择本研究的自变量。纳入的变量包括患者基本情况(年龄、性别及患冠心病、脑梗死、糖尿病、高血压情况)、术后症状与体征(颅高压、发热、颈项强直)、距脑脊液检查最近一次的术后血常规(白细胞、中性粒细胞百分比)、术后脑脊液检查(性状、潘氏试验、白细胞、葡萄糖、脑脊液/血清葡萄糖比值、蛋白、氯)及微生物培养结果、置管情况[脑室外引流(external ventricular drainage,EVD)、腰大池置管引流(lumbar cistern drainage,LD)、其他置管]、其他可能的危险因素(急诊手术、脑脊液漏、使用免疫抑制药物、手术时长)。脑脊液葡萄糖检查判定标准:脑脊液葡萄糖<2.5 mmol/L判为异常;脑脊液葡萄糖≥2.5 mmol/L,且脑脊液/血清葡萄糖比值≥0.66 mmol/L判为正常;脑脊液葡萄糖≥2.5 mmol/L,但脑脊液/血清葡萄糖比值<0.66 mmol/L判为异常。
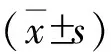
2 结果
2.1 基本情况 978例神经外科手术患者,术后393例发生颅内感染,发病率为29.96%。其中,以颅内和椎管内肿瘤术后颅内感染发病率最高,为38.33%(174/454),其次为神经系统功能性疾病(29.73%,11/37)、脑血管病(24.92%,77/309),颅脑外伤(13.21%,14/106),其他神经外科手术为23.61%(17/72)。患者年龄为55.0(45.0,64.0)岁,感染组和非感染组分别为53.0(42.0,63.0)、55.0(46.0,65.0)岁;57.7%的患者为男性,其中感染组和非感染组患者男性占比分别为58.0%、57.5%。见表1。
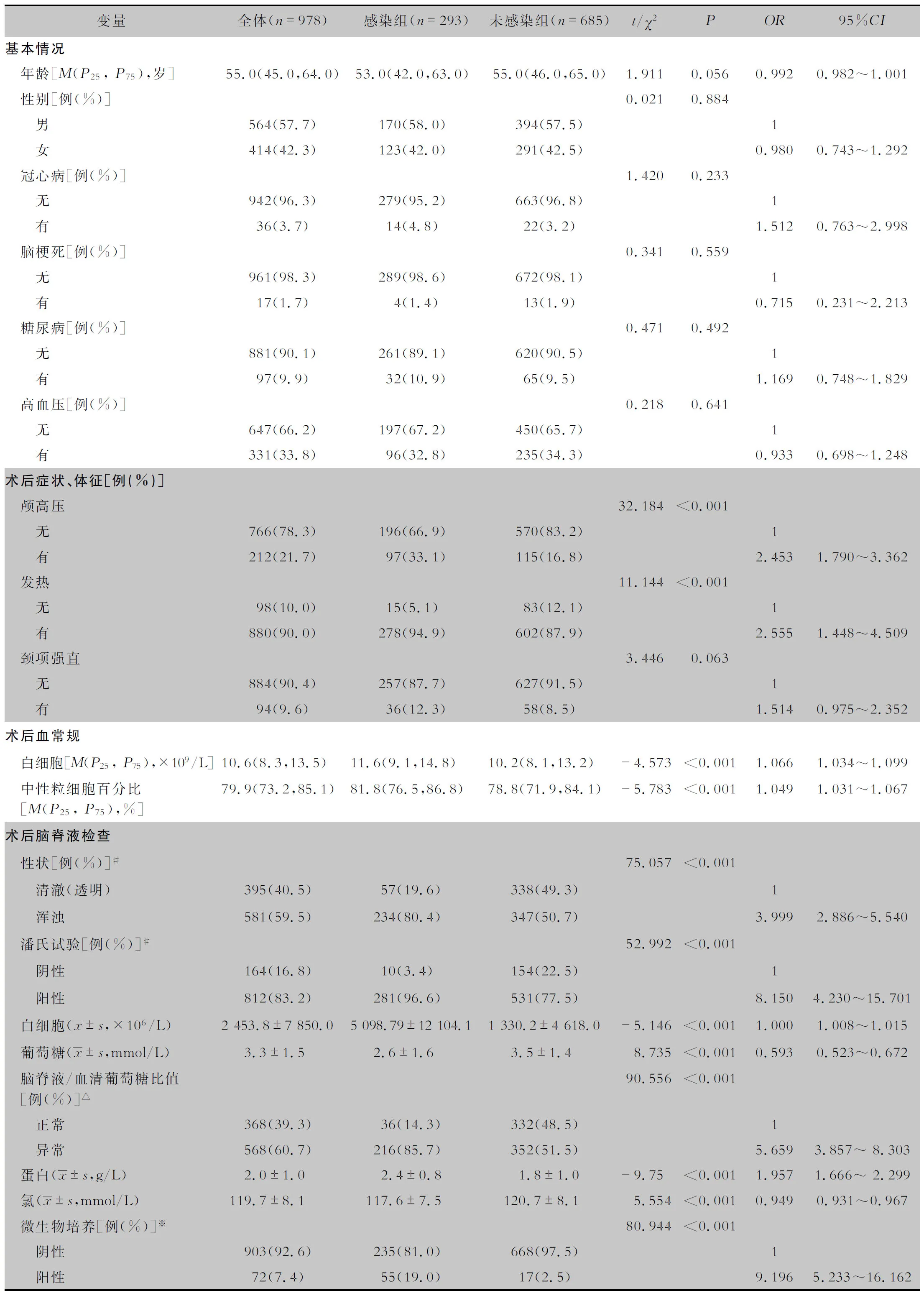
表1 神经外科患者术后颅内感染危险因素logistic单因素分析
2.2 颅内感染危险因素的单因素分析 978例神经外科手术患者术后颅内感染危险因素单因素分析结果显示,感染组与非感染组患者的年龄及性别、冠心病、脑梗死、糖尿病和高血压的比例等基本情况比较,差异均无统计学意义(均P>0.05)。患者手术时长及术后颅高压、发热、EVD置管、LD置管、急诊手术、使用免疫抑制药物的比例,以及术后血常规、脑脊液检查结果两组比较,差异均有统计学意义(均P<0.05);术后颈项强直、其他置管、脑脊液漏的比例两组比较,差异均无统计学意义(均P>0.05)。见表1。
2.3 颅内感染危险因素多因素分析 将所有单因素分析差异有统计学意义(P<0.05)的因素纳入logistic多因素分析,结果显示患者术后颅高压、发热、血常规中性粒细胞百分比增加、脑脊液浑浊、潘氏试验阳性、葡萄糖浓度降低、微生物培养阳性、脑脊液/血清葡萄糖比值异常,以及未留置EVD管、留置LD管、使用免疫抑制药物和手术时间长是神经外科手术后颅内感染的独立危险因素(均P<0.05)。见表2。
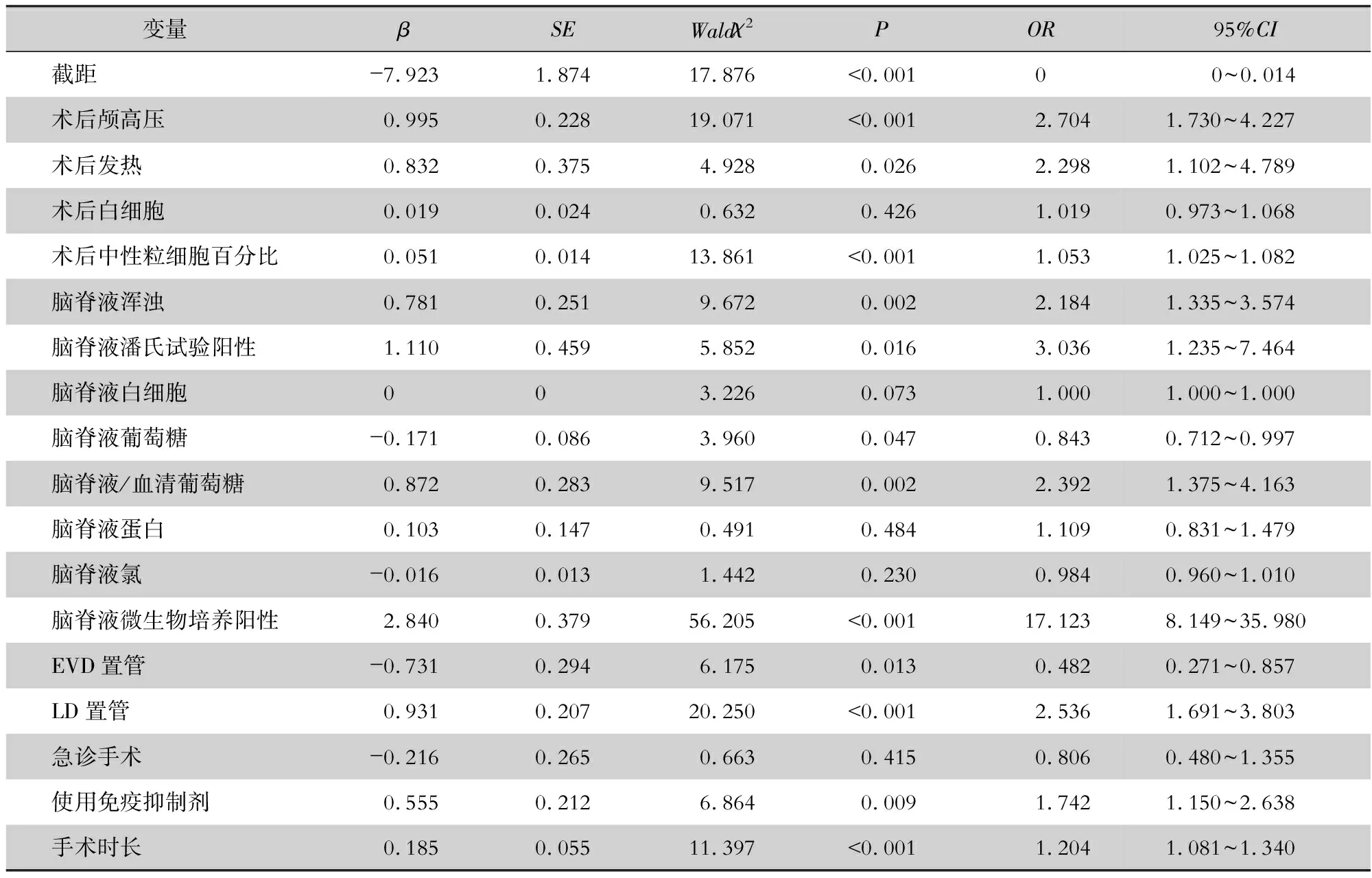
表2 神经外科患者术后颅内感染危险因素logistic多因素分析
2.4 Lasso回归变量选择与模型估计 采用Lasso回归对预测变量进行筛选,随着惩罚系数lambda (λ)越来越大,筛选变量的惩罚力度也越大,对应的非特征变量系数逐渐精确于零。经分析λ取值为0.023时,Lasso回归模型的精度最佳,所筛选变量结果最佳,见图1。本研究选择λ=0.023时为最优模型,此时 Lasso回归模型纳入的自变量为手术时长、冠心病及术后颅高压、发热、血常规中性粒细胞百分比、LD置管、使用免疫抑制剂,以及术后脑脊液性状、白细胞计数、葡萄糖浓度、脑脊液/血清葡萄糖比值、蛋白浓度、氯浓度、潘氏试验、培养结果。
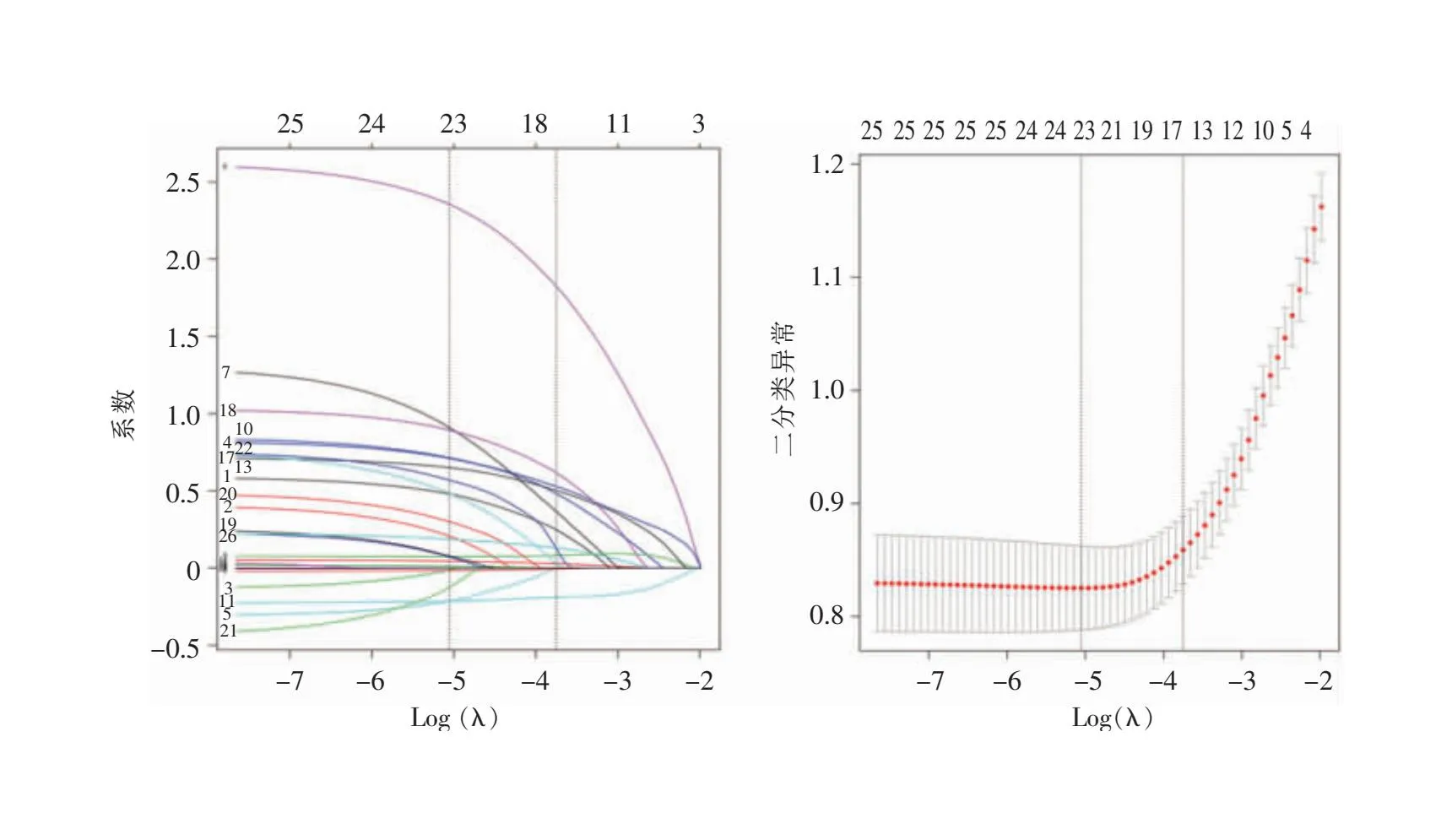
图1 基于 Lasso 回归的特征性变量选择
2.5 预测模型构建与验证 将 Lasso回归筛选的变量组合,进行共线性筛查,结果显示各变量的方差膨胀因子(VIF)均<2,提示变量间共线性差,纳入模型可信度高。经缺失数据插补(随机森林法)、检查两两交互作用项和Bootstrap内部验证,最终在 Lasso回归筛选的变量组合中删除冠心病,其余变量均纳入logistic回归构建神经外科手术患者术后颅内感染预测模型,模型为颅内感染=-7.098 58+0.227 11×手术时长(h)+1.077 15×是否术后颅高压(否=0,是=1)+0.748 04×是否术后发热(否=0,是=1)+0.055 60×术后血常规中性粒细胞百分比(%)+0.711 97×术后脑脊液性状(清澈=0,浑浊=1)+0.000 03×术后脑脊液白细胞计数(×106/L)-0.203 76×术后脑脊液葡萄糖浓度(mmol/L)+0.790 65×术后脑脊液/血清葡萄糖比值(正常=0,异常=1)+0.066 73×术后脑脊液蛋白浓度(g/L)-0.023 24×术后脑脊液氯浓度(mmol/L)+1.101 50×术后脑脊液潘氏试验是否阳性(阴性=0,阳性=1)+2.711 81×术后脑脊液培养是否阳性(阴性=0,阳性=1)+0.840 57×患者是否LD置管(否=0,是=1)+0.646 23×是否使用免疫抑制药物(否=0,是=1)。见图2。

图2 神经外科患者术后颅内感染风险Nomogram预测模型
建模组和验证组的AUC分别为0.885、0.868,灵敏度分别为0.578、0.621,特异度分别为0.896、0.902,准确度分别为0.704、0.730,均提示模型效果较好,且两模型效果相近,提示模型有良好的预测能力,见图3A。校准曲线可见该模型预测概率和实际概率线与建模组和验证组数据集中的理想曲线接近,提示Nomogram模型有良好的拟合优度,即预测感染概率与实际感染概率的一致性较好,见图3B和3C。通过决策曲线可以看出,在大部分的临界概率值时,模型均具有较高的净收益,证明模型预测能力良好,见图3D和3E。
3 讨论
本研究根据神经外科手术患者基本特征、颅内感染诊断常用的简单临床和实验室变量,确定神经外科手术患者术后发生颅内感染的独立危险因素,并使用Lasso回归筛选15个变量,经共线性筛查、缺失数据插补(随机森林法)、检查两两交互作用项后最终纳入14个变量建立预测模型,应用于颅内感染风险预测,该模型可进行可视化风险计算,AUC达0.885,具有良好的预测准确性。
神经外科患者术后各项临床表现和实验室检查结果对颅内感染判定尤为重要[20]。术后颅高压被认为是颅内感染的临床表现之一[19];术后发热是神经外科手术患者并发症之一,发热患者更容易出现颅内感染[21-22],本研究中也观察到这两点。从实验室检查结果发现,发生颅内感染的患者术后血常规中性粒细胞百分比每增加1个单位,感染风险增加0.053倍,与国内专家共识[19](下简称共识)中提到的颅内感染患者实验室检查中中性粒细胞比例相符。在中枢神经系统,脑脊液为脑组织供应营养并转运代谢产物[23],术后脑脊液检查对于感染诊断至关重要[24],本研究发现脑脊液浑浊感染风险增加1.184倍,潘氏试验阳性感染风险增加2.036倍。正常脑脊液葡萄糖浓度为2.5~4.5 mmol/L,本研究中,感染组术后葡萄糖浓度每增加1个单位,颅内感染风险减少15.7%,符合细菌感染后脑脊液葡萄糖特点,但不能完全依据脑脊液葡萄糖判断,因为脑脊液葡萄糖浓度会受血清葡萄糖浓度影响[25],因此,结合脑脊液/血清葡萄糖比值判定颅内感染更具诊断价值[17,26]。本研究中,感染组脑脊液/血清葡萄糖比值异常感染风险增加1.392倍,与共识相关内容一致。既往研究报道脑脊液培养是确定脑膜炎致病微生物的金标准[27],可识别致病微生物和抗菌药物敏感性[26],虽有研究[28]报道脑脊液的微生物培养(针对全部脑脊液)阳性率较低(4.35%),但神经系统感染患者脑脊液平均阳性率达33.75%,表明颅内感染患者的脑脊液培养阳性率仍相对较高,本研究发现微生物培养阳性感染风险增加16.123倍(19.0% VS 2.5%),提示在诊断颅内感染过程中,微生物培养具有较高的价值,建议尽可能送检培养,寻找微生物证据,为临床诊疗提供方向。留置EVD管和LD管是神经外科常见的治疗方法之一[29]。本研究发现,留置EVD管为颅内感染的保护因素,与既往研究[15,30]不一致,可能与留置EVD管的时间相关,留置时间较短(<5 d)并不会增加颅内感染的风险,可以解释不能单纯以是否留置EVD管判断其颅内感染的风险。手术后用预先放置的LD管进行早期脑脊液引流可减少术后脑脊液漏,安全有效地预防术后延迟发热和感染,而长时间留置LD管则会增加颅内感染的风险[31],本研究发现感染风险增加1.536倍。其他可能的危险因素中,患者使用免疫抑制药物增加颅内感染风险0.742倍,与既往报道[6]一致。此外,本研究发现,手术时长更长是颅内感染的独立危险因素,手术时长每增加1个单位,感染增加0.204倍,与既往研究[10,16,32]基本一致。
本研究构建的预测模型具有一定创新性和实用性。(1)利用Lasso回归方法筛选出变量组合,并采用二元logistic回归构建预测模型,模型AUC为0.885,高于多数既往相关研究[13-15]。(2)与其他报道相比,本研究增加了内部验证,结果显示模型建模组和验证组之间存在较高的一致性,更加突出了本研究构建模型的可靠性和稳定性。(3)构建的预测模型以Nomogram图的形式进行可视化呈现,在使用过程中更具可操作性。(4)与以往研究[13-15]相比,本研究所得颅内感染风险预测模型,纳入的是基于目前临床诊疗常见的指标,且较易获取,更有利于模型的推广及实际应用。(5)构建的模型应用对象覆盖全部神经外科手术患者,适用性更广,有助于临床医生预测颅内感染风险并及早诊断颅内感染。同时,本研究也存在一些不足和局限,该模型虽进行了内部验证且显示出良好的预测能力,但数据来源于单个中心,在其他中心的预测效果有待验证,未来需要进行多中心的外部验证,进一步明确其预测效果。
综上所述,本研究构建的神经外科患者术后颅内感染预测模型,预测指标科学且容易获取,稳定性与可靠性强,具有较高的应用价值和较广的适用范围,可为神经外科患者术后颅内感染的判定提供参考。
利益冲突:所有作者均声明不存在利益冲突。
