葛根总黄酮提取工艺优化及其抑菌与抗氧化活性研究
2023-12-25郑敏苏福联袁名远刘玉黄东海张巍李宇廖璐婧罗凯何美军
郑敏 苏福联 袁名远 刘玉 黄东海 张巍 李宇 廖璐婧 罗凯 何美军


摘要:對葛根[Pueraria montana (Loureiro) Merrill]总黄酮的抑菌和抗氧化活性进行研究。采用单因素试验结合响应面法优化葛根的水提工艺,利用紫外分光光度法和高效液相色谱法对葛根总黄酮进行表征,并运用琼脂扩散法和以DPPH·、ABTS+·和总还原能力为指标评价葛根总黄酮的生物活性。结果表明,优化后的葛根总黄酮提取工艺为料液比(m∶V,g∶mL)1∶16,提取时间69 min,提取3次,总黄酮得率为7.690%。优化后的葛根总黄酮中检出9种常见黄酮成分,其含量总占比为91.81%;葛根总黄酮对11株供试菌有不同的抑菌活性,并首次发现其对粪链球菌(Enterococcus faecalis)和苏云金芽孢杆菌(Bacillus thuringiensis)有中度敏感作用,MIC分别为250、500 mg/mL,具有较强的清除能力和总还原能力,其中对DPPH·、ABTS+·自由基的IC50分别为0.398、0.189 mg/mL。
关键词:葛根[Pueraria montana (Loureiro) Merrill]; 响应面; 工艺优化; 总黄酮; 抑菌; 抗氧化
中图分类号:R284.2 文献标识码:A
文章编号:0439-8114(2023)11-0065-08
DOI:10.14088/j.cnki.issn0439-8114.2023.11.012 开放科学(资源服务)标识码(OSID):
Optimization of extraction process of total flavonoids from Pueraria montana and its antibacterial and antioxidant activities
ZHENG Min1,2, SU Fu-lian1,2, YUAN Ming-yuan1,2, LIU Yu1,2, HUANG Dong-hai1,
ZHANG Wei3, LI Yu1, LIAO Lu-jing1, LUO Kai2, HE Mei-jun1
(1.Institute of Chinese Herbal Medicines, Hubei Academy of Agricultural Sciences/Key Laboratory of Chinese Herbal Medicine Biology and Cultivation, Ministry of Agriculture and Rural Affairs/Hubei Research and Development Center of Chinese Herbal Medicine, Enshi 445000,Hubei,China;2. College of Biological and Food Engineering, Hubei Minzu University, Enshi 445000,Hubei,China;3.Institute of Animal Husbandry and Veterinary Research, Hubei Academy of Agricultural Sciences,Wuhan 430064, China)
Abstract: The antibacterial and antioxidant activities of total flavonoids from Pueraria montana (Loureiro) Merrill were studied. The water extraction technology of Pueraria montana was optimized by the single factor test and response surface method. The total flavonoids were characterized by ultraviolet spectrophotometry and high performance liquid chromatography. The biological activities of total flavonoids were evaluated by agar diffusion method, with DPPH·, ABTS+· and total reduction capacity as indicators. The results showed that the optimized extraction process of total flavonoids from Pueraria montana was as follows: Solid-liquid ratio (m∶V,g∶mL) of 1∶16, extraction time of 69 min, extraction times of 3 times, and the total flavonoids yield was 7.690%. Nine common flavonoids were detected in the optimized total flavonoids of Pueraria montana, the total content of which accounted for 91.81%. The total flavonoids of Pueraria montana had different antibacterial activities against 11 strains tested, and it was found to be moderately sensitive to Enterococcus faecalis and Bacillus thuringiensis for the first time, with MIC of 250, 500 mg/mL, respectively. It had strong scavenging ability and total reduction ability, and the IC50 of DPPH· and ABTS+· free radicals were 0.398, 0.189 mg/mL, respectively.
Key words: Pueraria montana(Loureiro)Merrill; response surface; process optimization; total flavonoid; antibacterial; antioxidation
葛根[Pueraria montana (Loureiro) Merrill]又称野葛、葛藤、葛麻姆,是豆科葛属植物,已被国家卫生健康委员会收纳为药食同源类中药。葛根中的主要活性成分是葛根素、大豆苷、大豆苷元、染料木苷等黄酮类成分,具有预防癌症、抗糖尿病、抗菌和抗氧化等生物活性[1-3]。已有研究表明,黄酮是一种很强的抗氧化剂,能有效清除体内自由基和促进体内血液循环;黄酮类物质是植物源中的抑菌剂,与抗生素有良好的协同作用[4-6]。从中草药中提取有效的天然抗氧化剂和抑菌剂是一个研究热点,而采用紫外分光光度法和高效液相色谱法联合分析葛根中黄酮活性成分鲜见报道。本研究采用响应面法优化葛根总黄酮提取工艺,分析葛根黄酮组分及含量,探讨其对人体的常见致病菌抑制作用和抗氧化活性表征,以期为葛根综合评价及资源开发提供理论基础。
1 材料与方法
1.1 材料
1.1.1 试材与试剂 葛根,购自普宁市泽群中药饮片有限公司(批号200902),经湖北省农业科学院中药材研究所张美德研究员鉴定为豆科植物葛的干燥根;3′-羟基葛根素(批号P28N8F49269,纯度≥96%)、葛根素(批号S02M98B54875,纯度≥98%)、3′-甲氧基葛根素(批号P07N9F73425,纯度≥98%)、葛根素-6″-O-木糖苷(批号P14D9S77617,纯度≥98%)、葛根素芹菜糖苷(批号P09J7F8770,纯度≥98%)、刺芒柄花苷(批号018GB164369,纯度≥98%)对照品,购自上海源叶生物科技有限公司;大豆苷(批号111738-201904,纯度为93.4%)、大豆苷元(批号11502-202003,纯度为99.3%)、染料木苷(批号111709-201702,纯度为99.9%)对照品,购自中国食品药品检定研究院;无水乙醇、色谱甲醇、过硫酸钾,购自沃凱国药集团化学试剂有限公司;水为去离子水、娃哈哈纯净水,购自周边超市;1,1-二苯基-2苦基肼自由基(批号:JZ5ZI-KS,纯度>97.0%),购自梯希爱(上海)化成工业发展有限公司;2,2′-联氨-双(3-己基苯并噻唑-6-磺酸)二胺盐(批号C12467437,纯度为98%)、L-抗坏血酸(批号C12578987,纯度>99.0%)、磷酸缓冲液(批号C2209133,0.1 mol/L,pH 6.6)、鐵氰化钾、三氯乙酸、三氯化铁,均购自上海麦克林生化有限公司。11株供试菌,如表1所示,由中国科学院南海海洋研究所中国科学院热带海洋生物资源与生态重点实验室鉴定。
1.1.2 仪器 Agilent 1260型高效液相色谱仪,配DAD检测器和反相色谱柱120 HC-C18(4.6 mm×250 mm),美国安捷伦公司;UV18000型紫外可见分光光度计,日本岛津公司;BC-W208型旋转蒸发器,上海贝凯生物化工设备有限公司;ZDHW型电热套,巩义市予华仪器有限公司;FA2204C型电子分析天平(S/N:0280736761),上海天美天平仪器有限公司;HH-S型恒温水浴锅,金坛市恒丰仪器制造有限公司;漩涡混匀仪,上海沪析实业有限公司;Neofuge 15型高速离心机,力新仪器上海有限公司;Infinite M200 PRO型多功能酶标仪,瑞士Tecan公司。
1.2 方法
1.2.1 葛根总黄酮的提取 称取20 g葛根饮片,按照一定的料液比加入去离子水浸泡30 min,按一定的提取时间和提取次数于100 ℃进行回流提取,随后将提取液多次抽滤,滤液合并后于75 ℃减压浓缩,浓缩液用去离子水定容至250 mL,得葛根提取液。
1.2.2 葛根总黄酮含量的测定 精密称取2.50 mg葛根素标准品溶于去离子水中制成0.25 mg/mL母液,稀释成浓度梯度为0、0.002 5、0.003 7、0.004 9、0.006 1、0.007 4、0.008 6、0.009 8 mg/mL。分别在波长250 nm处测定吸光度,再以浓度(X)为横坐标、吸光度(Y)为纵坐标绘制葛根素标准曲线,得回归方程为Y=82.332X-0.005,R2=0.999 7,方程在葛根素标准品浓度为0~0.009 8 mg/mL时吸光度与葛根素质量浓度呈良好的线性关系。精确量取0.5 mL浓缩液于50 mL容量瓶中,以去离子水定容,在波长250 nm处测定其吸光度,重复3次,计算其总黄酮得率[7,8]。公式如下。
总黄酮得率=[c×n×Vm×100%] (1)
式中,c为葛根总黄酮检测浓度(mg/mL);n为葛根提取液稀释倍数;V为葛根提取液定容总体积(mL);m为葛根的质量(g)。
1.2.3 单因素试验设计 研究料液比、提取时间、提取次数对总黄酮提取率的影响,称取20 g葛根,浸泡30 min,其他提取条件保持一致:①设置5个梯度的料液比(g∶mL)1∶5、1∶10、1∶15、1∶20、1∶25,提取时间80 min,提取次数3次;②设置5个梯度的提取时间20、40、60、80、100 min,料液比(g∶mL)1∶15,提取次数3次;③设置5个梯度的提取次数1、2、3、4、5次,料液比(g∶mL)1∶15,提取时间80 min;考察各因素对葛根总黄酮得率的影响。
1.2.4 响应面试验设计 根据单因素试验结果,以料液比(A)、提取时间(B)、提取次数(C)为自变量,总黄酮得率为响应值,选取单因素试验中各自变量表现较好的3个水平,利用Design-Expert 8.0.6响应面软件,以Box-Behnken原理设计三因素三水平试验,并对结果进行分析。响应面设计因素与水平编码如表2所示[9,10]。
1.2.5 葛根黄酮的HPLC定量分析 采用高效液相色谱(HPLC)外标法[11],测定响应面优化后的工艺条件所制备的葛根中黄酮类化合物的组成及其含量。色谱条件:流动相A为85%甲醇溶液、15%水;流动相B为85%水、15%甲醇溶液。洗脱程序:0~15.00 min,流动相A 15%、流动相B 85%;15.01~60.00 min,流动相A 40%、流动相B 60%;60.01~75.00 min,流动相A 60%、流动相B 40%;75.00~75.01 min,流动相A 15%、流动相B 85%。检测波长为254 nm;流速为1.0 mL/min;柱温为25 ℃;进样量为10 μL。
将3′-羟基葛根素、葛根素、3′-甲氧基葛根素、葛根素-6″-O-木糖苷、大豆苷、葛根素芹菜糖苷、染料木苷、刺芒柄花苷、大豆苷元共9个标准品,分别加入30%乙醇溶液制成浓度为0.97、0.98、0.79、0.99、0.30、1.05、0.41、0.47、0.42、0.99、0.42 mg/mL的标准品储备液;分别精密吸取各标准品储备液适量,用30%乙醇溶液定容至10 mL得混合标准品储备液;混合标准品储备液采用二倍稀释法,制成不同浓度的混合标准品溶液以绘制标准曲线。取适量葛根提取物稀释一定倍数,0.45 μm滤膜过滤后按色谱条件进样,进行重复性、精密度、稳定性及加标回收试验,计算其相对标准偏差(RSD),黄酮组分得率计算公式如下。
黄酮组分得率=[c×n×Vm×1 000×100%] (2)
式中,[c]为HPLC检测浓度(mg/mL);[n]为葛根提取液稀释倍数;[V]为葛根提取液定容体积(mL);[m]为葛根质量(g);1 000为换算系数。
计算葛根提取液中上述9种常见黄酮成分在葛根总黄酮中的占比,计算公式如下。
黄酮组分占比=[黄酮组分得率总黄酮得率×100%] (3)
1.2.6 葛根总黄酮的抑菌活性测定 采用琼脂扩散法[12],测试葛根总黄酮对11个供试菌的抑菌活性。取优化后工艺制备的葛根提取液适量,减压浓缩后,在70 ℃条件下真空干燥,制成干燥的葛根总黄酮提取物。将适量干浸膏溶于无菌水中制成1 000 mg/mL的供试液。将供试菌活化,于37 ℃培养,使其OD600 nm达0.6;分别取该供试菌液20 μL与20 mL LB培养基混匀,倒入无菌平板,待其冷却后将8 mm无菌滤纸片贴于其上,随后吸取10 μL葛根供试液滴加至滤纸片上,同时滴加25 mg/mL的卡那霉素作为阳性对照,无菌水作为阴性对照,于37 ℃培养12 h,试验重复3次。测量其抑菌圈直径,高度抑制>20 mm、中度抑制10~20 mm、轻度抑制<10 mm。采用二倍稀释法[13],进一步测定对葛根供试液敏感度较高组的最小抑菌浓度(MIC)。LB培养基配制:每升LB培养基含5 g酵母提取物、10 g胰蛋白胨、10 g氯化钠、20 g琼脂,调pH至7.2~7.4。
1.2.7 葛根总黄酮的抗氧化活性测定
1)DPPH·清除能力。采用DPPH法[12],并稍作修改,精密称取适量1,1-二苯基-2-三硝基苯肼(DPPH)溶于适量无水乙醇制成的0.2 mmol/L DPPH-乙醇溶液中。分别取适量抗坏血酸和葛根总黄酮供试液(浓度分别为0.10、0.30、0.50、0.70、0.90、1.10 mg/mL)。向96孔板中加入100 μL 0.2 mmol/L DPPH-乙醇溶液与100 μL葛根总黄酮供试液,放入酶标仪中振摇1 min,30 ℃避光反应30 min后,于517 nm處读取吸光度。以抗坏血酸作为阳性对照,以去离子水和无水乙醇作为空白对照。计算DPPH自由基清除率与IC50(半抑制浓度)。公式如下。
DPPH清除率=[A2-A0+A1A2×100%] (4)
式中,A1为葛根总黄酮供试液与无水乙醇吸光度;A2为DPPH-乙醇溶液与去离子水吸光度;A0为DPPH-乙醇溶液与葛根总黄酮供试液吸光度。
2)ABTS+·清除能力。参照刘雨诗等[14]的方法,稍作修改,取2.45 mmol/L过硫酸钾溶液与7 mmol/L ABTS储备液等体积混合,于37 ℃避光、静置过夜,制备ABTS储备液,使用时用无水乙醇将ABTS储备液稀释,置于734 nm波长处,吸光度为0.70±0.02,得ABTS工作液。在96孔板中加入150 μL ABTS工作液与30 μL抗坏血酸和葛根总黄酮供试液(浓度分别为0.10、0.30、0.50、0.70、0.90、1.10 mg/mL),放入酶标仪中振摇1 min,于30 ℃避光反应6 min后,于734 nm处读取吸光度。以抗坏血酸作为阳性对照,以去离子水作为空白对照。计算ABTS阳离子自由基清除率与IC50。公式如下。
ABTS+·清除率=[A2-A0+A1A2×100%] (5)
式中,A1为葛根总黄酮供试液与去离子水吸光度;A2为ABTS工作液与去离子水吸光度;A0为ABTS工作液与葛根总黄酮供试液吸光度。
3)总还原能力。采用微量法[15],在试管中依次加入磷酸盐缓冲液(0.01 mol/L,pH=6.6),抗坏血酸和葛根总黄酮供试液(浓度分别为0.10、0.30、0.50、0.70、0.90、1.10 mg/mL),1% 铁氰化钾各500 μL,混匀后置于50 ℃水浴中反应20 min,冷却至室温,加入10%三氯乙酸500 μL,混匀后3 000 r/min离心 10 min,吸取上清液1 mL,加入1 mL去离子水和100 μL 0.1% 三氯化铁溶液充分混匀,30 ℃避光 30 min后,向96孔板中加入200 μL混合样液,放入酶标仪后,于700 nm处读取吸光度。以抗坏血酸作为阳性对照,以去离子水作为空白对照。吸光度差值([ΔA])越大,表示总还原能力越强。公式如下。
[ΔA=A-A0] (6)
式中,A为磷酸缓冲液、葛根总黄酮供试液、铁氰化钾溶液、三氯乙酸、去离子水和三氯化铁吸光度;[A0]为磷酸缓冲液、铁氰化钾溶液、三氯乙酸、去离子水和三氯化铁吸光度。
1.3 数据处理
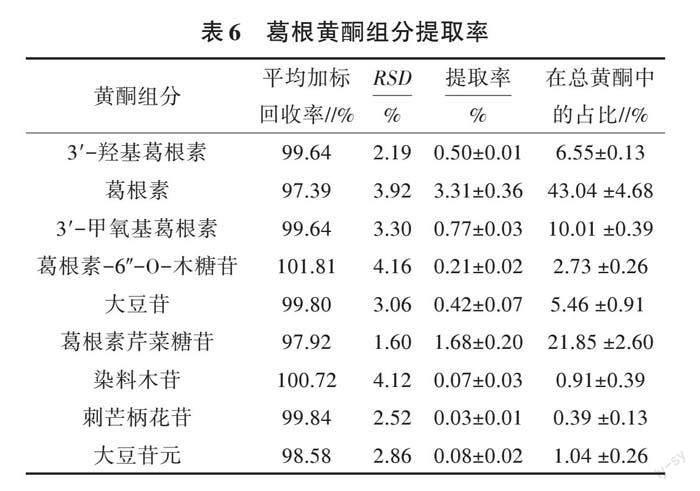
所有数据使用Origin 9.0软件进行分析作图,采用Design-Expert 8.0.6进行响应面分析,数据以“平均值±标准偏差”表示,0.01 2 结果与分析 2.1 单因素试验结果分析 2.1.1 料液比对葛根总黄酮得率的影响 如图1所示,随着溶剂体积的增加,总黄酮得率升高,当料液比(g∶mL)达1∶15时,总黄酮得率最大,为7.03%;当继续增大溶剂体积时,总黄酮提取率在7.00%左右小幅波动,不再增加。 2.1.2 提取时间对葛根总黄酮得率的影响 如图2所示,随着提取时间的增加,总黄酮得率逐渐升高,在提取时间80 min时达到最大值,为7.38%。当提取时间继续延长时,总黄酮得率开始下降,这可能是因为随着时间的延长,黄酮类化合物不断溶出到提取液中,总黄酮得率也就逐渐增加。同时,在提取的过程中也可能会发生黄酮类化合物的氧化、持续高温导致的结构破坏等,当提取时间进一步增加,随着黄酮类化合物氧化和破坏的积累,导致其得率下降。 2.1.3 提取次数对葛根总黄酮得率的影响 如图3所示,在1~3次内,总黄酮得率与提取次数呈正相关,浸提次数为3次时,总黄酮得率达到最大值,为7.34%,之后随着提取次数的增加,总黄酮得率开始下降。这可能是因为当提取次数少时,黄酮提取不充分,多次提取合并后得率上升,当提取至3次时黄酮类物质提取比较充分。提取次数过多使浓缩体积大幅增加,导致提取液受热时间过长,可能造成黄酮类物质的损失,降低了总黄酮得率;同时,还会带来整体工艺时间过长、能耗增加、溶剂用量增大等系列问题,因此,提取次数以3次为宜。 2.2 响应面试验结果与分析 2.2.1 响应面设计与结果 以料液比、提取时间、提取次数为因素,总黄酮得率为响应值,利用Box-Behnken原理设计了三因素三水平共17组试验,响应面试验设计与结果如表3所示。通过对其进行回归分析,得到3个因素与总黄酮得率之间的二次回归方程:Y= 7.30 + 0.57A - 0.50B - 0.09C + 0.52AB + 0.42AC - 0.58BC - 0.72A2 - 0.43B2 - 0.95C2。 2.2.2 回归模型的建立与分析 对回归模型进行方差分析,结果如表4所示,模型F为163.68,差异极显著,失拟项F为2.15,差异不显著,且模型R2为0.995 3,R2adj为0.989 2,说明模型可靠,能够很好地对总黄酮得率进行分析和预测。由F可知,A、B、AB、AC、BC、A2、B2、C2对葛根总黄酮得率的影响极显著(P<0.01),C对总黄酮得率的影响显著P<0.05)。 响应面陡峭表明该因素对总黄酮得率的影响较强,曲面平缓表明影响较弱;等高线的形状可反映各因素间交互效应的强弱,趋于椭圆形表明两因素的交互作用显著,而圆形表明不显著。由图4可知,比较响应面的陡峭程度,料液比和提取时间均大于提取次数,表明各因素对总黄酮得率影响大小顺序为料液比=提取时间>提取次数;比较3个因素交互作用的等高线,料液比与提取时间、料液比与提取次数交互作用的等高线均呈椭圆形,且排列越密集,交互作用越显著,其响应面曲线较陡,对葛根总黄酮得率影响均极显著。 2.2.3 验证试验 通过响应面分析,得出料液比(g∶mL)1∶16.25,提取时间69.04 min,提取次数3.18次为最佳工艺参数,由此预测总黄酮得率为7.502%。在试验过程中,工艺參数取整后调整为料液比(g∶mL)1∶16,提取时间69 min,提取次数3次。通过试验验证,调整后工艺所得总黄酮得率为7.690%,与预测值对比,RSD<5%,相对误差较小,说明模型预测能力良好,预测结果可信度高。 2.3 葛根黄酮的HPLC定量分析 结果表明,从葛根总黄酮中共检出9个黄酮类成分,按出峰时间依次为3′-羟基葛根素(1)、葛根素(2)、3′-甲氧基葛根素(3)、葛根素-6″-O-木糖苷(4)、大豆苷(5)、葛根素芹菜糖苷(6)、染料木苷(7)、刺芒柄花苷(8)、大豆苷元(9),色谱图如图5所示,标准品的线性关系如表5所示。 由表5可知,10个黄酮标准品浓度与峰面积在0.000 3~0.235 9 mg/mL时线性关系良好(R2为0.990 9~0.999 9),样品检测重复性、精密度以及稳定性均良好,适用于黄酮的检测。黄酮组分检测结果如表6所示,葛根总黄酮提取物中3′-羟基葛根素、葛根素、3′-甲氧基葛根素、葛根素-6″-O-木糖苷、大豆苷、葛根素芹菜糖苷、染料木苷、刺芒柄花苷和大豆苷元共9个黄酮成分的提取率,分别为0.50%±0.01%、3.31%±0.36%、0.77%±0.03%、0.21%±0.02%、0.42%±0.07%、1.68%±0.20%、0.07%±0.03%、0.03%±0.01%、0.08%±0.02%,其总和占提取物中总黄酮的91.98%,其平均回收率为97.39%~101.81%,RSD为1.60%~4.16%。 2.4 葛根总黄酮的抑菌试验结果与分析 葛根总黄酮的抑菌结果如表7所示,其对11种供试菌有不同的抑制作用,其中对鲍曼不动杆菌[(8.26±0.18) mm]、金黄色葡萄球菌[(8.63±0.12) mm]、枯草芽孢杆菌[(8.27±0.08) mm]、耐甲氧西林金黄色葡萄球菌[(8.61±0.13) mm]、大肠杆菌[(8.14±0.06) mm]、多耐铜绿假单胞菌[(8.98±0.11) mm]6种菌有微弱的抑制作用;对粪链球菌[(10.38±0.10) mm]和苏云金芽孢杆菌[(10.01±0.11) mm]有中度的抑制作用,对耐甲氧西林表皮葡萄球菌、藤黄微球菌以及肺炎克雷伯菌3种菌没有抑制作用。进一步测定葛根总黄酮对上述8种菌的MIC,结果表明,葛根总黄酮对大部分菌的抑制能力较弱,仅可测出对粪链球菌(250 mg/mL)、苏云金芽孢杆菌(500 mg/mL)以及多耐铜绿假单胞菌(500 mg/mL)的MIC。 2.5 葛根总黄酮的体外抗氧化试验结果与分析 清除自由基能力是评价体外抗氧化活性的常用方法。如图6所示,随着葛根总黄酮浓度的增加,葛根中的活性成分含量均有不同程度的提高,但均低于相同质量浓度的抗坏血酸。葛根总黄酮对DPPH·和ABTS+·自由基的线性回归方程分别为Y1=72.43X1+21.14、Y2=71.43X2+36.49;IC50分别为0.398、0.189 mg/mL。如图6a、图6b所示,当浓度为0.90 mg/mL时,葛根总黄酮的DPPH·、ABTS+·清除率最高,分别为82.38%和96.25%;如图6c所示,在浓度为0.10~0.90 mg/mL时,葛根总黄酮和抗坏血酸的抗氧化能力具有较好的线性关系,其线性回归方程为Y3=0.45X4+0.01,相关系数R2=0.96,当浓度大于0.70 mg/mL时,总还原能力趋于平缓,呈一定的正相关,说明葛根总黄酮具有较好的总还原能力。 3 讨论 本研究采用响应面法优化了葛根的提取工艺,优化后的工艺条件下总黄酮得率为7.690%,经验证该提取工艺稳定可行。并对提取物进行了定性定量分析,研究结果显示,葛根中的3′-羟基葛根素、葛根素、3′-甲氧基葛根素、葛根素-6″-O-木糖苷、大豆苷、葛根素芹菜糖苷、染料木苷、刺芒柄花苷、大豆苷元的提取率分别为0.50%±0.01%、3.31%±0.36%、0.77%±0.03%、0.21%±0.02%、0.42%±0.07%、1.68%±0.20%、0.07%±0.03%、0.03%±0.01%、0.08%±0.02%,其總和占葛根总黄酮的91.98%。本研究与Zhao等[16]的研究结果一致,其采用热水提取(Hot water extraction)法从葛根中获得葛根素、大豆苷、大豆苷元的得率分别为2.2%±0.06%、0.4%±0.03%、0.03%± 0.02%;杨青青等[17]也得到类似结果,葛根总黄酮的得率分别为2.11%和0.44%,都显著低于本研究结果。本研究对葛根总黄酮提取物中黄酮类成分的定性定量分析,较为详细地阐明了其中各黄酮成分的含量及其在总黄酮中所占的比例,增强了分析结果的代表性和整体性。 本研究探讨了葛根总黄酮对11种供试菌的抑制作用。首次发现对粪链球菌(MIC=250 mg/mL)和苏云金芽孢杆菌(MIC=500 mg/mL)有中度抑制作用。这与魏磊等[18]的研究结果类似,抑菌谱一致,但是抑菌浓度有差异,这可能是由不同的提取方法导致葛根中黄酮类化合物含量差异造成的。本研究还发现葛根总黄酮具有较好的抗氧化活性,在质量浓度为0.70 mg/mL时,对DPPH·、ABTS+·具有一定的清除能力和总还原能力,与范琳等[19]报道的葛根水相萃取抗氧化的结果一致。 4 小结 通过响应面法优化得到葛根提取工艺,并建立了与之匹配的提取物定性和定量检测方法。优化后的提取工艺合理、可行、高效,定性定量分析了葛根黄酮中的成分组成。此外,葛根总黄酮具有良好的抑菌、抗氧化活性,但本研究提取的葛根总黄酮仅是粗黄酮,存在着许多杂质,有待进一步纯化分离,进而加深对其体内抑菌、抗氧化的研究。 参考文献: [1] QI Q,ZHANG X Q,YAO L,et al. Pueratin improves diminished ovarian reserve by inhibiting apoptosis[J]. Experimental and therapeutic medicine,2021,22(6):1-10. [2] NIU W,MIAO J,LI X,et al. Metabolomics combined with systematic pharmacology reveals the therapeutic effects of Salvia miltiorrhiza and Radix Pueraria lobata herb pair on type 2 diabetes rats[J].Journal of functional foods,2022,89(1):1423. [3] 陈丽红,唐于平,王 强.不同提取方法制备的葛根芩连配方颗粒抑菌药效研究[J].中成药,2012,34(10): 2016-2017. [4] 庞会娜,范 琳,肖凤琴,等.指纹图谱结合化学计量法对葛根抗氧化活性部位的药效物质筛选[J].中国药房,2021,32(7):839-844. [5] 向志军,赵广荣,元英进,等.复方丹参的体外抗氧化活性研究[J].中草药,2006(2):211-213. [6] 胡清文.三种中药材的化学成分及其生物活性研究[D].济南:山东大学,2018. [7] MIGUES V H,DAVID J M,GOMES A F,et al. Determination of soybean isoflavone by HPLC/DAD and simple UV spectroscopic analysis: A comparative study[J].Food analytical methods,2022, 15(2):367-376. [8] 张 晋,陈 杨,曹飒丽,等.水煎煮法提取葛根总黄酮的动力学模型适用性研究[J].中国中药杂志,2013, 38(17):2788-2792. [9] WOUMBO C Y,KUATE D,KLANG M J,et al. Valorization of glycine max (soybean) seed waste: Optimization of the microwave-assisted extraction (MAE) and characterization of polyphenols from soybean meal using response surface methodology (RSM)[J].Journal of chemistry,2021(11):1-12. [10] BUCKOW R,KASTELL A,TEREFE N S,et al. Pressure and temperature effects on degradation kinetics and storage stability of total anthocyanins in blueberry juice[J].Journal of agricultural and food chemistry,2010, 58(18):10076-10084. [11] 王 萍,王宇鹤,辛爱洁,等.Box-Behnken响应面法优化粉葛配方颗粒提取工艺[J].中成药,2017,39(6): 1293-1296. [12] KATHURIA D,DHIMAN A K,SUREKHA A. Effect of different extraction techniques and drying conditions for the assay of isoflavone from Harit soya seeds[J].Journal of food processing and preservation,2021,46(1):e16107. [13] 袁名远,刘 玉,黄东海,等.响应面优化复合藤茶固体饮料研究[J].食品科技,2021,46(8):96-103. [14] 刘雨诗,刘娟汝,张存艳,等.微波萃取葛根总黄酮工艺及其抗氧化活性研究[J].时珍国医国药,2020,31(1): 68-72. [15] SUN Y,YANG B,WU Y,et al. Structural characterization and antioxidant activities of κ-carrageenan oligosaccharides degraded by different methods[J].Food chemistry,2015(1),178:311-318. [16] ZHAO T,LUO Y,ZHANG X,et al. Subcritical water extraction of bioactive compounds from Radix Puerariae and optimization study using response surface methodology[J].Chemical engineering communications,2019, 206(9):1-11. [17] 杨青青,龚吉军.响应面法优化超声辅助葛根浸提工艺及浸提液抗氧化活性研究[J].食品安全质量检测学报,2021,12(13):5409-5417. [18] 魏 磊,王 偉,侯玥莹,等.葛叶总黄酮的提取工艺优化及抗菌抗氧化能力研究[J].安徽农业科学,2021, 49(14):152-156,161. [19] 范 琳,王 苗,马馨桐,等.葛根抗氧化活性有效部位的筛选研究[J].食品研究与开发,2021,42(6): 119-123.
