地膜降解特征对不同土壤水分和温度条件的响应
2023-12-25高智挺王改玲
高智挺 王改玲

摘要:以2種PBAT生物降解膜(生物降解膜1、生物降解膜2)和普通PE膜作为研究材料,采用室内培养试验,结合扫描电镜(SEM)和傅里叶红外光谱(FTIR)技术,探讨其在不同土壤水分和温度条件下的降解特征。结果表明,在20%土壤含水量,20 ℃、40 ℃、20 ℃(12 h)和40 ℃(12 h)昼夜交替(20 ℃/40 ℃)3种不同土壤温度条件下培养90 d,20 ℃/40 ℃土壤温度时普通PE膜、生物降解膜1、生物降解膜2的失重率最高,分别达2.89%、11.91%、8.33%。在20 ℃土壤温度,15%、20%、25%、30% 4种不同土壤含水量条件下,PE膜降解程度无明显差异;生物降解膜1在土壤含水量为30%时失重率最高,为5.36%;生物降解膜2在土壤含水量为25%时失重率最高,为6.46%。依据FTIR图,推测培养90 d后2种生物降解膜发生了诺里什Ⅰ型反应,在20 ℃/40 ℃土壤温度下2种生物降解膜烃键伸缩振动明显,代表分子链断裂。SEM显示生物降解膜降解加深的形貌特征变化趋势符合基质掉落—裂纹/小穿透性孔洞—大面积裂纹/大穿透性孔洞的规律。由此得出,PBAT生物降解膜的降解程度明显高于PE膜,高温湿润的土壤环境有利于PBAT生物降解膜的降解。
关键词:PBAT生物降解膜;土壤水分;土壤温度;降解特征;扫描电镜;傅里叶红外光谱
中图分类号:X71 文献标识码:A
文章编号:0439-8114(2023)11-0027-07
DOI:10.14088/j.cnki.issn0439-8114.2023.11.006 开放科学(资源服务)标识码(OSID):
Response of degradation characteristics of films to different soil moisture
and soil temperature
GAO Zhi-ting, WANG Gai-ling
(College of Resources and Environment, Shanxi Agricultural University, Jinzhong 030801, Shanxi, China)
Abstract: Two PBAT biodegradable films(biodegradable film 1 and biodegradable film 2) and a PE film were used as research materials, and the degradation characteristics of different films were studied by indoor culture experiment, scanning electron microscopy (SEM) and Fourier transform infrared spectrum (FTIR) under different soil moisture and different temperature culture conditions. The results showed that, when the films were cultured for 90 d under three different soil temperature conditions of 20 ℃, 40 ℃, 20 ℃ (12 h) and 40 ℃ (12 h) day and night alternation (20 ℃/40 ℃) respectively at the soil moisture content of 20%, the weight loss rates of the common PE membrane, biodegradable film 1 and biodegradable film 2 were the highest at 20 ℃/40 ℃, reaching to 2.89%, 11.91%, 8.33%, respectively. When the films were cultured for 90 d at 15%, 20%, 25% and 30% soil mositure respectively at 20 ℃, there was no significant difference in the degradation degree of PE film, while the biodegradable film 1 had the highest weight loss rate of 5.36% at 30% soil mositure, and that of the biodegradable film 2 was 6.46% at 25% soil mositure. It could be speculated that the Norrish type I reactions occurred in the two biodegradable films after 90 d of culture based on the FTIR. The expansion vibration of the two biodegradable films was obvious at 20 ℃/40 ℃, representing the molecular strand fracture. SEM showed the change trend of the morphological characteristic of the PBAT biodegradable films degradation was consistent with the law of matrix drop—crack/small penetrating holes—large area crack/large penetrating holes. It was concluded that the degradation degree of PBAT biodegradable films was significantly higher than that of PE film, and the high temperature and humid soil environment was conducive to the degradation of PBAT biodegradable films.
Key words:PBAT biodegradable film; soil moisture; soil temperature; degradation characteristics; scanning electron microscopy (SEM); Fourier transform infrared spectrum (FTIR)
中国是世界上最大的地膜使用国和生产国。迄今为止,地膜使用量已经达到其他国家总和的1.6倍[1]。农用地膜可以保温保墒,促进作物根系生长,改善田间小气候,但是由于大量残膜滞留在耕层土壤中,造成土壤板结,水肥运输障碍等问题[2-4]。2015年,农用地膜残留已被正式列为亟待解决的“面源污染”问题之一。生物降解地膜可降解、无污染,同时还有显著的除草效果,应用可降解地膜代替普通PE膜是解决上述问题的有效途径[3-5]。用生物降解地膜替代普通地膜可有效缩减残膜累积率和地膜降解周期[6],且不会造成作物大面积减产[7],其分解产物矿化无机盐还能有效改善土壤物理结构和养分供应能力。然而,目前对可降解地膜降解规律的相关研究较少。13C、14C同位素标记法证明,微生物可利用聚合物C作为能源,降解始于地膜表面,其降解特性受降水、温度和微生物活性等诸多环境因素的影响[8]。黄格省等[9]指出在无光、高湿的环境下生物膜更易降解。刘佳茜等[10]对PBAT地膜降解菌的筛选表明,细菌对塑料地膜的降解率远低于真菌。林娟等[11]对聚乳酸降解菌株的研究发现,在降解体系中加入氧助化剂,提高体系内pH和温度均能加速微生物对塑料地膜的降解。Yakabe等[12]发现当土壤含水率增加时,生物膜降解诱导期会随之缩短。王朝云等[13]对麻纤维地膜的研究表明,麻纤维地膜的降解特性受到土壤肥力和pH的显著影响。2018年农业农村部将生物降解地膜应用技术列为十项重大引领性农业技术,在烟草、马铃薯等作物上进行了适度规模化应用。但不同土壤水分和温度条件对生物降解地膜的降解特征仍不清楚。因此,研究生物降解地膜在不同土壤水热条件下的降解规律及其适用性十分必要。本研究以目前国内应用较多的2种PBAT生物降解膜和普通PE膜作为试验材料,通过室内培养试验分析不同地膜的降解特性,结合扫描电镜(SEM)、傅里叶红外光谱(FTIR),分析地膜降解的微观形貌、化学结构变化趋势,以期为生物降解膜的推广和应用提供理论依据。
1 材料与方法
1.1试验材料
供试地膜均为黑色,分别为普通PE膜(产自山西省运城市开拓塑料有限公司,地膜原重9.42 g/m2)、生物降解膜1(产自山东省天野生物降解新材料科技有限公司,地膜原重15.49 g/m2)、生物降解膜2(产自吉林省白山市喜丰塑业有限公司,地膜原重17.42 g/m2),厚度均为0.01 mm,宽度均为80 cm。供试土壤采自山西农业大学资源环境试验站,基本理化性质为pH 8.75、全氮含量0.43 g/kg、全磷含量0.69 g/kg、全钾含量25.25 g/kg。
1.2 试验方法
试验于2021年6月25日在山西农业大学资源与环境学院实验室内进行。称取风干、过筛(1 mm)的土样120 g,将其均匀装入直径12 cm培养皿。裁剪出尺寸大小为8 cm×8 cm的样品膜,放在干燥器中干燥48 h后逐一称重。将称重后的地膜埋入装有风干土的培养皿中,调整含水率,放入恒温培养箱中。试验开展前对培养皿进行质量测定,试验开展后每隔1 d采用质量控制法补充水分[14]。
湿度试验:设置4个土壤质量含水量梯度,分别为15%、20%、25%、30%,温度设为20 ℃,每个处理设置3次平行。
温度试验:设置3个土壤温度梯度,分別为20 ℃、40 ℃、20 ℃(12 h)和40 ℃(12 h)昼夜交替(20 ℃/40 ℃),土壤质量含水量调整为20%,每个处理设置3个平行。
培养90 d时采用破坏采样方法采集地膜样品和土壤样品。地膜样品采集后,用毛刷清理膜上泥土和杂物,先用去离子水清洗多次[15],再将样品放入烧杯中,用超声波清洗仪清洗8~10 min。将清洗后的样品自然风干,置于干燥器内保存[8],称重至恒重。
1.3 测定指标及方法
1.3.1 地膜失重率 采用分析天平测得原始地膜降解前质量,取样清洗风干后用分析天平测得降解后质量。地膜失重率公式如下。
失重率=[(降解前质量-降解后质量)降解前质量]×100%
1.3.2 地膜形貌特征 采用SEM测定,将样品膜黏附在载物台上,分别进行溅射喷金处理,采用场发射扫描电子显微镜观察放大5 000倍后地膜表面微观形貌特征变化。
1.3.3 地膜分子结构 采用傅立叶红外光谱仪测定样品地膜的红外光谱,测量范围为4 000~400 cm-1。
1.4 数据处理
采用Excel 2021软件对数据进行初步整合,使用Origin 2021b进行绘图,采用DPS 22.0软件进行双因素方差分析,并采用LSD法对不同参数进行差异显著性分析。
2 结果与分析
2.1 不同土壤条件对地膜失重率的影响
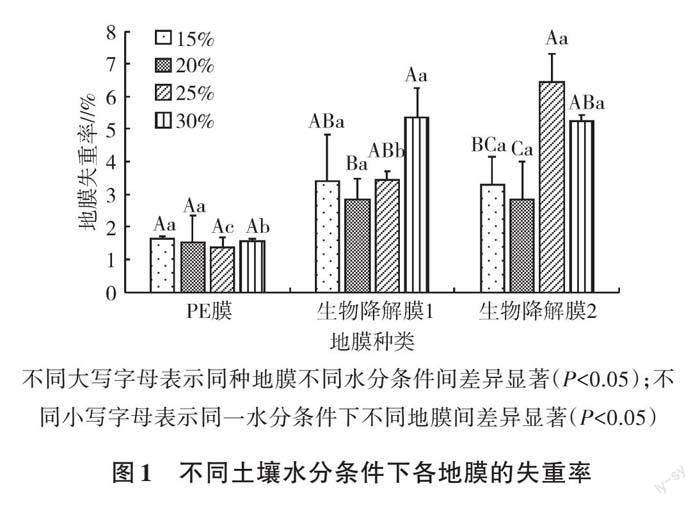
2.1.1 不同土壤水分条件对地膜失重率的影响 不同水分条件下各地膜失重率见图1。各水分条件下,PE膜均产生了一定程度的降解,失重率为1.36%~1.64%,各处理间差异不显著(P>0.05),此现象与陈福慧等[16]的研究结果基本相似。土壤中的细菌、真菌、放线菌大多数都具有破坏PE膜表面和附着在PE膜表面上形成生物膜的能力,从而提升聚乙烯地膜的降解效率[17]。生物降解膜1在土壤质量含水量为30%的条件下失重率最大,为5.36%,显著高于土壤质量含水量20%的处理(P<0.05)。生物降解膜2在土壤质量含水量为25%的条件下失重率最大,为6.46%,显著高于土壤质量含水量15%和20%的处理(P<0.05)。土壤质量含水量为25%和30%时,2种生物降解膜失重率显著高于PE膜(P<0.05),且含水量为25%时,2种生物降解膜失重率具有显著差异(P<0.05)。
不同大写字母表示同种地膜不同水分条件间差异显著(P<0.05);不同小写字母表示同一水分条件下不同地膜间差异显著(P<0.05)
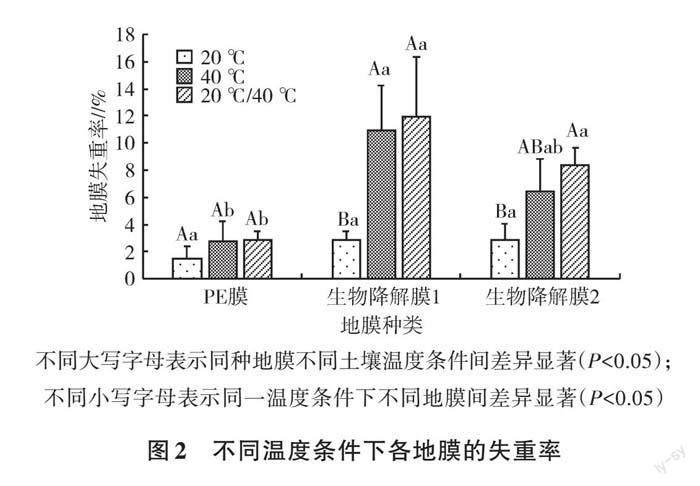
2.1.2 不同土壤温度条件对地膜失重率的影响 不同土壤温度条件下各地膜失重率见图2。由图2可知,在不同土壤温度条件下,3种地膜失重率均值表现为20 ℃/40 ℃>40 ℃>20 ℃,20 ℃土壤温度条件下3种地膜之间失重率均无显著差异(P>0.05)。2种生物降解膜在20 ℃/40 ℃的土壤温度条件下失重率显著高于20 ℃(P<0.05),20 ℃/40 ℃、40 ℃土壤温度间无显著差异(P>0.05)。20 ℃/40 ℃土壤温度时,普通PE膜和生物降解膜1、生物降解膜2的失重率分别为2.89%、11.91%、8.33%。本研究土壤环境温度均高于PBAT的玻璃化转变温度,土壤环境温度达40 ℃时,地膜分子运动能量提高,PBAT分子链基团脱落,断裂强度显著下降,有利于降低地膜表面疏水性,以便于微生物附着[18],因此地膜失重率明显增加。
2.2 不同土壤条件对地膜形貌特征的影响
2.2.1 不同土壤水分条件对地膜形貌特征的影响 不同土壤水分条件培养后的地膜扫描电镜(×5 000)结果见图3。PE膜表面较为平整,2种生物降解膜表面有明显的基质颗粒。总体而言,经过90 d的培养,PE膜与原样差异不明显,表面只出现少许生物入侵痕迹;2种生物降解膜表面均发生了不同程度的裂解,并出现小分子残膜和小孔隙,且2种生物降解膜原样表面均分布小颗粒物。在土壤含水量为15%的条件下,生物降解膜1表面呈不同程度的裂纹和凹槽;在土壤含水量为20%的条件下,生物降解膜1表面基质明显脱落,开始出现小分子残膜;在土壤含水量为25%的条件下,生物降解膜1表面残膜面积明显增加,厚度变得不均;在土壤含水量为30%的条件下,生物降解膜1表面残片进一步分解为直径小于5 μm碎屑,机械性显著下降。在土壤含水量为15%的条件下,生物降解膜2表面变得凹凸不平,出现一些褶皱;土壤含水量为20%的条件下,生物降解膜2表面出现大量鳞片状颗粒;在土壤含水量为25%的条件下,生物降解膜2表面裂纹加深,穿透性孔洞增多,内部结构呈蜂窝状,机械性能降低,进入韧性脆化阶段;在土壤含水量为30%的条件下,生物降解膜2表面残膜量增加,但表面裂解程度低于土壤含水量为25%的条件。扫描电镜结果表明,生物降解膜裂解加深的程度符合基质掉落—裂纹/小穿透性孔洞—大面积裂纹/大穿透性孔洞的变化趋势,生物降解膜1降解的最佳水分条件为土壤质量含水量30%,生物降解膜2降解的最佳水分条件为土壤质量含水量25%,上述变化趋势与生物降解膜的失重率研究结果一致。
2.2.2 不同土壤温度条件对地膜形貌特征的影响 图4为3种地膜原样和在不同土壤温度下培养90 d时5 000倍扫描电镜结果。总体来说,生物降解膜的降解程度大于普通PE膜,40 ℃和20 ℃/40 ℃土壤温度下地膜的降解程度明显大于20 ℃,20 ℃/40 ℃地膜表面破损程度最大。在20 ℃土壤温度下,生物降解膜1表面基质明显脱落;在40 ℃土壤温度下,生物降解膜1降解程度加深,表面出现许多细小孔洞,部分裂纹达10~20 μm,表面机械性显著下降;在20 ℃/40 ℃土壤温度下,生物降解膜1表面出现了大面积裂纹。在20 ℃土壤温度下,生物降解膜2表面基质亦出现明显脱落;在40 ℃土壤温度下,出现大面积残膜,机械性明显减弱,伴随有大面积凸起破裂碎片,代表已进入快速降解阶段;在20 ℃/40 ℃土壤温度下,残膜直径达10 μm,表面变得蓬松且更加凹凸不平,此时地膜裂解程度大于20 ℃和40 ℃土壤温度条件,这一变化趋势与失重率结果一致。
2.3 不同土壤条件对地膜分子结构的影响
各地膜在波數为4 000~500 cm-1的傅里叶红外光谱图见图5。PE膜有明显的亚甲基(—CH2—)吸收峰,证实确系聚乙烯类高聚物。2种生物降解膜主要成分基本一致,红外光谱显示均存在苯环特征峰(—C6H4—)、羰基特征峰(—C=O)以及—CH2—不对称伸缩振动峰,上述官能团均为PBAT(对苯二甲酸丁二酯)特征峰。另外,还存在羟基(—OH)和酯基(—C=O),说明生物降解膜中可能还含有PLA(聚乳酸)。从总体上看,生物降解膜2的红外光谱透射率高于生物降解膜1,造成此现象的原因可能是二者材料差异所导致[18]。
由图5a、图5b可知,在含水量为20%~30%和40 ℃、20 ℃/40 ℃土壤温度条件下,PE膜在波数为 2 500~1 500 cm-1吸收峰处明显蓝移,伴随着小的吸收峰波动,据此推测PE膜发生非生物氧化降解,即分子受到机械力的作用,通过反应进一步生成醛、羧酸、酯类化合物[19],但很多官能团还未发生断裂,未进入完全降解阶段,因此未出现新的特征峰[16,19],此现象可能是因为普通PE膜表面能低,相对分子质量大,性能稳定的原因所致[8]。由图5 c、图5e可知,2种生物降解膜在室内培养90 d后,峰值均发生蓝移,此现象可能是地膜分子空间位阻增大,基团发生了取代反应,结合2种生物降解膜在酯键(—C=O)即波数为1 717 cm-1处的吸收峰面积明显减小,在波数为3 425 cm-1羟基(—OH)、2 915 cm-1(—CH2—)和724 cm-1苯环(—C6H4—)处峰伸缩振动变化明显,推测生物降解膜在微生物的作用下发生了诺里什Ⅰ型反应,PBAT分子链中的酯键发生了断裂,此现象与曲萍等[20]的研究结果一致。生物降解膜1在土壤含水量为30%的条件下,生物降解膜2在土壤含水量为25%的条件下,透射率相对较低,说明降解程度相对较高。
由图5b、图5d、图5f可知,PE膜和生物降解膜1在20 ℃/40 ℃下地膜透射率相对较低;在20 ℃/40 ℃土壤温度下,生物降解膜1、生物降解膜2在波数为1 750~1 675 cm-1处的羰基特征峰(C=O)明显减弱,并且变宽。2 500~2 000 cm-1为—C≡C—和累积双键伸缩振动所产生的谱带,20 ℃/40 ℃下2种生物降解膜在波数为2 353 cm-1和2 359 cm-1峰值伸缩振动明显,结合羟基(—OH)吸收峰的变化,可以推测该条件下可能发生了诺里什II型反应导致化学链断裂形成了不饱和碳键[21]。
3 讨论
研究表明,培养90 d后2种PBAT生物降解地膜降解程度均高于普通PE膜,其表面微观结构、化学结构和官能团均显著改变,其中40 ℃和20 ℃/40 ℃土壤温度条件下各地膜降解程度均高于20 ℃,此现象与Jakubowicz[22]、赵爱琴[23]的研究结果一致,高温往往会引起地膜高分子链的基团脱落,加速其热降解作用。20 ℃/40 ℃条件下各地膜降解程度略高于40 ℃,此现象与乔海军[17]、陈斌[18]的研究结果基本一致。温度最高的培养环境,地膜降解速率不是最快的,土壤中微生物及相应的生物酶类构成地膜降解的生物学环境[8],在PBAT为主要成分的降解地膜老化过程中起到至关重要的作用。赵爱琴[23]的研究表明,35 ℃时微生物活性稳定,且其活性高于45 ℃,35 ℃是淀粉基质地膜降解最彻底的温度。有研究表明,降解PBAT的菌群中,霉菌和酵母菌的适宜生存温度为20~45 ℃;放线菌的最适生存温度为25~30 ℃;细菌是喜温生物,最高生存温度为50~55 ℃;40 ℃和20 ℃均有利于霉菌的生存,而40 ℃培养条件下虽然积温较高,但水分蒸发快,土壤环境干燥,放线菌活性受到抑制,进而影响地膜的降解[19]。
吴思等[8]的研究结果显示,25%含水量条件时,PBAT生物降解膜降解速率和降解程度显著高于含水量15%和35%的水分条件;土壤含水量达35%时,含氧量明显降低,会抑制真菌活性,降解程度下降。本研究结果表明,PBAT生物降解膜1的最适降解湿度为土壤质量含水量30%,PBAT生物降解膜2的最适降解湿度为土壤质量含水量25%。其原因可能与试验条件及降解膜性质有关。在吴思等[8]的研究中,设定的土壤质量含水率为15%、25%和35%,未能观测30%时的降解情况,同时其研究发现,相同环境下主要成分相似的生物降解地膜的降解特性主要取决于物料本身的三维结构和配方差异。在最佳温度和水分条件下地膜中的PBAT和其他组分共同降解促使地膜降解速率加快[23],降解膜表面结构较PE膜更为松散,疏水性低,更有易于微生物侵蚀和水解形成短链分子,在土壤酶的作用下进一步生成寡聚片段,从而被吞噬细胞吞噬[8]。
SEM可以直观展示地膜表面微观结构变化。龙世方等[15]指出麻纤维生物降解地膜降解趋势与纤维混纺生物降解地膜的降解趋势一致,均为小孔隙—裂纹—裂缝—大孔[8]。Aydin等[24]通过观测SEM图像得出油基聚乳酸膜的降解趋势为褶皱—褶皱/裂缝—褶皱/孔洞。本研究中主要成分为PBAT的降解地膜,降解趋势与宋欣等[25]研究的淀粉基质地膜基本一致,降解加深程度符合基质掉落—裂纹/小穿透性孔洞—大面积裂纹/大穿透性孔洞的变化趋势。
FTIR用于验证地膜各种官能团的形成和变化。本研究验证了2种生物降解地膜主要成分PBAT的存在,2种地膜结构密度和三维构型的差异明显不同。各土壤环境条件下,培养90 d后,2种生物降解膜在20 ℃/40 ℃土壤温度条件下,在波数为2 353、 2 359 cm-1的特征峰均有显著变化,PBAT高聚物主键由于水解或酶解而使化学键断裂,此现象与乔海军[17]的研究结果一致。本研究中,不同土壤环境条件下,位于1 750~1 675 cm-1处的羰基(—C=O)吸收峰面积明显减少,可以推测降解过程中氧桥断裂,发生了诺里什Ⅰ型反应,此现象与曲萍等[20]、宋欣等[25]、王星等[26]的研究结果一致,但与麻纤维基质地膜[6]和光降解地膜[26]分子结构变化机理不同,可能是由于地膜材料差异所导致。本研究中的PBAT生物降解膜降解过程中酯键发生了断裂,因此随着降解程度的加深酯键的吸收峰面积明显减弱。
4 小结
在相同土壤条件下,2种PBAT生物降解膜的降解程度均高于PE膜。培养90 d后生物降解膜表面出现了大面积残膜,随着降解程度加深,酯键的特征峰显著减弱,红外光谱透射率减少,微观形貌变化趋势为基质掉落—裂纹—穿透性孔洞/大面积裂纹。温度条件为20 ℃(12 h)和40 ℃(12 h)昼夜交替时 3种地膜裂解程度最深;生物降解膜1的最佳降解水分条件为土壤质量含水量30%,生物降解膜2的最佳降解水分条件为土壤质量含水量25%。
参考文献:
[1] 王 琼,周金娥,代健康.生物降解地膜应用与地膜残留污染防控探究[J].农业与技术,2017,37(18):4.
[2] 白 雪,周怀平.山西省典型地区农用地膜利用现状及残膜污染调查分析[J].中国农学通报,2017,33(36):99-104.
[3] 趙德英.梨园树盘覆盖的土壤生态效应及树体生理响应研究[D].北京:中国农业科学院,2013.
[4] 邓方宁,林 涛,何文清.生物降解地膜覆盖对棉田土壤水-热-盐及产量的影响[J].生态学杂志,2020,39(6):1956-1965.
[5] 陈和杰.不同地膜覆盖下灌水量对大棚西瓜生长、产量和品质的影响[D].陕西杨凌:西北农林科技大学,2017.
[6] 温善菊,伍维模,战 勇,等.可降解地膜的生物降解作用研究[J].河南农业科学,2012,41(6):71-74.
[7] 王 战,罗兴录,樊吴静,等.不同地膜覆盖对木薯生长与产量的影响[J].广东农业科学,2015,42(20):15-18.
[8] 吴 思,高维常,蔡 凯,等.PBAT生物降解地膜降解特征对不同土壤水分的响应[J].灌溉排水学报,2020,39(6):43-50.
[9] 黄格省,师晓玉,张 彦,等.国内外乙烷裂解制乙烯发展现状及思考[J].现代化工,2018,38(10):1-5.
[10] 刘佳茜,侯丽君,刘婷婷,等. PBAT地膜降解菌的筛选及其降解特性研究[J]. 农业环境科学学报,2021,40(1):129-136.
[11] 林 娟,周景文,康 振,等.聚乳酸降解菌株筛选鉴定及降解过程优化[J].微生物学通报,2013,40(9):1560-1569.
[12] YAKABE Y, NOHARA K, HARA T. Factors affecting the biodegradability of biodegradable polyester in soil[J]. Chemosphere, 1992, 25(12):1879-1888.
[13] 王朝云,许香春,易永健.麻地膜降解对土壤性质和作物产量影响的研究[J]. 农业环境科学学报,2011,30(1):84-92.
[14] LI C, MOORE K J, LEE J. Effects of biodegradable mulch on soil quality[J]. Applied soil ecology, 2014, 79: 59-69.
[15] 龙世方,朱奇宏,周建利,等.麻纤维地膜在不同土壤水分条件下的降解特征[J].农业现代化研究,2019,40(2):349-356.
[16] 陈福慧,付新梅.不同地膜水中生物降解性能的比较研究[J].化工新型材料,2012,40(11):133-135.
[17] 乔海军.生物全降解地膜的降解过程及其對玉米生长的影响[D].兰州:甘肃农业大学,2007.
[18] 陈 斌.三种全生物降解地膜降解性能的测试与表征[D].山东泰安:山东农业大学,2016.
[19] 李 真,何文清,刘恩科,等.聚乙烯地膜降解过程与机理研究进展[J].农业环境科学学报,2019,38(2):268-275.
[20] 曲 萍,郭宝华,王海波,等. PBAT全生物降解地膜在玉米田中的降解特性[J].农业工程学报,2017,33(17):194-199.
[21] 田凤飞.全生物降解海藻多糖干地膜降解特性研究[D].山东青岛: 中国海洋大学, 2015.
[22] JAKUBOWICZ I. Evaluation of degradability of biodegradable polyethylene (PE)[J].Polymer degradation and stability, 2003, 80(1): 39-43.
[23] 赵爱琴.土壤温度和水分对生物降解地膜降解过程的影响及田间应用[D].北京:中国农业大学,2005.
[24] AYDIN R S T, AKYOL E, HAZER B. Soybean oil based polylactic acid membranes: Synthesis and degradation characteristics[J]. Journal of polymers & the environment, 2017, 26(13): 1-10.
[25] 宋 欣,沈 峥,乔恒波.不同厚度生物降解地膜在崇明生态岛“两无化”稻田中的降解特性研究[J].环境污染与防治,2022,44(1):51-54.
[26] 王 星,李占斌,李 鹏.可降解地膜的热解和红外光谱特征分析[J].应用基础与工程科学学报,2011,19(S1):150-160.
