碱解法—液质联用测定小麦中2甲4氯异辛酯及其代谢物2甲4氯
2023-12-25杨玉娟
杨玉娟,封 雅
(苏州华测安评技术服务有限公司,江苏 苏州 215121)
2甲4氯异辛酯为苯氧乙酸类除草剂,主要登记作物为冬小麦田,大豆田,小麦田,春小麦田,春玉米田,水稻田(直播),高粱田等,用于防治一年生和多年生阔叶杂草,其主要具有较强的内吸传导性,能穿过角质层和细胞膜,迅速传导至杂草各个部位,最后引起全株死亡[1]。FAO 在2甲4氯评估报告指出2甲4氯异辛酯在小麦中很容易被水解为2甲4氯,其可与葡萄糖等形成共轭物[2],董见南等在研究小麦中2甲4氯异辛酯的残留及代谢转化时也发现2甲4氯异辛酯在小麦植株体内可快速代谢为2甲4氯,消解半衰期为1.1~3 d[3]。2甲4氯亦是苯氧乙酸类除草剂,通常以盐、胺盐或酯来配制和使用,均为低毒农药,但随着该类农药的广泛使用其带来的食品农药残留、水土污染问题亦不能忽视。目前我国规定小麦中2甲4氯和2甲4氯异辛酯临时残留限量均为0.1 mg/kg[4],日本小麦中2甲4氯残留限量为0.04 mg/kg(酯、盐等)[5],欧盟规定小麦2甲4氯残留限量为0.2 mg/kg (包括盐、酯、共轭物)[6]。
目前国内外对2甲4氯异辛酯的测定方法主要为气相色谱-质谱联用仪和气相色谱,其代谢产物2甲4氯的测定方法主要为高效液相色谱-质谱联用仪[7-12]。《农药登记残留试验待测残留物和植物源性食品膳食风险评估残留物目录(2021版)(征求意见稿)》中2甲4氯异辛酯的残留物定义为2甲4氯异辛酯、2甲4氯及其共轭物之和,要求检测过程加碱水解释放共轭物,膳食风险评估采用2甲4氯计算ADI(每日容许摄入量)[13]。但2甲4氯异辛酯遇酸、碱分解[14],若二者独立测定,在测定样品时加碱水解释放共轭物时会引起2甲4氯异辛酯水解造成二者含量结果不准确。因此,加碱将2甲4氯异辛酯彻底水解为2甲4氯,并释放2甲4氯的共轭物,HPLC-MS/MS仪器测定结果为2甲4氯含量,能够满足2甲4氯异辛酯在农药登记试验的膳食风险评估要求。聂春林等采用甲醇-氢氧化钠提取并碱解小麦籽粒和秸秆中的2甲4氯异辛酯,高效液相色谱测定2甲4氯含量的方法,表明将2甲4氯异辛酯碱解为2甲4氯的方法可行,转化率可达95%~102%。但该方法提取和净化过程较为复杂,采用液相色谱仪检测,灵敏度较低,检测时间较长[15]。本文中籽粒和秸秆样品通过0.1%甲酸乙腈提取、氢氧化钠碱解的方法将2甲4氯异辛酯和2甲4氯共轭物均转变为2甲4氯,样品经GCB和PSA净化后采用HPLC-MS/MS检测,检测过程简单快捷,回收率好、灵敏度较高,适用于小麦籽粒和秸秆中2甲4氯异辛酯和代谢产物2甲4氯及其共轭物的残留检测。
1 材料与方法
1.1 仪器设备 美国AB SCIEX Triple quad 4500液质联用仪,瑞士梅特勒XS205DU电子天平;常州普天仪器制造有限公司MS200多管漩涡混合仪;湖南湘仪实验室仪器开发有限公司L550离心机;普兰德移液器(100 μL~5 mL);Milli-Q Academic超纯水仪等。
试剂和材料 2甲4氯异辛酯标准品:纯度93.43%;2甲4氯标准品:纯度98.7%;乙腈(色谱纯);甲酸(色谱纯);氯化钠(分析纯);无水硫酸镁(分析纯);盐酸(分析纯,36.0%~38.0%);氢氧化钠(分析纯);GCB净化剂(石墨化碳黑);PSA净化剂(N-丙基乙二胺),0.22 μm PTFE亲水性滤膜,50 mL和2 mL离心管等。
1.2 试验方法
1.2.1 试验样品 采集江苏苏州小麦籽粒和秸秆空白样品,经粉碎机粉碎后制备成空白实验室样品。
1.2.2 标准溶液的配制 分别准确称取18.81 mg的2甲4氯异辛酯和12.92 mg的2甲4氯标准品于10 mL容量瓶中,用乙腈定容,配制成浓度分别为1 757 mg/L(标准品纯度为93.43%)的2甲4氯异辛酯和1 292 mg/L 2甲4氯标准储备液。按照2甲4氯异辛酯相对分子量312.8,2甲4氯相对分子量200.6,2甲4氯异辛酯以2甲4氯计浓度为1 126 mg/L。
1.2.3 样品处理 提取:分别称取2.5 g籽粒、秸秆样品(精确至0.01 g,偏差±0.02 g)于50 mL离心管中,加入10 mL 0.1%甲酸乙腈溶液(秸秆先加入10 mL水润湿),2 500 rpm涡旋提取10 min,加入约0.5 g NaCl和约1 g无水MgSO4(秸秆加入约1 g NaCl和约2 g无水MgSO4),2 500 rpm涡旋提取5 min,4 000 rpm离心5 min,转移上清液。
碱解:在上清液中加入2 mL (秸秆2.5 mL)0.25 mol/L的NaoH溶液,2 500 rpm涡旋碱解15 min(秸秆碱解30 min)后加入1 mL 1mol/L的盐酸溶液,2 500 rpm涡旋5 min,加入约1 g NaCl和约2 g无水MgSO4,2 500 rpm涡旋5 min,然后4 000 rpm离心5 min,上清液待净化。
净化:移取上清液1 mL,加入20 mg GCB(秸秆加入约20 mg GCB和7 mg PSA),籽粒涡旋30 s后静置,秸秆涡旋15 s后尽快过滤膜。上清液过0.22 μm亲水PTFE滤膜,供HPLC-MS/MS分析测定。
1.2.4 液相色谱条件 色谱柱:Waters ACQUITY UPLC BEH C18(2.1×50 mm,1.7 um);柱温:40°C;进样量2 μL;流动相:0.1%甲酸溶液(A):乙腈(B),梯度洗脱条件(表1)。
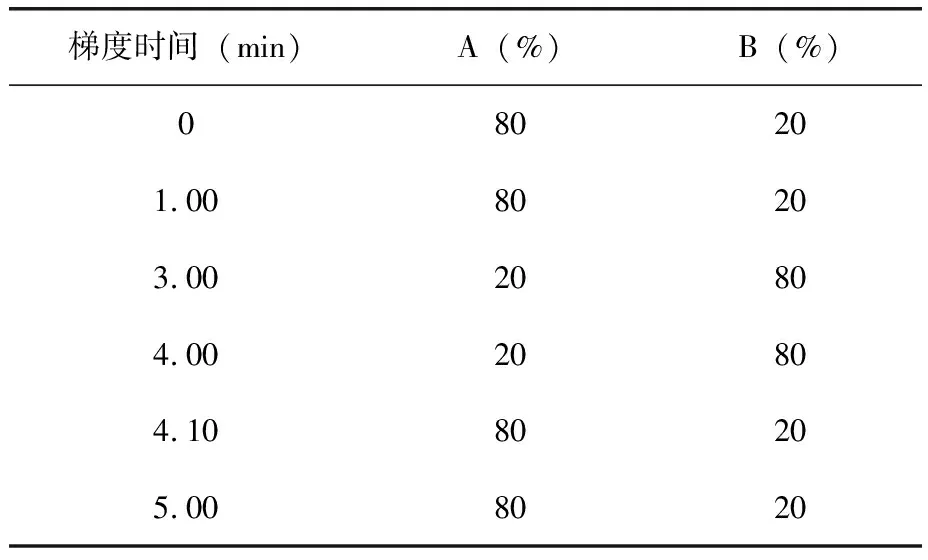
表1 液相色谱流动相梯度洗脱条件
1.2.5 质谱条件 离子源:ESI,负离子模式。电喷雾离子源温度550℃,电喷雾电压4.5 kV,气帘气30 psi,雾化气GS1:55psi,辅助气GS2:55 psi。质谱参数(表2)。

表2 质谱参数
2 结果与分析
2.1 2甲4氯异辛酯转化为2甲4氯的转化率将2甲4氯异辛酯(以2甲4氯计)用10 mL 0.1%甲酸乙腈配制成浓度为1、5、10、50、100 μg/L的标准溶液,设置一个空白样品(0.1%甲酸乙腈),经1.2方法中籽粒的前处理方法进行提取、碱解和净化处理后上机。采用经过前处理的空白溶液配制2甲4氯系列标溶液对以上2甲4氯异辛酯样品结果进行定量,比较二者峰面积,结果表明2甲4氯异辛酯(以2甲4氯计)在1~100 μg/L范围内,转化为2甲4氯的为93%~99%(表3),表明经1.2试验方法,2甲4氯异辛酯可完全转化为2甲4氯。

表3 2甲4氯异辛酯转化率
2.2 提取和碱解 常用的提取试剂为乙腈、甲醇等,甲醇不利于后续的盐分层,因此本研究主要采用乙腈作为提取试剂。借鉴聂春林等采用甲醇-0.25 mol/L NaOH作为提取试剂[15],笔者初期试验也考虑采用提取和碱解一体的方式,在纯溶剂阶段提取和碱解一体是可行的,但加入样品基质后,碱解对小麦样品的破坏力较大,基质效应明显,易污染仪器,造成结果不稳定,因此采用先提取再碱解的前处理方法。样品提取溶剂选取过程中比较乙腈、0.1%甲酸乙腈和0.25 mol/L NaOH∶乙腈(1∶5)提取剂,发现籽粒样品添加2甲4氯标准品后经0.25 mol/L NaOH∶乙腈(1∶5)提取为经0.1%甲酸乙腈提取的峰面积的1/3,因此本研究采用0.1%甲酸乙腈作为提取剂。碱解时间及加碱量,多次试验表明秸秆样品需要较长的碱解时间才可达到较为满意的回收率,因此秸秆样品碱解过程中的加碱量和碱解时间较籽粒样品多。
2.3 净化剂选择 常用的净化剂包括C18(十八烷基键合硅胶)、PSA、GCB,GCB对色素有较 强的吸附能力,PSA对脂肪酸、有机酸、糖类及部分亲脂的色素有吸附能力,C18主要对脂肪等非极性化合物有吸附能力[16]。本研究通过在籽粒中添加 0.01 mg /kg 的2甲4氯对以上3种净化剂净化结果进行比较,发现对2甲4氯的吸附能力顺序为C18>PSA>GCB,因此本研究采用GCB净化籽粒上清液。而秸秆上清液仅用GCB净化后效果略差,净化后仍有明显的颜色,而加入少量PSA后,样品液颜色变浅,可能是PSA有助于去除部分亲脂的色素和其他的一些物质,减少干扰,可以确保回收率较好,因此本研究采用GCB和PSA两种净化剂净化秸秆上清液。
2.4 标准曲线和基质效应 分别采用乙腈溶剂、籽粒基质空白和秸秆基质空白配制2甲4氯溶剂标准曲线、籽粒基质标准曲线和秸秆基质标准曲线,浓度范围均为1~100 μg/L。通过浓度和峰面积的做回归曲线后进行定量并计算相关系数,结果表明溶剂标准曲线、籽粒和秸秆基质标准曲线在1~100 μg/L范围内线性良好,相关系数均>0.999(表4)。
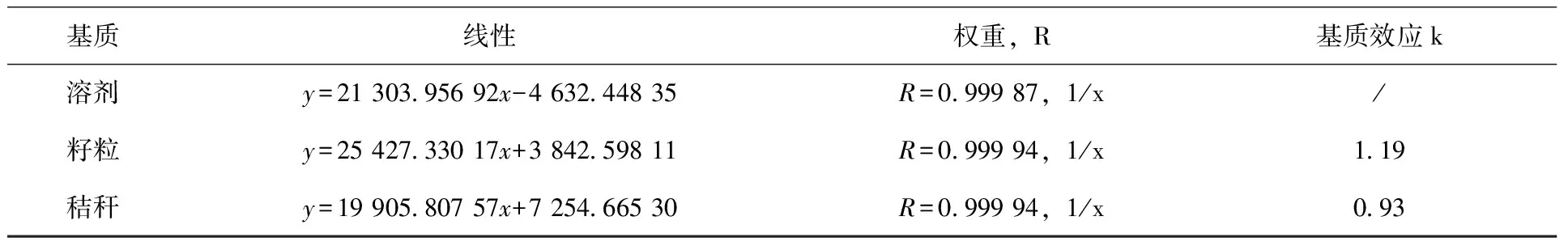
表4 2甲4氯在不同基质中的标准曲线
采用基质标准曲线斜率和溶剂标准曲线斜率之比(k)来评价基质效应,当k>1.1时为基质增强效应,k<0.9时为基质减弱效应,而当k在0.9~1.1之间时为基质效应不明显,本试验籽粒和秸秆基质效应(表4),结果显示2甲4氯在籽粒中呈现基质增强效应,在秸秆中基质效应不明显。为保证试验定量结果准确性,本方法均采用基质标准曲线消除基质效应。
2.5 方法的回收率和精密度 称取已粉碎混匀的籽粒和秸秆空白样品2.5 g,使样品中2甲4氯异辛酯或者2甲4氯的浓度分别为0.02、0.5和5 mg/kg,静置30 min,均设置5个平行,另设空白(用于空白试验和基质标准曲线的配制)。按照1.2.3进行前处理和分析测定,计算回收率和精密度(相对标准偏差),结果(表5)。2甲4氯异辛酯在0.02、0.5 和5 mg/kg的添加水平下,籽粒的回收率分别为96%、87%、93%,相对标准偏差分别为5.6%、4.6%、3.3%,秸秆的回收率分别为91%、91%、86%,相对标准偏差分别为2.1%、3.4%、4.7%。2甲4氯在0.02、0.5和5 mg/kg的添加水平下,籽粒的回收率分别为94%、102%、106%,相对标准偏差分别为6.1%、3.3%、3.9%,秸秆的回收率分别为98%、102%、100%,相对标准偏差分别为3.0%、4.8%、6.3%;另溶剂空白在标准品相应位置的信号应无响应,籽粒和秸秆基质空白在标准品相应位置峰面积均低于最低定量限的30%,以上试验结果表明本方法符合农药残留分析方法NY/T 788-2018要求[17]。溶剂空白、籽粒和秸秆空白色谱图(图1~3)。本方法小麦籽粒和秸秆中2甲4氯和2甲4氯异辛酯定量限浓度均为0.02 mg/kg,典型谱图(图4~7)。

图1 溶剂空白
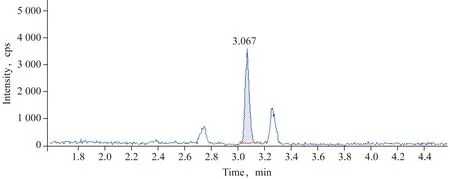
图2 秸秆基质空白

图3 籽粒基质空白
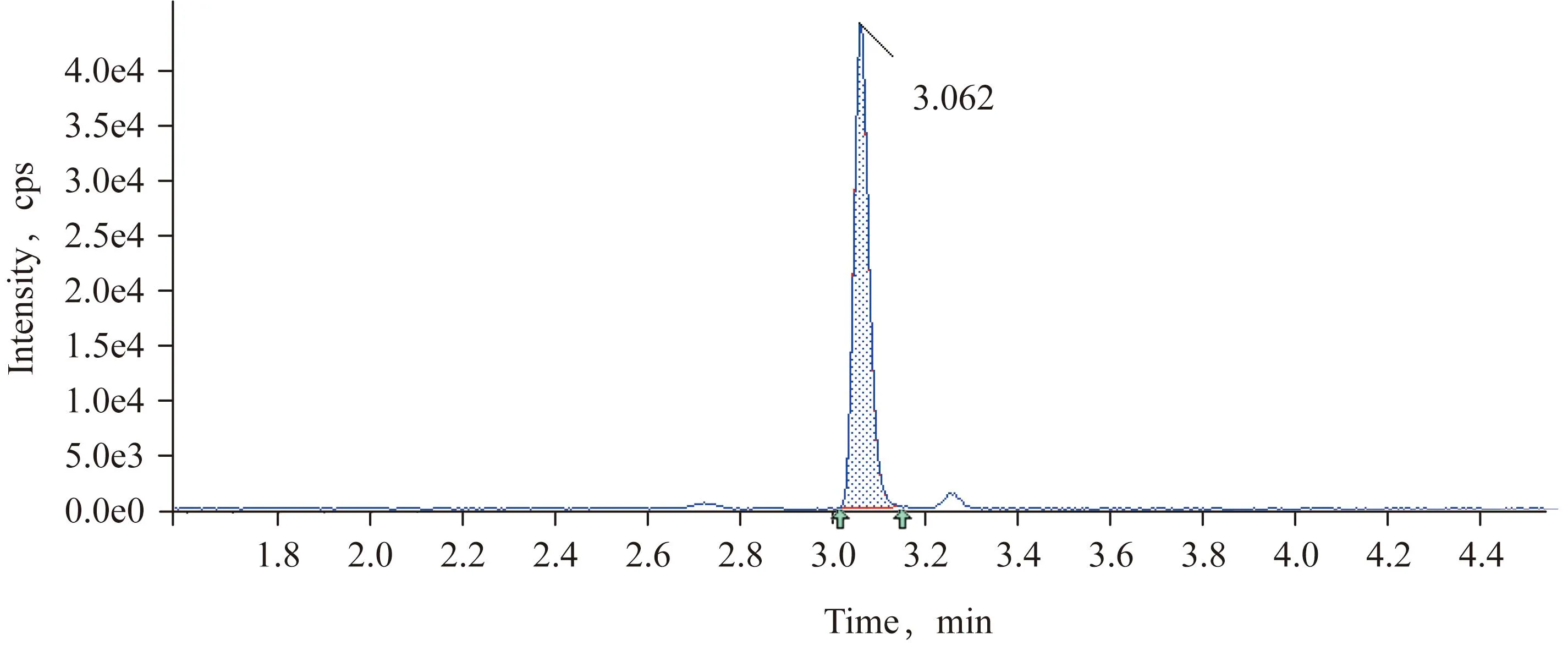
图4 秸秆中2甲4氯添加浓度为0.02 mg/kg色谱图
图5 籽粒中2甲4氯添加浓度为0.02 mg/kg色谱图
图6 秸秆中2甲4氯异辛酯添加浓度为0.02 mg/kg色谱图

图7 籽粒中2甲4氯异辛酯添加浓度为0.02 mg/kg色谱图
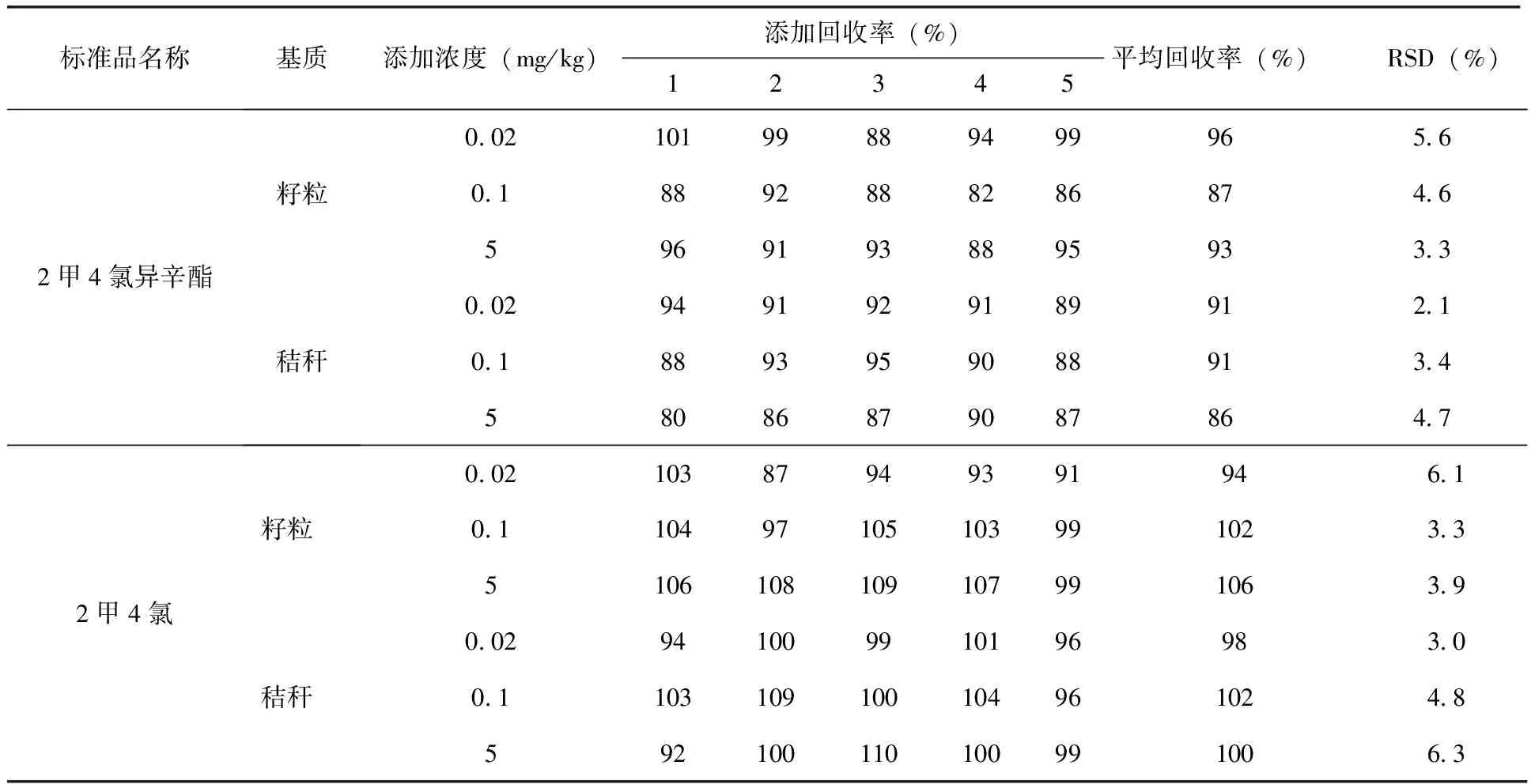
表5 2甲4氯异辛酯和2甲4氯在小麦籽粒和秸秆中的添加回收率(n=5)
3 结论
本研究结合QuEChERS前处理方法和碱解衍生技术,将小麦籽粒和秸秆中的2甲4氯异辛酯水解为2甲4氯并释放2甲4氯共轭物,建立了一种检测小麦样品中2甲4氯异辛酯和2甲4氯及其共轭物残留的HPLC-MS/MS 检测方法,定量限为0.02 mg/kg,该方法回收率和精密度等符合农药残留检测分析的要求,检测过程简单快捷,可应用于大量小麦样品中2甲4氯异辛酯和代谢产物2甲4氯及其共轭物的残留检测,为2甲4氯异辛酯在小麦中的膳食风险评估提供更为便捷的检测方法。
