不同向日葵品系对菌核病抗性的综合鉴定
2023-12-25王彦尊王文浩何丽芬闫玉星刘文俊郑洪元王彦雯
王彦尊 王文浩 何丽芬 闫玉星 张 红 刘文俊 郑洪元 王彦雯
(1 山西农业大学经济作物研究所,汾阳032300;2 山西省文水县农业农村局,文水032100)
由 核 盘 菌(Sclerotinia sclerotiorum(Lib.)de Bary)侵染引起的向日葵菌核病会使向日葵空籽率上升,产量降低,籽仁蛋白质及含油量等营养物质含量下降,影响籽粒的食用价值与商品价值,最终影响经济效益。核盘菌子囊孢子可以通过风力传播,导致植株整个生育期均有染病可能性,防治时期难以掌握[1]。目前采用的防控措施主要包括农艺措施、化学防治、生物防治和筛选抗病资源选育抗病品种。向日葵抗(耐)菌核病鉴定方法主要分为室内与室外两种条件下,其中室内鉴定方法主要包括皮壳鉴定法、草酸鉴定法、菌土法鉴定和茎部或根颈部抗性鉴定等方法[2-6],室外鉴定方法主要是使用牙签法或打孔法将核盘菌接种在向日葵花盘背面[7]。向日葵菌核病主要在东北、华北、西北等种植区发生,发病率在10%~30%之间[8],由此造成的减产严重的高达60%。培育和筛选对菌核病有抗性的向日葵育种材料仍然是未来向日葵育种家的首要任务[9],也是防治该病害最经济有效的途径之一[10-13]。
1 材料与方法
1.1 试验材料供试品系:材料均来源于山西农业大学经济作物研究所向日葵课题组自主收集、选育的种质资源,具体见表1。供试菌株:核盘菌菌株。供试培养基:马铃薯葡萄糖培养基(PDA 培养基)、基本培养基。

表1 供试向日葵品系资源信息
1.2 试验方法
1.2.1 病原菌的分离与纯化核盘菌菌核取自山西农业大学经济作物研究所食用向日葵试验地中的发病植株。将收集到的菌核置于75%的酒精中消毒3~5s,用无菌水漂洗2 次,再用5%次氯酸钠溶液消毒1~3min,75%的酒精中再次消毒3~5s 后,再用无菌水漂洗3 次,用灭菌过的滤纸吸干菌核周围水分后,接种在PDA 培养基中,25℃恒温培养箱培养。
1.2.2 室内抗菌核病能力鉴定当向日葵幼苗生长至3~4 对真叶时,取其叶片进行清洗并使用灭菌滤纸擦拭多余水分后,将试验材料均匀地放在直径15cm 的培养皿滤纸上,叶片背面朝上备用。将纯化好的菌株,接种在PDA 培养基上,待菌落生长至培养皿3/4 时,取边缘菌丝块(直径4mm),接种在基本培养基上培养,当菌落铺满培养皿的80%时,使用直径4mm 的打孔器沿着菌落边缘打取菌丝琼脂块,将其接种在待测叶片叶脉两侧,使核盘菌菌丝与叶片充分接触,以未接菌的培养基琼脂块作为对照,每个材料重复3 次,定时观察发病情况并拍照,用十字交叉法量取病斑直径。
1.2.3 田间抗菌核病能力鉴定将核盘菌菌核接种在PDA 培养基中,置于24℃的恒温培养箱进行生长繁殖14d 后,将培养基表面的菌核去除后称重,将含菌丝的培养基粉碎后,加入无菌水配制成20g/L的菌丝悬浮液。待向日葵进入始花期,进行田间菌丝侵染花盘试验,具体试验方法为:将配制好的溶液均匀喷施在花盘正面的小花上,用牛皮纸袋包裹花盘做保湿处理并隔绝外部环境影响,每盘喷施量为5mL,每个品种接种10 盘,试验重复3 次。接种30d 后进行病害调查与数据统计。
1.2.4 抗性筛选方法
1.2.4.1 室内鉴定试验 待叶片接种菌丝块48h后,用十字交叉法量取病斑直径,并根据表2 对菌核病抗性水平进行划分。

表2 向日葵品系对菌核病抗性水平的划分标准
1.2.4.2 室外鉴定试验 向日葵花盘接种PDA 菌丝悬浮液30d 后,观察花盘背面感病面积,统计感病植株数量及感病等级(表3),计算病情指数(病情指数=[∑(各级别花盘数×相对级数值)/调查总花盘数×4]×100)进而对被鉴定材料进行抗性评价。发病率(%)=发病花盘数/处理总花盘数×100。
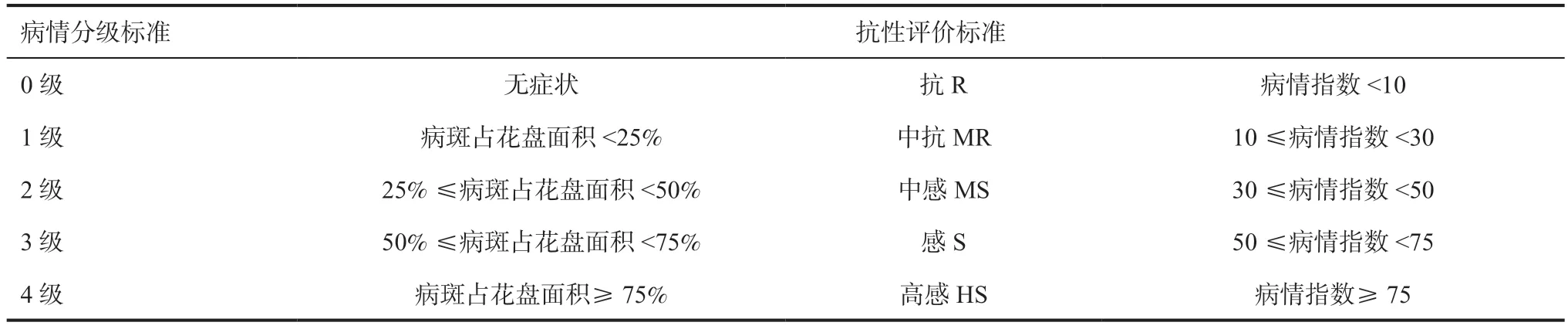
表3 向日葵品系抗菌核病病情分级标准及抗性评价标准
2 结果与分析
2.1 菌株的分离纯化及菌丝致病力鉴定将消毒菌核接种在PDA 培养基上,25℃恒温培养2~3d 后,菌核附近可见白色菌丝生成,3~4d 后菌丝扩散至培养皿60%~75%,培养6~7d,培养基边缘可见小颗粒菌核生成(图1)。取培养3~4d 的PDA 培养基边缘菌丝块,接种在基本培养基上培养4~5d 后,取基本培养基边缘菌丝块接种在叶片背面的叶脉两侧,24h可见褐色坏死组织(图2),48h 叶面出现大面积坏死组织(图3),致病力较强。
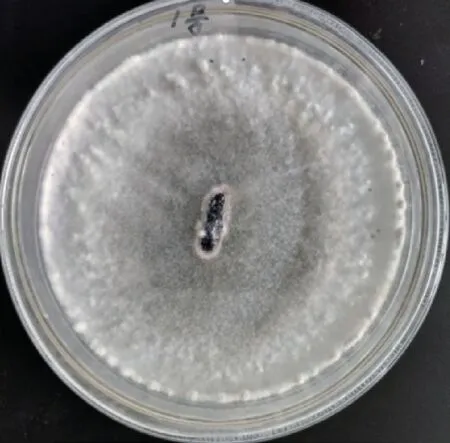
图1 核盘菌菌核在PDA 培养基培养7d 生长情况

图2 向日葵叶片接种PDA 菌丝块24h 的生长状况

图3 向日葵叶片接种PDA 菌丝块48h 的生长状况
2.2 不同向日葵品系对菌核病抗性的室内鉴定以向日葵品系对菌核病抗性水平的划分标准为依据,将供试的38 个品系进行离体叶片室内鉴定,结果见表4。在所有供试材料中,自交系A35×B35(图4)对菌核病表现出一定的抗病性,自交系A4×B4(图5)对菌核病表现出一定的耐病性,其余品系均表现出不同程度的感病性,且未发现对菌核病产生免疫的向日葵品系。

图4 自交系A35×B35 接种菌丝块48h 的生长状况

图5 自交系A4×B4 接种菌丝块48h 的生长状况
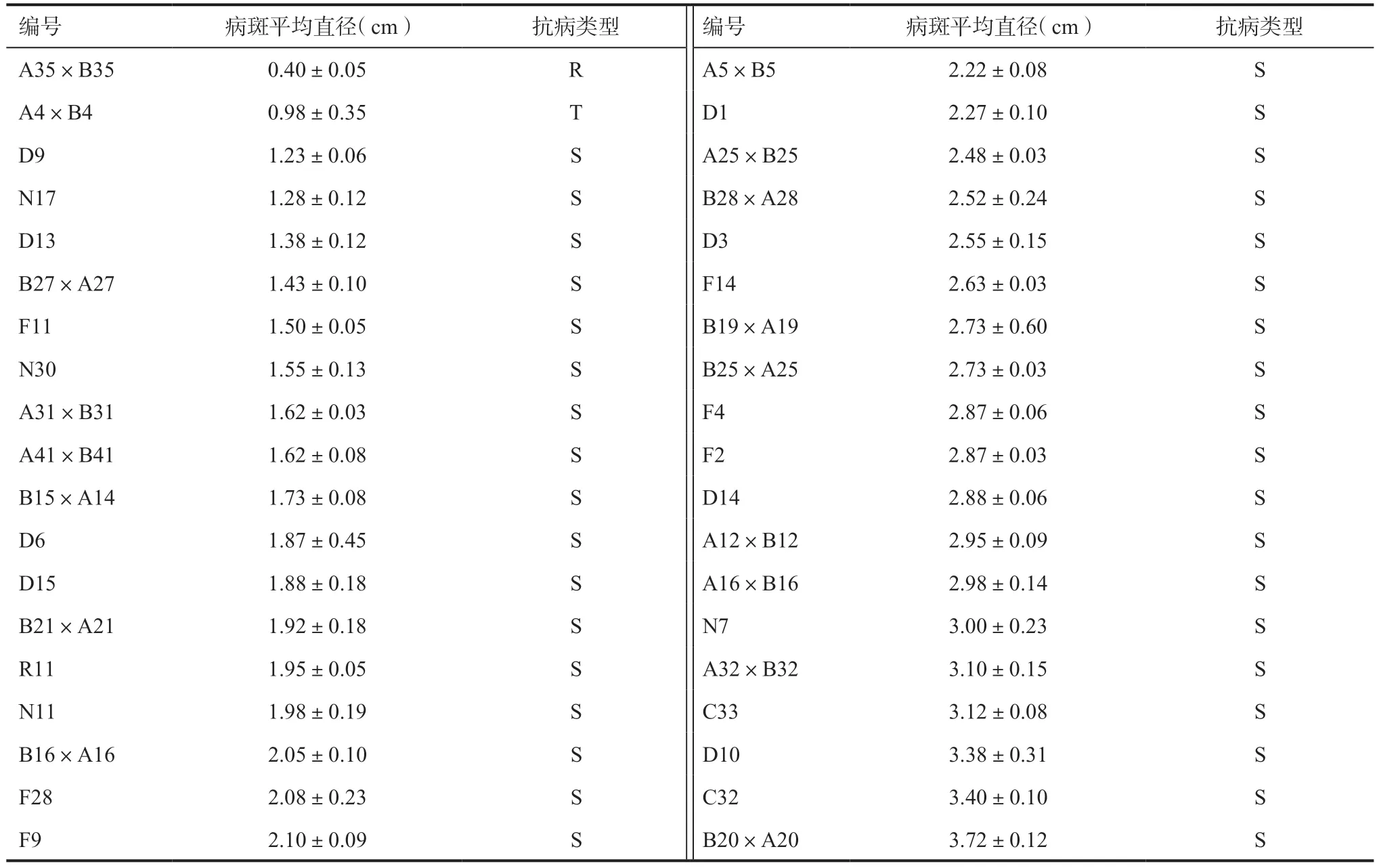
表4 不同向日葵品系对菌核病抗性的室内鉴定结果
2.3 不同向日葵品系对菌核病抗性的田间鉴定以向日葵抗菌核病病情分级标准及抗性评价标准为依据,将供试的38 个向日葵品系进行田间菌丝体悬浮液喷施鉴定,结果见表5。在所有供试材料中,A35×B35 与A4×B4 对菌核病表现出一定的抗病性,且A35×B35 向日葵花盘正面(图6)发现有菌落生成,但背面(图7)未出现盘腐症状,说明该材料对菌核病有一定的抵抗力,虽然核盘菌对向日葵进行了侵染并形成菌落,但未侵入植株内部。D9 与N17 对菌核病也表现出一定的抗性,达到中抗水平,其余材料均表现出不同程度的感病性,如N7 花盘背面已经出现腐烂情况,且侵染面积已经超过75%(图8),C32 花盘已严重腐烂并脱落(图9),在脱落处可见新生成的核盘菌菌核。

图6 自交系A35×B35 接种PDA 悬浮液30d 的生长状况

图7 自交系A35×B35 接种PDA 悬浮液30d 的生长状况

图8 自交系N7 接种PDA 悬浮液30d 的生长状况

图9 不育系C32 接种PDA 悬浮液30d 的生长状况
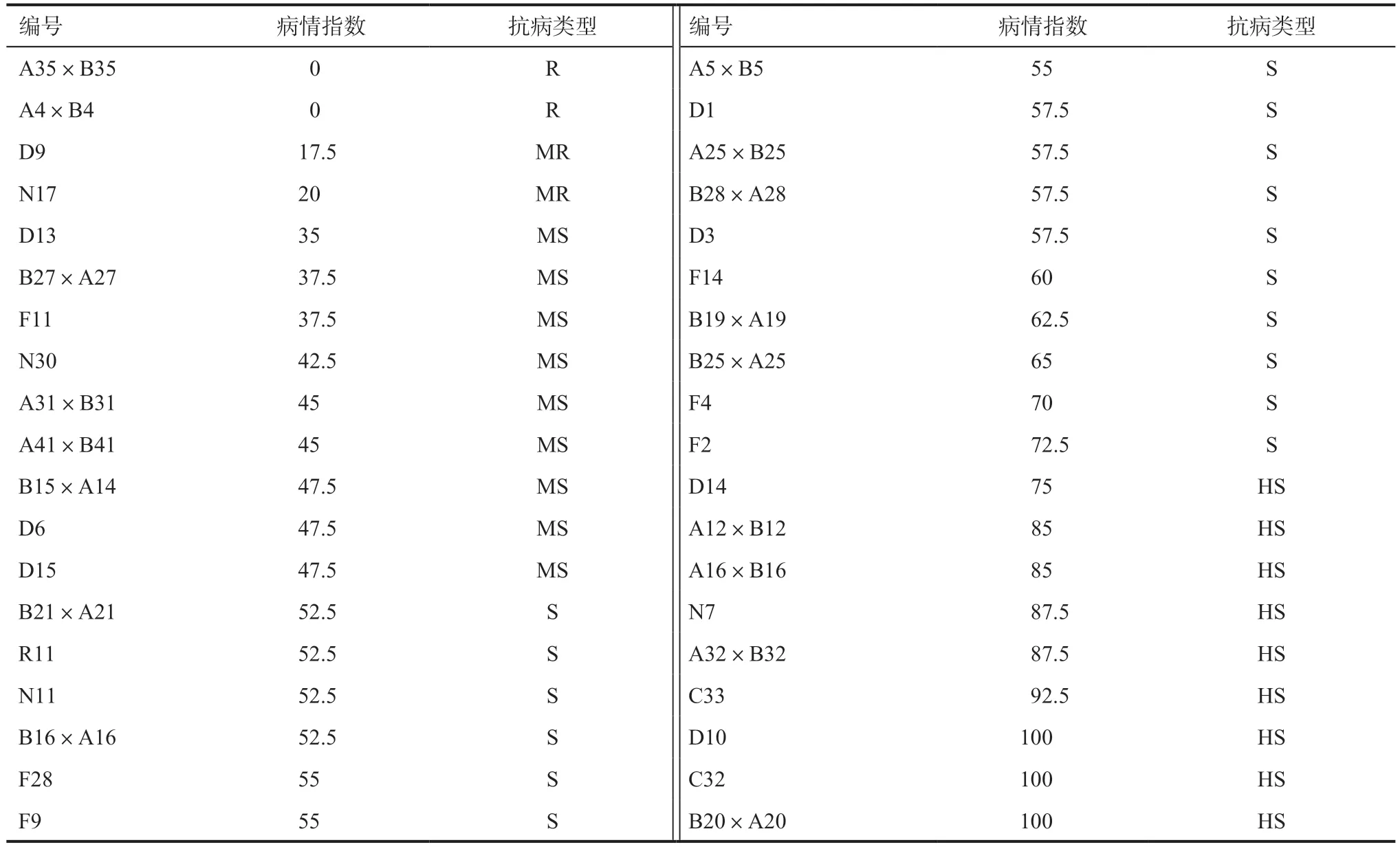
表5 不同向日葵品系对菌核病抗性的田间鉴定结果
通过室内离体叶片鉴定与室外PDA 菌丝悬浮液喷施鉴定试验,综合病情指数与叶片病斑平均直径2 项指标,得出试验结果如下:A35×B35(品系07(Y)-136A)在两种鉴定方法下,均表现出一定的抗性,其为抗菌核病品系;A4×B4(品系07(Y)-141A)经室外鉴定,结果为抗性材料,但经离体叶片鉴定试验,结果为耐性材料,综合得出,该品系为耐菌核病材料;通过本试验,筛选获得抗菌核病材料A35×B35(品系07(Y)-136A)1 个,A4×B4(品系07(Y)-141A)、D9(品系11(CX)-1)、N17(品系15(HN)-34)耐病材料3 个,D13 等中感材料9 个,B21×A21 等感病材料16 个,D14 等高感材料9 个。
3 结论与讨论
在向日葵生长过程中,均存在因感染菌核病导致大面积减产的现象,尤其是北方向日葵开花期到成熟期正逢雨季,连续降水会加重菌核病现象的发生,严重影响向日葵的生产效益与经济效益。因此,选育向日葵品种不仅要注重品质与产量,还应当注重对菌核病的抵抗力。
核盘菌菌核致病力的强弱会随着实验室继代培养次数的增加呈减弱趋势,为保证核盘菌致病力,本试验通过采集上一年度新生菌核并进行纯化,用于菌核病抗性鉴定。而在常规大田喷施套袋保湿进行菌核病鉴定的试验中,由于多雨湿度大等自然因素,会加重菌核病的发生,从而对品种抗菌核病鉴定造成影响,故而本试验结合室内离体叶片鉴定,综合判断品种抗(耐)菌核病能力强弱,一定程度上可降低误差。本试验通过对38 个不同向日葵品系进行综合鉴定,共发现抗菌核病材料1个,耐病材料3个,感病材料25 个,高感材料9 个,为实现向日葵抗菌核病的育种目标奠定了基础。
