米口袋染色体制片技术优化及其核型分析
2023-12-25李玉萍欧香苗淑杏朱士农
李玉萍 欧香 苗淑杏 朱士农

李玉萍,歐香,苗淑杏,等.米口袋染色体制片技术优化及其核型分析[J].福建农业科技,2023,54(8):40-44
摘 要:以米口袋根尖为供试材料,用常规压片法探讨不同预处理方法和预处理时间对染色体制片的影响,优化染色体制片技术,并对其进行染色体核型分析,旨在为米口袋的分类、种质资源保存和利用及育种提供细胞学依据。结果表明:(1)当预处理时间为3 h时,0.1%秋水仙素溶液预处理效果最好;当预处理时间为6 h时,0.01%秋水仙素溶液预处理效果最好。得到的分裂相多,染色体浓缩程度适宜,分散性较好,形态清晰;(2)米口袋体细胞染色体数目为2n=2x=14,为二倍体植物。核型公式K(2n)=2x=14=10m+4sm,具中部着丝点染色体(m)的为第1、2、3、4、7对染色体,具近中部着丝点染色体(sm)的为第4、5对染色体。染色体相对长度组成为2n=14=2L+8M2+ 4M1,染色体长度比1.30,没有臂比大于2的染色体,属“1A”类型,为对称型核型,说明米口袋在进化上属于比较原始的类型。
关键词:米口袋;染色体;核型分析;制片技术
中图分类号:R 284.2 文献标志码:A 文章编号:0253-2301(2023)08-0040-05
DOI:10.13651/j.cnki.fjnykj.2023.08.006
Optimization of the Chromosome Production Technology of Gueldenstaedtia vernaand Its Karyotype Analysis
LI Yu-ping, OU Xiang, MIAO Shu-xing, ZHU Shi-nong*
(College of Horticulture & Landscape, Jinling Institute of Technology, Nanjing, Jiangsu 210038, China)
Abstract:The effects of different pretreatment methods and pretreatment time on the chromosome production were explored by using the conventional tabletting method with Gueldenstaedtia verna as the tested material, in order to optimize the chromosome production technology. And the chromosome karyotype analysis was carried out to provide the cytological basis for the classification of Gueldenstaedtia verna, the preservation & utilization of germplasm resources and its breeding. The results showed that: (1) When the pretreatment time was 3 h, the pretreatment effect of 0.1% colchicine solution was the best, while when the pretreatment time was 6 h, the pretreatment effect of 0.01% colchicine solution was the best. There were many division phases, the degree of chromosome condensation was suitable, the dispersion was better, and the morphology was clear. (2) The chromosome number of somatic cells of Gueldenstaedtia verna was 2n=2x=14, which was a diploid plant. The karyotype formula was K(2n)=2x=14=10m+4sm. The chromosomes with the metacentric chromosome (m) were the 1st, 2nd, 3rd, 4th and 7th pairs of chromosomes, and the chromosomes with the submetacentric chromosome (sm) were the 4th and 5th pairs of chromosomes. The composition of the relative length of chromosome was 2n=14=2L+8M2+4M1, the length ratio of chromosome was 1.30, and there were no chromosomes with the arm ratios greater than 2, which belonged to the ″1A″ type and was a symmetrical karyotype, indicating that the Gueldenstaedtia verna was a relatively original type in the evolution.
Key words:Gueldenstaedtia verna; Chromosome; Karyotype analysis; Production technology
米口袋Gueldenstaedtia verna(Georgi)Boriss.又名米布袋、地丁、大米口袋,为豆科Leguminosae米口袋属Gueldenstaedtia多年生草本植物。米口袋属植物约有20种,分布于中亚和亚洲东部,中国有15种,主要分布在东北、华东、华北、陕西中南部、甘肃东部等地区。米口袋植株矮小,全株被白色长柔毛;分茎极缩短,叶和总花梗丛生其上;单数羽状复叶,小叶呈椭圆形或长圆形,灰绿色;伞形花序有2~6朵花,花冠蝶形,紫色。荚果圆筒状,棕色;种子多数,三角状肾形,小如米粒,因此得名。花期4月,果期5月至6月。米口袋全草及根可入药,能清热解毒、消肿散结;地上部分可食用,营养价值高于白菜等蔬菜,有重要的开发利用价值。米口袋喜冷凉湿润的气候,耐寒、耐旱、耐贫瘠,具有较强的抗性。目前对米口袋属植物的研究主要集中在种名考证及其分布、化学成分的种类和含量及其药理作用、生态习性及园林应用、电镜扫描花粉形态观察等方面,有关染色体的核型分析却是鲜有报道,而核型分析可为植物区系起源和进化提供重要依据,同时有利于探索植物系统发育过程中属种之间的亲缘和进化关系。本试验拟从细胞学水平出发,采用染色体常规压片技术对江苏省南京市野生米口袋进行核型分析,以期为我国米口袋属植物的分类及种间亲缘关系、种质资源鉴定提供细胞遗传学基础和依据。
1 材料与方法
1.1 试验材料
以金陵科技学院幕府校区绿地野生的米口袋种子为试验材料,于2020年6月至7月间采摘自然成熟的种子在通风的实验室内阴干,然后贮藏在4℃的冰箱中备用。
1.2 试验方法
1.2.1 根尖培养 2020年12月选取成熟饱满的米口袋种子,用水浸泡44 h(每隔8 h换1次水),使其充分吸水,然后将种子转入平铺有滤纸的培养皿中,加入适量清水,盖上皿盖后置于25℃的恒温箱内,每天浇水以保持种子正常的生命活动。待根长至1~2 cm时,于上午9:0~10:00剪取根尖0.5~1.0 cm。
1.2.2 预处理及固定 剪取的根尖,用蒸餾水清洗干净,吸水纸吸去水分,置于小玻璃瓶中,然后向瓶中滴加适量预处理液。预处理液分别为:0.001mol·L 8-羟基喹啉、0.002 mol·L 8-羟基喹啉、0.01% 秋水仙素和0.1% 秋水仙素。然后于4℃冰箱分别处理3 h和6 h。以不做任何预处理直接在4℃冰箱固定做对照。将经过预处理的根尖,用蒸馏水清洗3~4次,用卡诺固定液在4℃冰箱中固定24 h,然后用蒸馏水清洗3~4次后转入70%酒精中,于4℃冰箱中保存备用。
1.2.3 解离与染色 将冰箱内保存的根尖用蒸馏水清洗3~4次,用1 mol·L的HCl在60℃的恒温水浴锅中解离8 min。将解离后的根尖用蒸馏水清洗3~4次,置于干净的载玻片上,滴加1~2滴卡宝品红溶液,染色2 min。
1.2.4 压片与镜检 盖上盖玻片,然后用滤纸包住玻片吸取多余染色液,用大拇指在上面施加少量压力,勿使盖玻片移动,用铅笔轻敲,使细胞舒展,染色体散开。用Nikon DS-Ri2光学显微镜进行镜检。
1.2.5 数据分析 参照李懋学等植物核型分析的标准,染色体数目以体细胞染色体数目为主,要求统计的细胞数目在30个以上,其中85%以上的细胞具有恒定一致的染色体数,即可认为是该植物的染色体数目。因此,本试验选取50个染色体分散良好、收缩适宜的中期分裂相细胞进行观察和分析,统计各个细胞染色体数目,从而得出米口袋染色体数目。选择5个染色体分散良好、收缩适宜且形态清晰的中期分裂相细胞,分别测量各个细胞的染色体长臂长度、短臂长度及染色体总长度,并取其平均值。
以测量和计算得到的各项参数为基础,利用Adobe Photoshop 6.0图像处理软件对染色体进行复制剪贴、排列和同源染色体配对等分析,并将配对好的同源染色体按从长到短的顺序依次从左往右排列,并依次命名。染色体类型采用Levan、孙浩男等的方法,核型不对称性按Stebbins的分类标准。
2 结果与分析
2.1 米口袋染色体制片的优化
由图1、表1可知,不同预处理方法及预处理时间,米口袋根尖染色体制片的效果不同。当预处理时间为3 h时,0.1%秋水仙素溶液预处理效果最好,得到的分裂相多,染色体浓缩程度适宜,分散性较好,形态清晰;当预处理时间为6 h时,0.01%秋水仙素溶液预处理效果最好,得到的分裂相多,染色体浓缩程度适宜,分散性较好,形态清晰。
2.2 米口袋染色体核型分析
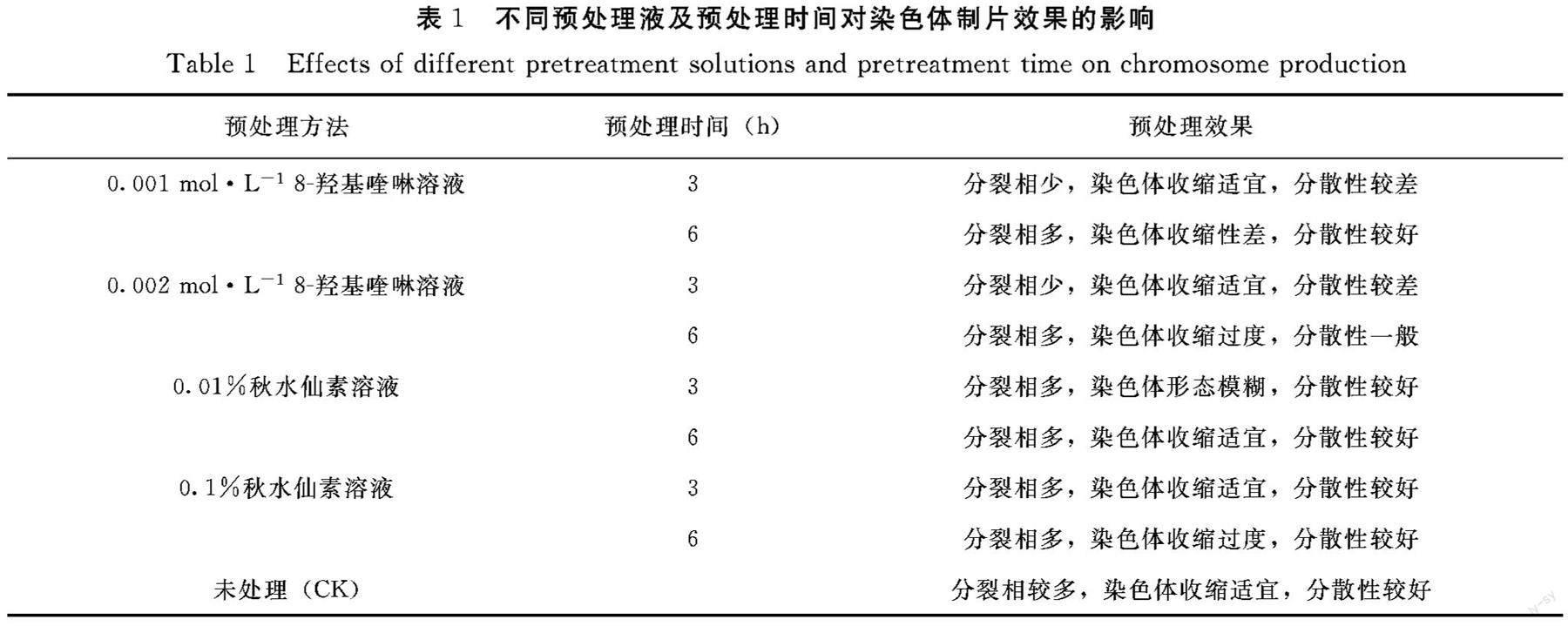
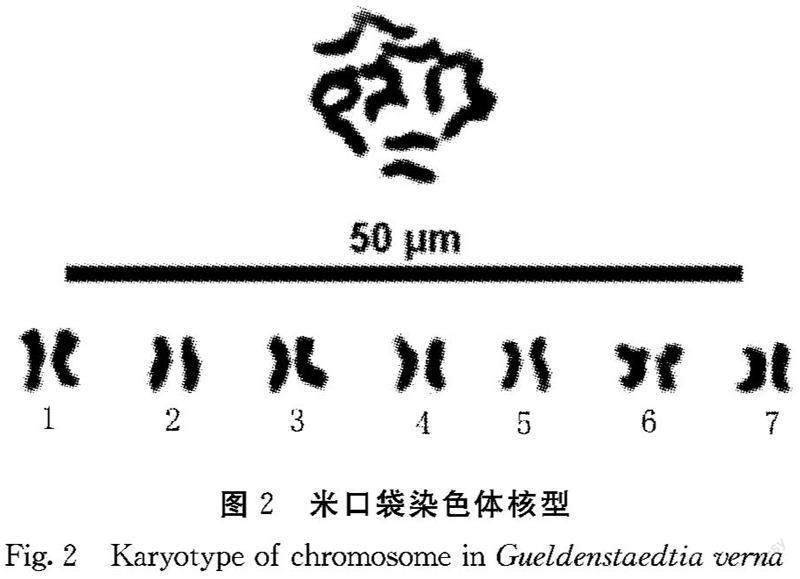
2.2.1 染色体数目 选取米口袋根尖分生组织细胞分裂相中染色体分散较好的细胞50个观察并统计,结果显示:米口袋染色体数目在12~16条,其中有44个细胞染色体数目为14条,占计数细胞的90%,4个细胞染色体为12条,占计数细胞的8%,2个细胞染色体为16条,占计数细胞的4%。根据李懋学等的标准,确定米口袋体细胞染色体数目为2n=14(图2)。
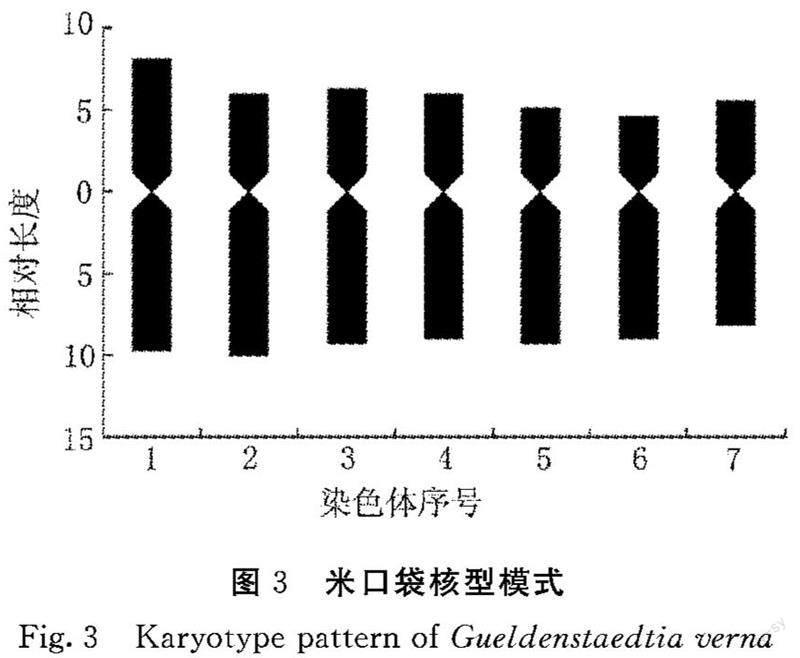
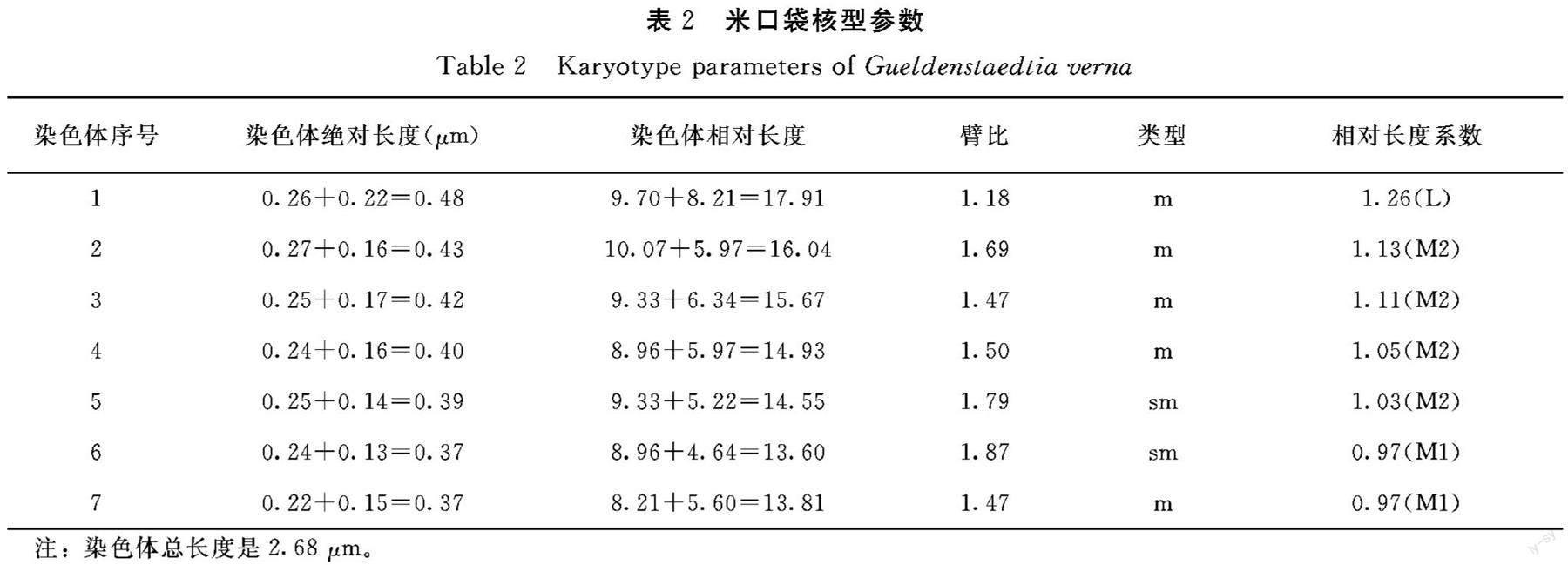
2.2.2 染色体形态 根据图2、图3和表2可知,米口袋体细胞染色体数目为2n=14,共7对染色体,为二倍体植物。米口袋核型公式为K(2n)=2x=14=10m+4sm,具中部着丝点染色体(m)的为第1、2、3、4、7对染色体,具近中部着丝点染色体(sm)的为第4、5对染色体。最长染色体为0.48 μm,最短染色体为0.37 μm,染色体长度变化在0.48~0.37 μm,最长染色体是最短染色体的1.30倍。相對长度变异范围为13.60~17.91,染色体相对长度组成为2n=14=2L+8M2+4M1。染色体长度比1.30,没有臂比大于2的染色体,属“1A”类型,核型对称性明显。
3 结论与讨论
本试验从优化染色体制片技术幵始,探索米口袋染色体核型特征,为该属植物及该区域植物的研究提供细胞学依据。植物染色体核型研究的首要环节是染色体制片技术,因而制片技术的好坏直接影响核型分析的成功与否。良好的染色体制片受多种因素影响,其中合适的预处理液及其浓度和处理时间是制片的关键,对染色体制片的质量至关重要。预处理效果好,不仅可以获得较多的处于中期分裂相的染色体,而且可以使染色体分散开,有助于核型分析。因此,在试验过程中应该特别注意预处理的方法。本研究结果显示当预处理时间为3 h时,0.1%秋水仙素溶液预处理效果最好;当预处理时间为6 h时,0.01%秋水仙素溶液预处理效果最好。得到的中期分裂相多,染色体浓缩程度适宜,分散性较好,形态结构清晰,有助于米口袋染色体核型分析。
染色体核型对细胞遗传学和细胞分类学具有重要的意义,为植物分类及种间亲缘关系、种质资源鉴定提供细胞遗传学基础和依据。本研究从细胞学水平出发,采用染色体常规压片技术对江苏省南京市野生米口袋进行核型分析。结果表明,米口袋的染色体数目为14条,与杨德奎的研究结果一致。但米口袋染色体核型公式及染色体相对长度组成有别于本研究结果,杨德奎的研究结果显示,米口袋核型公式为K(2n)=2x=14=14m,染色体相对长度组成为2n=14=6M2+8M1;而本试验的研究表明,米口袋核型公式为K(2n)=2x=14=10m+4sm,染色体相对长度组成为2n=14=2L+8M2+4M1,造成这种差异的原因可能是试验材料来源不同。本研究表明米口袋属“1A”类型,核型对称性明显,说明其进化程度较低。
参考文献:
[1]史美荣.响应面法优化米口袋总黄酮的超声提取工艺[J].中国农业通报, 2017,33(23):129.
[2]陈立,王军宪,栗燕,等.米口袋属植物研究概况[J].陕西中医,2001,22(3):184,184-185.
[3]中国科学院《中国植物志》编委会.中国植物志[M].北京:科学出版社,1998,42(2):150.
[4]李惠侠.徐州市银山春季野生花卉调查与应用[J].现代园艺,2017(12):128.
[5]赵永光,常丽新,腾兰稳,等.碣石山区常见野菜营养成分分析及营养价值评价[J].安徽农业科学,2008,36(10):4048.
[6]韦群辉,邹海舰,钱子刚,等.川滇米口袋和白花米口袋的生药研究[J].中草药,1999(3):216-219.
[7]黄海兰,徐波.米口袋清除自由基活性及其成分研究[J].青岛大学学报(自然科学版),2006(4):30-35.
[8]杨德奎.山东米口袋属花粉形态的研究[J].山东科学,2002(1):17-19.
[9]李懋学,陈瑞阳.关于植物核型分析的标准化问题[J].武汉植物学研究,1985,3(4): 297-302.
[10]邓果特.中国芒属植物染色体核型与倍性研究[D].长沙:湖南农业大学,2012.
[11]LEVAN A,FREDGA K,SANDBERG A A.Nomenclature for centromeric position on chromosomes[J].Hereditas Band,1964,52:197-202.
[12]孙浩男,郑妍,李明阳,等.10种月见草属植物染色体核型分析[J].西北林学院学报,2022,37(2):133-139.
[13]STEBBINS C L.Chromosomal evolution in higher plants[M].London:Edard Arnord LTD,1971:87-89.
[14]韩杰,孔德仪,彭方仁.薄壳山核桃染色体制片技术的优化与核型分析[J].分子植物育种,2018,16(16):5240-5246.
[15]刘鹏,马利超,王宇,等.16种野豌豆属植物花粉形态的扫描电镜观察[J].草业学报,2015,24(1):107-114.
[16]刘栋,苗红梅,马琴,等.野亚麻(L.stelleroides Planch.)的染色体核型分析[J].种子,2020,39(10):32-35,41.
[17]雷文英,赵丽丽,简忠领,等.白刺花染色体压片技术优化及核型分析[J].种子,2017,36(8):5-9.
[18]杨德奎.山东米口袋属植物的核型分析[J].广西植物,2002,22(4):349-35.
(责任编辑:柯文辉)
收稿日期:2023-07-20
作者简介:李玉萍,女,1976年生,博士,副教授,主要从事园林植物遗传育种和应用研究。
*通信作者:朱士农,男,1963年生,博士,教授,主要从事园艺植物栽培、新品种选育的研究(E-mail:zsn@ jit.edu.cn)。
基金项目:南京市绿化园林局科技项目(YLKJ202111JH)。
