CXCR4-3’-UTR 双荧光素酶报告基因载体的构建及与microRNA-494 的靶向作用
2023-12-23林海霞舒丹桦
林海霞,舒丹桦
肾脏纤维化被认为是导致慢性肾脏疾病和终末期肾功能衰竭的常见途径。CXCR4 在慢性肾脏疾病,如特发性膜性肾病、糖尿病肾病、狼疮性肾炎等疾病进展中起着重要的作用,它主要存在于肾小管细胞尤其是近端肾小管细胞中[1-3]。CXCR4 在介导肾小管上皮细胞损伤和肾脏纤维化中起着重要的作用,其可通过JAK/STAT/GSK3 信号通路激活-catenin,促进肾脏纤维化;因此,靶向抑制CXCR4表达,以及抑制多条下游信号通路,可延缓慢性肾病肾纤维化的进展[4]。miRNA 属于一类内源性小的非编码RNA,长度通常为19 ~22 个核苷酸,通过翻译抑制mRNA 在转录后水平调节基因的表达[5]。它们是肾脏形态发生变化的关键调节因子,miRNA表达的失调参与多种肾脏疾病的发病机制,miRNA控制肾脏祖细胞的存活和凋亡之间的平衡[6],除外肾脏发育过程中的需求外,miRNA还参与调节成熟肾单位的许多生物过程[7]。前期研究[8]使用茎环实时荧光定量PCR(RT- qPCR)检测到大鼠肾间质成纤维细胞(NRK-49F)在转化生长因子1(TGF- 1)3 ng/ml 刺激下microRNA-494(miR-494)表达升高,并且胶原蛋白I(Col I)、纤维连接蛋白(FN)mRNA 表达显著升高,表明miR-494 可能参与调控并促进TGF- 1 诱导肾间质成纤维细胞的细胞外基质分泌。本研究运用Pathway 和Gene Ontology(GO)预测miR-494 的靶基因,为临床防治肾间质纤维化提供新的靶点,报道如下。
1 资料与方法
1.1 材料 胎牛血清购自美国Gibico公司,DMEM/F12 培养基购自美国Gibico公司,脂质体2000 购自美国Invitrogen 公司,蛋白电泳转移系统购自美国Bio-Rad 公司,DuaL-Glo Luciferase Assay System 荧光检测试剂盒购自美国Promega 公司,荧光素酶报告基因pMIR 购自美国Abcam 公司,荧光素酶报告基因pRLSV40 购自美国Promega 公司。
1.2 方法
1.2.1 生物信息学分析运用 Pathway 和GO 预测miR-494 的靶基因,并预测CXCR4 mRNA 3’-UTR与miR-494 的结合位点,应用Prime Primer 5.0 软件设计CXCR4 基因引物。
1.2.2 野生型目的基因(wt)合成 PCR 扩增体系:GoTaq Mix 20l,模板DNA 4l,CXCR4-wt-3’-UTR-F 1.2l,CXCR4-wt-3’-UTR-R 1.2l,灭菌双蒸水13.6l,总体积40l。95 ℃预变性2 min,95 ℃变性1 min,58 ℃复性30 s,72 ℃延伸1 min,扩增35 个循环,72 ℃最后延伸5 min,扩增片段长度为280 bp。取5l PCR 产物于2%琼脂糖凝胶中,在100 V 电压下电泳,紫外灯下观察结果。使用PCR纯化试剂盒对剩余PCR 产物进行纯化。
1.2.3 突变型目的基因(mut)合成 依据预测的结合位点碱基序列,随机改变其中5 个碱基片段,合成两段长42 ~46 bp 的互补DNA 单链CXCR4-mut-3’-UTR-F、CXCR4-mut-3’-UTR-R(表1),分别用DEPC水配置成100mol/L的工作液,反应体系:5×退火 Buffer 10l,CXCR4-mut-3’-UTR-F 8l,CXCR4-mut-3’-UTR-R 8l,灭菌双蒸水24l,总体积50l。95 ℃条件下5 min,冷却1 h。产物为5’端带有Spe I 酶切位点、3’端带有Pme I 酶切位点的双链DNA片段,长度为46bp。并用PCR纯化试剂盒纯化。
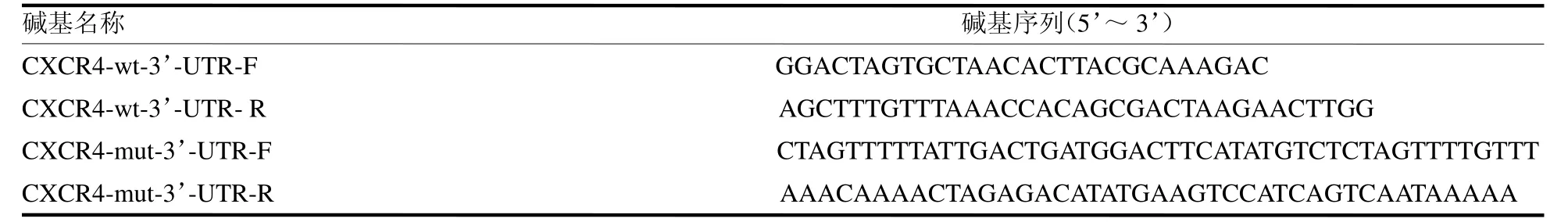
表1 双荧光素酶报告基因载体引物序列
1.2.4 目的片段的克隆 纯化的DNA 目的片段(CXCR4-wt/mut)与pMCm-T 连接。连接体系:pMCm-T载体1l,目的基因纯化产物4l,10×Ligation Buffer 1l,50% PEG 1l,灭菌双蒸水2l,T4 DNA Ligase 1l,总反应体系10l。16 ℃连接2 h。连接产物转化感受态细菌DH5(转化流程:取200l DH5 感受态细胞冰上静置至融化后加入上述连接载体并轻弹混匀→冰上静置30min→42℃水浴90s→再次冰上静置5 min→加入500l 不含抗生素的LB培养基,37 ℃、250 r/min、摇菌1 h)后,取50l 菌液接种于表面涂布含有20l 100 mmol/L IPTG 和100l 20 mg/ml X-gal 的Amp+LB 平板(37 ℃预热1 h),倒置于37 ℃细菌培养箱过夜,进行蓝白斑筛选。次日,挑取数个蓝色的单克隆菌落置于3 ml LB 培养基中37 ℃250 r/min摇菌过夜,并按质粒小抽试剂盒说明书提取质粒,按顺序对各个质粒进行编号。
1.2.6 CXCR4 基因3’UTR端荧光素酶报告基因的构建及鉴定 分别对pMCm-T-CXCR4-wt/mut 载体和pMIR载体进行双酶切,酶切体系为pMIR/pMCm-T-CXCR4-wt/mut 4l,SpeI 限制性内切酶0.5l,PmeI 限制性内切酶0.5l,10×Buffer 2l,灭菌蒸馏水13l,总反应体系20l。在37 ℃水浴中进行酶切3 h。完成后于1.5%琼脂糖凝胶中电泳分离酶切产物,在紫外灯下切下含有目的DNA 的琼脂糖凝胶,AXYGEN胶回收试剂盒回收目的片段。T4 DNA连接酶连接经双酶切后的pMIR 载体和CXCR4 3’UTR-wt/mut 片段,连接体系:CXCR4 3’UTR-wt/mut 片段10l,pMIR 载体2l,T4 DNA 连接酶1l,10×Buffer 2l,灭菌蒸馏水5l,置PCR 仪中16 ℃连接16 h,转化感受态细胞DH5 ,接种于Amp+LB培养板。挑取数个菌落进行菌落小摇、质粒抽提、双酶切鉴定,酶切鉴定阳性质粒进行测序,测序过程由上海桑尼生物科技有限公司完成,组载体命名为pMIR-CXCR4-wt/mut。
1.2.7 双荧光素酶活性检测 将NRK49F细胞均匀种于24 孔细胞培养板中(5 万细胞/孔),用含10%胎牛血清的DMEM/F12 培养液静置培养,待细胞贴壁生长至30%~40%,分别用脂质体2 000 瞬时转染NRK49F 细胞。共分4 组:pMIR-CXCR4-3’-UTRwt +miR-494 mimics 组、pMIR-CXCR4-3’-UTR-wt+阴性对照组(NC)组、pMIR-CXCR4-3’-UTR-mut +miR-494 mimics 组、miR-494 组+NC 组。重组载体、pRLSV40 内参质粒、miR-494 mimics 及NC 共转染NRK-49F 细胞48 h 后,分别检测海肾荧光素酶和萤火虫荧光素酶活性,并求出相对荧光素酶活性值。用Promega 公司的Dual-Luciferase Reporter Assay System 试剂盒进行双荧光素酶报告基因检测。从恒温培养箱中取出已转染的NRK-49F 细胞板,留75l原培养基(其余培养基弃去),平衡至室温。向每孔加入75l Dual-Glo®Luciferase Reagent,混匀,孵育10 min,让细胞充分裂解。将裂解液转移至不透光96 孔板,然后在全波长扫描式多功能读数仪中检测萤火虫荧光。每孔中加入75l Dual-Glo®Stop&Glo Reagent,混匀,孵育10 min,测量海肾荧光。以两侧检测结果的比值代表各孔样本的相对荧光强度,实验重复3 次。各实验组以阴性对照组为1,获得mimics 组的相对荧光强度进行统计分析。
1.3 统计方法 采用SPSS17.0 统计软件进行分析,计量资料以均数±标准差表示,两组比较采用独立样本 检验,多组比较采用单因素方差分析。<0.05表示差异有统计学意义。
2 结果
2.1 miR-494 靶基因的预测结果 找到 12 个miR-494 相关的靶基因,并成功预测CXCR4 mRNA 3’-UTR 端与miR-494 的结合位点,见图1。应用Prime Primer 5.0 软件设计构建含Spe I 酶切位点(ACTAGT)及Pme I 酶切位点(GTTTAAAC)的CXCR4基因引物,见表1。

图1 microRNA.org网站预测CXCR4 mRNA与miR-494 的结合位点
2.2 测序结果 经过基因序列比对后发现,野生型和突变型CXCR4 3’-UTR 的基因序列与原序列并未发生改变,说明CXCR4 3’-UTR 双荧光素酶报告载体构建成功,见图2 ~3。
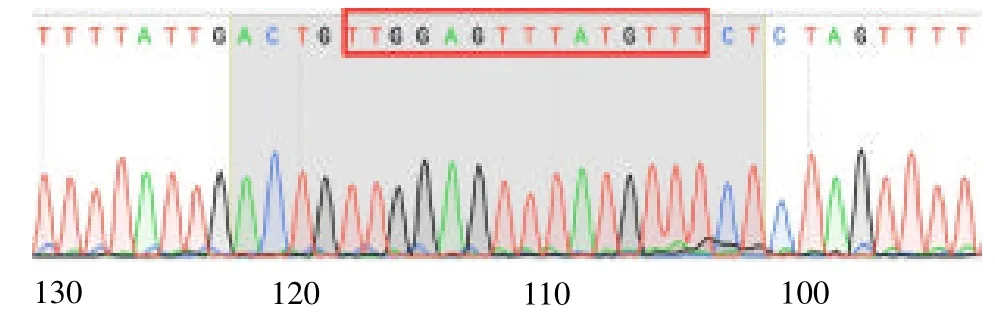
图2 荧光素酶报告载体pT-CXCR4-wt 部分测序图
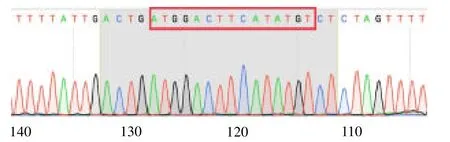
图3 荧光素酶报告载体pT-CXCR4-mut 部分测序图
2.3 双荧光素酶报告基因检测结果 与野生型质粒(pMIR-CXCR4-wt-3’-UTR)+miR-NC 组相比,野生型质粒(pMIR-CXCR4-wt-3’-UTR)+miR-494 mimics 组荧光素酶的相对表达量降低了约52%,差异有统计学意义(=9.638<0.05);突变型质粒(pMIRCXCR4-mut-3’-UTR)+ miR-NC 组与突变型质粒(pMIR-CXCR4-mut-3’-UTR)+ miR-494 mimics 组的荧光素酶的相对表达量差异无统计学意义(=0.104,<0.05),见表2。

表2 CXCR4 萤火虫荧光素酶/海肾荧光素酶活性比值
3 讨论
肾脏纤维化的特征是细胞外基质、肌成纤维细胞和炎症细胞的过度和持续积累,导致肾功能的进行性丧失[9]。许多趋化因子可以诱导上皮细胞间充质转分化的发生,其中CXCL12/CXCR4 在各种细胞和组织中广泛表达,参与成纤维细胞的激活、增殖、迁移及细胞外基质的分泌[10-12],CXCL12/CXCR4 的生物轴在多种器官纤维化中起着重要作用,因此,它们是非常具有前途的抗纤维化治疗靶点[13]。在单侧输尿管结扎模型中,肾小管细胞中的CXCR4 基因和蛋白水平显著上调,导致血小板衍生生长因子- 、TGF-1 mRNA 表达增加,提示TGF-1 的增加与肾脏纤维化有关,而抑制CXCR4 的表达可减轻肾纤维化[14]。Tang 等[15]也证明了CXCL12/CXCR4 可通过Wnt途径,使得-SMA表达增加,e-钙黏蛋白表达减少,从而诱导肾小管上皮细胞的上皮间质转化(EMT),而促进肾纤维化。
miR-494 模拟物可抑制乳腺癌细胞中CXCR4蛋白的表达水平,通过抑制Wnt/ -catenin途径,抑制细胞增殖和侵袭;而miR-494 抑制物则增强CXCR4蛋白的表达水平,促进细胞增殖和浸润,CXCL12/CXCR4是预防乳腺癌转移和进展的潜在治疗靶点[16]。miR-494-3p 的过度表达还可能通过调控CXCR4 mRNA,从而在前列腺癌中发挥作用[17-18]。
本研究通过生物信息学的相关方法和有关靶点的预测软件,成功筛选出了miR-494的靶基因CXCR4及结合位点,并且成功构建CXCR4 3’-UTR 的双荧光素酶报告基因载体,并验证miR-494 和CXCR4 之间存在靶向关系。另外在双荧光素酶报告基因的实验中发现miR-494 可以降低野生型CXCR4-3’-UTR的双荧光素酶活性,但是对于突变型CXCR4-3’-UTR的双荧光素酶活性则没有抑制作用。本研究确定了miR-494 同CXCR4 基因的靶向调控关系,为进一步研究其在肾间质纤维化机制中的作用奠定了基础。
利益冲突 所有作者声明无利益冲突
作者贡献声明 林海霞:实验设计、研究实施、数据采集、数据分析/解释、撰写文章;舒丹桦:研究实施、数据采集
