鼠神经生长因子联合rTMS治疗帕金森病的疗效观察
2023-12-23王磊黄廷张真
王磊 黄廷 张真
帕金森病(Parkinson's disease,PD)是一种神经退行性疾病。资料显示,PD 发病率在65 岁以上人群中高达1.7%;其主要病理改变为中枢系统黑质致密部多巴胺能神经元进行性丢失,患者同时产生运动和非运动症状[1]。目前研究普遍认为PD是神经系统退化、遗传以及环境因素共同作用的结果[2]。多巴胺能药物是临床治疗PD 的主要药物,但对于合并步态障碍的PD 患者其疗效欠佳。近年来,重复经颅磁刺激(repetitive transcranial magnetic stimulation,rTMS)作为对PD 患者尤其是合并冻结步态者具有积极的治疗效果[3]。本研究旨在观察使用鼠神经生长因子联合rTMS 治疗PD患者的临床效果。
1 资料与方法
1.1 一般资料
选取2019 年9 月至2022 年9 月枣阳市第一人民医院收治的PD 患者92 例。入选标准:①符合《中国帕金森病治疗指南(第三版)》中PD 诊断标准[4];②年龄18~80 岁;③神经功能评估中观察到有冻结步态;④H-Y 分期≤4 级;⑤病程不超过5年;⑥研究取得患者或家属知情同意。排除标准:①既往癫痫发作史;②植入心脏起搏器或其他金属;③既往颅内手术史;④合并骨关节病、肌肉功能障碍及等其他影响运动功能的疾病;⑤存在严重认知功能障碍。以随机数字表法分为对照组(n=46)与观察组(n=46)。对照组中,女18 例,男28 例;年龄(64.78±8.24)岁;病程(6.32±1.84)年。观察组中,女20 例,男26 例;年龄(65.20±7.93)岁;病程(6.50±1.56)年。两组性别、年龄、病程等一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会批准通过。
1.2 方法
两组患者在原有抗PD 治疗基础上均给予鼠神经生长因子(丽珠集团丽珠制药厂,国药准字S20100005,规格:30 μg)肌肉注射治疗,1 次/d。观察组在上述治疗方案基础上联合使用rTMS 治疗,采用Magpro R30 型经颅磁刺激仪(丹麦Tonica公司),刺激位点位于双侧M1-LL 区,刺激强度为110%,刺激频率10 HZ,左右侧各1 000 脉冲,每周治疗5 次。对照组给予伪刺激,刺激参数及时间同研究组,但使用无磁场线圈一侧平面与头皮治疗位点对应。两组均治疗两周。
1.3 观察指标
①统一帕金森病评分量表第Ⅲ部分(UPDRSⅢ)评分:分别于治疗前和治疗1、2 周后采用UPDRS Ⅲ量表评估患者的运动功能,UPDRS Ⅲ评分共包括14 个维度,总分56 分,得分越高表明运动障碍越严重[5]。②简易精神状态检查量表(Mini-Mental state examination,MMSE):分别于治疗前、治疗一周、治疗两周后评定MMSE 评分,共评价定向力(10 分)、记忆力(3 分)、注意力和计算力(5 分)、回忆能力(3 分)、语言能力(9 分),总分30 分[6]。③汉密尔顿焦虑量表(Hamilton anxiety scale,HAMA)、汉密尔顿抑郁量表(Hamilton depression scale,HAMD)评分:分别于治疗前和治疗两周后采用HAMA、HAMD 量表对患者进行评价,量表评分越高表示焦虑、抑郁状态越严重[7]。④冻结步态问卷(freezing of gait-questionnaires,FOGQ):分别于治疗前和治疗两周后使用FOGQ问卷评估,该问卷共6 项,每项0~4 分,总分值0~24分,得分越高表示冻结步态症状越严重[8]。⑤起立-行走计时测验(timed up and go test,TUGT):分别于治疗前和治疗两周后进行TUGT 测试[9],记录患者完成测试的时间,取重复行走两次平均值作为最终结果。⑥神经递质:分别于治疗前和治疗两周后使用ML-2001 型脑电超慢涨落分析仪(北京同仁光电技术公司)测定5-羟色胺(5-hydroxytryptamine,5-HT)、多巴胺(dopamine,DA)水平。
1.4 统计学方法
使用SPSS 20.0 进行统计分析。计量资料符合正态分布以()表示,同组内治疗前后多个时间点比较使用方差分析,两两比较采用配对t检验;两独立组间比较使用t检验。以P<0.05 表示差异有统计学意义。
2 结果
2.1 两组治疗前后UPDRS Ⅲ评分比较
治疗前,两组UPDRS Ⅲ评分比较,差异无统计学意义(P>0.05)。两组治疗一周、两周的UPDRS Ⅲ评分均低于治疗前,差异有统计学意义(P均<0.05);且观察组UPDRS Ⅲ评分低于对照组,差异有统计学意义(P均<0.05)。见表1。
表1 两组治疗前后UPDRS Ⅲ评分比较[(),分]Table 1 Comparison of UPDRS Ⅲscores between the two groups before and after treatment[(),point]

表1 两组治疗前后UPDRS Ⅲ评分比较[(),分]Table 1 Comparison of UPDRS Ⅲscores between the two groups before and after treatment[(),point]
注:与本组治疗前比较,aP<0.05。
2.2 两组治疗前后MMSE 评分比较
治疗前,两组MMSE 评分比较,差异无统计学意义(P>0.05)。两组治疗一周、两周的MMSE 评分均高于治疗前,差异有统计学意义(P均<0.05);且观察组MMSE 评分高于对照组,差异有统计学意义(P均<0.05)。见表2。
表2 两组治疗前后MMSE 评分比较[(),分]Table 2 Comparison of MMSE scores between the two groups before and after treatment[(),point]

表2 两组治疗前后MMSE 评分比较[(),分]Table 2 Comparison of MMSE scores between the two groups before and after treatment[(),point]
注:与本组治疗前比较,aP<0.05。
2.3 两组治疗前后HAMA、HAMD 量表评分比较
治疗前,两组HAMA、HAMD 量表评分比较,差异无统计学意义(P均>0.05)。治疗两周后两组HAMA、HAMD 量表评分均低于治疗前,差异有统计学意义(P均<0.05);且观察组HAMA、HAMD量表评分均低于对照组,差异有统计学意义(P均<0.05)。见表3。
表3 两组治疗前后HAMA、HAMD 量表评分比较[(),分]Table 3 Comparison of HAMA and HAMD scores between the two groups before and after treatment[(),point]
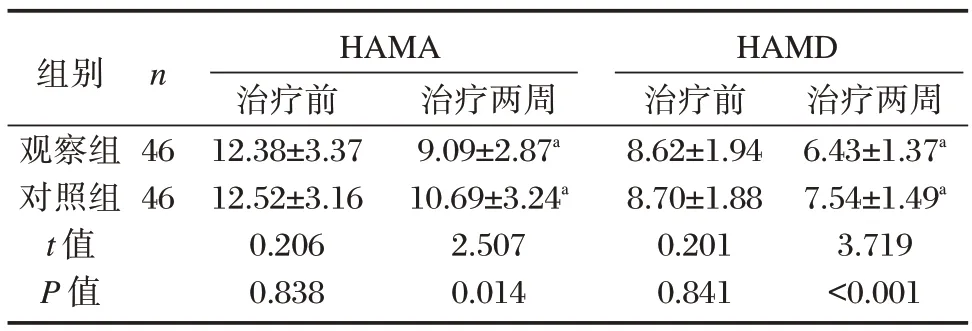
表3 两组治疗前后HAMA、HAMD 量表评分比较[(),分]Table 3 Comparison of HAMA and HAMD scores between the two groups before and after treatment[(),point]
注:与本组治疗前比较,aP<0.05。
2.4 两组治疗前后步态指标比较
治疗前,两组FOGQ 评分、TUGT 测验时间比较,差异无统计学意义(P均>0.05)。治疗两周后两组FOGQ 评分、TUGT 测验时间均低于或短于治疗前,差异有统计学意义(P均<0.05);且观察组FOGQ 评分、TUGT 测验时间均低于或短于对照组,差异有统计学意义(P均<0.05)。见表4。
表4 两组治疗前后FOGQ 评分、TUGT 测验时间比较()Table 4 Comparison of FOGQ scores and TUGT time between the two groups before and after treatment()
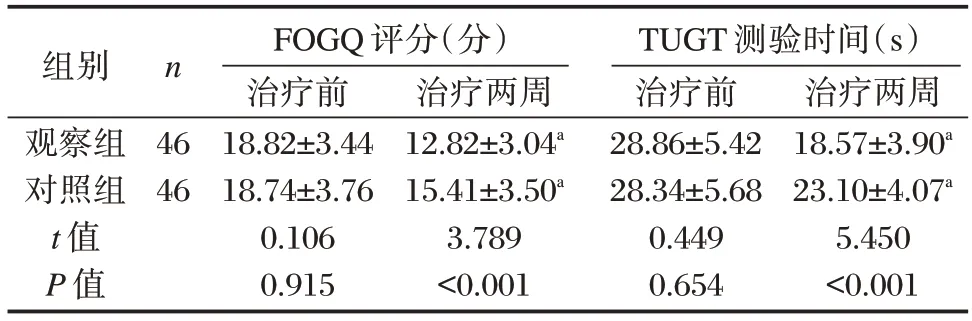
表4 两组治疗前后FOGQ 评分、TUGT 测验时间比较()Table 4 Comparison of FOGQ scores and TUGT time between the two groups before and after treatment()
注:与本组治疗前比较,aP<0.05。
2.5 两组治疗前后神经递质水平比较
治疗前,两组5-HT、DA 水平比较,差异无统计学意义(P均>0.05)。治疗两周后两组5-HT、DA 水平均高于治疗前,差异有统计学意义(P均<0.05);且观察组5-HT、DA 水平均高于对照组,差异均有统计学意义(P均<0.05)。见表5。
表5 两组治疗前后5-HT、DA 水平比较()Table 5 Comparison of 5-HT and DA levels between the two groups before and after treatment()

表5 两组治疗前后5-HT、DA 水平比较()Table 5 Comparison of 5-HT and DA levels between the two groups before and after treatment()
注:与本组治疗前比较,aP<0.05。
3 讨论
多巴胺能药物通过外源性途径补充脑DA 水平不足从而发挥治疗PD 作用,但此类药物不能延缓病情进展,且长期使用存在疗效减退或出现副作用,临床症状得不到有效控制[10]。鼠神经生长因子能通过抑制钙超载、超氧自由基释放以及细胞凋亡等多种机制促进神经修复,发挥神经保护作用。本研究中对照组治疗后脑5-HT、DA 水平较治疗前显著提高,患者的运动症状、认知功能以及焦虑抑郁情绪较治疗前均有不同程度改善,提示鼠神经生长因子能明显改善PD 临床症状。
冻结步态是PD 较严重的一种临床症状,其典型临床表现为患者在启步或转弯时突发步态紊乱。冻结步态可导致PD 患者不能产生有效行走、频繁跌倒,严重降低患者的独立性和活动能力,损害其生活质量。本研究结果显示,使用10 Hz 的高频rTMS 治疗刺激双侧M1-LL 区可以改善PD 患者的运动症状,此外患者的冻结步态症状得到显著改善,表现为FOGQ 评分较对照组显著降低,TUGT测验时间较对照组显著缩短。既往一项研究[11]显示,给予10 Hz 的高频rTMS 治疗PD 伴冻结步态患者,显著改善了患者的SS-180 时间、FOGQ 以及UPDRS-III 评分,本研究中结果与该研究一致。
本研究分析了rTMS 对非运动症状的影响,结果显示10 Hz 高频rTMS 治疗后患者的MMSE 评分较治疗前升高,而HAMA 评分、HAMD 评分较治疗前降低,提示使用10Hz 的高频rTMS 刺激双侧M1-LL区能改善PD 患者的认知功能以及焦虑、抑郁情绪。然而与本研究不同的是,在一项随机、双盲研究中,研究者使用10 Hz 的高频rTMS 刺激PD 患者的M1区连续三天发现患者的运动症状得到明显改善,然而焦虑、抑郁等非运动症状并未见明显改善[12]。笔者分析这可能与该研究治疗时间不足有关。此外,不同研究中个体差异、样本量以及治疗设备不同都可能造成治疗结果的差异。目前已知rTMS 治疗PD的主要机制是通过不同途径刺激内源性DA 的释放,增加DA 的含量。相关研究显示,高频rTMS 刺激可以对PD 患者的部分大脑区域做功能性连接,促进基底神经节辅助运动区神经元的兴奋,引起纹状体中DA 的瞬时释放[13]。此外,研究发现rTMS还能刺激大脑皮层促进5-HT、谷氨酸等神经递质的释放[14]。本研究中观察组治疗两周后的5-HT、DA水平均显著高于对照组,提示rTMS 能改善PD 患者的5-HT、DA 等神经递质水平,这可能是rTMS 改善PD 患者运动和非运动症状的重要机制。
综上所述,鼠神经生长因子联合rTMS 治疗PD患者疗效确切,能有效改善患者的脑神经递质水平,对运动症状和非运动症状均有明显的改善作用。
