全面性发育迟缓患儿的染色体分析及预后危险因素研究*
2023-12-23陈玲崔玲玉王泽熙檀晓娜岳玲
陈玲 崔玲玉 王泽熙 檀晓娜 岳玲
(河北省儿童医院神经康复科,河北 石家庄 050000)
全面性发育迟缓(Global developmental delay,GDD)是康复儿科常见的疾病之一,是指5岁及以下儿童存在2个及以上发育领域发育迟滞,如粗大或精细运动、言语及认知等,严重影响儿童的身心健康[1]。染色体异常是引起GDD的重要原因之一,包括染色体数目、结构异常、染色体拷贝数变异(Copy number variations,CNVs)等,尤其是染色体CNVs在遗传易感性、多态性等多方面发挥重要作用,与GDD的发生密切相关[2]。因此,明确GDD患儿染色体特征,早期诊断、治疗对改善GDD患儿预后尤为重要。此外,有研究指出,GDD患儿预后与患儿语言功能、合并症、干预时机等有关[3-4]。因此,分析GDD患儿预后的危险因素,并采取相应的治疗措施,对改善患儿预后至关重要。基于此,本研究旨在探讨GDD患儿的染色体特征及患儿预后的影响因素。
1 资料与方法
1.1 一般资料 本研究经河北省儿童医院伦理委员会审批。选取2018年1月—2021年5月河北省儿童医院收治的181例GDD患儿作为观察对象。患儿家属签署知情同意书。诊断标准:GDD符合美国精神病学协会诊断和统计学手册(第5版)[5]中诊断标准,包括适应能力缺陷与智力缺陷,表现于社交、概念等领域。排除标准:①合并发育协调障碍,表现为运动能力差、动作笨拙,影响生活学习。②合并先天性骨骼肌肉、周围神经疾病。③合并先天性甲状腺功能低下。④合并黏多糖病、苯丙酮尿症等遗传代谢疾病。⑤合并孤独症谱系障碍,以交流障碍、刻板行为、语言障碍为主要表现。⑥明确为脑性瘫痪、发育指标延迟等其他神经发育障碍性疾病。181例患儿中男性123例,女性58例;首诊月龄3~42月,平均(23.44±6.83)月;出生方式:顺产107例,剖宫产74例。
1.2 方法
1.2.1 染色体分析 于患儿入院当日采集静脉血4 mL,装于含乙二胺四乙酸的抗凝管中,采用盐析法抽提DNA,并使用紫外线分光光度计测定1 μL DNA原液的浓度及光密度(Optical density,OD)值,保证OD值在1.6~1.8之间。使用美国Illumina NovaSeq 6000测序仪(Illumina公司)进行CNVs测序,并将数据与参考基因组对比。参照美国遗传学学会制定的指南[6]将CNVs分为良性CNVs、临床意义不明CNVs、可能致病性CNVs、致病性CNVs。
1.2.2 基线资料收集 临床资料包括患儿年龄、性别(男、女)、出生方式(顺产、剖宫产)、宫内感染(孕妇妊娠期间感染引起的胎儿宫内感染)、早产(孕妇妊娠28周但未到37周胎儿娩出)、新生儿黄疸(表现为皮肤、巩膜等黄染,出生24 h后血清胆红素升高>5 mg/d,持续时间足月儿超过2周,早产儿超过4周)、新生儿感染(新生儿呼吸道感染、消化系统感染等)、新生儿缺血缺氧性脑病[(Hypoxic-ischemic encephalopathy,HIE),符合以下标准:有明确的胎儿宫内窘迫,出生后1 min时Apgar评分≤3分且5 min时≤5分,出生后出现意识改变、原始反射异常等神经系统症状,出现排除产伤、颅内出血等原因引起的抽搐]。
1.3 GDD患儿预后判定及分组 全部患儿随访1年,参照文献[5]评估患儿预后,将治疗后适应能力、智力恢复正常的患儿判定为预后良好,将治疗后仍为GDD,或发展为智力障碍、脑性瘫痪等疾病的患儿判定为预后不良。根据预后情况将181例患儿分为预后不良组与预后良好组。

2 结果
2.1 GDD患儿CNVs检出情况 181例GDD患儿中共检出非良性CNVs 59例,检出率为32.60%(59/181),其中致病性CNVs为25.41%(46/181),可能致病性CNVs为5.52%(10/181),临床意义不明CNVs为1.66%(3/181);检出良性CNVs122例,检出率为67.40%(122/181)。见图1。

图1 GDD患儿CNVs检出情况
2.2 非良性CNVs患儿染色体分析 59例非良性CNVs患儿中CNVs位于7号、14号染色体各10例,位于15号染色体9例,位于10号染色体6例,位于22号染色体5例,位于2号、4号、11号染色体各4例,位于12号、13号染色体各2例,位于16号、17号、18号染色体各1例。59例患儿中CNVs缺失32例(54.24%),CNVs重复11例(18.64%),CNVs嵌合缺失3例(5.08%),CNVs缺失伴嵌合重复4例(6.78%),CNVs同时缺失重复5例(8.47%),非整倍体重复4例(6.78%)。见图2。
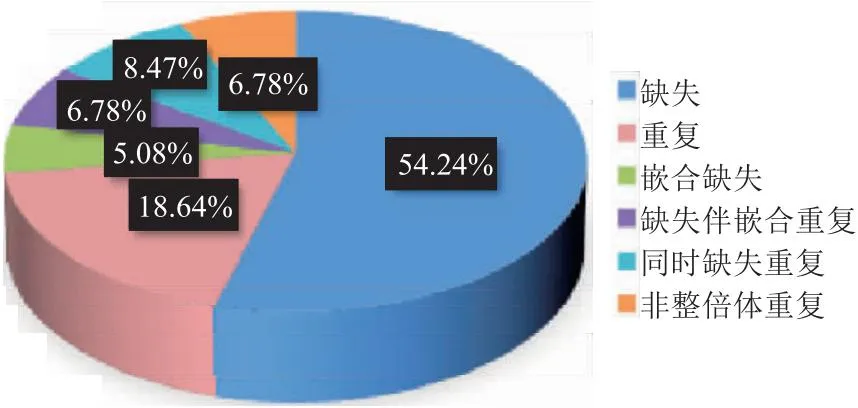
图2 患儿CNVs类型分布
2.3 181例GDD患儿预后情况 随访1年,181例患儿经治疗后预后良好39例(21.55%),预后不良142例(78.45%)。预后不良患儿中99例(54.70%)仍为GDD,较治疗前有所改善,25例(13.81%)发展为智力障碍,18例(9.94%)发展为脑性瘫痪。
2.4 不同预后GDD患儿基线资料比较 预后不良组患儿首诊年龄高于预后良好组,新生儿黄疸、早产、HIE、致病性CNVs占比高于预后良好组,差异有统计学意义(P<0.05);两组间性别、出生方式、宫内感染等基线资料比较,差异无统计学意义(P>0.05)。见表1。
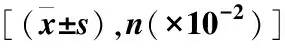
表1 不同预后GDD患儿基线资料比较
2.5 GDD患儿预后的影响因素分析 将GDD患儿预后作为因变量(1=预后不良,0=预后良好),将首诊时间、新生儿黄疸、早产、HIE、CNVs作为自变量(表2),经单项Logistic回归分析,将P值放宽至<0.1,纳入符合条件的因素,行多项Logistic回归分析结果显示,首诊年龄高、新生儿黄疸、早产、HIE、致病性CNVs是GDD患儿预后不良的危险因素(OR>1,P<0.05)。见表3。

表2 变量赋值说明
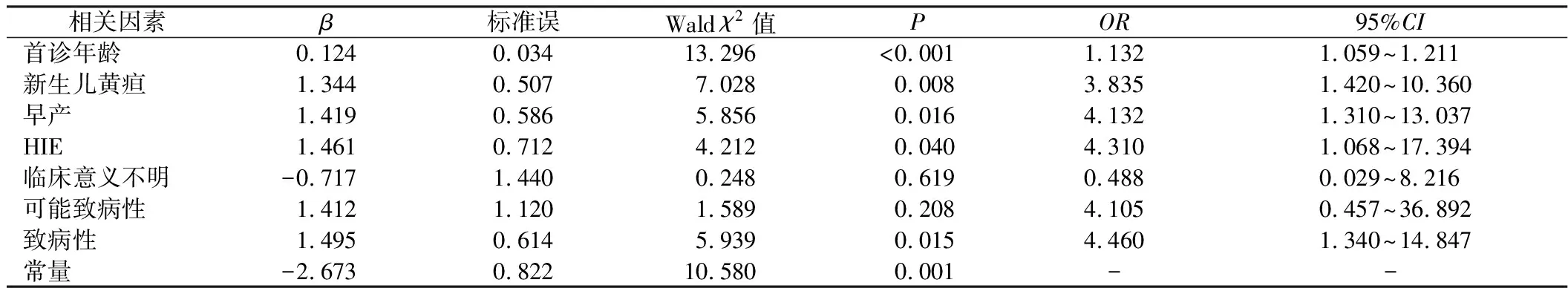
表3 GDD患儿预后影响因素的回归分析
3 讨论
GDD是婴幼儿时期常见的神经系统疾病,表现为社会适应能力、智力等方面的缺陷,对患儿未来的成长造成严重影响[7]。GDD的病因包括环境因素、遗传因素,其中遗传因素在重度GDD中占比更高,尤其随着围产保健的水平提高,染色体异常所致的GDD占比显著升高[8]。因此,关注GDD患儿染色体特征,推进产前筛查,并加强遗传学检查的宣传,以降低GDD的患病风险,是目前临床研究的重点之一。
染色体异常是导致GDD的重要遗传因素,由于染色体中亚显微结构缺失或重复,可导致人类遗传的多态性,增加神经性发育障碍相关疾病的易感性[9]。其中致病性CNVs可引起2q37微缺失综合征、1p36缺失综合征、9p三体等,均可导致不同程度的GDD[10]。本研究结果显示,181例GDD患儿非良性CNVs检出率为32.60%,其中致病性CNVs检出率为25.41%,59例CNVs患儿CNVs主要位于7号、14号、15号染色体;59例患儿中CNVs缺失32例,CNVs重复11例,CNVs嵌合缺失3例,CNVs缺失伴嵌合重复4例,CNVs同时缺失重复5例,非整倍体重复4例。本研究中有3例患儿为临床意义不明CNVs,对于这3例患儿仍需要定期随访,根据临床与基因组数据,进一步重新对其分类。因此,应加强孕妇产检时的遗传咨询,重点关注胎儿细胞遗传性染色体的分析,早期筛查染色体异常,降低GDD患儿的出生率。
徐艳红[11]研究中185例GDD患儿治疗后78.38%未恢复正常。本研究中181例GDD患儿预后不良率为78.45%,与上述研究相近。说明GDD患儿经治疗后预后并不理想,仍有大部分患儿无法恢复正常。因此,分析与GDD患儿预后有关的因素,对改善患儿预后具有重要意义。本研究结果显示,GDD患儿预后不良可能受首诊年龄、新生儿黄疸、早产、HIE、致病性CNVs的影响。分析原因在于:①首诊年龄。早期干预通常指GDD患儿出生至2周岁期间实施的综合性治疗,包括哺乳、游戏等多种训练,可刺激患儿声音、语言能力,促进患儿生长发育[12]。研究证实,在儿童出生后半年内是神经细胞发育的最佳时期,神经细胞的代偿能力、可塑性最强,随着年龄的增长,其神经细胞发育逐渐减弱[13]。在早期对GDD患儿进行综合性的治疗,可改善患儿脑部能量供应,更好地促进患儿的运动功能、语言功能的发展[14]。并且在早期采取有效的治疗措施能促进GDD患儿的体重、身长等发育,有助于患儿早期追赶性生长,避免了因生长发育落后导致的智力障碍、运动功能障碍[15]。因此,在临床中应加强对患儿家属的健康教育,重视对儿童生长发育的评估,早期诊断GDD,并尽早采取治疗干预措施,有利于改善患儿的预后。②新生儿黄疸。出生时患有新生儿黄疸的GDD患儿胆红素会通过血脑屏障对神经元细胞造成损伤,即使经过蓝光照射治疗后神经系统的损伤也不可逆,且残留的胆红素也会持续损害神经系统,加重GDD患儿的病情程度,影响患儿预后[16-17]。此外,低水平的游离胆红素也会损伤神经细胞,轻度的黄疸也会引起暂时性或永久性的神经系统后遗症,进一步影响GDD患儿的智能发育,导致患儿预后不良[18]。因此建议针对存在早产、胎膜早破、红细胞增多等新生儿黄疸高危因素的GDD患儿,应积极采取有效治疗措施降低患儿胆红素水平,以减轻后续的神经元持续损害,减轻对患儿智能发育的影响,进而改善患儿预后。③早产。由于早产儿过早的脱离母体,胎儿神经细胞髓鞘未完全形成,脑发育不成熟,导致神经系统发育受阻,即使在出生后未发生脑损伤,神经行为发育仍低于足月儿[19]。存在早产的GDD患儿中枢神经系统发育更差,尤其是灰白质比例较低,小脑、小海马异常,均会严重影响患儿的认知功能,并持续损伤患儿的智能发育,影响患儿预后[20]。此外,早产儿出生体重低,在生长发育时需要更多的能量追赶生长,易导致出生后持续较长的时间落后于同龄儿童,影响患儿的社会适应能力,加重患儿智力发育落后、行为障碍等,影响患儿预后[21]。④HIE。新生儿的大脑为代谢最旺盛的器官,其能量占全身的50%,脑的能源主要来自葡萄糖,但脑内糖原含量少,主要通过血液供给获取[22]。而出生时患有HIE的GDD患儿脑代谢功能受到影响,在脑缺氧的情况下,丙酮酸会在糖酵解作用下还原为乳酸,引起严重的细胞内酸中毒,导致脑损伤,加重患儿脑发育障碍,影响患儿预后[23]。同时,患有HIE的GDD患儿在围生期脑血流灌注量减少,会导致局部脑组织缺血,导致脑实质损害与脑损伤,经治疗后仍难以恢复正常,预后较差[24]。因此,针对出生时患有HIE或早产的GDD患儿,应尽早评估患儿的生长发育水平,做到早期评估、早期治疗,针对患儿的病情制定个体化的综合康复治疗方案,如早产患儿则可强化作业疗法、引导式教育,改善患儿的认知功能;出生时患有HIE的患儿则建议加强肢体按摩、理疗等,有利于改善GDD患儿的预后。⑤致病性CNVs。研究证实致病性CNVs是导致GDD的重要遗传因素[25]。但关于致病性CNVs与GDD患儿治疗预后的相关研究鲜有报道,而本研究也为观察性研究,无法深入明确致病性CNVs对GDD患儿预后的作用,仍需要大量研究实验进一步明确其作用机制。
4 结论
GDD患儿预后不良可能受首诊年龄、新生儿黄疸、早产、HIE、致病性CNVs的影响。因此,应加强孕妇产检时的遗传咨询,重点关注胎儿细胞遗传性染色体的分析,早期筛查染色体异常,降低GDD患儿的出生率;同时针对存在高危因素的GDD患儿,应早期采取综合性的治疗干预措施,促进患儿运动功能、语言能力与智力的发育,以改善患儿预后。
