多巴胺包裹的纳米金粒子介导的光热治疗对黑色素瘤生长的抑制作用*
2023-12-23饶运佳严瑾王文茜朱冬梅林涛王洁向小聪陈竹冯刚
饶运佳 严瑾 王文茜 朱冬梅 林涛 王洁 向小聪 陈竹 冯刚
(南充市中心医院·川北医学院第二临床医学院组织工程与干细胞研究所,四川 南充 637000)
恶性黑色素瘤(Metastatic melanoma,MM)是一种由皮肤和其他器官的黑色素细胞产生的肿瘤,是一种侵袭性和恶性程度很高的肿瘤[1]。外科手术治疗仍是恶性黑色素瘤的首选治疗方案[2],但手术治疗无法解决黑色素瘤复发和转移的问题[3]。由于黑色素瘤对放化疗并不敏感,因此放化疗在黑色素瘤的治疗中受到了很大的限制。因此,积极探索黑色素瘤新的治疗方式是非常必要的。光热治疗(Photothermal therapy,PTT)是近年来新兴的肿瘤疗法。光热治疗主要是通过光敏剂将光能转化成热能,造成肿瘤局部高温从而杀伤肿瘤细胞[4]。近年来,PTT在浅表肿瘤的治疗中显示出了良好的应用前景。目前,光热治疗的研究方向主要集中在利用人工修饰的纳米光敏剂介导光热治疗。纳米尺寸的光敏剂可以通过粒径依赖的高通透性和滞留效应 (Enhanced permeability and retention effect,EPR效应)被动靶向肿瘤组织;也可以通过连接靶向基团主动靶向肿瘤组织,从而富集在肿瘤组织深部,对肿瘤深部组织产生治疗作用,其热疗的效果极大地优于目前临床所采用的传统热疗。纳米金粒子(Au)具有良好的光热转化效率,是一种理想的光热治疗材料。多巴胺可以在温和的条件下包裹修饰纳米金粒子,改善Au的生物相容性。同时,多巴胺本身也具有良好的光热转化效率,可以协同增强Au的光热转化效率。更重要的是多巴胺含有丰富的官能团,可以进一步接枝其他功能基团。因此,本研究中我们尝试利用多巴胺修饰的纳米金粒子(Au@PDA)作为光热治疗的光热材料,探索其在体内外对黑色素瘤细胞的抑制作用。
1 材料与方法
1.1 主要试剂与仪器 氯金酸溶液和柠檬酸钠粉末均购于中国上海源叶生物科技有限公司,盐酸多巴胺购买于美国Sigma公司,小鼠黑色素瘤细胞(B16F0)购于中国科学院上海细胞库,胎牛血清和1640培养液均购于美国Thermo公司,0.25%胰酶购于美国Gibco公司,CCK-8试剂盒购于中国凯基生物科技发展有限公司,Annexin V/PI凋亡试剂盒购于中国南京诺唯赞生物科技股份有限公司,Mouse HMGB1 ELISA KIT购于中国广州睿信生物科技有限公司,CD4一抗购买于美国ABcam公司,CD8一抗购于美国Cell signaling Technology公司,二抗购于中国赛维尔生物有限公司,其余化学试剂均为市售分析纯。流式细胞仪(FACS Calibur,美国BD公司),纳米粒度仪 Zeta 电位分析仪(DLS,ZS90,英国 Malvern 公司),透射电子显微镜 (TEM,Tecnai G2 F20S-TWIN,美国 FEI 公司),倒置显微镜(DMi8,德国Leica公司),光纤激光器(中国西安镭泽电子科技有限公司),ICP-OES (ARCOS,德国Spectro公司),FLIR ONE红外热像仪(美国FLIR公司)。
1.2 方法
1.2.1 材料的制备
1.2.1.1 Au的制备 ①氯金酸溶液工作液配制:取30.6 μL氯金酸溶液于5 mL去离子水中,混匀,避光。②柠檬酸钠工作液配制:准确称取柠檬酸钠粉末1 g,溶于100 mL去离子水中,快速搅拌或超声使柠檬酸钠完全溶解。③Au的制备:取1 mL氯金酸工作液和5 mL柠檬酸钠工作液溶解于100 mL去离子水中,搅拌混匀。100 ℃加热使之快速沸腾2.5 min后,调至80 ℃,维持沸腾状态5 min,溶液由透明变为酒红色,可得Au,室温冷却后,13000 rpm,离心20 min,弃去上清液。
1.2.1.2 Au@PDA的制备 ①Tris-HCl溶液配制:取Tris粉末2.42 g于2 L去离子水中,调pH为8.8,充分混匀。②将80 mg 盐酸多巴胺和10 mL Au加入到480 mL的Tris-HCl溶液中,再盖上保鲜膜,于45 ℃下充分搅拌2 h;先在5 000 rpm下离心10 min,再在离心力10 000 g下离心15~20 min,吸去上清液,去离子水洗去多余的多巴胺,可得多巴胺包裹的纳米金粒子(Au@PDA)。
1.2.2 纳米粒子的表征 将Au和Au@PDA样品分散于乙醇中,并滴在铜网上,干燥喷金后通过TEM表征其形貌;将Au和Au@PDA的稀释液体样品置于比色皿中,使用纳米粒度仪测试样品水合粒径和Zeta电位。
1.2.3 体外光热性能考察 将制备好的Au和Au@PDA用去离子水配制成溶液,用ICP-OES对溶液中Au进行定量,使溶液中Au的浓度为0.2 g/L。取400 μL液体置于1.5 mL EP管中,用808 nm激光(1 W/cm2)照射10 min,然后关闭激光,恢复至室温。用红外热像仪记录照射后溶液温度的变化。循环照射3次,观察Au和Au@PDA粒子温度变化,绘制温度-时间变化曲线。每组实验3个平行样品。
1.2.4 细胞培养及分组 B16F0用含有10% FBS的1640培养基,37 ℃ 5% CO2条件进行培养,每日观察细胞生长状态,定期换培养基,当细胞融合度达到80%~90%时,用0.25%胰酶消化传代。将B16F0细胞加入含有2.5 μL的Au(Au为0.2 g/L)、Au@PDA(Au为0.2 g/L)、生理盐水的培养基分别记为Au组、Au@PDA组、Control组。将Au组、Au@PDA组细胞培养6 h后,1 W/cm2的808 nm激光照射20 min,分别记为Au+NIR组和Au@PDA+NIR组。
1.2.5 体外对黑色素瘤生长的影响
1.2.5.1 细胞相容性实验 5组B16F0细胞(每孔8×103个细胞)接种于96孔板中,分别在0、24和48 h使用CCK-8法测定细胞存活率。
1.2.5.2 细胞迁移检测 5组B16F0细胞(每孔2×104个细胞)接种于12孔板中,培养36 h后,用20 μL的枪头在孔板上划3条直线,并用生理盐水洗两次后加入相应的细胞培养液,分别于0、12 、24 h于显微镜下拍照,用Image J处理并计算细胞迁移率,细胞迁移率=(0 h划痕宽度-培养后划痕宽度)/0 h划痕宽度×100%。
1.2.5.3 细胞凋亡检测 5组B16F0细胞(每孔2×104个细胞)接种于12孔板中,培养12 h后,向孔板中加入相应的细胞培养液,光照48 h后,用Annexin V/PI凋亡试剂盒染色后,流式细胞仪分析。
1.2.5.4 HMGB1检测 B16F0细胞(每孔1×104个细胞)接种于24孔板中,培养12 h后,向孔板中加入相应的培养液,48 h后再次按照相同方法光照,光照后立即收集上清液用HMGB1试剂盒进行检测。
1.2.6 动物实验
1.2.6.1 实验动物 选取30只SPF级6~8周龄的C57BL/6小鼠,雄性,体重约20 g,购于川北医学院动物实验中心。本实验所有实验方案均符合川北医学院动物实验伦理学要求。
1.2.6.2 动物模型的构建及实验过程 制备B16F0细胞悬液(2×106/100 μL),每只小鼠注射100 μL的细胞悬液于小鼠右侧肩部。待小鼠肿瘤体积增长到150 mm3时,将小鼠随机分成5组,每组6只,开始进行治疗。实验分组分为Control组、Au组、Au+NIR组、Au@PDA组和Au@PDA+NIR组。整个治疗过程,每个疗程间隔1天,处理方式给药见表1。每组光热治疗均使用同一激光发射器,光线聚于明显的肿瘤病灶处,距离光源的高度约为3.0 cm ,治疗时间持续为20 min;每隔2天测量一次肿瘤的体积,肿瘤体积=长径×短径×短径/2;在细胞造模处理荷瘤鼠18天后,处死小鼠取肿瘤组织拍照并称重,具体治疗流程见图1。称重后,小鼠的肿瘤组织用4 % 福尔马林固定,石蜡包埋切片后进行免疫组化染色,观察肿瘤组织中的浸润T淋巴细胞。摘取小鼠的主要脏器(心肝脾肺肾),4 % 福尔马林固定,石蜡包埋切片后进行常规HE染色。

图1 5组小鼠治疗过程示意图
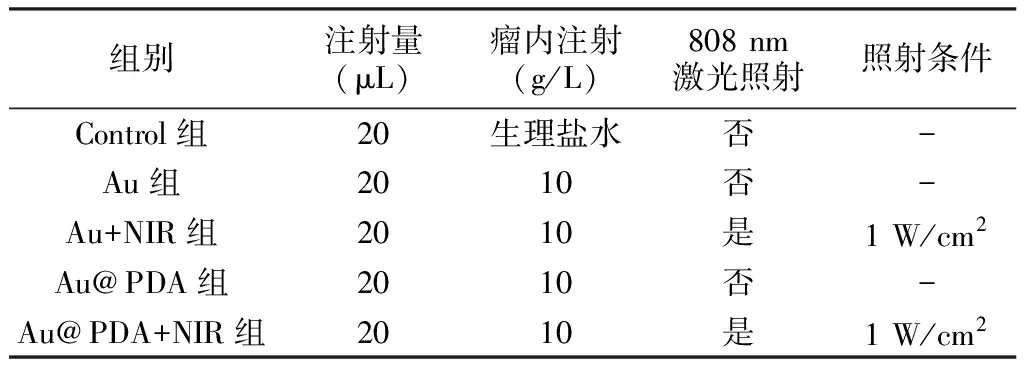
表1 5组小鼠处理方式

2 结果
2.1 纳米粒子的基本理化性能 本研究成功制备了多巴胺包裹的纳米金粒子,多巴胺能够均匀地包裹纳米金粒子。Au和Au@PDA均呈球状(2A、B);DLS测试Au的水合粒径为(10±3)nm,Au@PDA的水合粒径为(120±40)nm(图2C)。Zeta电位结果显示,多巴胺修饰后并没有显著改变纳米金粒子表面电荷,Au和Au@PDA的Zeta电位均在-20 mV左右(图2D)。
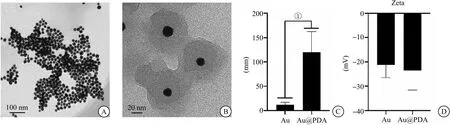
图2 多巴胺包裹的纳米金粒子的基本性能图
2.2 Au和Au@PDA光热性能分析 体外的光热性能实验结果显示,经过10 min的照射,Au温度升至(40.8±0.1)℃,而Au@PDA温度则升至(49.3±0.1)℃,Au和Au@PDA均具有良好且稳定的光热性能,光照后温度可以显著升高,但Au@PDA表现出比Au更好的光热性能,见图3。这表明多巴胺对金粒子的光热性能起到了很好的协同作用,纳米粒子在3个升温降温的周期中均保持了良好的光热性能。

图3 纳米粒子的光热性能(n=3)
2.3 体外对黑色素瘤细胞生长的影响
2.3.1 纳米粒子的生物相容性和对黑色素瘤生长的抑制作用 迁移实验结果显示,Au@PDA+NIR组细胞迁移率显著低于其他各组(P<0.05);Au+NIR组在12 h和24 h的迁移率,均高于Au@PDA+NIR组,而低于Control组、Au组和Au@PDA组(P<0.05),见图4。CCK-8结果显示,Au和Au@PDA在不光照的条件下,细胞存活率均高于80%,表现出了良好的生物相容性;在光照后,各组的细胞存活率显著下降。其中Au@PDA+NIR组细胞存活率最低,光照后24 h细胞存活率仅为(35.4±0.4)%,48 h的存活率为(39.5±0.5)%,各时间点的存活率均明显低于其他组(P<0.05);Au+NIR组的细胞存活率则降低到60%左右,见图5。细胞凋亡的结果显示,Au@PDA+NIR组细胞凋亡率最高;Au+NIR组细胞早期凋亡率和晚期凋亡率均高于Control组、Au组和Au@PDA组(P<0.05),见图6。以上结果表明,Au@PDA和Au均能够抑制B16F0细胞凋亡,但Au@PDA抑制B16F0细胞迁移和增殖能力更强。

图4 纳米粒子对B16F0细胞迁移能力的影响

图5 纳米粒子对B16F0细胞增殖能力的影响
2.3.2 光照对黑色素瘤细胞免疫原性的影响 在本研究中,我们对光照后B16F0细胞分泌的HMGB1进行了检测,结果显示,光热治疗组分泌的HMGB1明显增加,其中Au@PDA+NIR组分泌的HMGB1最高,其次为Au+NIR组,均显著高于其他各组(P<0.05),见图7。

图7 治疗后B16F0细胞分泌HMGB1的统计结果(n=3)
2.4 体内的抗肿瘤实验
2.4.1 肿瘤体积和重量变化 动物实验的结果显示,在整个治疗期间,Au@PDA+NIR组小鼠的肿瘤生长较缓慢,光照治疗对该组小鼠的肿瘤生长表现出显著的抑制作用;Au+NIR组小鼠的肿瘤在前两次治疗中对肿瘤有较显著的抑制,在第14天后,肿瘤迅速生长,Au+NIR已经无法抑制肿瘤生长。在第18天处死小鼠后,取各组肿瘤的瘤块进行称重。相对于其余各组,Au@PDA+NIR组的肿瘤的重量为(0.5±0.1) g,其余各组的肿瘤体重均大于2 g,见图8。表明Au@PDA+NIR组对体内肿瘤的生长起到了显著的抑制作用,且多巴胺的包裹对金粒子的光热作用起到了显著的协同增强作用。

图8 纳米粒子在体内对小鼠黑色素瘤的生长抑制情况
2.4.2 体内各组织的组织学染色结果 光热治疗能显著地引起肿瘤组织的坏死,光照组的坏死组织明显增多,见图9。免疫组织化学染色的结果表明,Au@PDA+NIR组肿瘤组织浸润的CD4+T细胞和CD8+T细胞最多,视野中阳性细胞数分别为(18±1)个和(9±1)个;Au+NIR组肿瘤组织浸润的CD4+、CD8+T细胞在视野中阳性细胞数分别为(9±1)个和(6±1)个,均高于非光照组(P<0.05),见图10,这表明光照激活了机体的抗肿瘤免疫反应。小鼠主要脏器的HE染色结果显示实验组小鼠的主要脏器无显著的结构变化和炎症反应(图11),提示Au@PDA和Au具有良好的生物相容性。

图9 肿瘤HE染色结果(100×,标尺=250 μm)

图10 肿瘤组织的CD4和CD8细胞情况

图11 小鼠主要器官的HE染色图像(100×,标尺=500 μm)
3 讨论
纳米金粒子主要包括球形纳米金粒子和金纳米棒和金纳米笼等非球形纳米金粒子[5],在这些纳米金粒子中,非球形的纳米粒子光热转化效率较高,但其制备过程复杂,所需的试剂毒性较强[6-7]。而制备球形纳米金粒子仅需要用到柠檬酸钠缓冲液,且制备过程简单,安全性大大的优于其他形貌的纳米金粒子。但球形纳米金粒子的不足之处在于光热转换效率不及非球形纳米金粒子高。为了弥补球形纳米金粒子光热转换效率不高的问题,我们选取同样有具有光热转换能力的多巴胺进行修饰。一方面,多巴胺提高了球形纳米金粒子的光热转换效率;另一方面,多巴胺含有丰富的官能团,为进一步接枝其他功能基团,为赋予纳米金粒子更多的生物学功能提供了基础[8-9]。本研究中,我们采用简单而温和的方法成功地制备了Au@PDA和Au,两种粒子形貌呈均匀的球形,PDA对Au的包裹均匀,未显著改变Au的Zeta电位。光热曲线显示Au@PDA相较于Au升温速度快,温度更高,说明多巴胺的包裹对纳米金粒子的光热效应起到了显著的协同作用。CCK-8实验证实Au和Au@PDA粒子具有良好的生物相容性,符合GB/T14233·2-2005标准中大于80%的要求[10]。在体内的抗肿瘤实验中,各脏器的HE染色结果也表明纳米金粒子对各脏器无显著的影响。
PTT是利用光热传导剂的光热效应将光能转化为热能,从而提高病灶周围环境的温度,高温使细胞膜发生损伤,导致直接的细胞坏死[11-12],从而影响了细胞的增殖和迁移。同时,热疗也可以通过增加调亡相关基因的表达(如P53基因等)从而诱导细胞调亡[13]。本研究中,我们在体外细胞实验中证实了Au和Au@PDA粒子为光敏剂的光热治疗显著的诱导了黑色素瘤细胞的凋亡,抑制了黑色素瘤细胞的增殖和迁移。
近年来,文献报道光热治疗还可以诱导肿瘤的免疫原性死亡,从而激活机体的抗肿瘤免疫[14]。大量文献证实,光热治疗后的肿瘤部位抗原递呈细胞和浸润T细胞比例显著增加,血清中抗肿瘤的炎性因子也有所增加[15-16]。目前,研究者认为光热治疗主要是通过诱发肿瘤细胞的免疫原性死亡(Immunogenic cell death,ICD),从而激活机体的免疫。ICD是指细胞在发生凋亡的同时,从非免疫原性细胞转化为免疫原性细胞,并由此激发机体内抗肿瘤的免疫杀伤效应[17]。其发生的机理是细胞在凋亡后,释放出损伤相关分子模式标志物,如钙网织蛋白(Calreticulin,CRT)、三磷酸腺苷(Adenosine triphosphate,ATP)、HMGB1和热休克蛋白70(Heat Shock Proteins 70,HSP70)等,向免疫系统发出“eat me”的信号,诱导抗原递呈细胞来吞噬这些死亡的肿瘤细胞,进而将这些信号递呈给T细胞,激活T细胞,激发机体的免疫[18]。高迁移率蛋白B1(High mobility group protein B-1,HMGB1)是肿瘤免疫原性死亡的一种标志性蛋白[19]。在本研究中,我们检测了光照后B16F0细胞HMGB1分泌情况。结果显示,光照组的黑色素瘤细胞分泌的HMGB1显著升高。这表明,Au@PDA和Au经过光热治疗让黑色素瘤细胞发生了免疫性死亡,进而激活了机体的抗肿瘤免疫反应。动物实验结果证实,光照组的肿瘤组织中的浸润CD8+、CD4+T淋巴细胞的数量显著增多。CD8+T淋巴细胞是具有细胞毒性的免疫细胞,其所介导的细胞毒T淋巴细胞反应(Cytotoxic T lymphocyte,CTL)是经典的抑制肿瘤生长的免疫反应[20-21]。CTL即可以分泌IFN-γ抑制肿瘤生长;又可以在识别肿瘤抗原后,通过分泌穿孔素、颗粒酶发挥直接杀伤肿瘤细胞的作用[22]。CD4+T淋巴细胞中TH1型细胞被证实具有抗肿瘤作用[23-24]。TH1型CD4+T细胞可以通过表达CD40L等膜分子和分泌IFN-γ等细胞因子活化巨噬细胞,也可产生IL-2等细胞因子促进TH1、CTL和NK等细胞的活化,增强抗肿瘤免疫反应[25]。就本次实验的结果来看,肿瘤的生长受到了显著性的抑制。因此,我们更趋向认为肿瘤组织中的浸润CD4+T细胞属于TH1型CD4+T细胞。肿瘤组织中浸润CD4+T细胞和CD8+T细胞数量的增加,这表明机体的抗肿瘤免疫反应被显著的激活。
4 结论
本研究中我们成功地利用多巴胺包裹纳米金粒子作为光敏剂,将其应用到黑色素瘤的光热治疗中。实验结果表明,Au@PDA不仅可以通过直接的热能诱导B16F0的凋亡,抑制其增殖、迁移,生长;同时,光热治疗还可以通过诱导B16F0发生ICD反应,从而激活机体的抗肿瘤免疫反应。Au@PDA粒子在黑色素瘤治疗中的具有良好的应用前景,为黑色素瘤的治疗提供了一种新的治疗途径。同时,黑色素瘤作为肿瘤免疫治疗的一种模型肿瘤,也为光热治疗在其他实体瘤中的应用提供了理论基础。
