绿原酸对牙龈卟啉单胞菌诱导牙龈上皮细胞自噬的调控作用及机制*
2023-12-23吴珊赵国廷董振耀马秀花姚毅章
吴珊 赵国廷 董振耀 马秀花 姚毅章
(青海省第五人民医院口腔科,青海 西宁810007)
牙龈卟啉单胞菌(Porphyromonas gingivalis,P.g)是牙周炎的致病菌,也是口腔鳞状细胞癌的危险因素。研究显示,P.g感染可通过破坏牙龈上皮屏障、内化进入牙龈上皮细胞,促进牙龈上皮细胞增殖和自噬[1-2]。自噬是一种细胞内降解过程,在维持细胞稳态方面起着关键作用,据报道,P.g可诱导牙龈上皮细胞自噬,利用自噬机制来生存[3];且自噬可诱导破骨细胞增殖,导致牙槽骨吸收,这是导致牙周炎患者牙齿脱落的根本原因[4]。因此,抑制P.g诱导的自噬是治疗牙周病的一个新策略。AMP活化蛋白激酶(AMP-activated protein kinase,AMPK)/UNC-51样激酶1(UNC-51-like kinase 1,ULK1)通路在调节细胞自噬过程中发挥重要作用,激活的AMPK可使ULK1磷酸化,诱导自噬,而抑制AMPK/ULK1通路激活,可抑制自噬体的产生[5]。绿原酸(Chlorogenic acid,CGA)是具有多种药理活性的酚类化合物,可从金银花、杜仲等药材获得,具有抗炎、抗氧化作用。研究显示,负载CGA的纳米胶束在局部注射后可在牙龈组织中保留超过24 h,抑制牙槽骨吸收并阻止牙周炎小鼠模型进展,有望成为牙周炎的新型治疗策略[6]。此外,CGA被报道可抑制P.g的增殖和P.g的蛋白酶活性,对牙周疾病发挥保护作用[7]。然而,CGA对P.g诱导的牙龈上皮细胞自噬的影响及作用机制尚不明确。研究显示,CGA能够通过激活AMPK发挥降糖调脂的抗糖尿病作用[8];CGA还可抑制皮质酮诱导的PC12细胞的自噬与凋亡,发挥抗抑郁作用[9]。以上研究表明CGA对AMPK通路和自噬具有调节作用,但CGA是否通过调节AMPK/ULK1通路影响人牙龈上皮细胞的自噬与凋亡少见报道。因此,本研究通过P.g诱导人牙龈上皮细胞(Human gingival epithelial cells,HGE)建立炎性HGE细胞模型,探讨CGA对炎性HGE细胞自噬的影响及其可能的作用机制,为牙周病的治疗提供理论基础。
1 材料与方法
1.1 实验材料与主要试剂 HGE、牙龈卟啉单胞菌(P. gingivalis)(ATCC,美国),CGA(HPLC≥98%,源叶生物科技有限公司),MTT检测试剂盒、Annexin V-FITC/PI细胞凋亡检测试剂盒、BCA蛋白检测试剂盒(北京百奥莱博科技有限公司),AICAR(Selleck,美国),兔抗人LC3Ⅱ、LC3I、Beclin-1、P62、p-ULK1、ULK1、p-AMPK、AMPK抗体及Alexa Fluor®488标记的二抗(Abcam,英国)。
1.2 细胞增殖实验 HGE细胞培养于含药双抗(100 U/mL青霉素、100 μg/mL链霉素)的RPMI1640培养液中,待细胞生长至对数期时,以每孔2×104个细胞接种于96孔板中,使用或不使用P.g处理(MOI=100)HGE细胞12 h,再使用浓度为5、10、20、40、60 mg/L的CGA处理24 h,每孔加入20 μL的MTT溶液(PBS缓冲液制成5 mg/mL溶液),37 ℃避光孵育4 h,再加入150 μL DMSO溶液,检测酶标仪490 nm处吸光度值。
1.3 细胞处理及分组 将对数生长期HGE细胞分为对照组(Control组,不做任何处理)、P.g组、CGA组(药物浓度分别为10.0、20.0、40.0 mg/L)、CGA+AICAR(AMPK激活剂)组,每组设置6个复孔。P.g组使用P.g诱导建立细胞模型;CGA组在P.g诱导HGE细胞12 h后,分别使用终浓度为10.0、20.0、40.0 mg/L CGA(溶于DMSO中配制成100 mg/mL母液)处理细胞24 h;CGA+AICAR组P.g诱导HGE细胞12 h后,使用浓度为40.0 mg/L的CGA与1.0 nmol/L的AICAR共同处理细胞24 h,Control组与P.g组不使用药物处理。
1.4 流式细胞仪检测细胞凋亡 各组处理的HGE细胞以每孔2×104个细胞接种于96孔板中培养24 h后,0.25%胰蛋白酶消化细胞,PBS洗涤,加入5 μL FITC染料及2.5 μL PI染料,避光孵育20 min,流式细胞仪检测细胞凋亡。
1.5 免疫荧光染色检测HGE细胞LC3Ⅱ表达 各组处理的HGE细胞使用冰PBS缓冲液洗涤细胞,4%预冷的多聚甲醛固定10 min,冰PBS洗涤3次,0.5%的TritonX-100孵育细胞10 min,冰PBS洗涤3次,5% BSA室温封闭30 min,加入LC3Ⅱ抗体(5%BSA配制)4 ℃孵育过夜,加入Alexa Fluor®488标记的二抗室温避光孵育1h,DAPI复染细胞核,荧光显微镜观察并拍照。
1.6 Western blot检测蛋白表达 各组处理的HGE细胞以每孔1×106接种于6孔板培养48 h后,500×g离心5 min、收集细胞,加入预冷的RIPA裂解液提取蛋白,使用BCA试剂盒检测蛋白含量,取30 μg蛋白进行电泳分离并转膜,5%的BSA封闭1 h,别加入LC3Ⅱ(1:1000)、LC3I(1:1000)、Beclin-1(1:1000)、P62(1:1500)、p-ULK1(1:1500)、ULK1(1:1000)、p-AMPK(1:1000)、AMPK(1:1000)稀释液和β-actin(1:1500)抗体稀释液,4 ℃孵育过夜,加入二抗室温孵育1h,ECL显色放大,凝胶成像系统成像,以β-actin为内参,对各蛋白进行定量分析。

2 结果
2.1 CGA对HGE细胞增殖的影响 与Control组比较,使用5、10、20、40、60 mg/L的CGA处理HGE细胞24 h后,细胞增殖活性无显著变化(P>0.05),见图1。
2.2 CGA对炎性HGE细胞增殖的影响 与Control组比较,P.g处理HGE细胞后,细胞增殖活性显著增加,使用5~60 mg/L的CGA处理P.g诱导的HGE细胞24 h后,细胞增殖活性有所下降,CGA浓度在10 mg/L以上时,对HGE细胞的抑制作用较为明显(图2),故选择10、20、40 mg/L的CGA进行后续实验。
2.3 CGA对炎性HGE细胞凋亡的影响 与Control组比较,P.g组细胞凋亡率差异无统计学意义(P>0.05);与P.g组比较,浓度为10.0、20.0、40.0 mg/L的CGA处理的HGE细胞凋亡率显著升高,且呈药物浓度依赖性(P<0.05);与40mg/L CGA组比较,CGA+AICAR组HGE细胞凋亡率显著降低(P<0.05)。见图3。
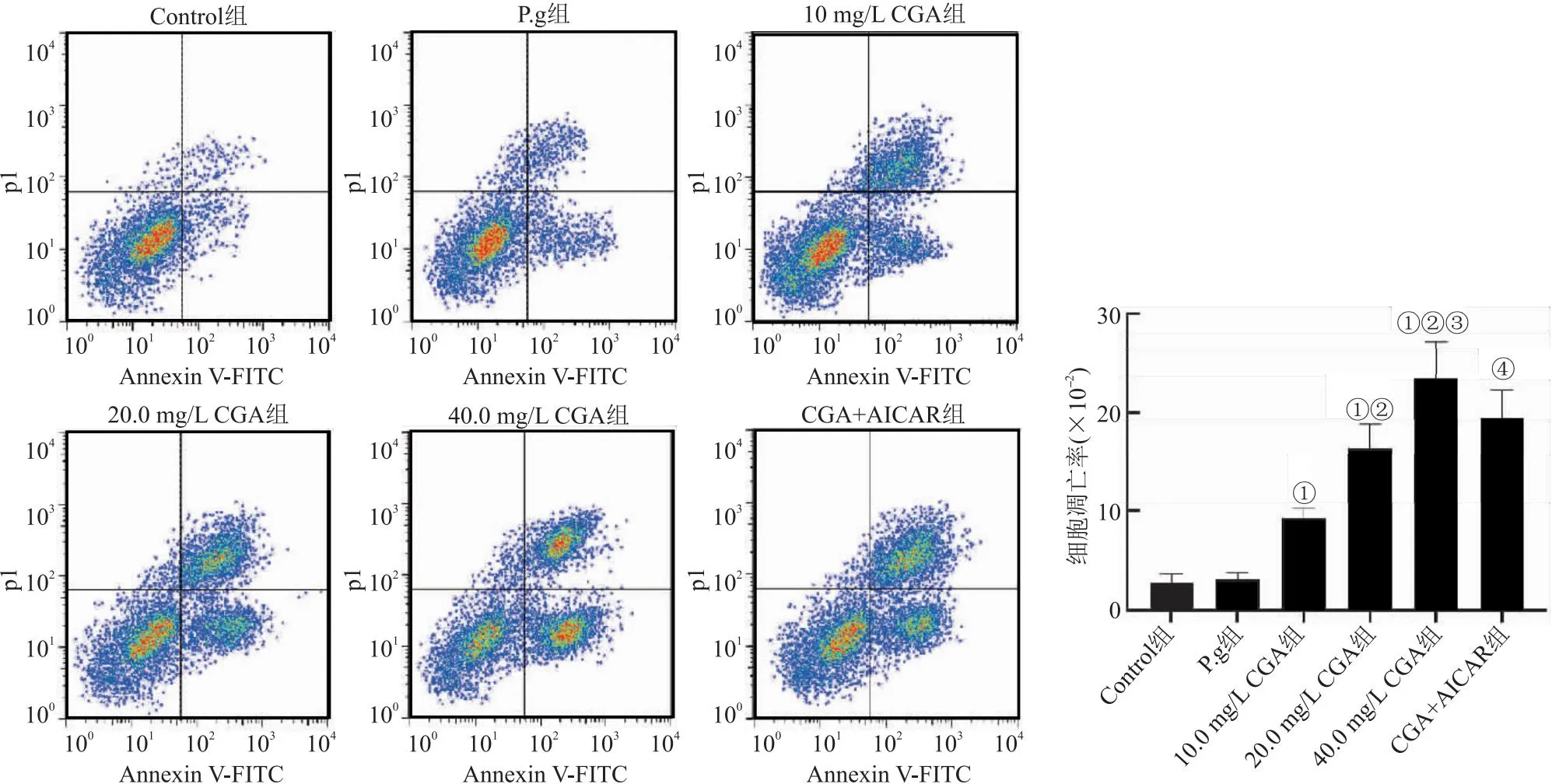
图3 CGA对炎性HGE细胞凋亡的影响
2.4 CGA对炎性HGE细胞LC3Ⅱ表达的影响 免疫荧光染色结果显示,LC3Ⅱ显示为绿色荧光,与Control组比较,P.g组绿色荧光增强,相对荧光强度显著升高(P<0.05);与P.g组比较,CGA浓度为10.0、20.0、40.0 mg/L处理组HGE细胞绿色荧光明显减弱,相对荧光强度显著降低(P<0.05);与40mg/L CGA组比较,CGA+AICAR组绿色荧光增强,相对荧光强度显著升高(P<0.05),见图4。

图4 免疫荧光检测炎性HGE细胞LC3Ⅱ表达
2.5 CGA对炎性HGE细胞自噬蛋白表达的影响 与Control组比较,P.g组LC3Ⅱ/I、Beclin-1蛋白表达水平显著升高,P62表达水平显著降低(P<0.05);与P.g组比较,浓度为10.0、20.0、40.0 mg/L的CGA处理组LC3Ⅱ/I、Beclin-1蛋白表达水平显著降低,P62表达水平显著升高(P<0.05),且呈药物浓度依赖性;与40.0 mg/L CGA组比较,CGA+AICAR组HGE细胞LC3Ⅱ/I、Beclin-1蛋白表达水平显著升高,P62表达水平显著降低(P<0.05),见图5。
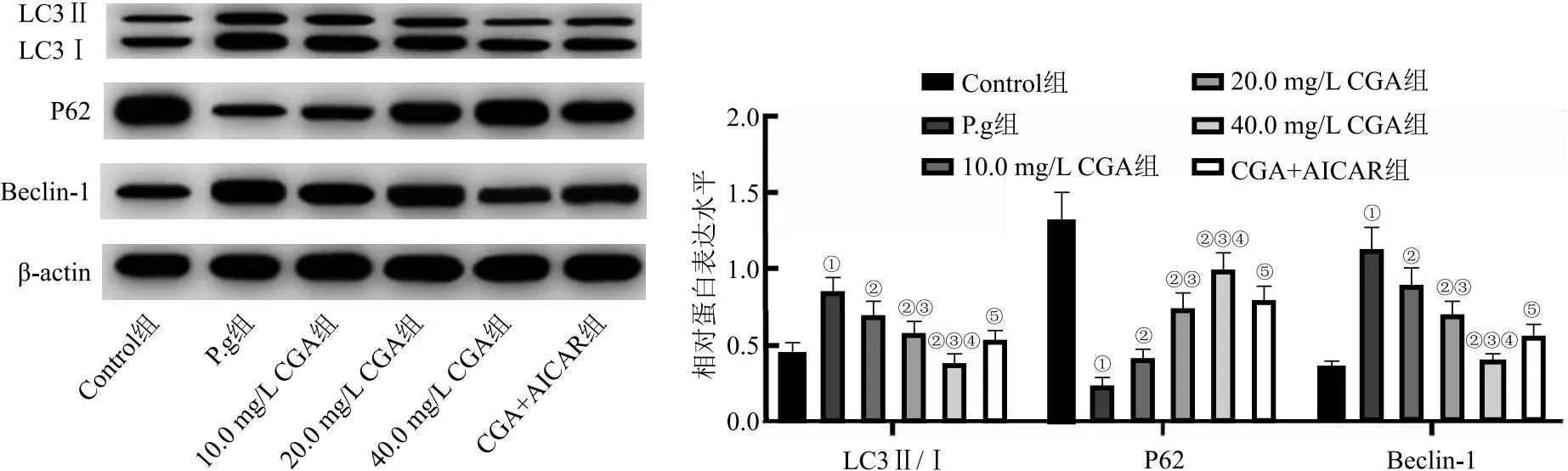
图5 Western blot检测炎性HGE细胞LC3Ⅱ/I、Beclin-1、P62蛋白表达
2.6 CGA对炎性HGE细胞AMPK/ULK1通路相关蛋白表达的影响 与Control组比较,P.g组p-ULK1、p-AMPK蛋白表达水平显著升高(P<0.05);与P.g组比较,浓度为10.0、20.0、40.0 mg/L的CGA处理组p-ULK1、p-AMPK蛋白表达水平显著降低(P<0.05),且呈药物浓度依赖性;与40.0 mg/L CGA组比较,CGA+AICAR组HGE细胞p-ULK1、p-AMPK蛋白表达水平显著升高(P<0.05),见图6。

图6 Western blot检测炎性HGE细胞p-ULK1、p-AMPK蛋白表达
3 讨论
P.g可诱导口腔来源细胞如牙龈上皮细胞、牙龈成纤维细胞的自噬,实现其在宿主细胞内的生存和增殖,进而促进牙周炎的炎性反应。脂多糖是P.g外膜的重要毒力因子,可激活细胞炎症反应与自噬[10]。本研究使用P.g诱导HGE细胞后,细胞自噬水平升高,表明建模成功。
CGA是一种由咖啡酸和奎尼酸组成的缩酚酸化合物,具有抗炎、抗氧化、抗肿瘤、抗病毒的作用,还具有调节糖脂代谢,治疗代谢疾病的作用[11-12]。研究显示,CGA可抑制高糖诱导的人牙周膜成纤维细胞凋亡[13];且CGA可抑制P.g的增殖,表现出抗菌作用,还可抑制P.g的蛋白酶活性,对牙周疾病具有保护作用[7]。本研究使用5~60 mg/L的CGA处理炎性HGE细胞24 h后,HGE细胞增殖活性下降,表明CGA对炎性HGE细胞增殖有抑制作用,且CGA浓度在10 mg/L及其以上时,可显著抑制HGE细胞的增殖,故选择浓度为10、20、40 mg/L的CGA进行后续实验。
CGA可调节细胞自噬,自噬与细胞凋亡密切相关,如CGA可通过上调溶酶体功能增强自噬保护过氧化氢诱导的人神经母细胞瘤细胞氧化损伤[14];而在皮质酮诱导的PC12细胞中,CGA可通过抑制自噬,抑制PC12细胞凋亡[9]。本研究使用10、20、40 mg/L的CGA处理炎性HGE细胞,发现CGA可呈浓度依赖性方式诱导HGE细胞凋亡。LC3Ⅱ、Beclin-1、P62自噬的标志性蛋白,P.g被报道可促进人牙龈成纤维细胞自噬,诱导LC3Ⅱ表达[15]。本研究使用不同浓度的CGA处理炎性HGE细胞后,LC3Ⅱ、Beclin-1蛋白表达水平显著降低,P62表达水平显著升高,且呈浓度依赖性,表明CGA可抑制炎性HGE细胞自噬,诱导细胞凋亡。这与既往研究中CGA诱导自噬的结果不一致,推测其原因可能与自噬的特性有关。因为自噬是一把双刃剑,即可诱导凋亡,又可抑制凋亡,这种抑制或促进作用可以根据细胞内情形而相互转化。
细胞自噬由多种信号通路调控,AMPK是细胞能量感受器,也是应激反应触发自噬的主要调节因子[16-17];在能量缺乏下,AMPK发生磷酸化而被激活,活化的AMPK可以使自噬起始关键蛋白ULK1磷酸化,ULK1活化后,可提高FUNDC1与LC3Ⅱ的结合效率,促进自噬的产生[18]。AMPK/ULK1信号通路在多种疾病(如药物神经损伤、脑缺血、肝损伤)的自噬中发挥重要调控作用[19-20]。研究显示,抑制AMPK/ULK1通路激活可抑制缺氧复氧诱导的星形胶质细胞自噬,促进细胞存活并减少细胞凋亡[21]。而激活AMPK/ULK1通路,可诱导心肌细胞自噬与凋亡[22]。本研究使用不同浓度CGA处理炎性HGE细胞后,p-ULK1、p-AMPK蛋白水平降低,且呈浓度依赖性,提示CGA具有抑制AMPK/ULK1通路激活的作用。此外,本研究还显示,使用AMPK激活剂AICAR与CGA共同处理炎性HGE细胞后,HGE细胞凋亡率下降,LC3Ⅱ、Beclin-1蛋白水平显升高,P62表达水平降低,表明AICAR可部分逆转CGA对炎性HGE细胞自噬的抑制作用。以上结果表明,CGA可能通过抑制AMPK/ULK1通路,抑制人牙龈上皮细胞自噬,促进细胞凋亡。但姚宏纪等[8]的报道显示,CGA对AMPK发挥激动作用,在糖尿病合并糖脂代谢紊乱的小鼠中,CGA可通过激活AMPK改善血脂、糖耐量和胰岛素抵抗。这与本研究结果不一致,推测CGA对AMPK是发挥激动还是抑制作用与疾病、细胞和组织类型有关。
4 结论
CGA可通过抑制AMPK/ULK1通路抑制炎性HGE细胞自噬与增殖,并促进细胞凋亡。本研究初步探讨了CGA作为牙周炎治疗候选药物的潜力,但CGA的具体作用与机制尚需进一步的研究验证,在未来的研究中将以牙龈成纤维细胞为对象并结合体内实验,进行深入分析。此外,CGA在机体的代谢与安全性评估也是接下来的研究重点。
