匹莫齐特对金黄色葡萄球菌的体外和体内抗菌研究
2023-12-22张晓洁佘鹏飞李颖佳
陈 体,段 瑶,张晓洁,佘鹏飞,李颖佳
(1.中南大学湘雅三医院检验科,湖南 长沙 410013; 2.中南大学湘雅二医院精神卫生研究所,湖南 长沙 410011; 3.国家精神心理疾病临床医学研究中心,湖南 长沙 410011)
金黄色葡萄球菌(Staphylococcusaureus,SA)是一种凝固酶和过氧化氢酶均阳性的最常见革兰阳性球菌。SA通常可导致皮肤软组织感染、菌血症和骨关节感染等疾病,如治疗不当,可造成严重后果,甚至死亡。随着青霉素类抗生素的不合理使用,SA的耐药率不断增加[1]。
耐甲氧西林金黄色葡萄球菌(methicillin-resistantStaphylococcusaureus,MRSA)是指含有mecA基因或者对苯唑西林耐药的SA[2]。MRSA感染较甲氧西林敏感金黄色葡萄球菌(MSSA)感染具有更高的病死率,是二十一世纪面临的最重要问题之一。MRSA在医疗环境和相关感染患者中分离率极高,占临床分离SA的45.9%[3]。由于MRSA广泛的耐药性,世界卫生组织(WHO)不断呼吁研发新型抗菌药物来应对耐药问题[4]。针对难治性MRSA感染的有效药物研究可以减少患者对糖肽类抗生素如万古霉素和替考拉宁的依赖性,从而减缓耐药菌的产生。达托霉素是自2003年以来美国食品药品监督管理局(Food and Drug Administration,FDA)唯一批准上市的天然抗生素,被认为是治疗MRSA相关菌血症的一线药物,但2020年Thitiananpakorn等[5]发现,MRSA对达托霉素和万古霉素存在交叉耐药。因此,新型抗菌药物的研发已成为亟待解决的问题。
匹莫齐特是FDA批准的一种二苯基丁哌啶类抗精神病药。1963年Janssen等[6]首次发现,匹莫齐特可用于治疗慢性精神病、Torette综合征和耐药性抽动。近年来有研究[7-8]发现,匹莫齐特可有效治疗结核分枝杆菌和伤寒沙门菌引起的感染,还能通过作用于泛素特异性蛋白酶1有效治疗弥漫性大B细胞淋巴瘤。然而,尚未有研究报道匹莫齐特对SA的抗菌作用,本文对此进行了研究,现将结果报告如下。
1 材料与方法
1.1 材料
1.1.1 试剂及仪器 恒温摇床购自上海圣科仪器设备有限公司,恒温孵育箱购自美国赛默飞公司,冷冻切片机购自德国徕卡公司,激光共聚焦显微镜购自日本蔡司公司,酶标仪购自美国Bio-Tek公司,麦氏比浊仪购自法国梅里埃公司,50 mL离心管和96孔无菌细胞培养板购自美国康宁公司,全自动组织匀浆仪购自武汉谷歌生物有限公司,匹莫齐特、庆大霉素(gentamycin,GEN)、万古霉素(vancomycin,VAN)、多西环素(doxycycline,DOX)、青霉素G(penicillin G,P)、克拉霉素(clarithromycin,CLA)、左氧氟沙星(levofloxacin,LEV)和促溶剂Cremophor EL均购自美国MedChemExpress公司,SYTO9/PI荧光染料购自美国赛默飞公司,CCK-8试剂盒购自美国MedChemExpress公司。
1.1.2 试验菌株与动物 SA标准菌株USA 300和ATCC 43300购自美国标准菌种保存库(American type culture collection,ATCC),表皮葡萄球菌(Staphylococcusepidermidis,SE)标准菌株RP62A由上海交通大学瞿涤赠送,铜绿假单胞菌标准菌株PAO1和大肠埃希菌ATCC 25922均购自ATCC菌种保存库,SA临床菌株于2019年分离自中南大学湘雅三医院住院患者痰标本。所有菌株均接种于甘油磁珠中于-80℃保存,并于羊血琼脂平板上连续传代两次后,挑取单个菌落进行试验。6周龄雌性无病原菌级ICR小鼠购自湖南斯莱克景达有限公司。
1.2 试验方法
1.2.1 微量肉汤稀释试验 将对数生长期的菌液制备成浓度相当于0.5麦氏单位(McFarland,McF),用Mueller-Hinton (MH)肉汤稀释200倍后备用。用MH肉汤将匹莫齐特稀释至64 μg/mL,再进行倍比稀释,使药物浓度依次为64、32、16、8、4、2 μg/mL,分别加到96孔无菌细胞培养板中,每孔50 μL,再加入50 μL稀释好的菌液。将96孔细胞培养板放置湿盒,37℃培养16~18 h后读取最低抑菌浓度(minimal inhibitory concentration,MIC),即孔内完全抑制细菌生长的最低药物浓度。同时检测并记录630 nm处的OD值,即为细菌的相对生长浊度。从1×MIC至最高浓度孔中分别吸取5 μL培养液至羊血琼脂平板上,37℃过夜孵育,以血琼脂平板上生长的菌落数小于0.1%的接种菌量对应肉汤管中的最低浓度为最低杀菌浓度(minimal bactericidal concentration,MBC),即能够杀灭培养基内99.9%细菌的最低抗菌药物浓度[9]。
1.2.2 匹莫齐特对生物膜的抑制和清除试验 (1)生物膜抑制试验:将匹莫齐特用胰蛋白胨大豆肉汤(Tryptone Soya Broth,TSB)进行倍比稀释,于96孔无菌细胞培养板每孔加入50 μL。挑取SA单个纯菌落于TSB中,37℃ 180 r/min振荡培养24 h。将菌悬液调为0.5 McF并用TSB稀释至约1×106CFU/mL,每孔加入50 μL。将96孔细胞培养板放置湿盒中,37℃静置孵育24 h,弃上清液,用生理盐水漂洗3次去除未与孔壁结合的浮游菌。于酶标仪检测630 nm处的OD值,即为生物膜的相对量。(2)生物膜清除试验:将24 h振荡培养的菌悬液用新鲜TSB 1∶200稀释后,于96孔无菌细胞培养板中每孔加入200 μL。放置湿盒中,37℃静置孵育24 h,弃上清液,用生理盐水漂洗去除未与孔壁结合的细菌。将匹莫齐特用TSB肉汤进行倍比稀释后,每孔加入100 μL,继续静置孵育24 h,用生理盐水漂洗去除未结合细菌,并于酶标仪检测630 nm处的OD值[9]。
1.2.3 激光共聚焦显微镜(confocal laser scanning microscope,CLSM)观察生物膜 (1)生物膜抑制试验观察:将无菌盖玻片放置于6孔板中,每孔加入1 mL含有不同浓度药物的TSB培养基,再加入1 mL培养24 h的菌悬液,使其终浓度约为1×106CFU/mL。湿盒中37℃静置培养24 h后,用生理盐水去除未与盖玻片结合的细菌,分别滴加20 μL浓度为10 μmol的SYTO9和PI荧光染液。避光孵育15 min后,用生理盐水漂洗去除多余染液,并于CLSM观察生物膜的荧光着色情况。(2)生物膜分散试验观察:将无菌盖玻片放置6孔板中,每孔加入2 mL 1×106CFU/mL的菌悬液,37℃静置培养24 h构建生物膜。用生理盐水去除未与盖玻片结合的细菌,再分别加入2 mL含有不同浓度药物的TSB肉汤。继续37℃静置孵育24 h后,用生理盐水去除未与盖玻片结合的细菌,进行SYTO9/PI染色,其余同上[10]。
1.2.4 棋盘稀释法测定匹莫齐特与抗菌药物的联合抗菌效果 使用96孔无菌细胞培养板,用MH肉汤将匹莫齐特进行倍比稀释,其他待测抗菌药物最高从2×MIC浓度开始稀释,均采用8个稀释度,各取50 μL分别排列在平板的行与列上。在无菌微孔板中接种对数生长期SA ATCC 43300使终浓度约为5×105CFU/mL,37℃培养16~18 h后判断结果,无细菌生长的最低药物浓度为MIC。通过计算协同抑菌指数(fractional inhibitory concentration,FIC)判断相互作用。FIC=联合用药时甲药MIC/单独应用甲药时MIC+联合应用乙药时MIC/单独应用乙药时MIC,FIC指数≤0.5、>0.5~1、>1~2和>2时分别表示协同、相加、无关和拮抗作用[11]。
1.2.5 CCK-8检测细胞毒性 使用DMEM高糖培养基+10%胎牛血清+1%青霉素和链霉素双抗(P/S),5% CO2,37℃体外培养HEK-293T细胞。待细胞汇合度达到80%后,使用胰蛋白酶消化贴壁细胞,待细胞消化完成后用DEME培养基终止消化,1 000 r/min离心5 min收集细胞,再使用DMEM培养基重悬细胞沉淀,并进行细胞计数。以每孔10 000个细胞的密度接种于96孔无菌细胞培养板中,每孔50 μL。再分别加入倍比稀释的匹莫齐特,使其终浓度分别为64、32、16、8、4、2 μg/mL。将96孔细胞培养板置于二氧化碳温箱孵育24 h。每孔再分别加入CCK-8溶液10 μL,37℃孵育箱中继续培养1.5 h,使用酶标仪在450 nm波长下检测各孔的吸光度[12]。
1.2.6 匹莫齐特体内抗菌活性及毒性研究[13]将35只清洁级6~8周ICR雌性小鼠(体重约25 g)随机分成5组,分别为对照组、匹莫齐特组、VAN组、DOX组、匹莫齐特+DOX组,每组7只小鼠。观察小鼠的精神状态,生理状态,饮水和饮食情况,适应7 d后背部皮肤去毛备用。离心收集对数生长期SA ATCC 43300,用生理盐水调成3 McF的菌液,每只小鼠背部皮下注射接种200 μL的菌液。感染30 min后,每组背部皮下分别注射剂量为30 mg/kg的相应药物,对照组仅注射DMSO溶剂,观察小鼠的精神、生理状态,以及饮水和饮食情况有无变化,如有明显变化详细记录,感染24 h后观察背部脓肿大小并拍照。采用心脏采血法采集小鼠血液,分离血清进行丙氨酸转氨酶(glutamic-pyruvic transaminase,ALT)、尿素氮(urea nitrogen,Urea)和肌酸激酶(creatine kinase,CK)检测,评价小鼠肝、肾及心肌功能。同时将小鼠背部脓肿部位剪下放入无菌试管中,每组7只小鼠脓肿组织,留取一个组织进行hematoxylin-eosin(HE)染色和革兰染色,其余6个组织剪碎,添加1 mL生理盐水,超声破碎处理后进行细菌计数。HE和革兰染色:取新鲜脓肿组织置于4%的多聚甲醛固定24 h,再沉糖48 h后用包埋剂进行包埋处理,将冷冻好的包埋组织进行冰冻切片及HE染色、革兰染色,显微镜观察组织切片[13]。
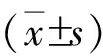
2 结果
2.1 匹莫齐特对SA的抑菌活性 药敏试验结果显示,匹莫齐特对SA(包括MRSA和MSSA)具有良好的抗菌活性,MIC为8~16 μg/mL。匹莫齐特对SE也具有抗菌活性,MIC为16 μg/mL,但匹莫齐特对这些细菌的MBC均>32 μg/mL,且对常见的革兰阴性菌,如铜绿假单胞菌和大肠埃希菌均无抗菌活性,见表1。2 μg/mL亚抑菌浓度的匹莫齐特对MRSA标准菌株也具有显著的抑制活性,可分别使SA ATCC 43300(见图1A)和USA 300(见图1B)的菌量从(100±3.99)%、(100±3.80)%减少到(79.81±0.84)%、(69.58±8.54)%(q值分别为6.47、6.17,均P<0.05)。且随着匹莫齐特的浓度增高,其抗菌活性越强,具有明显的剂量依赖性。
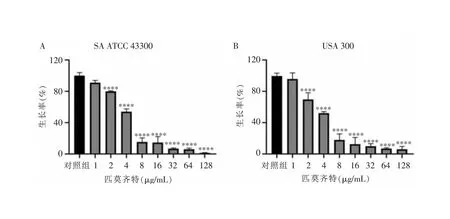
注:****表示与对照组比较,P<0.000 1;A为SA ATCC 43300;B为USA 300。
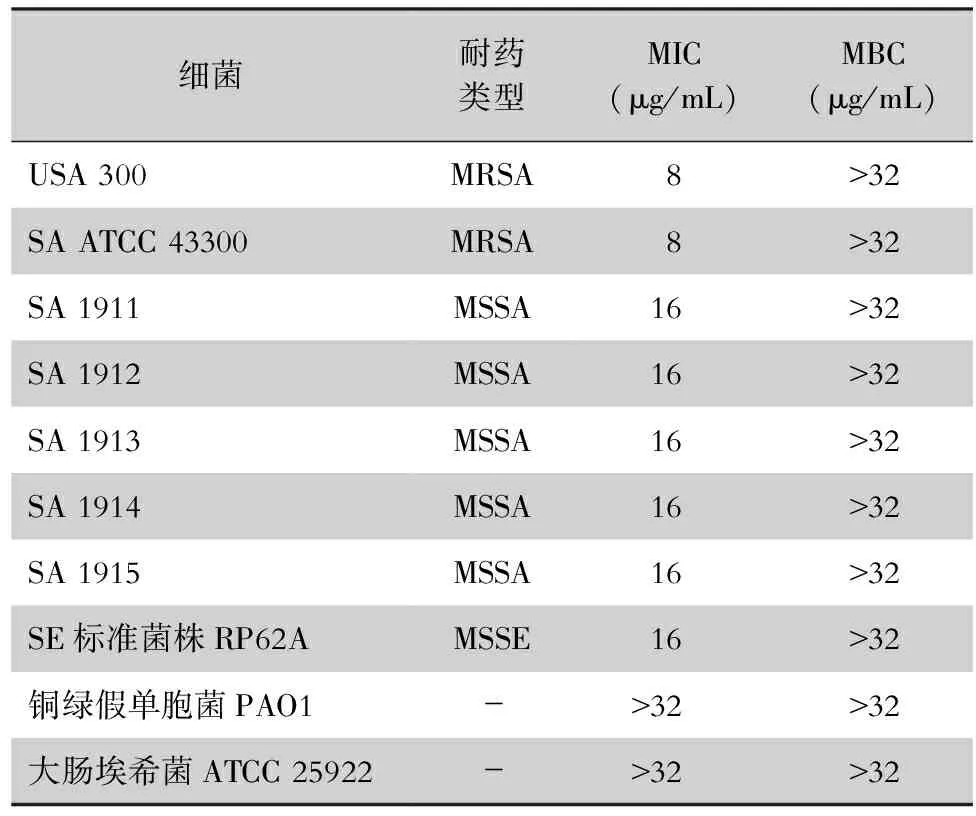
表1 细菌对匹莫齐特的敏感试验结果
2.2 匹莫齐特抗SA生物膜的作用 匹莫齐特抗生物膜活性的定量检测结果显示,4 μg/mL的匹莫齐特可明显抑制MRSA生物膜的形成,使SA ATCC 43300和USA 300的生物膜形成量从(100±13.49)%、(100±6.43)%(见图2A)分别降至(62.06±10.13)%(q=2.99,P<0.05)、(81.98±4.84)%(q=2.64,P<0.05)(见图2B)。且随着匹莫齐特浓度增高,对生物膜抑制效果越强。同时,8 μg/mL和16 μg/mL的匹莫齐特还能明显清除已形成的生物膜,分别使SA ATCC 43300和USA 300的生物膜总量从(100±18.27)%、(100±6.72)%(见图2C)减少至(55.60±9.80)%(q=3.89,P<0.05)、(9.11±1.14)%(q=23.98,P<0.05)(见图2D)。进一步采用CLSM观察生物膜的形态发现,对照组生物膜结构完整,主要呈现绿色荧光。采用8 μg/mL的匹莫齐特处理SA ATCC 43300菌株24 h后能有效抑制SA生物膜形成,有效降低绿色荧光强度且增加死菌(红色荧光)比例(见图3A)。对照组中已形成的生物膜几乎布满盖玻片,以绿色荧光为主,几乎未见红色死菌(见图3B)。而8 μg/mL匹莫齐特处理USA 300菌株后,生物膜结构明显破坏,总量明显减少,红色荧光比例增加。
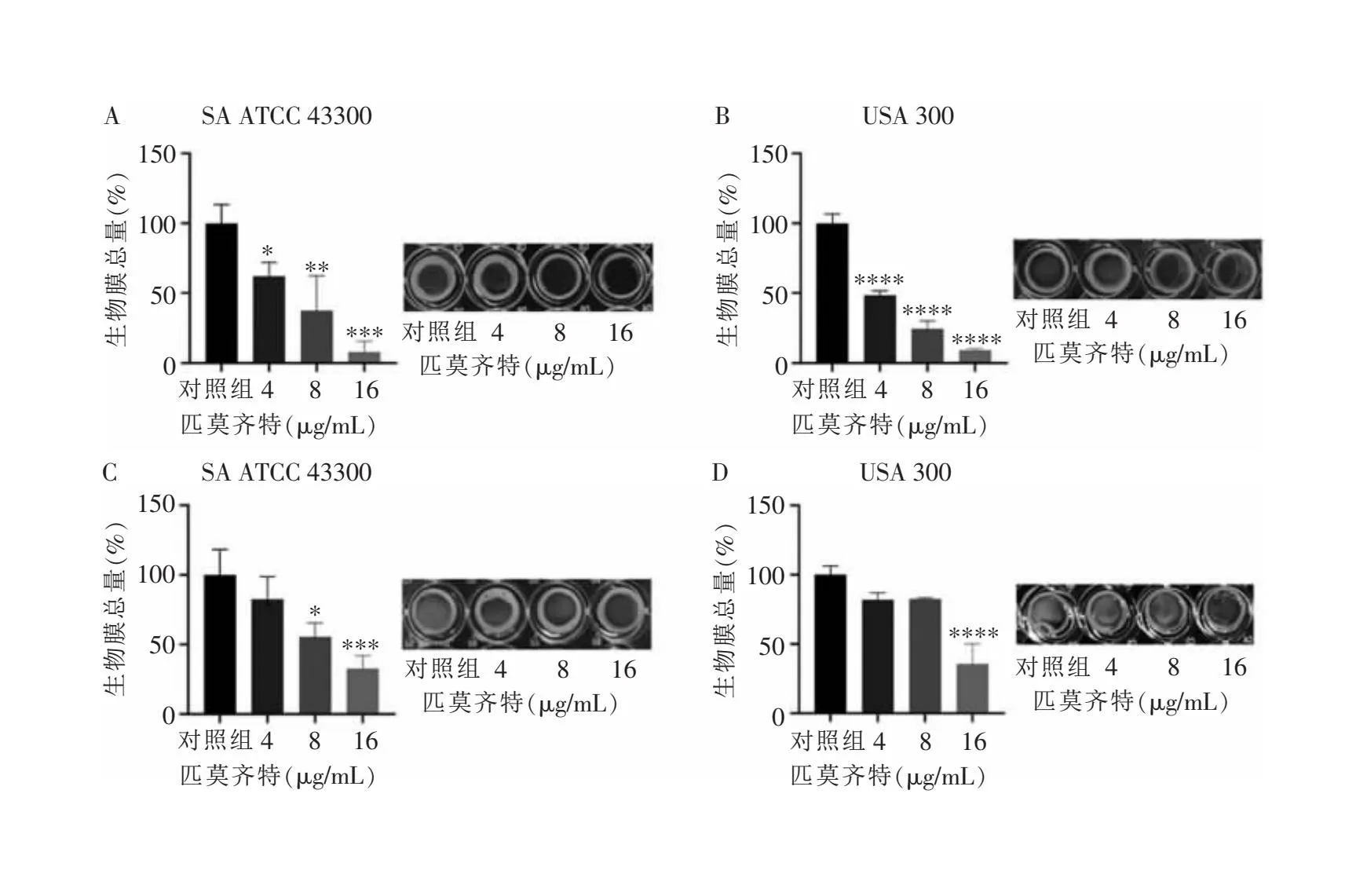
注:A和B分别为匹莫齐特对SA ATCC 43300、USA 300的生物膜抑制作用;C和D分别为匹莫齐特对SA ATCC 43300、USA 300的生物膜分散作用;与对照组比较,*表示P<0.05,**表示P<0.01,***表示P<0.001,****表示P<0.000 1。
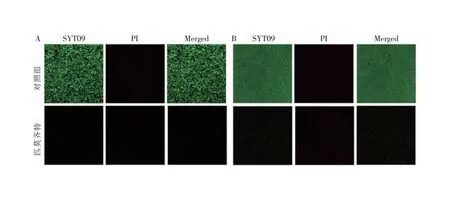
注:A为生物膜抑制作用;B为生物膜分散作用。
2.3 匹莫齐特与抗菌药物联合抗菌效果 分别选取不同种类的常用抗菌药物与匹莫齐特进行联合药敏试验,结果显示匹莫齐特与VAN、CLA和P联合均表现为无关作用,FIC值为2。匹莫齐特与GEN、LEV联合为拮抗作用,FIC值均>2。但匹莫齐特与DOX联合具有明显的协同抗菌作用,FIC为0.5。见图4。因此,后续动物模型中,选择匹莫齐特与DOX联用评估体内抗菌活性。
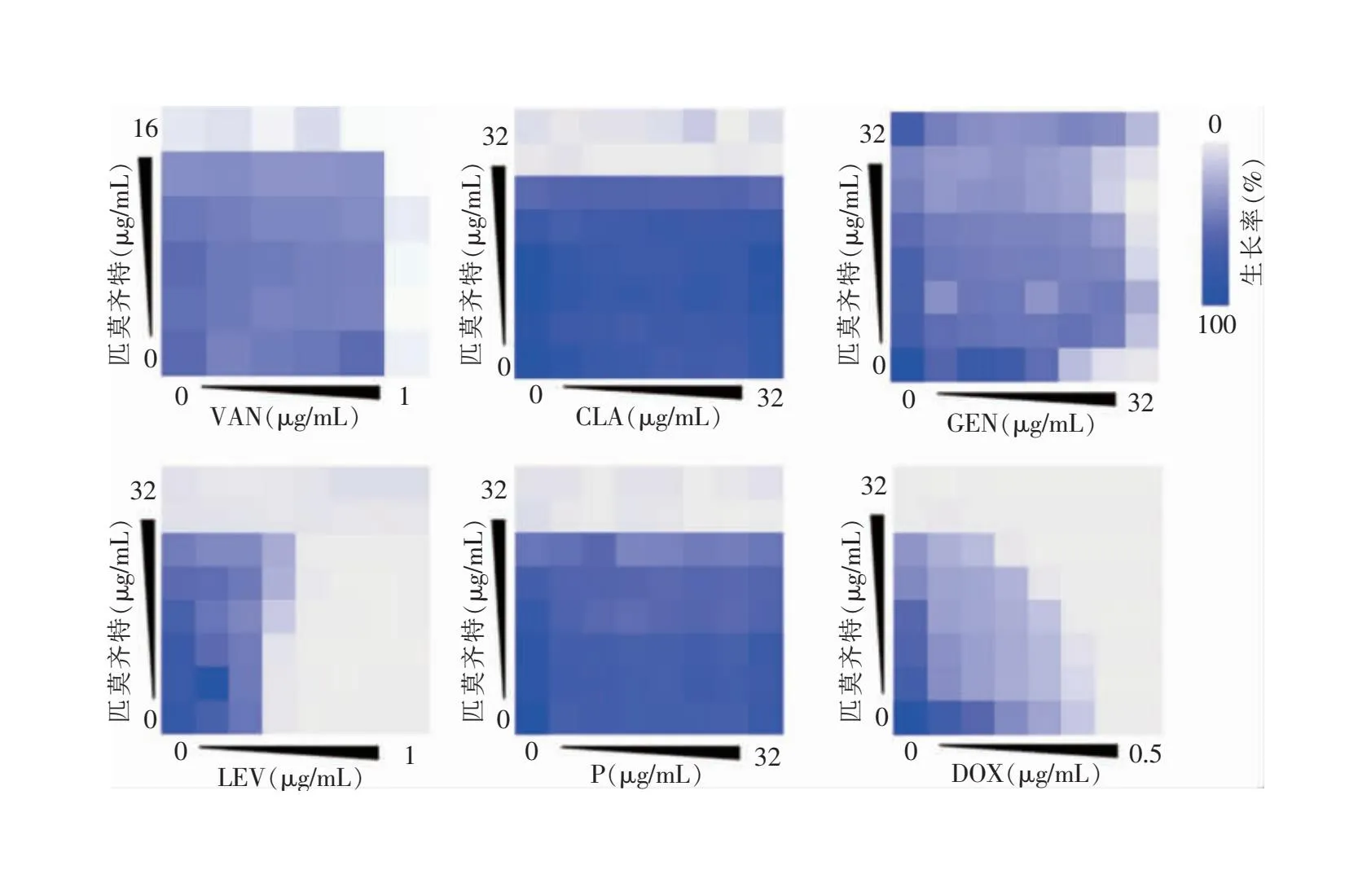
图4 棋盘稀释法检测匹莫齐特与常用抗菌药物对MRSA SA ATCC 43300的联合抗菌效果
2.4 匹莫齐特毒性及体内抗菌活性检测结果 CCK-8试验发现,匹莫齐特半数抑制浓度>64 μg/mL,细胞毒性极低。随后,通过构建小鼠脓肿模型,发现30 mg/kg的匹莫齐特虽然单用效果不佳,但其与30 mg/kg DOX联用后,可显著降低脓肿的大小(见图5A),表现出有效的协同作用。匹莫齐特+DOX组还能明显降低脓肿组织中的细菌载量,使活菌量从(8.25±0.13)对数值CFU/脓肿减少到(3.31±0.81)对数值CFU/脓肿(q=3.74,P<0.05)(见图5B)。脓肿组织切片革兰染色结果显示,与未加药的对照组比较,匹莫齐特+DOX组脓肿中的聚集细菌显著减少(见图5C);脓肿组织切片HE染色结果显示,对照组具有明显的炎性细胞浸润,而匹莫齐特+DOX组可有效降低组织中的炎性浸润(见图5C)。与未加药的对照组相比,匹莫齐特+DOX组对肝功能生化指标ALT、肾功能生化指标Urea和心肌功能生化指标CK的表达量均无明显影响(均P>0.05,见图6),说明抗菌剂量的匹莫齐特具有良好的体内耐受性。
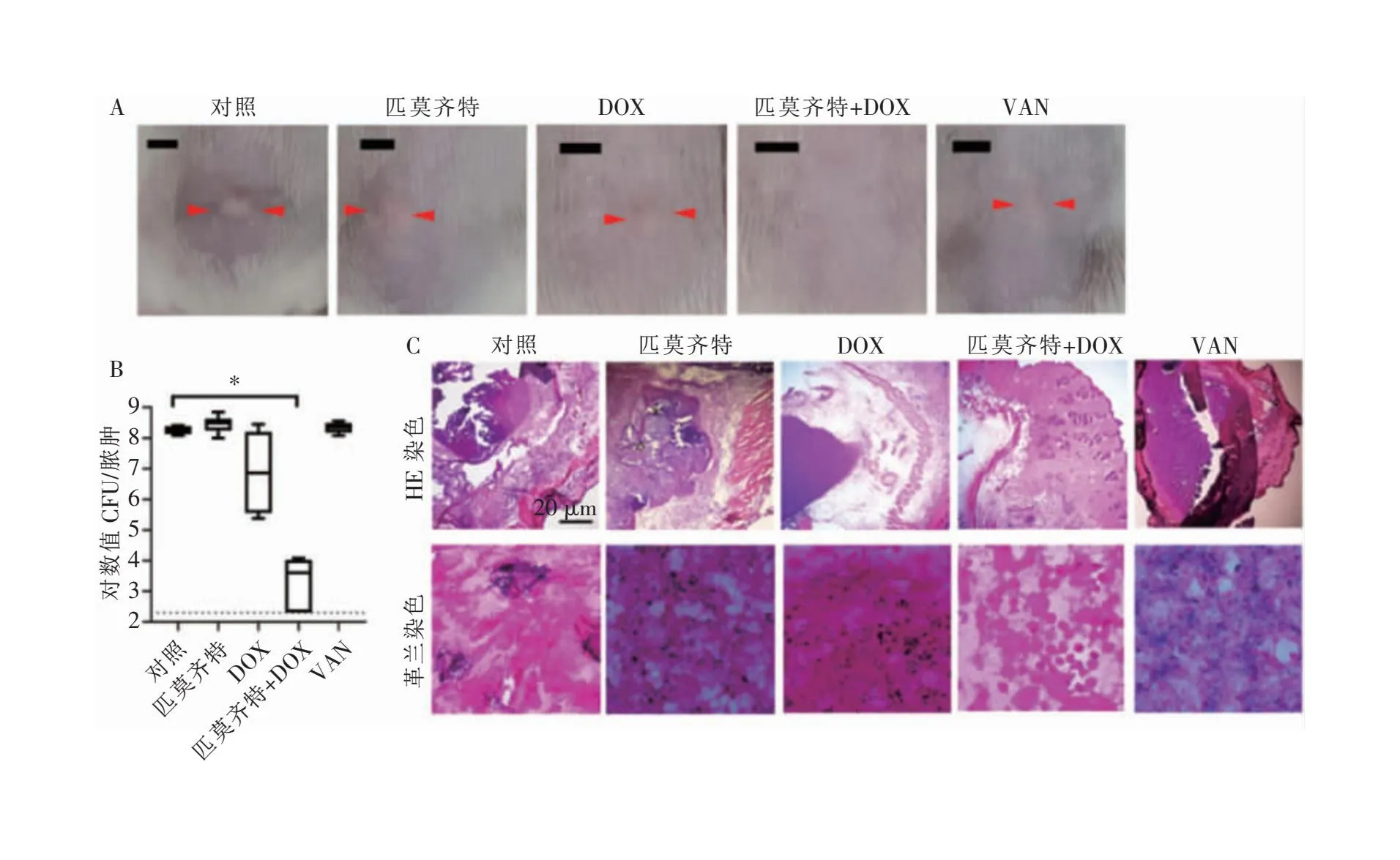
注:A为匹莫齐特单用或与DOX联用后小鼠皮下脓肿的代表性图片,红色箭头表示脓肿的位置,未标记的图片表示未见脓肿组织,标尺为2.5 mm;B为脓肿菌载量计数;C为HE染色和革兰染色观察脓肿病理改变,标尺为20 μm;*表示与对照组比较,P<0.05。
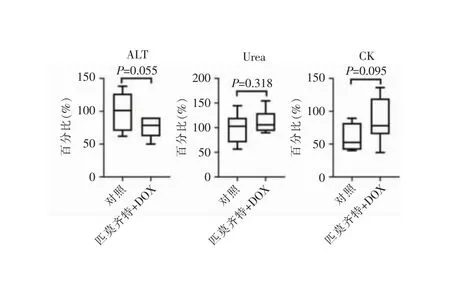
注:匹莫齐特+DOX组体内毒性检测结果,其中 ALT、Urea和CK分别代表肝、肾和心肌功能生化指标。
3 讨论
难治性SA感染是临床诊疗中的棘手问题,目前尚无针对SA生物膜有效的抗菌药物,因此,新型抗菌药物的研发亟不可待。老药新用具有研发成本低和研发效率高等优点,已成为当下的研究热点。本研究通过系列试验发现,哌啶类抗精神病药匹莫齐特具有有效的抗菌活性,其对SA的MIC为8~16 μg/mL。每毫升微克级别的匹莫齐特还能明显抑制SA生物膜的形成,并能清除已形成的生物膜。此外还发现,匹莫齐特与DOX联用具有体外和体内协同抗菌性及极低的细胞和体内毒性。
SA生物膜是细菌的高耐药表型突变。生物膜状态下的SA,其耐药性要比相应的浮游菌高10~1 000倍不等,成为复发性感染常见原因之一[14]。生物膜内部常形成持留菌,持留菌是细菌的一种休眠体,不分裂增殖且胞内代谢活性极低,对常见抗菌药物均耐药。持留菌可出现在生长的平台期或生物膜内部,当细菌周围微环境发生改变时,持留菌可随着营养物质的获得而转变成增殖活跃态的细菌,从而引起感染反复[15]。近年来,研发针对生物膜的新型抗菌药物已成为研究热点。本研究发现哌啶类药物匹莫齐特具有明显的生物膜抑制和清除作用,对耐药菌的杀菌特点使其比传统抗菌药物更具实用价值。类似的研究有:Lee等[16]发现治疗特发性血小板减少性紫癜类药物艾曲波帕对MRSA具有明显的体外和体内抗菌活性;Oliveira等[17]发现非甾体类抗炎药物布诺芬能有效抑制SA生物膜的形成,并能进一步破坏细菌细胞膜,引起胞内内容物流出;再如,乙醛脱氢酶1型抑制剂双硫仑对SA及其多重耐药菌具有明显的体外和体内抗菌活性。双硫仑还能清除SA已形成的生物膜,其胞内杀菌能力和抗菌药物后效应均优于VAN[18]。
匹莫齐特具有极低的细胞毒性和良好的体内耐受性。大鼠试验中,匹莫齐特口服用药的半数致死剂量高达1 100 mg/kg,小鼠的半数致死剂量高达228 mg/kg[19]。但仍有少量研究[20]报道,匹莫齐特单日服用剂量超过20 mg/d时可引起精神病患者猝死。但与其他抗精神病类药物相比,匹莫齐特的不良反应仍然较小。本研究中,小鼠单次注射匹莫齐特的剂量为30 mg/kg,无论是单独使用还是与抗生素DOX联合使用,小鼠的精神、生理状态及饮水和饮食情况与对照组比较,差异均无统计学意义。本研究发现,处理时间段匹莫齐特小鼠肝、肾和心肌功能未出现明显改变,说明当匹莫齐特作为抗菌药物使用时,其有效治疗剂量在处理时段对小鼠的体内毒性较小。虽然匹莫齐特长期并多次给药是否会对机体产生明显毒性还需后期进一步研究,但考虑到SA主要以皮肤软组织等局部感染为主[1],因此,可将匹莫齐特作为局部感染用药或外用,以减少不良反应。此外,后续还可进一步对匹莫齐特联用抗菌药物进行优化,探索最佳给药剂量和给药频率,以降低匹莫齐特的用量。总而言之,匹莫齐特在临床使用中具有高安全性、低不良反应发生概率、药价便宜和可获得性高等优点。因此,具有极大的研发潜力,便于后期进一步改造优化,以提高其抗菌活性并减少不良反应。
本研究中,匹莫齐特显示出与DOX有效的体外和体内协同抗菌效果。抗菌药物联用具有诸多优点,如降低单种药物的使用剂量即可达到最佳治疗效果;增强药物对MRSA的抗菌效果;有效降低细菌的耐药性产生频率等[21]。因此,低剂量的匹莫齐特还可作为DOX的佐剂,增强其抗菌效果和临床实用性。
综上所述,匹莫齐特对SA及其生物膜具有明显的杀菌活性。匹莫齐特的细胞毒性低,且30 mg/kg的匹莫齐特还具有明显的体内抗菌活性。但本研究存在一定局限性,如匹莫齐特作为抗菌药物使用时的体内毒理学数据尚需要明确,匹莫齐特与DOX联用时的体内药代动力学改变尚需进一步研究,匹莫齐特的作用机制尚未阐明等。此外,考虑到匹莫齐特本身用于治疗精神病类疾病,因此,匹莫齐特可能更适用于精神病患者合并SA相关感染的治疗。
利益冲突:所有作者均声明不存在利益冲突。
