免疫缺陷人群新型冠状病毒感染诊治策略中国专家共识(2023.V2版)
2023-12-22巨春蓉王梅英徐永昊许芝彬徐培航赖逾鹏陈莉延李时悦薛武军卢洪洲黎毅敏俞云松
巨春蓉,王梅英,袁 静,徐永昊,许芝彬,徐培航,赖逾鹏,陈莉延,李时悦,薛武军,卢洪洲,黎毅敏,俞云松
[1.广州医科大学附属第一医院广州呼吸健康研究院,广东 广州 510120; 2.国家呼吸医学中心,广东 广州 510120; 3.国家呼吸疾病临床研究中心,广东 广州 510120; 4.呼吸疾病国家重点实验室,广东 广州 510120; 5.深圳市第二人民医院(深圳大学第一附属医院),广东 深圳 518025; 6.国家生化工程技术研究中心,广东 深圳 518025; 7.深圳市第三人民医院(南方科技大学第二附属医院),广东 深圳 518112; 8.国家感染性疾病临床医学研究中心,广东 深圳 518112; 9.深圳禾正医院,广东 深圳 518073; 10.西安交通大学第一附属医院肾脏病医院,陕西 西安 710061; 11.中华医学会器官移植学分会,北京 100010; 12.浙江省人民医院,浙江 杭州 314408; 13.中国医药教育协会感染疾病专业委员会,北京 100191]
自2019年新型冠状病毒(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2,以下简称新冠病毒)感染流行以来,至2023年1月20日已导致全球超过6.64亿例确诊病例和670多万例死亡患者[1]。迄今,新冠病毒经历了原始株、阿尔法变异株(Alpha)、德尔塔变异株(Delta)和奥密克戎变异株(Omicron)等病毒株的变异。至2022年底,新冠病毒历经了多次的变异,其中流行时间较长的病毒变异株依次是Delta和Omicron。截至2023年5月17日,被标注为需要留意的变异株(Variant of Interest,VOIs)有2个,分别为XBB.1.5和XBB.1.16;需要关注的变异株(Variant of Concern,VOCs)有5个,分别为B.1.1.7、B.1.351、P.1、B.1.617.2和B.1.1.529;监视下的变异株(Variants Under Monitoring,VUMs)为7个,分别为BA.2.75、CH.1.1、BQ.1、XBB、XBB.1.9.1、XBB.1.9.2和XBB.2.3。截至2023年8月31日,全国31个省(自治区、直辖市)及新疆生产建设兵团共报送9 608例本土病例新冠病毒基因组有效序列,均为奥密克戎变异株,涵盖106个进化分支,主要流行株为XBB系列变异株,占比居前3位的分别为XBB.1.9及其亚分支、XBB.1.22及其亚分支、XBB.1.16及其亚分支。这些变异株在以下三个方面有比较严重的后果:(1)病毒传播速度的加快;(2)对单克隆抗体治疗的敏感性下降;(3)不能被疫苗或自然感染产生的多克隆抗体有效中和。XBB家族是一类新冠病毒奥密克戎(Omicron)变异体的一些亚系分支株,其特点是在尖刺蛋白中携带了F486P突变。XBB.1.16于2023年1月首次被发现[2],随后在印度、美国、新加坡和澳大利亚、中国等国家或地区流行,2023年3月5日被正式命名。XBB.1.16也携带了F486P突变,同时其刺突蛋白中还有两个突变位[3]。美国目前流行的变异株中仍以XBB.1.5为主,但XBB.1.16和XBB.1.9.1近期占比均上升。我国近期输入病例中XBB.1.16的占比增加,但本土病例中XBB.1.16仍维持相对低水平,还未形成传播优势。
感染新冠病毒后,患者病情发展、转归及后续特异性免疫力的产生都与其机体免疫功能密切相关[4]。免疫缺陷人群是指具有遗传或获得性免疫功能受损的群体,主要包括原发性免疫缺陷病患者、艾滋病(AIDS)患者、实体器官移植受者、造血干细胞移植受者、正接受化学治疗的恶性肿瘤患者、因风湿免疫性疾病等接受糖皮质激素治疗者、正在接受其他免疫抑制剂(如环孢素、环磷酰胺、羟氯喹、甲氨蝶呤)治疗者等[5]。此类群体规模庞大,以实体器官移植为例,早在2015年,我国每年实施的器官移植手术的总例数>15 000 例,2017年我国器官捐赠与移植总体规模已经位居全球第2位,近年来器官移植的数量仍然在稳步上升。2022年1—10月,我国实施器官移植手术17 141例,其中,肝脏移植5 123例,肾脏移植10 734例,心脏移植596例,肺脏移植688例。免疫缺陷人群由于免疫功能低下,其感染新冠病毒后可能面临比普通人群更高的住院率、并发症或死亡风险[6]。
近年来,随着骨髓移植和器官移植领域的迅速发展,恶性肿瘤化学治疗技术的日新月异,风湿病领域多种免疫抑制药物研发技术的不断进步等,我国免疫缺陷人群数量逐渐增多。免疫缺陷人群罹患新冠病毒感染后,其临床表现、诊断、治疗均和普通人群存在很大差异性,需要高度关注。但目前尚缺乏可供参考的针对免疫缺陷人群新冠病毒感染诊疗领域的指南或共识。基于此,广州医科大学附属第一医院广州呼吸健康研究院、国家呼吸医学中心联合中华医学会器官移植学分会、中国医药教育协会感染疾病专业委员会等,共同组织国内多个领域(呼吸与危重症医学科、器官移植科、风湿免疫科、血液科、感染科、重症医学科)共60多位专家,检索多篇国内外相关文献,撰写了《免疫缺陷人群新型冠状病毒感染诊治策略专家共识》(以下简称“共识”)。本共识基于国内外新冠病毒感染的流行病学、循证医学证据和临床研究等方面数据,采用2009版牛津大学循证医学证据分级与推荐意见强度分级方法[7](见表1),经过专家多次研讨并达成一致意见,供同道参考借鉴。
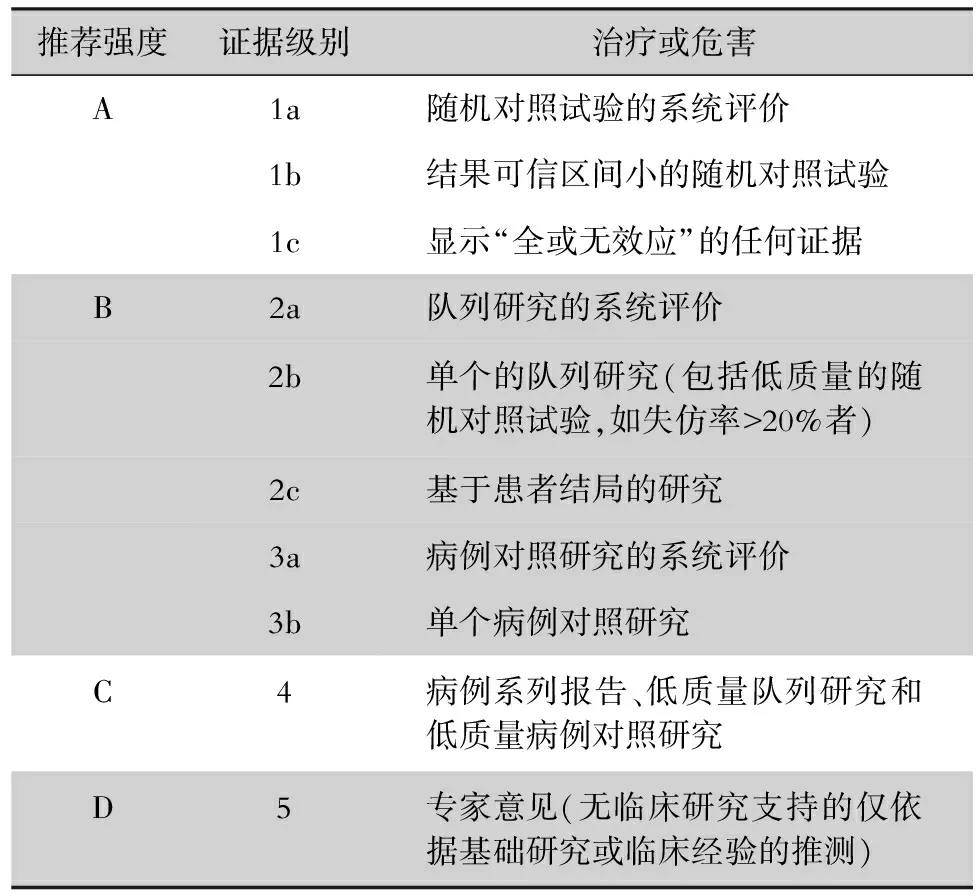
表1 2009版牛津大学循证医学证据分级与推荐意见强度分级标准
1 免疫缺陷人群新冠病毒感染的检测
1.1 检测的重要性
建议1免疫缺陷人群均属于转重型或危重型的高危人群,应主动筛查并动态监测新冠病毒。如果检测结果为阳性,应尽快和专科医生取得联系并获得相应的指引。一旦感染,建议尽快启动抗病毒治疗。(推荐强度D,证据级别5)
感染新冠病毒后的疾病严重程度及病程进展在个体间均有很大差异。免疫缺陷患者感染新冠病毒后,部分患者表现为肺炎,甚至重型或危重型肺炎;而且病程持续时间长,核酸检测持续阳性。部分免疫缺陷患者的病程呈双峰征,即首先是急性呼吸道病毒感染诱发的炎症反应,随后在重型或危重型患者中,由于免疫失调诱发炎症因子释放综合征(cytokine release syndrome,CRS)甚至炎症风暴,表现为多种细胞因子及炎症介质显著升高;同时,CRS发生、发展过程中,淋巴细胞等免疫活性细胞被趋化至炎症部位,因此,包括T细胞等早期可能出现增殖,但随后逐渐减少甚至耗竭。免疫缺陷人群罹患新冠病毒感染后存在以下特点:①因为免疫缺陷疾病类型不同而出现不同的免疫反应;②与普通人群相比,其临床表现、病程进展速度不同;③原发免疫性疾病进程及病情活动会影响新冠病毒感染后的严重程度和预后;④原有免疫抑制剂的服用及机体的免疫状态会影响新冠病毒感染病程[8]。因此,免疫缺陷人群如有新冠病毒暴露史,不论是否出现相关症状,均应主动及时检测并动态监测是否感染新冠病毒。如果罹患新冠病毒感染,应及时与专科医生取得联系并获得专业化指引,及时早期抗新冠病毒治疗,阻止新冠病毒感染重症化及规范原发免疫性疾病用药有着非常重要的意义。
1.2 检测方法
建议2免疫缺陷人群新冠病毒检测方法首选鼻咽拭子核酸,并进行动态监测。如果高度怀疑新冠病毒感染而鼻咽拭子核酸阴性时,建议检测支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)中的核酸。(推荐强度A,证据级别1c)
对于高危人群,主动进行新冠病毒的筛查和监测,可以更早地发现感染情况。早期发现有助于采取相应的隔离措施,避免病毒在人群中传播,并尽早开始治疗,从而降低病情的严重程度和死亡风险。目前新冠病毒感染的诊断标准如下。①具有新冠病毒感染的相关临床表现;②具有以下1种或以上病原学、血清学检查结果:新冠病毒核酸检测阳性;新冠病毒抗原检测阳性;新冠病毒分离、培养阳性;恢复期新冠病毒特异性IgG抗体水平较急性期升高4倍或以上[9]。新冠病毒核酸检测阳性为确诊的首要标准。
免疫缺陷人群抗体检测存在特殊性。在原发性和继发性免疫缺陷患者中观察到,注射新冠病毒疫苗后,这类人群的免疫反应受损、应答不足,抗体效价低甚至无法产生抗体[10]。对于未接种新冠病毒疫苗、既往也未产生新冠病毒抗体者,新冠病毒IgG或IgM检测阳性仅能作为回顾性诊断的参考依据。因此,对于免疫缺陷人群而言,确认新冠病毒感染的首选检测方法为病毒核酸检测和抗原检测,不推荐新冠病毒抗体作为诊断依据。核酸检测具有早期诊断、灵敏度和特异度高等特点,是确诊新冠病毒感染的“金标准”。目前使用最广泛的是实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)技术。抗原检测一般采用胶体金法和免疫荧光法,其灵敏性与感染者病毒载量呈正相关,具有检测快速、操作简便等优点[11]。但病毒抗原检测容易出现假阴性结果,阳性支持新冠病毒感染诊断,而阴性不能排除。针对免疫缺陷患者,如果有新冠病毒暴露史,而新冠病毒抗原检测阴性,建议增加新冠病毒鼻咽拭子核酸检测,以避免漏诊而延误早期抗病毒治疗;如新冠病毒鼻咽拭子核酸阴性,但胸部影像学高度怀疑新冠病毒导致的肺炎,建议进一步采集病毒载量更高的下呼吸道标本如BALF等进行核酸检测,提高检出率[12]。
少部分新冠病毒感染者可能出现“复阳”。研究显示,患有基础疾病(如心脏病、恶性肿瘤、肥胖症、糖尿病、高血压、免疫相关疾病)的患者更有可能出现新冠病毒复阳,目前认为复阳是病毒与人体免疫系统“拉锯战”的结果[12]。因此,免疫缺陷患者在新冠病毒感染确诊后,应动态监测新冠病毒核酸情况,直至新冠病毒核酸转阴(2次采样至少间隔24 h)[13-14]。
2 免疫缺陷人群新冠病毒感染后危险程度评估
建议3免疫缺陷患者感染新冠病毒后,动态监测外周血淋巴细胞计数,有条件者同时监测淋巴细胞亚群。(推荐强度B,证据级别2b)
一般情况下,新冠病毒感染者的淋巴细胞计数呈现2次下降趋势:第1次下降为感染初期,淋巴细胞被耗竭,或者从血液中分散到各器官浸润组织发挥作用。第2次下降则可能是由于免疫系统尤其是获得性免疫功能受到抑制引起淋巴细胞计数下降,患者病情恶化。一项共纳入138例确诊为新冠病毒感染住院患者的回顾性研究显示,大多数新冠病毒感染者的淋巴细胞明显减少,且非存活患者发生更严重的2次淋巴细胞减少,表明淋巴细胞计数持续显著下降可能与新冠病毒感染临床预后不佳相关[15]。
免疫细胞在新冠病毒感染后的病程中发挥至关重要的作用。新冠病毒进入人体后,通过激活固有免疫和适应性免疫系统触发炎症反应。适应性免疫系统主要包括CD4+T细胞、CD8+T细胞和B细胞,其中CD4+T细胞在急性感染期对清除病毒和改善疾病预后发挥更重要的作用。大部分免疫缺陷人群存在T细胞功能受损,当CD4+T细胞<200/mL时,容易出现病毒逃逸免疫系统[8]。研究[16]发现,即使新冠病毒感染者接受抗人类免疫缺陷病毒(HIV)治疗,病死率仍然高于无HIV感染的新冠病毒感染者。因此,免疫缺陷患者感染新冠病毒后,动态监测外周血淋巴细胞及监测淋巴细胞亚群有利于更准确地评估患者免疫状态。
建议4免疫缺陷人群确诊新冠病毒感染后,应常规进行临床病情危险程度评估,可采用免疫缺陷人群新冠病毒感染后风险评估体系。(推荐强度B,证据级别2a)
免疫缺陷人群新冠病毒感染后的病情严重程度差异较大。荟萃分析发现,免疫缺陷人群罹患新冠病毒感染后的住院风险和/或死亡风险更高。恶性血液肿瘤患者在感染新冠病毒后的死亡风险为34%[17]。与非移植患者相比,新冠病毒感染的实体器官移植患者入住ICU风险升高(OR=1.57,95%CI:1.07~2.31,P=0.02),死亡率增加(OR=1.40,95%CI:1.10~1.79,P=0.007)[18]。与普通人群相比,风湿免疫病患者的新冠病毒感染率增加(RR=1.53,95%CI:1.16~2.01),死亡率增加(OR=1.74,95%CI:1.08~2.80)[19]。与未感染HIV的患者相比,AIDS患者感染新冠病毒的死亡风险增加(RR=1.23,95%CI:1.02~1.48)[20]。普通人群的传统危险因素(包括高龄、慢性肾脏疾病、心血管疾病和其他合并症)也是免疫缺陷人群住院及死亡的重要危险因素。在对病情的影响中,某些免疫缺陷引起的危险因素甚至超过传统危险因素。研究显示,产生Ⅰ型干扰素自身抗体的人群,罹患重型新冠病毒感染的风险增高[21]。使用T细胞耗竭剂或者T细胞抑制剂(如抗胸腺球蛋白、钙调磷酸酶抑制剂、霉酚酸酯)或B细胞耗竭剂(例如利妥昔单抗)的患者,感染新冠病毒后更容易转为重型或危重型[22]。因此,建议免疫缺陷人群感染新冠病毒后,综合考虑年龄、疾病和治疗相关因素导致的异质性,进行临床病情严重程度评估,推荐采用新冠病毒感染风险评估体系(见表2)。
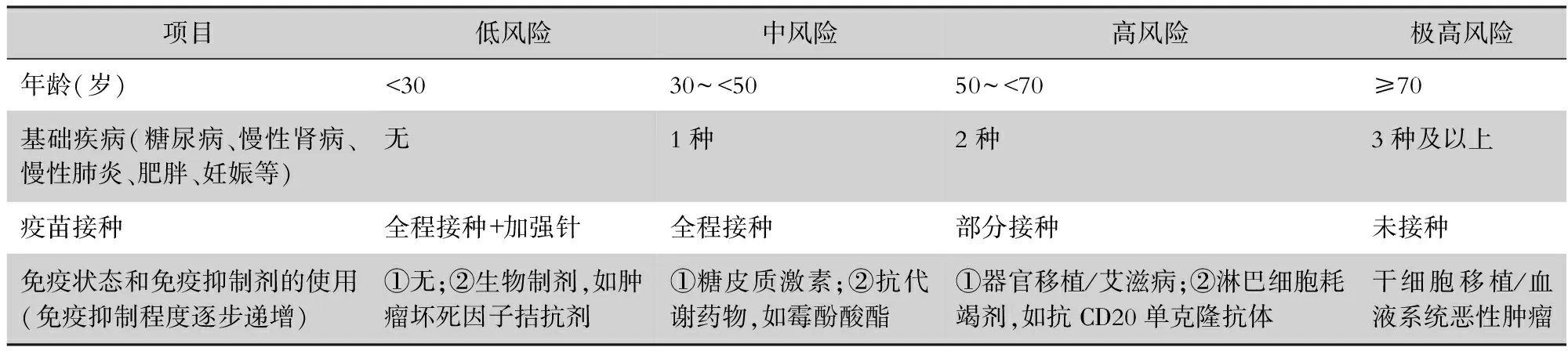
表2 免疫缺陷人群感染新型冠状病毒后的风险评估体系
3 免疫缺陷人群新冠病毒感染的治疗策略
针对普通人群新冠病毒感染诊疗策略,国内外已经发布多项指南及专家共识,内容包括一般治疗、抗病毒治疗、免疫治疗、抗凝治疗和呼吸支持治疗等。但是,针对免疫缺陷人群新冠病毒感染需要重点关注抗病毒治疗、原发病免疫抑制药物调整、重症救治关口时机、抗凝治疗和继发性机会性感染等问题。
建议5小分子抗病毒药物应用建议:①奈玛特韦/利托那韦和先诺特韦片/利托那韦片可作为首选(推荐强度A,证据级别1b),但免疫缺陷人群往往因为存在基础疾病而长期服用多种药物,奈玛特韦/利托那韦使用中应高度重视并考虑药物间相互作用。②针对免疫缺陷人群,尤其是伴有肝功能或肾功能不全的患者,从药物之间的相互作用及药物本身的安全性考虑,RNA聚合酶抑制剂(莫诺拉韦、氢溴酸氘瑞米德韦等)也可以作为一线药物选用(推荐强度A,证据级别1b)。
3.1 抗病毒治疗 目前,我国上市的小分子抗病毒药物已经相对普及,按照药理机制,小分子抗病毒药物主要分为3CL蛋白酶抑制剂和RNA依赖的RNA聚合酶(RNA-dependent RNA polymerase,RdRp)抑制剂。对于普通人群,小分子抗病毒药物均适用于发病5 d内的轻症和中型且伴有进展为重症高风险因素的成人。实体器官移植受者(solid organ transplant recipient,SOTR)人群均属于高危人群,而且由于其机体免疫力下降,机体清除病毒的时间显著延长,因此,在病程≥5 d后,如果BALF新冠病毒核酸循环阈值(cycle threshold,Ct)值仍然<35,且影像学有相应的表现,建议仍然可以启动抗病毒治疗[23]。
3.1.1 糜蛋白酶样蛋白酶抑制剂 3CL蛋白酶抑制剂主要包括如奈玛特韦/利托那韦片(Paxlovid)、来瑞特韦(乐睿灵)和先诺特韦/利托那韦(先诺欣),3CL蛋白酶抑制对目前所有的新冠病毒变种都可以产生作用(见表3)。
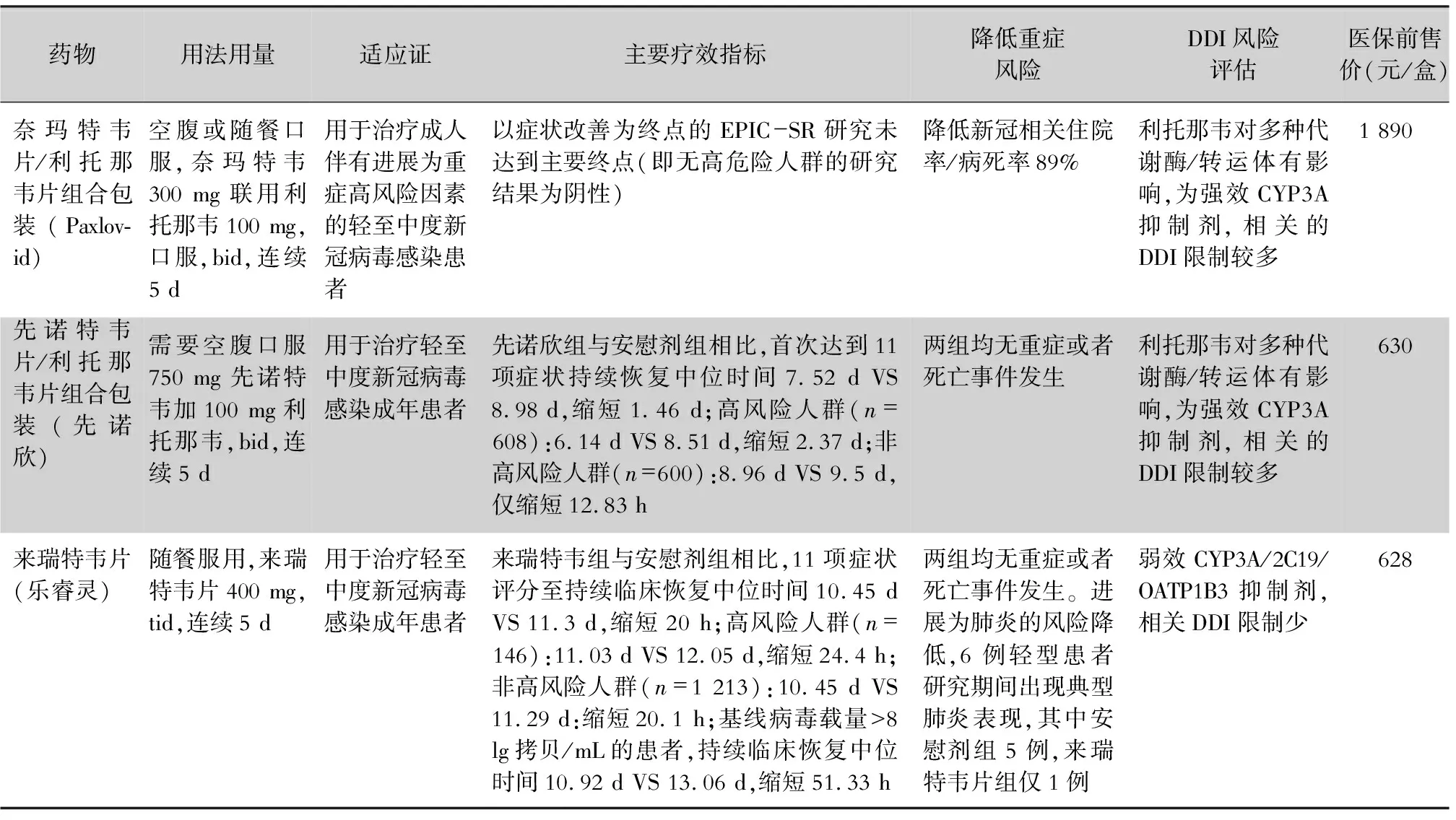
表3 国内附条件批准上市3款3CL蛋白酶抑制剂比较
3.1.1.1 奈玛特韦/利托那韦片(Paxlovid) 利托那韦通过有效快速抑制药物代谢的关键酶细胞色素P450(CYP)3A4,从而提高奈玛特韦血浆浓度。奈玛特韦/利托那韦通过作用于细胞内新冠病毒的蛋白酶而抑制病毒复制。奈玛特韦已经显示出对之前确定的突变毒株(即Alpha、Beta、Delta、Gamma、Lambda和Mu)一致的体外抗病毒活性。此外,在体外生化试验中,奈玛特韦能有效抑制Omicron相关的3CL蛋白酶,表明奈玛特韦有可能对Omicron保持强劲的抗病毒活性。奈玛特韦/利托那韦不得用于COVID-19暴露前或暴露后预防,可用于因COVID-19以外疾病住院的患者,这些患者应根据医生决定完成完整的5 d治疗疗程。错过服药8 h内可补服,超过8 h不补服,服用下一剂量,不要加倍服药。
利托那韦可能会导致肝损伤,因此在给既往有肝病、肝酶异常或肝炎患者使用奈玛特韦/利托那韦时应谨慎,但即便治疗时程短暂,奈玛特韦/利托那韦也会与多种药物相互作用,从而引起药物不良反应[24],尤其是SOTR人群常用药物如钙调磷酸酶抑制剂(如他克莫司、环孢素)和雷帕霉素(mTOR)药物(如西罗莫司、依维莫司)与利托那韦有重要的药物间相互作用。因此,美国移植协会建议,在服用钙调磷酸酶抑制剂或mTOR抑制剂的患者中,如果单纯从药物相互作用的安全性考虑,优先选用其他抗病毒药物而不是奈玛特韦/利托那韦[25]。如果需要使用该药物,使用前必须查阅药物相互作用表,以确保该药物安全使用。
3.1.1.2 先诺特韦/利托那韦(先诺欣、SIM0417、SSD8432) 先声药业与中国科学院上海药物研究所、武汉病毒研究所合作研发的抗3CL蛋白酶抑制剂,抑制新冠病毒3CL蛋白的合成。该药包括主要成分先诺特韦(研发代号:SIM0417)及利托那韦。在健康成年受试者中进行单次/多次给药后的安全性、耐受性及药代动力学等II/III期临床研究。于2023年1月28日,国家药品监督管理局以附件按照药品特别审批程序应急审评审批,批准在中国上市,用于治疗轻中度新冠病毒感染的成年患者。需要空腹服药750 mg先诺特韦+100 mg利托那韦。因该组合药物中含有利托那韦,因此,与利托那韦有重要的药物间相互作用,均有可能导致利托那韦相关不良事件,值得临床关注。另外,严重肝功能不全患者不能使用本品。
3.1.1.3 来瑞特韦 来瑞特韦属于中国首个单药3CL蛋白酶抑制剂,也是全球首款无须联用利托那韦的拟肽类3CL靶向抗病毒,实现了单药给药方案的重要突破。对新冠病毒原始株和突变株有效,能够降低重症率和死亡率。相比于奈玛特韦和先诺特韦,来瑞特韦无需临床联用利托那韦片,可减少联用药物带来的不良反应,降低有基础疾病老年人患者服用药物的风险,并可减轻医疗费用负担。体外和临床试验结果显示来瑞特韦是CYP3A酶底物,但暂未开展来瑞特韦与CYP3A酶诱导剂和中效抑制剂的临床试验。体外试验结果显示来瑞特韦对CYP3A酶具有时间依赖性抑制和诱导作用,可能会增加CYP3A4酶底物暴露量,带来安全性风险;也有可能会降低CYP3A4酶底物暴露量,导致药效降低;但来瑞特韦临床治疗剂量下的游离暴露量仅为体外酶抑制IC50的1/5,且仅在一个供体中表现出诱导作用,推测临床暴露量下其抑制/诱导作用较弱。体外试验结果显示,来瑞特韦对CYP2C19具有弱抑制作用,临床治疗剂量下的游离暴露量不到IC50的1/50,抑制作用较弱。
3.1.2 RNA依赖的RNA聚合酶(RdRp)抑制剂 另一类抗新冠病毒的小分子药物为RdRp抑制剂,主要包括莫诺拉韦、氢溴酸氘瑞米德韦片(商品名:民得维,研发代号:VV116)、阿兹夫定,见表4。
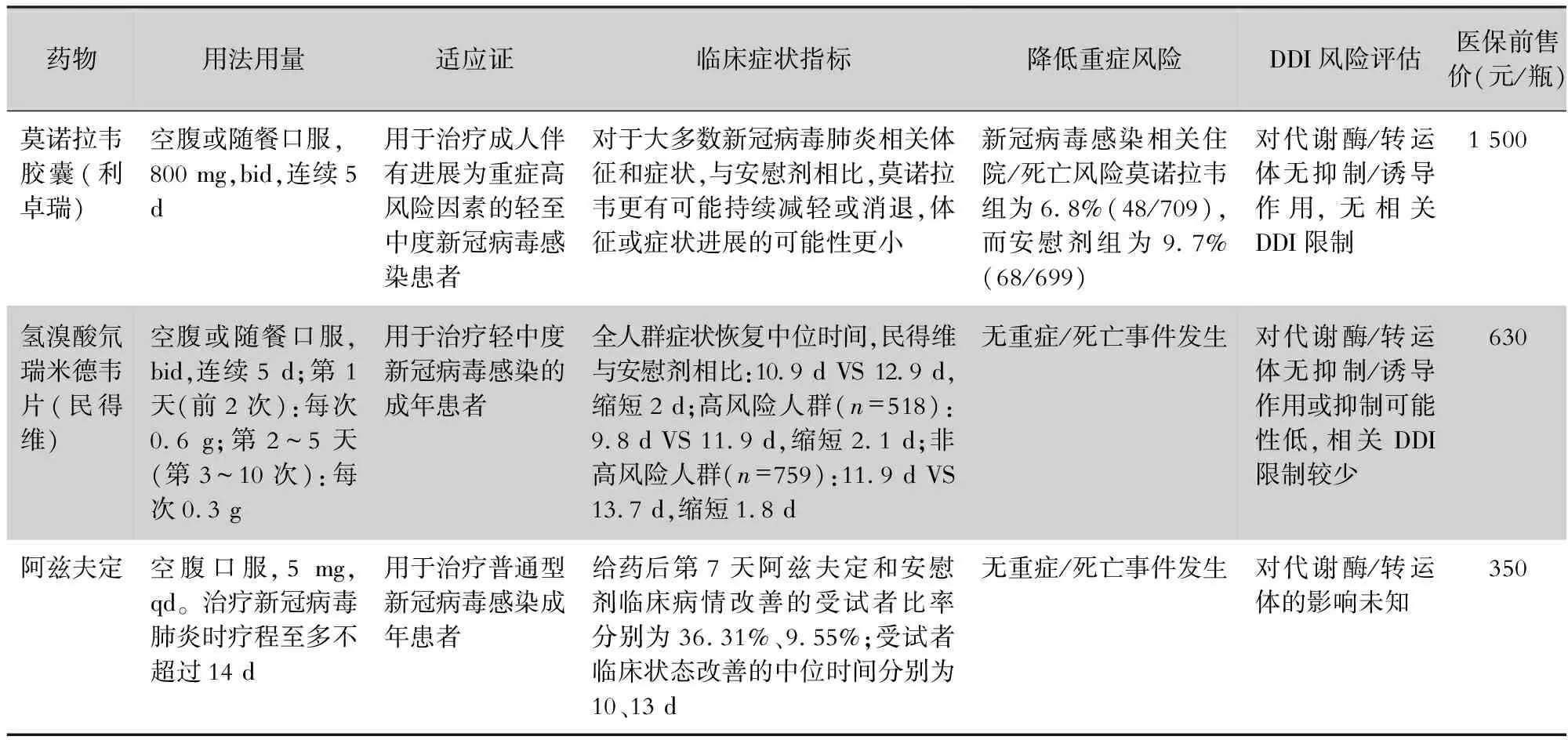
表4 国内附条件批准上市3款RdRp抑制剂比较
3.1.2.1 莫诺拉韦(molnupiravir,MOV,MK-4482/EIDD2801) 莫诺拉韦(利卓瑞)是一种可口服的直接作用于各种病毒聚合酶,因此莫诺拉韦具有广谱抗RNA病毒的活性。推荐剂量800 mg(200 mg×4)q12h,共服5 d(空腹或与食物同服),于症状开始后5 d内服用,诊断后越早服用越好。该药对肝功能、肾功能均无影响,因此,肝、肾功能不全者无需调整剂量。但该药可能影响骨骼和软骨生长,莫诺拉韦不能用于18岁以下患者,也不能用于暴露前或暴露后预防,对于新冠病毒感染住院患者,考虑获益不明确也不能使用。
3.1.2.2 氢溴酸氘瑞米德韦 氢溴酸氘瑞米德韦从瑞德西韦优化而来,VV116保留了瑞德西韦的抗病毒活性,并能口服给药,临床前药代动力学研究结果显示,具有很高的口服生物利用度。氢溴酸氘瑞米德韦2023年1月29日已在国内上市,被批准用于治疗轻中型新冠病毒感染的成年患者。氢溴酸氘瑞米德韦片的多中心、单盲、随机、对照Ⅲ期非劣效性临床试验研究结果显示,相比奈玛特韦/利托那韦,其在促进新冠病毒感染患者恢复方面表现相当甚至更佳,恢复期更短,安全性更好[23]。另外其药物相互作用少,对于免疫缺陷人群可能是更有前景的抗新冠病毒治疗药物[26]。
建议6免疫缺陷人群感染病毒后,排毒(virus shedding)时间延长,易出现病毒持续阳性。根据临床情况,评估获益风险比后,可适当延长小分子抗病毒药物使用时间。或者换用不同种类抗病毒药物,进行第二个疗程的抗病毒治疗。(推荐强度C,证据级别4)
免疫缺陷患者新冠病毒的排毒时间延长。这类患者中病毒复制的中位时间为20 d,而在普通人群中仅为11 d[27]。排毒时间延长可能会诱导变异株出现,从而增加治疗难度或诱导疫苗免疫逃逸[28-30]。虽然目前没有足够证据指导临床推荐使用抗病毒药物和/或抗新冠病毒单克隆抗体组合治疗,也没有数据支持将抗病毒治疗时间延长至美国食品药品监督管理局(Food and Drug Administration,FDA)授权以外的延长时间。但是,针对免疫缺陷人群,如果完成第一疗程的小分子抗病毒用药之后,临床症状没有缓解,且核酸检测持续阳性,Ct<35者,建议适当延长原有小分子抗病毒药物的使用时间,或换用其他小分子抗病毒药物,或换用/联合应用其他类型的抗病毒药物。
建议7对于病情进展较快的重型/危重型免疫缺陷患者,有条件可在抗新冠病毒小分子药物基础上早期联合或序贯使用新冠病毒感染后康复患者的血浆、新冠病毒特异性免疫球蛋白或新冠病毒的中和抗体。(推荐强度D,证据级别5)
多项研究显示,新冠病毒感染后康复患者恢复期血浆(coronavirus disease 2019 convalescent plasma,CCP)治疗非住院患者的疗效结果不一致,同样这些研究也很少纳入免疫缺陷患者[31-32]。目前,专家组没有足够的证据支持或反对在免疫缺陷非住院患者中使用高效价CCP。FDA已批准紧急授权,允许在免疫缺陷或正在接受免疫抑制治疗的患者中使用高效价CCP[33]。临床上,已有使用高效价CCP治疗具有明显新冠病毒感染症状、有新冠病毒活跃复制迹象且对现有疗法反应不充分的免疫缺陷患者,但目前尚缺乏大型临床研究相关的结果。
临床研究表明,抗新冠病毒的中和抗体治疗可降低高危新冠病毒感染者住院或死亡风险[34-35]。然而,由于这些研究只纳入了少数免疫功能低下的患者,因此没有足够的证据确定在此类人群中使用抗新冠病毒中和抗体的疗效。鉴于许多免疫功能低下患者体液免疫应答低,因此,对于免疫功能低下、病情进展迅速或不适合使用小分子抗病毒药物的患者,推荐早期联合或单独使用新冠病毒中和抗体治疗。目前国内上市用于治疗的中和抗体主要包括安巴韦单抗/罗米司韦单抗,该中和抗体的用法为两药剂量各1 000 mg,稀释后经静脉输注给药,速度≤4 mL/min,至少监测至输注完成后1 h。
建议8针对免疫缺陷人群,如果因为基础疾病长期服用免疫抑制剂等相关药物,罹患新冠病毒感染后,基于对原发疾病控制及药物相互作用安全性考虑,建议由专科医生评估后调整原有免疫抑制剂及相关用药。(推荐强度B,证据级别2b)
3.2 原发病免疫调节药物使用的调整 新冠病毒感染临床病程早期主要由新冠病毒复制驱动。免疫缺陷人群治疗原发病所应用的免疫抑制剂可能会降低宿主免疫反应,加速病毒复制、延长病毒排除和感染时程[36-37]。因此,免疫缺陷患者感染新冠病毒后,应考虑调整免疫抑制药物剂量或替换某些免疫抑制药物,以改善患者对感染的免疫应答。
免疫缺陷患者感染新冠病毒后需要注重免疫抑制剂的调整,是因为风湿免疫患者不良预后的主要危险因素不仅与合并症、年龄和性别有关,也与其特有的危险因素有关,包括原发病活动、长期使用糖皮质激素、慢作用抗风湿药(disease-modifying antirheumatic drugs,DMARD)和其他免疫抑制剂(硫唑嘌呤、环磷酰胺、环孢素、霉酚酸酯、他克莫司等)[22]。高疾病活动度患者的病死率高于低疾病活动度或处于缓解期的患者(OR=1.87,95%CI:1.27~2.77)。与不使用糖皮质激素的患者相比,泼尼松>10 mg/d持续使用3个月以上的患者死亡风险增加(OR=1.69,95%CI:1.18~2.41)。与甲氨蝶呤单药治疗相比,应用来氟米特、抗疟药、肿瘤坏死因子拮抗剂、阿巴西普、贝利尤单抗、IL-6抑制剂、IL-17/IL-23/IL-12+23抑制剂和靶向合成DMARD[如阿普斯特、Janus激酶(Janus kinase,JAK)抑制剂]的治疗不增加病死率;未接受DMARD治疗的患者死亡风险增加(OR=2.11,95%CI:1.48~3.01);应用利妥昔单抗(OR=4.04,95%CI:2.32~7.03)、柳氮磺吡啶(OR=3.60,95%CI:1.66~7.78)和免疫抑制剂(OR=2.22,95%CI:1.43~3.46)的患者病死率较高。许多免疫抑制药物特别是生物制剂如利妥昔单抗,具有较长半衰期或较长生物活性期,患者可能在停药后很长一段时间内仍处于免疫抑制状态。另外,对于既往长期服用糖皮质激素的患者,突然停止使用糖皮质激素可能会导致肾上腺功能不全等不良反应,因此,不建议骤然停用。糖皮质激素以外的药物调整剂量应根据具体情况而定。对于某些自身免疫疾病,可以暂时停用免疫抑制药物,在新冠病毒感染症状缓解后7~14 d重新开始用药[38]。而其他疗法,针对不同的免疫缺陷人群,其获益和风险不一[39]。
与普通人群相比,实体器官移植和造血干细胞移植受者感染新冠病毒后转为重型和死亡的风险显著升高。但是,如果减少或停用免疫抑制剂,移植物发生排斥反应或移植物抗宿主病和风险又显著升高。因此,对于实体器官移植受者和造血干细胞移植受者,免疫抑制方案的调整应评估患者排斥反应和感染加重风险情况后进行个体化实施。绝大多数器官移植受者长期接受二联至四联口服免疫抑制药,主要包括糖皮质激素、细胞周期抑制剂(霉酚酸酯或咪唑立宾)、钙调磷酸酶抑制剂(环孢素和他克莫司)、哺乳动物雷帕霉素靶蛋白抑制剂(西罗莫司或依维莫司)。造血干细胞移植受者可能同时还接受JAK抑制剂如卢可替尼、巴瑞替尼等。对于这部分人群,如果需要针对新冠病毒感染采用相应的药物治疗,则需要根据药物相互作用(drug-drug interaction)进行免疫抑制药调整(参考药物的相互作用)[23]。对于感染严重或存在继发感染、免疫功能低下的重型或危重型患者,如果主管医生考虑需要额外减少免疫抑制药物甚至停用免疫抑制药物,则需要通过多学科综合诊疗与移植专科医生讨论,根据疾病严重程度、移植物排斥反应风险、所使用的特异性免疫抑制剂特点、移植类型、移植术后时间、免疫抑制剂血药浓度等,进行综合评估及个体化调整[40]。
对于恶性血液病、恶性肿瘤等疾病,既往接受化学治疗者,罹患新冠病毒感染后,可以考虑推后化学治疗时间或停用化学治疗药物。具体治疗方案调整需咨询相应专科医生,进行获益和风险的利弊权衡评估。
建议9免疫缺陷人群感染新冠病毒后,为预防转为重型及危重型,呼吸支持应采取关口前移策略,对病情进展较快的中型、重型及危重型患者早期实施清醒俯卧位,合理使用高流量氧疗和无创辅助通气,以降低气管插管、有创通气风险和医院感染发病率。(推荐强度A,证据级别1b)
3.3 重症患者呼吸支持关口前移 免疫缺陷人群气管插管有创通气将增加发生医院获得性感染/呼吸机相关肺炎的风险,影响患者预后。在一项多中心、非盲法、随机对照研究中,清醒俯卧位(平均4 h/d)可以降低需要经鼻高流量湿化氧疗(high-flow oxygen through nasal cannula,HFNC)或无创通气(noninvasive ventilation,NIV)支持的新冠病毒感染者30 d内气管插管率,但不降低60天病死率[41]。一项纳入29项研究的荟萃分析也提示,对于伴有低氧血症的新冠病毒感染者,清醒俯卧位可以降低患者的气管插管率[42]。另外,一项纳入711例患者的多中心、随机对照研究显示,对比传统氧疗,HFNC可以显著降低气管插管率,但28天病死率差异无统计学意义[43]。虽然以上呼吸支持方式都未能显示进一步降低病死率,但对于免疫缺陷人群来说,降低气管插管率仍可能使患者潜在获益,未来仍需要相关研究进一步明确。
建议10对于需要住院治疗的免疫缺陷新冠病毒感染者,均需要进行静脉血栓栓塞(venous thromboembolism,VTE)的评估及预防(药物和/或机械预防)。只要没有禁忌证,建议予以低分子肝素或普通肝素抗凝治疗。前者使用更方便,但对于严重肾功能不全、出血风险高、血小板低下等特殊患者,后者安全性更高。住院期间,应结合D-二聚体水平、VTE风险、出凝血指标等动态评估,个体化调整抗凝药物剂量,以减少出血并发症。(推荐强度B,证据级别3a)
3.4 抗凝治疗 新冠病毒感染会损伤血管内皮,容易导致血栓事件,包括下肢深静脉血栓和/或肺栓塞。对于需要住院治疗的免疫缺陷新冠病毒感染者,均需要VTE健康教育、VTE评估及预防(药物和/或机械预防)。对所有具有高危因素,病情进展较快的中型、重型和危重型住院患者,只要无禁忌证,建议予以低分子肝素或普通肝素抗凝治疗。前者使用更方便,但对于严重肾功能不全、出血风险高、血小板低下等特殊患者,普通肝素安全性更高。针对收住ICU的重型和危重型新冠病毒感染者,建议应用药物预防和/或机械预防。对于已经应用体外膜式氧合(extracorporeal membrane oxygenation,ECMO)支持的患者,如果已经肝素化,则不必应用额外的药物预防,以免增加出血风险。药物预防的时间应该贯穿于整个住院期间,或直至危险因素去除。抗凝治疗时,应同时考虑出血并发症风险的增加,尤其是针对纤维蛋白原低和/或乳酸脱氢酶升高的患者。住院期间,应结合D-二聚体水平、VTE风险、出凝血指标等动态评估,个体化调整抗凝药物剂量,以减少出血并发症[44]。对于合并高出血风险的重型和危重型患者,积极纠正可能导致出血的因素,同时进行机械预防,如间歇充气加压泵、分级加压弹力袜等。
建议11免疫缺陷人群感染新冠病毒后,免疫防御功能降低,建议保护性隔离,需要特别关注继发的各种机会性感染,尽可能采用多种方法寻找相应病原学依据,不建议预防性应用抗菌药物/抗真菌治疗。(推荐强度B,证据级别2a)
3.5 机会性感染的监测 一项纳入22项队列研究的荟萃分析表明,高达16%的新冠病毒感染者存在机会性感染[45]。感染新冠病毒后,气道黏膜屏障功能被破环,易继发细菌和/或真菌感染[46-47]。尤其是肺移植受者及心肺联合移植受者。因此,免疫缺陷人群感染新冠病毒后,建议保护性隔离,同时需要特别关注继发的各种机会性感染。如果感染新冠病毒后,患者咳嗽时间延长,且伴有较多痰液,甚者多量黄脓痰或血性痰者,建议积极留取气道分泌物,同时进行相关实验室检测及胸部影像学检查,寻求细菌和/或真菌感染依据,评估是否需要使用相应抗菌药物或抗真菌药物[47],在没有任何依据的情况下,不建议预防性应用抗菌药物和/或抗真菌治疗。
4 免疫缺陷人群感染新冠病毒后恢复期的健康管理
建议12建议对免疫缺陷人群感染新冠病毒后恢复期进行专科疾病和“长新冠”的随访及健康管理。(推荐强度B,证据级别3a)
免疫缺陷患者感染新冠病毒后相关随访和健康管理:主要包括定期对患者身体及心理状况进行随访,追踪患者的长期预后及可能的各种后遗症。目前,将“长新冠”定义为伴随着包括疲劳、呼吸困难和神经认知障碍等长期症状的新冠病毒感染者[48]。有研究显示,大部分新冠病毒感染者出院4~8周后可能出现以下症状:与疾病相关的疲劳、呼吸急促、创伤后应激障碍症状、疼痛、嗓音变化、咳嗽、吞咽困难、焦虑、抑郁及注意力、记忆和自控问题。与非ICU收治的新冠病毒感染者相比,ICU收治患者的上述症状出现率更高[49]。超过50%的新冠病毒感染住院患者报告在症状出现60 d后持续感到疲劳[49-50]。此外,新冠病毒感染相关缺血性卒中和缺血性心脏病、心肌炎、脑膜炎、吉兰-巴雷综合征等,还需要出院后继续管理。临床医生和康复专业人员可以参考现有的临床实践指南,适当管理这些长新冠或后遗症。
对于免疫缺陷患者原有基础疾病,应定期监测机体免疫状态和免疫抑制剂药物浓度,器官移植受者和骨髓移植受者需定期监测移植物功能和排斥反应风险,在专科医生指导下调整免疫抑制剂使用。对于肿瘤患者需监测肿瘤状况并进行相应治疗等。
另外,随访管理工作应该注意监测并预防新冠病毒重复感染。尽管新冠病毒感染后对同型病毒株有一定抵抗力,但新冠病毒变异快,新变异株层出不穷,仍然可能导致再次感染。免疫缺陷患者细胞免疫力低下,新冠病毒再次感染可能性大。因此,对于免疫缺陷患者,预防新冠病毒重复感染尤其重要。
5 免疫缺陷人群新冠病毒感染的预防策略
建议13免疫缺陷人群在新冠病毒流行地区,可使用已获得FDA批准/紧急使用授权(emergency use authorization,EAU)的中和抗体替沙格韦单抗(tixagevimab)/西加韦单抗(cilgavimab)进行新冠病毒暴露前预防;如有新冠病毒暴露史,不论是否感染,都可尽快使用此单克隆抗体进行新冠病毒暴露后预防。(推荐强度A,证据级别1b)
部分人群在感染后疫苗应答不佳,进展为严重新冠病毒感染风险增高[51]。这些个体包括但不限于正在接受积极治疗的血液系统恶性肿瘤患者、1年内接受B细胞耗竭剂治疗(如利妥昔单抗、奥利珠单抗、奥比妥珠单抗、依帕珠单抗)患者[52]、接受嵌合抗原受体T细胞免疫治疗(chimeric antigen receptor T-cell immunotherapy,CAR-T)患者[53]、正在接受免疫抑制治疗的实体器官移植接受者[54]、患有严重联合免疫缺陷疾病的患者,以及HIV感染和低CD4+T细胞计数的患者[55]。
机体注入新冠病毒特异性中和抗体可以直接发挥免疫防御功能,无需依赖机体的免疫应答功能,可以快速起效,同时发挥预防及治疗作用[20]。新冠病毒单克隆中和抗体药物包括单药方案和鸡尾酒组合疗法,其中鸡尾酒疗法由两种分别结合S蛋白不同区域的单抗组合,发挥协同效应。目前已上市的单克隆抗体共有6种,分别是tixagevimab/cilgavimab(替沙格韦单抗/西加韦单抗)、BRII-196/BRII-198(安巴韦单抗/罗米司韦单抗)、bebtelovimab(贝特洛韦单抗),bamlanivimab/etesevimab(巴尼韦单抗/埃特司韦单抗)、casirivimab/imdevimab(卡西瑞单抗/伊德单抗)和sotrovimab(索托韦单抗)。但当前变异株的快速进展,中和抗体药物面临着巨大挑战,以美国为例,伴随着美国优势变异株的改变(目前以XBB系列及BQ系列为主),FDA也在不断更新多个中和抗体的EUA。有研究测试了目前已上市的六种单克隆抗体的中和效力,结果显示只有sotrovimab(索托韦单抗)对XBB亚型(包括XBB.1.16)表现出抗病毒活性[3]。
综上所述,对于免疫缺陷人群新冠病毒感染的诊断、治疗和随访需要呼吸与危重症医学科、器官移植科、风湿免疫科、血液科、感染科等多学科联合协作。虽然目前对于免疫缺陷人群的研究尚有许多未知,本共识也存在一定局限性,但随着研究的进展和认知的深入,共识组也将及时更新相关内容,为临床医生提供更新的、具有高水平循证医学证据的资料,以整体提升我国免疫缺陷人群新冠病毒感染的诊治水平。
名誉顾问:钟南山(广州医科大学附属第一医院广州呼吸健康研究院)
主审专家:张文宏(复旦大学附属华山医院感染科)、施毅(南京大学医学院附属金陵医院呼吸科)、陈荣昌(深圳市人民医院深圳市呼吸疾病研究所)、俞云松(浙江大学医学院附属邵逸夫医院感染科)、卓超(广州医科大学附属第一医院感染内科)、代华平(中日友好医院呼吸与危重症科)、戴冽(中山大学孙逸仙纪念医院风湿免疫科)、蔡绍曦(南方医科大学南方医院呼吸与危重症科)
编委秘书:许芝彬(广州医科大学附属第一医院器官移植科)、徐培航(广州医科大学附属第一医院器官移植科)、赖逾鹏(深圳市第二人民医院风湿免疫科)、陈莉延(深圳禾正医院呼吸与危重症医学科)
审稿专家(按姓氏汉语拼音排序):保鹏涛(解放军总医院第八医学中心呼吸与危重症医学部)、陈伟(南华大学附属第二医院呼吸与危重症医学科)、陈智鸿(复旦大学附属中山医院呼吸内科)、程璘令(广州医科大学附属第一医院呼吸与危重症科)、丁小明(西安交通大学第一附属医院肾移植科)、杜新(深圳市第二人民医院血液科)、冯敏(郑州大学第一附属医院重症医学科)、冯四洲(中国医学科学院血液病医院造血干细胞移植中心)、桂水清(深圳市第二人民医院重症医学科)、郭璐(四川省医学科学院四川省人民医院呼吸与危重症医学科)、郭颖(南方医科大学珠江医院器官移植科)、郝创利(苏州大学附属儿童医院呼吸科)、何清(中山大学孙逸仙纪念医院重症医学科)、洪城(广州医科大学附属第一医院广州呼吸健康研究院呼吸与危重症医学科)、胡长征(江门市中心医院感染科)、黄海辉(复旦大学附属华山医院抗生素研究所)、黄河(深圳市第二人民医院呼吸与危重症医学科)、黄洁(中国医学科学院阜外医院心力衰竭和移植中心)、李凌华(广州医科大学附属市八医院感染病中心)、李薇(昆明医科大学第一附属医院呼吸与危重症医学科)、李洋(广东省人民医院风湿免疫科)、梁伟权(佛山市第二人民医院呼吸与危重症医学科)、林慧庆(武汉大学人民医院胸外科)、刘春丽(广州医科大学附属第一医院呼吸与危重症医学科)、刘冬舟(深圳市人民医院风湿免疫科)、刘红梅(河南省人民医院呼吸与危重症科)、刘启发(南方医科大学南方医院血液科)、刘升明(暨南大学附属第一医院呼吸科)、刘晓青(广州医科大学附属第一医院重症医学科)、罗红(中南大学湘雅二医院呼吸与危重症医学科)、罗群(广州医科大学附属第一医院呼吸与危重症医学科)、罗益锋(中山大学附属第一医院呼吸与危重症医学科)、吕云辉(云南省人民医院呼吸与危重症医学科)、王长希(中山大学附属第一医院器官移植科)、王晶(海南医学院第二附属医院呼吸科)、王凌伟(深圳市人民医院呼吸与危重症科)、王振迪(华中科技大学同济医学院附属协和医院泌尿外科)、魏雪梅(新疆维吾尔自治区人民医院呼吸与危重症医学中心)、吴波(无锡市人民医院肺移植科)、吴玲(香港大学深圳医院风湿免疫科)、肖雪飞(中南大学湘雅三医院重症医学科)、徐国亮(厦门市中医院呼吸内科)、徐金富(上海市肺科医院呼吸与危重症医学科)、许淑云(华中科技大学同济医学院附属同济医院呼吸内科)、杨念生(中山大学附属第一医院风湿免疫科)、翟振国(中日友好医院呼吸与危重症医学科)、张慧涛(中山大学附属第五医院重症医学科)、张剑青(昆明医科大学第一附属医院呼吸与危重症医学科)、张静(复旦大学附属中山医院呼吸内科)、张伟杰(华中科技大学同济医学院附属同济医院器官移植研究所)、张宇明(广东医科大学附属医院血液科)、赵春梅(南方医科大学深圳医院风湿免疫科)、赵红梅(中日友好医院呼吸与危重症医学科)、赵艳丽(北京陆道培医院造血干细胞移植科)、周红梅(南方科技大学医院感染科)、周宇麟(中山大学附属第三医院呼吸与危重症医学科)、朱利平(复旦大学附属华山医院感染病科)
利益冲突:所有作者均声明不存在利益冲突。
