APOC3表达抑制剂筛选模型的构建及意义
2023-12-22刘思辰郑丽华
刘思辰,郑丽华,柯 超*
(1.中山大学肿瘤医院 神经外科,广东 广州510060;2.东北师范大学 药物基因和蛋白筛选国家工程实验室,吉林 长春130117)
人载脂蛋白C3(Apolipoprotein C3,APOC3)是富含甘油三酯(TG)的脂蛋白(Triglyceride rich lipoproteins,TRLs)及高密度脂蛋白的主要成分,在调节血浆甘油三酯水平中起重要作用,与血浆TG水平呈正相关,含有APOC3的高密度脂蛋白与颈动脉斑块的形成、缺血性脑卒中和脑梗死、痴呆和大脑中β-淀粉样蛋白沉积等的发生风险密切相关[1-3]。研究显示,APOC3可直接促进单核细胞向血管内皮细胞的黏附,引起炎症反应,进而促进脂代谢相关疾病——动脉粥样硬化的发生[4]。以上研究提示,下调APOC3的表达可能是治疗脂代谢异常疾病的有效途径之一。因此,本研究钓取了APOC3的启动子,构建了APOC3表达抑制剂筛选模型,并从中药单体化合物中筛选APOC3表达抑制剂,之后鉴定了化合物对APOC3表达的抑制作用,报道如下。
1 材料与方法
1.1 主要材料
用于筛选的中药小分子化合物购自中国食品药品检定研究院,纯度均在98%以上,用DMSO溶液配成10 mg/mL的母液,储存于-20℃冰箱中备用。进行筛选时,用DMSO稀释成5 μg/mL的工作液进行使用。抗APOC3(ab21032)抗体购自英国Abcam公司,抗GAPDH抗体购自上海康成生物有限公司,HRP标记的羊抗鼠IgG、兔IgG均购自北京鼎国昌盛生物技术有限公司。人氧化型低密度脂蛋白(oxLDL)购自广州奕源生物技术公司,油红O购自Sigma-Aldrich公司。
人胚肾细胞HEK 293T、人正常肝细胞L02购自ATCC细胞库,由本实验室保留和冻存。DNA提取试剂盒购自常州百代生物科技股份有限公司。
1.2 pAPOC3-luc质粒的构建
收集培养好的L02细胞用PBS洗涤后,按厂家提供的说明书提取基因组DNA,之后以L02细胞基因组DNA为模板,用特异性引物对APOC3启动子(-1 451~+39 bp)片段进行PCR扩增,引物序列如下:上游:5’-GGGGTACCGAGGAATTCCAAGTCTC-3,下游:5’-CCCAAGCTTGGGCATTACCTGGAGCAG-3。回收PCR片段,将该片段和pGL2-Basic载体分别用KpnⅠ和HindⅢ限制性内切酶酶切,之后分别回收片段和载体,用T4 DNA连接酶进行连接。用连接产物转化感受态大肠杆菌DH5α,之后涂布于Amp+LB营养琼脂平板上,次日挑取单菌落接种到LB培养基中培养细菌,之后提取质粒,电泳鉴定后送去测序公司测序。
1.3 细胞培养
人正常肝细胞系L02和人胚肾细胞HEK 293T培养于含10%新生牛血清、100 U/mL青霉素和100 μg/mL链霉素的DMEM完全培养基中,置于恒温37℃,5% CO2的细胞培养箱中培养。
1.4 细胞转染
准备2支1.5 mL离心管,其中1管加入100 μL CaCl2溶液,同时将2.5 μg质粒DNA加入并混匀。另1管加入100 μL BBS溶液,将混好质粒的CaCl2溶液分数次加入BBS溶液中,边加边吹打混匀。室温静置20 min,随后将混合液加入到待转细胞孔中,轻摇培养板混匀。培养4 h后,弃去原细胞培养液,加入完全培养基。
1.5 APOC3表达抑制剂的筛选
取对数生长期的HEK 293T细胞,用磷酸钙法转染pAPOC3-luc质粒,4 h后,消化细胞,以2×104个/孔的密度接种于96孔细胞培养板中。转染24 h后,弃去培养液,加入终浓度为5 μg/mL的中药单体化合物(用完全培养基稀释),对照为等体积的DMSO稀释液(用完全培养基稀释),对照组和实验组均设置3个复孔。24 h后进行荧光素酶活性检测,筛选可明显抑制APOC3启动子活性的单体化合物。
1.6 荧光素酶活性检测
以24孔板培养的细胞为例,将各孔细胞分别收集到1.5 mL离心管中,离心,弃上清。每管加入500 μL预冷的PBS重悬细胞,4℃离心,弃上清。每管加入100 μL细胞裂解液,-20℃静置20 min,取出后室温溶解,4℃离心,上清即为细胞裂解液。在96孔荧光素检测白板中加入5 μL荧光素酶活性分析缓冲液,并加入45 μL细胞裂解液,混匀,随后加入100 μL荧光素反应液,立即放入BMG荧光化学发光检测仪中,启动程序检测活性。
1.7 千层纸素A(Oroxylia A,OA)对APOC3 mRNA表达的影响
在6孔细胞培养板中接种5×105个/孔的L02细胞,培养24 h后,加入15 μg/mL的OA,对照组用等体积的DMSO处理,24 h后,弃去培养基。用TRIzol法提取总RNA。使用逆转录试剂盒,按照说明书操作将mRNA逆转录为cDNA。使用LightCycler 480 SYBR Green I Master,按照产品说明书操作。用PikoReal SW-software version 2.0(Thermo Fisher Scientific)分析结果。每个样品进行至少3次重复实验,以β-actin为内参,进行数据归一化处理。PCR 引物如下,APOC3-F:5’-AGGAGTCCCAGGTGGCCCAGCAG-3’,APOC3-R:5’-CACGGCTGAAGTTGGTCTGACCTCA-3’;β-actin-F:5’-CTAAGGCCAACCGTGAAAAG-3’,β-actin-R:5’-ACCAGAGGCATACAGGGACA-3’。
1.8 OA对APOC3蛋白表达的影响
在6孔板中培养L02细胞,实验组加入15 μg/mL的OA,对照组用等体积的DMSO稀释液代替,作用细胞24 h后,提取蛋白,并按比例加入4×蛋白上样缓冲液,于100℃孵育10 min。制备聚丙烯酰胺凝胶(12%分离胶和5%压缩胶),在每个上样孔中加入10 μL制备好的蛋白样品,上层胶80 V恒压电泳30 min,下层胶120 V恒压电泳1 h。电泳结束后将聚丙烯酰胺凝胶上的蛋白转到PVDF膜上,恒压100 V转印2 h。取出PVDF膜,洗涤后放入封闭液中,摇床上室温振荡封闭1 h。弃去封闭液,洗涤后将PVDF膜放入已预先加入对应抗体的稀释液中,4℃摇床孵育过夜。次日洗涤后将膜用二抗室温摇床孵育1 h。最后使用ECL显影,凝胶成像仪成像。
1.9 油红O染色法检测细胞脂质沉积
将处于对数期生长的L02细胞消化成单细胞悬液,以1×105个/孔的密度接种于24孔细胞培养板中的盖玻片上,培养24 h后,建模组加入80 mg/mL oxLDL溶液,化合物组加入80 mg/mL oxLDL溶液的同时加入15 μg/mL的OA,对照组用等体积的DMSO稀释液代替。24 h后洗涤盖玻片,加4%细胞固定液固定细胞30 min,加入油红O染色液(加的体积覆盖住板底即可),室温放置10 min,用真空泵吸去染色液,用60%异丙醇漂洗脱色,除去多余的染料,迅速用真空泵吸去,甘油封片,于显微镜下观察拍照。
1.10 统计学分析
本研究实验结果均重复3次以上。对实验数据分析的统计学检验方法为两组比较用双尾t-Test法,3组以上比较用one way ANOVA;P<0.05表示差异具有统计学意义。
2 结果
2.1 pAPOC3-luc荧光素梅报告质粒的构建
以L02细胞的基因组DNA为模板,用特异性引物对APOC3启动子区域(-1 451~+39 bp)进行PCR扩增,并将扩增片段用1%琼脂糖凝胶电泳进行分析。结果如图1所示,1号泳道1 500 bp左右的位置可以看到一条清晰的条带,与设计钓取的APOC3启动子片段大小基本一致。
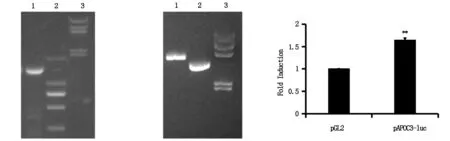
图1 APOC3启动子的PCR扩增
随后根据预先设计的引物中加入的酶切位点KpnⅠ和HindⅢ对钓取的片段和目的载体pGL2-Basic进行双酶切。随后回收酶切片段进行连接,并转化入DH5α菌株。挑取单克隆菌落,过夜培养扩增转化菌,并提取重组质粒,进行琼脂糖凝胶电泳分析。结果如图2所示,与pGL2-basic质粒条带位置相比,重组质粒的条带位置明显滞后,疑似已连接入目的片段。之后送上海生工测序,结果显示,重组质粒构建成功。
2.2 pAPOC3-luc中的启动子活性分析
为了检测所钓取的启动子是否具有活性,在HEK 293T细胞中分别转入pGL2-basic或pAPOC3-luc质粒,48 h后检测细胞中的荧光素酶活性。结果如图3所示,转入pAPOC3-luc的细胞其荧光强度明显高于转入pGL2-basic的细胞。
2.3 抑制APOC3表达的中药单体化合物的筛选
将前面所构建的pAPOC3-luc转染入HEK 293T细胞中,24 h后分别加入中药单体化合物继续培养24 h,收集细胞进行荧光素酶活性检测。结果如图4所示,化合物OA对APOC3基因的启动子活性有明显的抑制效果。
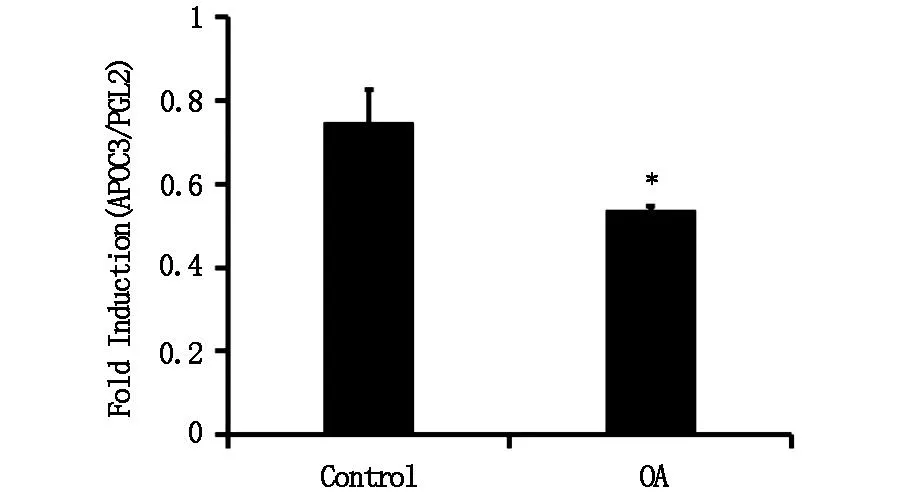
图4 OA对APOC3启动子活性的影响
2.4 OA对APOC3 mRNA和蛋白表达的影响
在mRNA水平和蛋白水平检测了OA对L02细胞中APOC3表达的影响。结果显示,经15 μg/mL OA作用24 h后,L02细胞中APOC3的mRNA(图5)和蛋白表达水平(图6)均明显下降。

图5 Real-time RT-PCR法检测OA对APOC3 mRNA表达的影响

图6 OA对APOC3蛋白表达的影响
2.5 OA对oxLDL诱导的肝细胞内脂质沉积的影响
用80 mg/mL oxLDL诱导L02细胞24 h,发现oxLDL可以增加肝细胞中脂质的累积,而OA则对oxLDL诱导的脂质沉积有一定的抑制作用(见图7)。

图7 OA对oxLDL诱导的L02细胞脂质累积的影响
3 讨论
APOC3 作为脂蛋白脂酶(Lipoprotein lipase,LPL) 抑制剂,可通过抑制脂肪酶、肝脂酶、胆固醇脂卵磷脂酰基转移酶的活性影响脂代谢,在调节脂代谢过程中具有十分重要的作用[5-6]。APOC3 基因缺失,或 APOC3 基因靶向断裂,或APOC3对LPL的抑制作用降低,都可导致血浆甘油三酯降低,因为LPL是TRLs分解代谢的关键酶,所以减少对LPL的抑制,就会加强脂解作用,加速TRLs分解,对抗HTG,从而对抗动脉粥样硬化(Atherosclerosis,As)[7-8]。反之,APOC3 基因在实验鼠体内过表达,则明显促进 As 的形成和发展[9]。
APOC3 作为载脂蛋白家族中的主要成员,其重要性已日益引起科学界的重视,随着对 APOC3 生物学活性及作用机制的深入研究,发现APOC3 很可能会成为预防、治疗代谢综合征和动脉粥样硬化相关的心脑血管疾病等的新靶点[10-11]。
本研究通过基因重组技术,将APOC3的启动子片段克隆到荧光素酶报告载体pGL2-basic上,构建了由APOC3启动子驱动的荧光素酶报告质粒。将此质粒转染入真核细胞,利用APOC3的启动子活性驱动下游荧光素酶的表达,通过荧光素酶活性的高低判断APOC3启动子的强弱。基于该原理对本实验室的300多种中药单体化合物进行筛选,最后筛选到了OA,发现它可以有效抑制APOC3的启动子活性,并进一步在mRNA和蛋白水平上确定其可以抑制APOC3的表达。
千层纸素 A 是从中药黄芩中提取的黄酮类化合物,其有抗肿瘤、抗炎、抗病毒、神经保护、抗凝血、促进新生血管生成等多种生物学活性[12]。本研究发现,其具有抑制APOC3表达的作用,并可抑制细胞中的脂质沉积。
