SIRT1在糖尿病肾病中的诊断及治疗价值
2023-12-22王雪冬裴爱月王淑娴梁晨阳付少杰马福哲
安 敏,王雪冬,裴爱月,王淑娴,梁晨阳,付少杰,马福哲*
(1.唐山职业技术学院附属医院 肾内科,河北 唐山063000;2.吉林大学第一医院 麻醉科,吉林 长春130021;3.吉林大学第一医院 内镜中心,吉林 长春130021;4.吉林大学第一医院 肾病内科,吉林 长春130021)
糖尿病肾病(DKD)是糖尿病的一种严重并发症,也是导致终末期肾病的主要原因之一[1]。但是在目前的临床实践中,一直缺乏可靠的分子靶点用于DKD的早期诊断和有效治疗[2]。机器学习策略是用于从一组方案中选择最佳模型来拟合观察结果的人工智能技术,具有非线性、容错性和实时性的优点,因此适合于复杂场景的应用[3]。近年来机器学习策略结合生物信息学技术,在寻找新型疾病诊断标志物方面展现出了巨大潜力[4]。微小RNA(miRNA)作为一种内源性非编码RNA,通过调控其下游靶基因的表达在DKD发生发展中发挥着重要作用[5]。因此本研究旨在利用机器学习策略对公共数据库转录组数据进行处理,鉴定出新的DKD诊断标志物,并预测调控该靶点的miRNA。之后利用多种分子生物学技术验证上游miRNA对该靶点表达的调控情况,以及对DKD炎症反应、氧化应激及纤维化的影响,以期探索出可用于DKD早期诊断和治疗干预的分子靶点。
1 材料与方法
1.1 材料
1.1.1公共数据来源 从GEO 数据库(http://www.ncbi.nlm.nib.gov/ geo/)中获取含有健康对照以及DKD患者的肾小球转录组数据。以GSE30528,GSE96804及GSE47185作为训练集,GSE99339及GSE30122作为验证集。训练集和验证集分别含有DKD患者64例和33例,对照组50例和61例。
1.1.2动物 6~8周龄的BTBR ob/ob小鼠(自发性2型DKD模型)40只,年龄匹配的BTBR野生型小鼠(BTBR WT)10只作为正常对照,均购于美国Jackson实验室。
1.1.3主要试剂 ROS试剂盒、MDA试剂盒购于南京建成生物工程研究所;小鼠QuantiChromTM肌酐试剂盒、白蛋白试剂盒购于美国博世生物公司;小鼠血糖试剂盒、低密度脂蛋白试剂盒、尿素氮试剂盒购于杭州齐誉生物科技公司;SIRT1、VCAM-1、P53、Ac-P53、PAI-1、CTGF、TGF-β1、GAPDH一抗以及二抗购自美国Abcam公司;pGL质粒载体购于美国Promega公司。
1.1.4细胞系及处理 SV40MES13小鼠肾小球系膜细胞系购自上海中乔新舟生物公司。为维持适宜的环境条件,细胞培养温度设置为37℃,并保持5%的CO2浓度。培养基成分包括RPMI-1640培养基、10%胎牛血清(FBS)、0.1 mg/mL链霉素以及100 U/mL青霉素。
1.2 方法
1.2.1机器学习及生物信息学分析 对各数据集进行批次校正后合并,以矫正后的P值<0.05以及|log2差异倍数|>1为筛选标准鉴定出DKD的差异表达基因(DEGs)。分别使用最小绝对收缩和选择算子(LASSO),随机森林(RF)以及支持向量机递归特征消除(SVM-RFE)3种机器学习算法针对训练集数据构建诊断模型,将3种算法均纳入的基因筛选为潜在生物标志物。在训练集及验证集中分别根据标志物基因的表达量绘制了其接受者操作特征(ROC)曲线。
1.2.2双荧光素酶报告系统 通过RNA预测数据库RNAhybird(https://bibiserv.cebitec.uni-bielefeld.de/rnahybrid/)预测可以与鉴定出的标志物mRNA 3’UTR区良好结合的目标miRNA。基于预测的结合位点合成包含目标miRNA结合位点的靶基因短序列,并将其插入到pGL-控制载体的KpnⅠ和BgⅢ位点,构建野生型质粒,将SV40MES13细胞种在24孔板中,与野生型报告质粒、荧光素肾素-胸苷激酶质粒以及目标miTNA,目标miRNA抑制剂共同转染24 h,使用Promega Dual荧光素酶报告检测系统分析荧光素酶活性。
1.2.3动物分组及处理 小鼠分为正常对照组、DKD空白对照组、DKD转染非同源miRNA对照组、DKD转染目标miRNA agomir组,DKD转染目标miRNA antagomir组,每组10只。按各自分组,分别给予阴性对照抑制剂、目标miRNA agomir、目标miRNA antagomir,2 mg/kg每周1次皮下注射,共干预24周。于第1、12、24周测血糖、血肌酐、低密度脂蛋白、尿蛋白肌酐比(UACR)以及24 h尿量。第24周小鼠安乐死,取肾组织进行进一步研究。
1.2.4肾脏氧化应激分析 对第24周取材小鼠的肾脏皮质组织,采用检测试剂盒测定其中的活性氧(ROS)和丙二醛(MDA)水平。
1.2.5RNA的提取与检测 应用TRizol试剂提取肾组织中总RNA,使用qRT-PCR方法检测miRNA以及mRNA的表达,基因表达量被适当的标准化为 U6或GAPDH,使用2-△△ct法对基因的表达水平进行量化。miR-138-5p正向引物序列:5′-GGGAGCTGGTGTTGTGAAT-3′,反向引物序列:5′-CAGTGAGTGTCGTGGAGT-3′;SIRT1 mRNA正向引物序列:5′-GTCACACTTACGACAGAGCAGC-3′,反向引物序列:5′-TTTCTCCAGTACATACACAAC-3′;GAPDH mRNA正向引物序列:5′-CCACCCATGGCAAATTCCATGGCA-3′,反向引物序列:5′-TCTAGACGGC AGGTCAGGTCCACC-3′;U6正向引物序列:5′-CTCGCTTCGGCAGCACA-3′,反向引物序列:5′-ACGCTTCACGAATTTGCGT-3′。
1.2.6蛋白表达测定 应用蛋白印迹法测定肾组织中蛋白的表达。使用含蛋白酶抑制剂的Ripa裂解液对总蛋白进行提取,并使用BCA试剂盒对蛋白浓度进行定量。采用常规Westernblot方法,用聚丙烯酰胺凝胶电泳法进行分离,并转移至PVDF膜上,再使用5%脱脂奶粉封闭15 min后于4℃下用一抗孵育过夜,次日用TBS-T将PVDF膜清洗3次,常温下与二抗孵育1 h,再用TBS-T洗膜3次,用ECL显影液显影。
1.2.7统计学分析 由SPSS 25.0分析所收集数据,数据以均数±标准差表示,使用t检验比较两组间差异,One Way ANOVA检验用于多重对比,P<0.05为差异具有统计学意义。
2 结果
2.1 基于机器学习策略鉴定DKD新型诊断标志物
在训练集数据中鉴定出100个DEGS,其中62个在DKD中低表达,38个高表达,见图1A。使用LASSO、RF以及SVM-RFE机器学习算法分别构建诊断模型,取交集后鉴定出DKD的潜在诊断标志物为SIRT1,见图1B~E。根据SIRT1在训练集和验证集中的表达量分别绘制ROC曲线,AUC分别为0.950和0.885,提示SIRT1对DKD具有良好的诊断效能,见图1F~G。

图1 基于机器学习策略鉴定DKD新型诊断标志物
2.2 鉴定调控SIRT1表达的miRNA
RNAhybird数据库预测发现SIRT1 mRNA 3’-UTR中的碱基序列为miR-138-5p提供了结合位点,见图2A。在2型DKD组和对照组中,qRT-PCR结果发现miR-138-5p在2型DKD组高表达(P<0.01,图2B),而SIRT1 mRNA在DKD组低表达(P<0.05,图2C)。Westernblot结果也发现SIRT1在DKD组低表达(P<0.05,图2D和2E),提示miR-138-5p可能调控SIRT1的表达。进一步的双荧光素酶实验结果提示,在SV40MES13细胞中,相较于对照组,miR-138-5p能显著降低SIRT1 mRNA 3’UTR质粒的荧光素酶活性(P<0.01,图2F),提示miR-138-5p可直接与SIRT1 mRNA 3’UTR结合。
2.3 调控miR-138-5p/SIRT1途径可减轻DKD肾损害
qRT-PCR结果发现miR-138-5p水平在BTBR ob/ob组及BTBR ob/ob+NC组均显著高于正常对照组(P<0.01),在BTBR ob/ob+agomir组水平显著高于BTBR ob/ob组(P<0.01),而在BTBR ob/ob+antagomir组水平显著低于BTBR ob/ob组(P<0.01),见图3A,而Westernblot结果发现肾组织SIRT1表达水平在BTBR ob/ob组及BTBR ob/ob+NC组均低于正常对照组(P<0.05),在BTBR ob/ob+agomir组表达水平显著低于BTBR ob/ob组(P<0.01),而在BTBR ob/ob+antagomir组表达水平高于BTBR ob/ob组(P<0.05),见图4A,提示miR-138-5p高表达及低表达动物模型造模成功,且miR-138-5p可负向调控SIRT1的表达。miR-138-5p高表达加重了2型DKD小鼠的多尿、高血糖、高脂血症、高尿素氮以及蛋白尿症状,相应的miR-138-5p低表达则减轻了2型DKD小鼠的上述症状,差异均具有统计学意义(P<0.05),见图3B-F,提示调控miR-138-5p/SIRT1途径可减轻DKD肾损害。

图3 调控miR-138-5p/SIRT1途径可减轻DKD肾损害
2.4 调控miR-138-5p/SIRT1途径可减轻DKD炎症、纤维化及氧化应激
为进一步探究调控miR-138-5p/SIRT1途径对DKD炎症、纤维化及氧化应激的影响,检测了PAI-1、VCAM-1、TGF-β1、CTGF、ROS以及MDA在肾组织的表达情况。相较于正常对照组,这些指标在2型DKD小鼠肾组织中均升高,差异均有统计学意义(P<0.05),相较于2型DKD小鼠,这些指标在miR-138-5p高表达模型组中均升高,在miR-138-5p低表达模型组中均降低,差异均有统计学意义(P<0.05),见图4,提示调控miR-138-5p/SIRT1途径可减轻DKD炎症、纤维化及氧化应激。
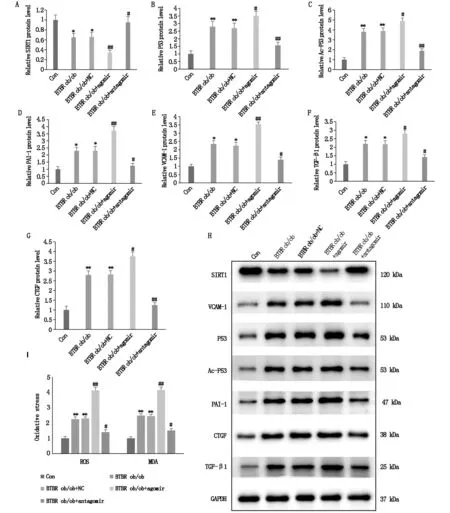
图4 调控miR-138-5p/SIRT1途径可减轻DKD炎症、纤维化及氧化应激
3 讨论
DKD是糖尿病常见慢性并发症之一,不仅是导致终末期肾脏病的主要原因,而且显著增加罹患心脑血管疾病的风险,导致高致死率、高致残率[6]。DKD目前尚缺乏特异性治疗手段,早期诊断和及时干预可以改善DKD患者的预后[7]。DKD的发病机制复杂且目前尚不完全清楚,深入研究其发病机制,寻找有助于早期诊断以及治疗干预的靶点具有重要意义[8]。
本研究通过数据挖掘联合机器学习策略,鉴定出SIRT1为DKD的潜在诊断标志物。SIRT1是组蛋白去乙酰化酶家族的成员之一,以NAD+依赖的方式使P53蛋白去乙酰化,从而抑制P53的转录活性,进而调节细胞活动和机体稳态[9]。P53是抑癌基因TP53的蛋白质表达产物,是重要的抗肿瘤因子[10]。先前的研究已经证实,P53在DKD中存在着过度活化,并且与DKD的发生、发展密切相关[11]。逆转DKD肾组织中SIRT1的低表达,可以抑制P53的过度活化,进而改善DKD肾组织的病理变化[12]。miRNAs对包括DKD在内的许多疾病中的多种生物学过程起着重要的调控作用[13-14]。而本研究则发现miR-138-5p可以识别和结合SIRT1,从而负向调控其表达,通过抑制miR-138-5p,即可逆转DKD肾组织中SIRT1的低表达,进而抑制P53的表达和活性,减轻DKD肾组织的炎症反应、纤维化及氧化应激等机制,改善DKD的肾脏损害。
综上所述,本研究发现了miR-138-5p/SIRT1途径在DKD发生发展中的重要作用,为DKD的早期诊断及治疗干预提供了新的靶点和思路。
