拉帕替尼联合曲妥珠单抗治疗人表皮生长因子受体2阳性乳腺癌病人的疗效及生存预后分析
2023-12-19戴继鑫牛凯
戴继鑫 牛凯
乳腺癌发病率位于女性恶性肿瘤的第一位,主要通过手术、放化疗等方式进行治疗。人类表皮生长因子受体-2(human epidermal growth factor receptor-2,HER2)是一种与乳腺癌的发生、发展密切相关的癌基因。有研究证实,HER2过表达可影响乳腺癌病人预后[1]。HER2过表达的乳腺癌病人常表现为生存率低、恶性程度高、病情进展快等特点。曲妥珠单抗是HER2阳性乳腺癌病人的一线治疗方案,可有效延长病人生存期,但其只有在充分结合HER2才能发挥抗肿瘤作用,但癌细胞可经其他膜表面受体旁路影响HER2下游信号通路,降低曲妥珠单抗的疗效,并可能产生耐药。拉帕替尼为第二个被FDA批注用于治疗HER2乳腺癌的药物,临床证实其对曲妥珠单抗耐药肿瘤具有较好的治疗疗效[2]。本研究旨在探究拉帕替尼联合曲妥珠单抗治疗HER2阳性乳腺癌病人的疗效及对生存预后的影响。
对象与方法
一、对象
2016年4月~2018年6月我院行新辅助化疗治疗的HER2阳性乳腺癌女性病人86例。采用随机数字表法将其分为观察组(拉帕替尼联合曲妥珠单抗治疗)及对照组(曲妥珠单抗治疗),每组各43例。纳入标准:年龄18~60岁;符合乳腺癌诊断标准[3]; TNM分期Ⅱb~Ⅲa期;经免疫组织化学染色证实为HER-2阳性;预计生存期≥10个月;浸润性小叶癌、浸润性导管癌;单侧乳腺癌;已接受手术治疗者病人知情同意且签署同意书。排除标准:存在严重心脏疾病;已出现肿瘤远处转移;妊娠期或哺乳期妇女;合并肝肾功能异常;合并其他恶性肿瘤疾病;对本研究所用药物过敏;出现病情恶化需调整治疗方案;近3个月内参与过其他研究;消化系统功能障碍;合并传染性疾病或凝血功能异常。本研究经医院伦理委员会批准(医伦-160402)。两组临床资料比较,差异无统计学意义(P>0.05)。见表1。
二、方法
1.治疗方法:两组在治疗前均应用地塞米松预防过敏,并使用止吐药物,参照《人表皮生长因子受体2阳性乳腺癌临床诊疗专家共识2016》对病人进行治疗[4],

表1 两组病人临床资料比较
病人如治疗期间中性粒细胞显著降低时需给予粒细胞集落刺激因子治疗。对照组给予曲妥珠单抗(上海罗氏制药有限公司,国药准字J20110020)治疗,第1个疗程第1天以8 mg/kg剂量静脉滴注,从第2个疗程开始将剂量降低至6 mg/kg,滴注时间需控制在1.5小时内,21天为1个疗程。观察组给予拉帕替尼(葛兰素史克有限公司,国药准字J20180011)联合曲妥珠单抗治疗,拉帕替尼剂量为1250 mg/d,饭后口服,曲妥珠单抗治疗方式同对照组,两组病人需持续治疗至疾病进展或不良反应不能耐受。
2.临床疗效判断:于治疗6个疗程后参照RECIST标准[5],将临床疗效分为完全缓解(complete response,CR)、部分缓解(partial remission,PR)、稳定(stable disease,SD)、疾病进展(progressive disease,PD),客观缓解率(objective response rate,ORR)为CR+PR、疾病控制率(disease control rate,DCR)为CR+PR+SD。
3.观察指标 :(1)血管生成因子及炎性因子:采集病人空腹静脉血3 ml,离心后分离血清,采用ELISA法检测病人治疗前及治疗6个疗程后的血清血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)、血管内皮生长因子B(VEGFB)、血管内皮生长因子C(VEGFC)及肿瘤坏死因子(TNF)-α、白细胞介素(IL)-1β、IL-6、IL-8水平。(2)凋亡因子:采用Western blot法检测病人治疗前及治疗6个疗程后的血清诱骗受体3(decoyreceptor3,DcR3)及环氧化酶-2(cyclooxygenase-2,COX-2)蛋白表达水平,以蛋白灰度值/β-actin灰度值表示各指标的蛋白相对表达量。(3)生存率:所有病人均随访3年或随访至其死亡时间,统计两组病人累积生存率,计算病人中位生存时间。。
三、统计学处理
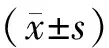

表3 两组血管生成因子水平比较 (μg/L)

表4 两组炎性因子水平比较
结果
1.两组临床疗效比较见表2。两组ORR及DCR比较,差异无统计学意义(P>0.05)。

表2 两组临床疗效比较 (例,%)
2.两组血管生成因子水平比较见表3。两组治疗后VEGFA、VEGFB、VEGFC水平低于治疗前,且观察组低于对照组,差异有统计学意义(P<0.05)。
3.两组炎性因子水平比较见表4。两组治疗后TNF-α、IL-1β、IL-6、IL-8水平低于治疗前,且观察组低于对照组,两组比较差异有统计学意义(P<0.05)。
4.两组凋亡因子水平比较见表5。两组治疗后DcR3、COX-2表达低于治疗前,且观察组低于对照组,两组比较,差异有统计学意义(P<0.05)。

表5 两组凋亡因子水平比较(灰度值)
5.两组生存曲线分析:观察组、对照组3年生存率分别为46.51%(20/43)和30.23%(13/43),中位生存时间分别为34.5个月、26.7个月,两组比较差异无统计学意义(Log -rank χ2=3.661,P=0.056)。
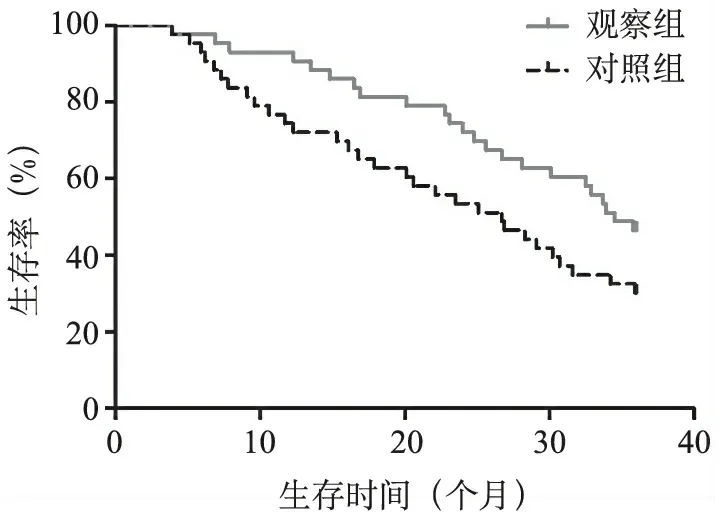
图1 两组生存曲线分析
6.两组不良事件发生率比较见表6。两组不良事件发生率比较,差异无统计学意义(P>0.05)。
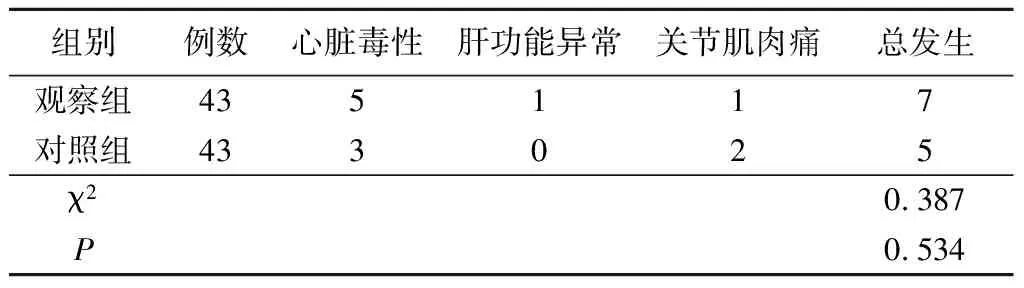
表6 两组不良事件发生率比较(例)
讨论
HER2是乳腺癌病人重要的预后指标,也是抗HER2药物治疗的主要预测指标。研究显示,HER2阴性病人的无病生存期明显长于HER2阳性病人[6]。曲妥珠单抗是第1个抗HER2的人源化单克隆抗体,该药物的出现改变了乳腺癌的诊治模式,在一定程度上改善病人HER2阳性乳腺癌病人预后。尽管曲妥珠单抗治疗HER2阳性乳腺癌有一定疗效,但较多临床研究显示,其与多种化疗药物具有协同增效作用,且联合治疗的临床疗效更佳[7]。有研究表明,HER2阳性腺癌最终都会对曲妥珠单抗产生耐药,且经该药物治疗病人的复发率较高[8],提示需在此药物的基础上给予其他化疗药物联合治疗。拉帕替尼是一种表皮生长因子受体及HER2的双靶点小分子酪氨酸激酶抑制剂,与曲妥珠单抗并无交叉耐药性,可作用于受体胞内激酶活性区,通过降低细胞增殖达到抗肿瘤作用。本研究发现,观察组、对照组ORR及DCR比较无明显差异,表明两种方式治疗HER2阳性乳腺癌病人的临床疗效相当,与上述研究结果不符,这可能与本研究纳入病人较少有关。曲妥珠单抗属于抗体类药物,作用于HER- 2受体胞外区,主要通过诱导肿瘤细胞凋亡发挥抗肿瘤作用。本研究发现,研究组治疗后DcR3及COX-2表达量低于对照组,表明联合治疗可抑制DcR3及COX-2表达,这可能是联合治疗能抑制肿瘤生长的作用机制之一,但目前临床上尚无研究证实。
IL-8是促血管生成因子,其与IL-1β还可直接影响乳腺癌血管形成、细胞侵袭及凋亡。IL-6可通过影响细胞周期基因、肿瘤干细胞自我更新、促进生成肿瘤血管及局部炎性反应等促进肿瘤的进展。TNF-α可影响血管内皮生长因子特异性结合血管内皮细胞,诱导肿瘤新生血管生成。本研究发现,观察组治疗后TNF-α、IL-1β、IL-6、IL-8水平低于对照组,表明联合治疗可降低TNF-α等炎性因子水平,而各炎性因子均与血管形成有关,故我们认为联合治疗或可起到降低机体血管内皮生长因子水平的作用。本研究结果显示,经联合治疗病人血清VEGFA、VEGFB、VEGFC水平显著低于经单药治疗病人,进一步证实了联合治疗可抑制血管内皮生长因子释放,这可能是联合治疗可抑制肿瘤生长的主要因素之一。
目前,曲妥珠单抗治疗HER2阳性转移性乳腺癌的临床疗效已得到证实,但是HER-2下游信号通路的改变均可能导致曲妥珠单抗的耐药。有研究表明,曲妥珠单抗治疗HER2阳性乳腺癌病人,虽极大程度改善了病人的预后,但仍然有一部分病人在经曲妥珠单抗治疗后出现原发或继发耐药现象,影响病人预后[9-10]。因此,本研究在该药物的基础上给予了拉帕替尼联合治疗。拉帕替尼因其不同的作用机制及具有服用方便、毒副作用小等优点,在二线抗HER2的治疗中显示出了优势。有研究表明,两种药物联合应用可发挥协同作用,抑制肿瘤细胞增殖效果更佳,改善病人预后[11-12]。但本研究发现,两组病人3年生存率无明显差异,即联合治疗对生存率的影响不大,与上述研究结果不符,这或与本研究纳入样本量少有关。本研究发现,两组病人不良反应发生率比较,无明显差异,表明在曲妥珠单抗的基础上应用拉帕替尼治疗HER2阳性乳腺癌病人,不会增加不良反应发生率。
综上所述,拉帕替尼联合曲妥珠单抗治疗HER2阳性乳腺癌,可降低血管内皮因子及炎症因子水平,抑制凋亡因子释放,但对病人生存率的影响不大。
