腺苷对大鼠离体脊髓运动神经元突触传递的影响
2023-12-18汪萌芽
刘 静,汪萌芽
(皖南医学院 细胞电生理研究室,安徽 芜湖 241002)
腺苷(Adenosine)是一种广泛存在的神经调质,与运动调控、学习记忆和睡眠、认知障碍等调节有关。在中枢神经系统中腺苷广泛分布于大脑皮层、海马、小脑、脑干和脊髓等部位[1]。腺苷A1、A2受体主要表达于脊髓背角、腹角和中央管周围区[2]。腺苷对于急、慢性疼痛和神经病理性疼痛[3-4]发挥着重要的镇痛作用。腺苷通过刺激Schaffer侧支纤维降低大鼠海马CA1区域诱发反应的长时程增强(long-term potentiation,LTP)[5],还可通过刺激苔藓纤维降低大鼠海马CA3锥体细胞诱发的场兴奋性突触后电位的LTP[6]。腺苷抑制中枢神经系统不同区域神经元的自发电活动[7],以及外周神经系统、嗅觉脑切片中诱发的突触活动[8]。腺苷调节哺乳动物脊椎运动控制的输出[9],对运动控制起着重要的作用。还能使脊髓腹角中间神经元超极化和运动神经元(Motoneuron,MN)去极化[10]。但腺苷在脊髓内在调控通路和下行激活通路中对运动控制的输出是否存在差异性。故本研究拟从腺苷对脊髓MN突触传递的影响来探究腺苷对脊髓内在调控通路和下行激活通路的影响。本实验运用脊髓切片MN细胞内记录技术,对同侧腹外侧索(ipsilateral ventrolateral funiculus,iVLF)和同侧中央管周围区(ipsilateral pericentral canal,iPCC)施加电刺激在MN诱发突触反应,分析腺苷对iVLF-EPSP和iPCC-EPSP的影响。为进一步了解腺苷对脊髓MN运动控制的调节及其机制提供参考。

A.RP=-65 mV;B.腺苷影响MN自发放电频率的统计图
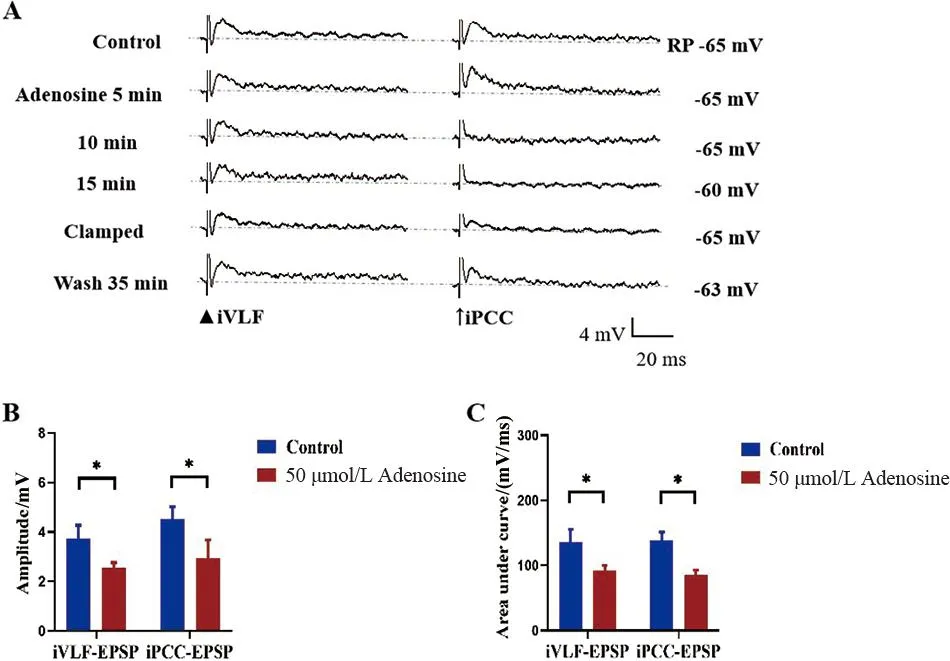
A.Control:对照,RP:静息电位,Clamped:手动钳制膜电位至RP水平,图中右侧数字表示膜电位的变化;Wash:ACSF冲洗(RP=-65 mV);B、C.腺苷对同细胞MN iVLF-EPSP和iPCC-EPSP幅度和曲线下面积影响的统计图
1 材料与方法
1.1 实验动物与脊髓切片的制备 选取8~14 d龄新生Sprague-Dawley(SD)大鼠,雌雄不拘,均由浙江省杭州医学院生产提供[动物生产许可证号:SCXK(浙)2019-0002]。根据本实验室已报道方法[11],取SD新生大鼠乙醚麻醉后,分离出腰骶膨大处的脊髓段,用振荡切片机(Vibratome 1500)切取(400~500 μm)的脊髓横切片若干,室温下(25±3)℃置于通入95%O2和5%CO2混合气体饱和的人工脑脊液(artificial cerebrospinal fluid,ACSF)中孵育备用。ACSF配方(mmol/L):CaCl22.4,NaCl 127.0,KCl 1.9,KH2PO41.2,NaHCO326.0,MgSO4·7H2O 1.3,Glucose·H2O 10.0。
1.2 细胞内记录 取脊髓切片放置在全浸式记录浴槽中,并固定脊髓切片。在恒流系统下持续灌流混合气体饱和的ACSF。取充有3 mol/L乙酸钾,尖端阻抗为60~120 ΜΩ的微电极(FSG12,Dagan Co.,USA),在显微镜下对脊髓腹角MN区域进行穿刺。电刺激由三通道电刺激器产生的脉冲,经隔离器以恒压模式通过同芯双极刺激电极施加。同芯双极刺激电极分别放置于脊髓腹根、iVLF和iPCC区域,用于激活腹根纤维、同侧iPCC以及iVLF的下行纤维。记录到的电信号经Axoclamp 900A微电极放大器放大处理后,与DigiData 1400A转换接口进行连接,用pClampex 10.2软件进行采样、显示和保存。
1.3 药物 腺苷(Sigma公司)用超纯水配制成母液,保存在-20℃冰箱中冷藏备用,使用前用ACSF稀释到所需浓度进行灌流。

2 结果
2.1 腺苷对离体脊髓MN基本电生理参数的影响 选取静息电位负于-60 mV,且动作电位有超射,稳定记录15 min以上的健康细胞,且在腹根施加电刺激记录到逆行AP鉴定为MN的细胞进行试验,灌流50 μmol/L腺苷15 min,观察到MN膜电位去极化(P<0.01)并伴随膜电阻增大(P<0.05),和AP幅度减小(P<0.01);但手动钳制到静息电位后,AP幅度[(64.40±6.45)mV]与用药前[(66.26±5.75)mV]相比差异无统计学意义(t配对=1.496,P>0.05)。见表1。
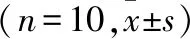
表1 腺苷对MN基本电生理参数的影响
2.2 腺苷对MN自发放电的影响 灌流腺苷15 min后可观察到MN自发放电频率减少(t配对=5.277,P<0.01),ACSF冲洗后,该抑制作用可被洗出。见图1。
2.3 腺苷在同细胞MN上对iVLF-EPSP和iPCC-EPSP的影响 灌流50 μmol/L腺苷15 min可观察到iVLF-EPSP的幅度和曲线下面积减小(t配对=2.728、2.405,P<0.05);iPCC-EPSP的幅度和曲线下面积减小(t配对=3.405、2.621,P<0.05),且作用可逆。其他参数的差异均无统计学意义(P>0.05)。见图2。
2.4 腺苷对脊髓MN iVLF-EPSP的浓度依赖性影响 累积灌流10、50、250 μmol/L腺苷各15 min观察到腺苷可浓度依赖性降低iVLF-EPSP的幅度(P<0.01),ACSF冲洗后可恢复。见表2、图3。
Control:对照,RP:静息电位,Clamped:手动钳制膜电位至RP水平,图中右侧数字表示膜电位的变化;Adenosine:累积灌流10、50、250 μmol/L各15 min;Wash:ACSF冲洗(RP=-65 mV,每一条记录线为1 min内10次记录的平均线)。
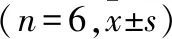
表2 腺苷对MN iVLF-EPSP电生理参数的影响
2.5 腺苷对脊髓MN iPCC-EPSP的浓度依赖性影响 累积灌流10、50、250 μmol/L腺苷各15 min观察到腺苷可浓度依赖性降低iPCC-EPSP的幅度(P<0.01),ACSF冲洗后可恢复。见表3、图4。

Control:对照,RP:静息电位,Clamped:手动钳制膜电位至RP水平,图中右侧数字表示膜电位的变化;Adenosine:累积灌流10、50、250 μmol/L各15 min;Wash:ACSF冲洗(RP=-65 mV,每一条记录线为1 min内10次记录的平均线)。
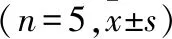
表3 腺苷对MN iPCC-EPSP电生理参数的影响
2.6 腺苷对MN iVLF-EPSP表观受体动力学的影响 灌流腺苷15 min后观察到表观结合速率常数K1、表观解离速率常数K2和表观平衡解离常数KT均无明显改变(t配对=1.039、1.408、0.635,P>0.05)。见图5。

一个记录到MN后灌流腺苷处理前(黑色线)、后(红色线)的iVLF-EPSP(RP=-65mV);B~D.对用药前后iVLF-EPSP表观受体动力学各参数分析图,
2.7 腺苷对MN iPCC-EPSP表观受体动力学的影响 灌流腺苷15 min后观察到表观结合速率常数K1、表观解离速率常数K2和表观平衡解离常数KT均无明显改变(t配对=1.000、1.741、1.900,P>0.05)。见图6。
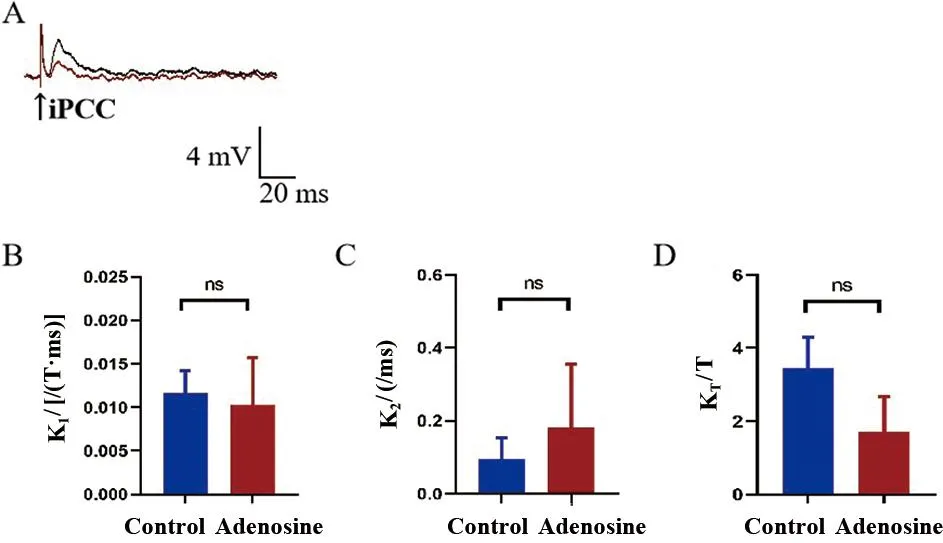
一个记录到MN后灌流腺苷处理前(黑色线)、后(红色线)的iPCC-EPSP(RP=-65mV);B~D.对用药前后iPCC-EPSP表观受体动力学各参数分析图,
3 讨论
腺苷是一种广泛存在的神经调质,属于G蛋白偶联受体,目前已被证实有4种受体,即A1、A2A、A2B和A3受体[12]。本实验运用细胞内记录技术,观察到灌流50 μmol/L腺苷使MN膜电位去极化并伴随膜电阻增大、AP幅度减小,但手动钳制膜电位至静息电位后,AP幅度与用药前相比未发生具有统计学意义的变化,表明腺苷可能并不直接影响AP,而是产生细胞膜电位去极化导致AP幅度的减小。而观察到的这种去极化现象与文献报道一致[10],即腺苷降低了突触前末梢释放递质的概率,使运动神经元去极化。腺苷介导的MN去极化并伴随膜电阻的增大可能与激活腺苷受体导致脊髓运动神经元K+通道关闭并激活Ca2+通道有关。而腺苷降低MN自发放电频率,可能与超极化后电位有关,有证据表明腺苷可增强超极化后电位,这很大程度上是由钙依赖性钾电导的增加所介导[13-14]。提示腺苷可能通过增强钙依赖性钾电流来减弱MN的兴奋性。腺苷可减小iVLF-EPSP和iPCC-EPSP的幅度和曲线下面积(P<0.05)。而腺苷对EPSP的抑制作用,可能与A1R的激活使兴奋性神经递质的释放减少有关,A1R介导的抑制突触传递,其机制被认为依赖于A1R与抑制性N型钙通道的偶合[15-16],从而减少中枢突触中由刺激所诱发的谷氨酸释放[17-18],这种通过同时控制N型钙通道和NMDA受体来影响对兴奋性刺激的反应[19-20],进而调节突触活动。其中A2AR药理学的激活可以调节NMDA受体的功能,故我们推测腺苷对脊髓MN突触传递的影响可能涉及A1R和A2R,其中以A1R为主。表观受体动力学分析是反映递质与受体结合的动力学过程。分析用药前后腺苷对iVLF-EPSP和iPCC-EPSP表观受体动力学参数值尽管有变化但无统计学意义,尚不能证明腺苷对突触后受体亲和力的影响,进而提示影响谷氨酸递质的释放等影响突触传递的可能性。具体的受体机制仍需在后续的研究和分析中予以明确。
综上,腺苷可以通过抑制脊髓内在调控通路和下行激活通路向运动神经元的突触传递而调控脊髓运动控制的输出。而进一步分析腺苷对脊髓内在调控神经元通路和下行激活通路突触传递影响的作用机制有助于我们深化对脊髓突触传递的认识,也为临床治疗SCI等运动障碍性疾病提供用药依据。
