TREM2促进心肌梗死后心肌细胞再生的机制研究
2023-12-18钱陈慧钰黄子鉴
钱陈慧钰,黄子鉴,傅 聪
(1.皖南医学院第一附属医院 弋矶山医院 心内科,安徽 芜湖 241001;2.皖南医学院 麻醉学实验实训中心,安徽 芜湖241002)
冠状动脉粥样硬化性心脏病(冠心病)在全球范围内的发病率逐年升高,也是造成居民死亡的主要因素之一。既往的观点认为心肌细胞是终末期细胞,无法再生。但随着近年来研究的不断深入,心肌细胞是终末期细胞这一观点不断受到挑战。越来越多的研究认为心肌细胞在特定的微环境下可以重新进入细胞周期,开始有丝分裂[1-2]。因此,阐明心肌细胞再生的机制和关键作用靶点对改善心肌梗死(myocardial infarction,MI)后心肌细胞凋亡,恢复心脏收缩功能,进而改善患者的心功能具有重要意义[3]。
髓系细胞触发受体2(triggering receptor expressed on myeloid cells-2,TREM2)属于免疫球蛋白超家族的跨膜受体。在小鼠肺缺血再灌注损伤模型中,TREM2可以作为一种保护性因子参与调控早期炎症反应的发生发展过程[4]。之前的研究发现TREM2可预防缺血性心肌损伤,促进MI后的心肌细胞存活[5]。因此,本研究旨在探讨TREM2在MI后发挥心脏保护作用的机制。
细胞周期素A2(CyclinA2)是调控细胞有丝分裂的关键蛋白,从S期到早期有丝分裂都高表达。通过激活细胞周期蛋白依赖性激酶Cdk1和Cdk2促进有丝分裂的启动[6]。有研究表明将CyclinA2基因递送到梗死的猪心脏会引起心肌细胞有丝分裂增加、心肌细胞数量增加和纤维化减少[7]。为此,本研究通过MI患者临床血浆样本检测和小鼠MI模型探讨MI后TREM2是否可以通过CyclinA2促进心肌细胞再生。
1 材料与方法
1.1 实验动物 SPF级雄性C57BL/6小鼠,8~10周龄,质量20~25 g,购自江苏集萃药康生物科技股份有限公司。许可证号为SCXK(苏)2018-000。TREM2-/-小鼠购自南京模式动物研究所。小鼠饲养于SPF级动物房(12 h∶12 h光照下饲养,可以自由获取食物和水)。
1.2 主要试剂 HE染色试剂盒和Masson三色染色试剂盒购自北京Solarbio公司;BCA检测试剂盒购自上海碧云天生物技术研究所;β肌动蛋白(β-actin)抗体购自biosharp生物有限公司;CyclinA2抗体购自美国R&D公司;PrimeScriptTM RT试剂盒和TB Green Premix Ex Taq试剂盒购自日本TAKARA公司;TREM2、CyclinA2和β-actin引物由上海生物工程有限公司设计合成。
1.3 TREM2血浆浓度检测 采集弋矶山医院心内科住院的经冠状动脉造影(CAG)确定的10例MI患者外周静脉血,8名年龄与性别匹配的无冠心病患者作为对照组。使用人TREM2 SimpleStep ELISA试剂盒(Abcam,英国)检测血浆TREM2浓度。
1.4 MI模型的建立和实验分组 将C57BL/6小鼠随机分为对照组、假手术组、野生型小鼠MI组和TREM2-/-小鼠MI组,每组6只小鼠。采用左前降支(LAD)永久结扎法建立AMI模型[8]。通过腹腔注射戊巴比妥钠(35 mg/kg)麻醉并插管。在第4肋间打开胸腔,暴露心脏。用7-0缝线在距左心耳2~3 mm处结扎LAD,左心室前壁苍白,心脏跳动减弱表明AMI诱导成功。
1.5 取材及指标检测
1.5.1 实时荧光定量PCR(qRT-PCR)检测心肌组织中TREM2和CyclinA2 mRNA表达水平 使用Trizol试剂从心脏组织中分离总RNA,通过逆转录试剂盒将总RNA逆转录为互补DNA(cDNA)。内参为β-actin。采用2-△△Ct法对目的基因的相对表达水平进行计算。引物序列为TREM2(正向引物:CTACCAGTGTCAGAGTCTCCGA,反向引物:CCTCGAAACTCGATGACTCCTC)、CyclinA2(正向引物:TTGTAGGCACGGCTGCTATGCT,反向引物:GGTGCTCCATTCTCAGAACCTG)和β-actin(正向引物:AGAGGGAAATCGTGCGTGAC,反向引物:AGGAAG-AGGATGCGGCAGT)。
1.5.2 免疫蛋白印迹(Western blot)法检测心肌组织中蛋白表达 用放射免疫沉淀法(RIPA)裂解液提取心肌组织总蛋白。BCA法测定蛋白质总浓度后,将蛋白质(30 μg)变性并通过15%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分离并转移到聚偏二氟乙烯(PVDF)膜上。用5%牛血清白蛋白(BSA)封闭膜1 h,TBST洗膜3次(每次10 min)后。将膜与β-actin一抗以1∶1 000稀释后在4℃下孵育过夜(12~16 h),然后将HRP标记的山羊抗兔IgG二抗(1∶40 000)与膜在常温孵育1 h。将膜与CyclinA2一抗以1∶400稀释后在4℃下孵育过夜,然后将HRP标记的山羊抗小鼠IgG二抗(1∶40 000)与膜在常温孵育1 h。ECL化学发光底物显影后用Tanon 5200发光成像系统捕获图像,用Image J软件计算条带灰度值。
1.5.3 HE染色和Masson染色检测 心肌组织病理学变化腹腔注射过量戊巴比妥(130 mg/kg)后断颈处死,生理盐水灌流后,取结扎线下方的左心室组织。4%多聚甲醛固定48 h后,经梯度脱水后石蜡包埋和切片(厚度5 μm)。切片在60℃烘箱中烤片2 h,冷却至室温后进行常规HE染色和Masson染色。用光学显微镜观察组织损伤,Image J计算心肌病变程度和纤维化面积。

2 结果
2.1 冠心病患者血浆中TREM2浓度升高 冠心病患者的血浆TREM2水平高于健康对照组,两组数据符合正态分布,差异有统计学意义(t=2.592,P=0.020)(图1)。
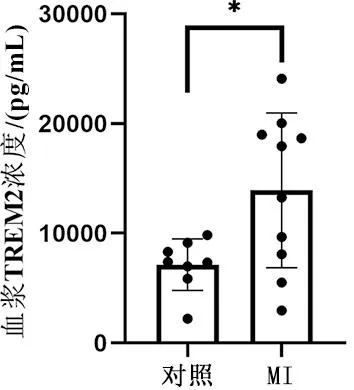
与对照组比较,*P<0.05。
2.2 PCR结果证明梗死后第2天心肌中CyclinA2表达最高 RT-PCR结果显示,MI后1、2、3 d,心肌组织中的TREM2 mRNA表达逐渐增加(P<0.05)(图2A),CyclinA2在梗死后第2天mRNA表达量达到高峰(P<0.05)(图2B)。
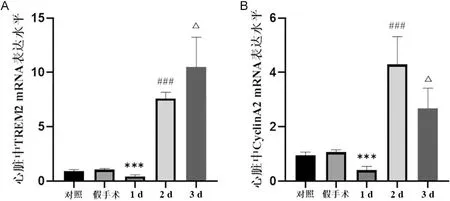
A.心肌组织中的TREM2 mRNA表达随时间变化情况;B.心肌组织中的CyclinA2表达随时间变化情况。与对照组比较,***P<0.001;与1 d比较,###P<0.001;与2 d比较,△P<0.05。n=6,FA=81.350,PA<0.001;FB=46.650,PB<0.001。
2.3 心肌组织CyclinA2蛋白表达水平 Western blot对各组小鼠心肌组织中CyclinA2蛋白表达水平进行半定量分析。分为对照组、假手术组、C57和TREM2-/-小鼠MI后第2天梗死区和梗死边缘区。如图3所示,与对照组相比,C57小鼠梗死区和梗死边缘区心肌中CyclinA2蛋白表达水平明显增加(P<0.05)。TREM2-/-梗死区心肌中CyclinA2蛋白表达水平较C57梗死区减少(P<0.05),此外TREM2-/-梗死边缘区心肌中CyclinA2蛋白表达水平较C57梗死边缘区减少(P<0.05)。
2.4 各组小鼠心肌组织损伤比较 HE染色结果显示(图4),对照组和假手术组心肌细胞形态规则,心肌纤维排列整齐,无明显水肿和炎性细胞浸润;与对照组相比,C57和TREM2-/-MI组小鼠心脏中可见心肌细胞排列紊乱、肿胀、数量减少,心肌纤维出现断裂,炎性细胞浸润明显(C57MI:P=0.044;TREM2-/-MI:P=0.000);与C57组相比,TREM2-/-小鼠心脏心肌细胞排列紊乱、数量减少,炎性细胞浸润增加,心肌损伤加重(t=4.781,P=0.001)。病理评分根据半定量量表分级:0=无病变;1=涉及25%心肌的病变;2=累及25%~50%心肌的病变;3=累及50%~75%心肌的病变;4=累及75%~100%心肌的病变[9]。Image J计算各组心肌病变程度得到相应的评分。
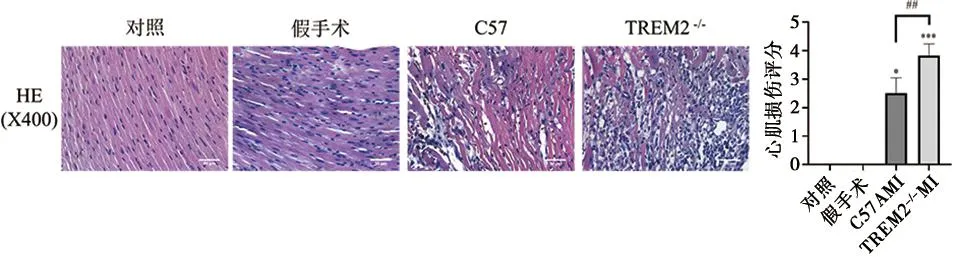
与对照组比较,*P<0.05,***P<0.001;与C57MI组比较,##P<0.01。n=6,比例尺:50 μm;H=22.181,P<0.01。
2.5 Masson染色显示各组小鼠梗死边缘区心肌纤维化程度 Masson染色显示(图5),假手术组胶原纤维网保持完好,规律地排列在心肌细胞之间;MI组在梗死边缘区可见大量心肌细胞坏死并被胶原纤维替代,心肌纤维化明显(P<0.001),残留的心肌细胞数目少且排列紊乱;TREM2-/-MI组心脏梗死边缘区胶原纤维较C57MI组明显增多(P<0.001),纤维化程度加重。
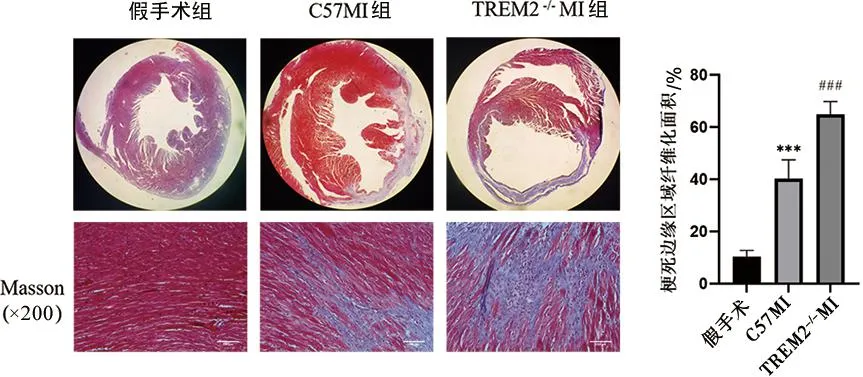
与假手术组比较,***P<0.001;与C57MI组比较,###P<0.001。n=6,比例尺:100 μm;F=165.300,P<0.001。
3 讨论
MI后大量心肌细胞凋亡引起的心力衰竭是MI后主要的并发症。目前很多研究表明干细胞疗法[10]和外泌体疗法[11-12]可能是心脏修复和再生的新方法。有大量研究表明向梗死心肌输送干细胞可以促进心脏修复,预防或逆转心室重塑[13]。外泌体疗法作为一种无细胞疗法减少了干细胞疗法中输入不良细胞的可能性,但是干细胞疗法和外泌体疗法的确切疗效还有待于进一步证实,目前尚无法运用于临床。
既往研究提示TREM2在循环系统中可以发挥多种保护作用。动物模型研究发现TREM2可以减轻高血压小鼠的炎症反应和神经元凋亡[14]。此外,心脏中存在一类高表达TREM2的巨噬细胞亚群,可以识别并吞噬损伤的线粒体,在维持心脏代谢平衡中起到了重要的作用[15]。本课题组前期研究还发现心脏高表达TREM2的小鼠MI后心肌细胞存活率升高,梗死面积减小。提示TREM2可通过不依赖巨噬细胞的途径直接增强缺血性损伤时心肌细胞的抗凋亡能力[5]。本研究发现,MI患者TREM2血浆浓度较健康对照组显著增加。野生型小鼠MI后心脏中TREM2和CyclinA2 mRNA表达水平增加,TREM2在MI后1、2、3 d逐渐增加,而CyclinA2在MI后第2天心脏表达达到高峰。可能的原因是凋亡心肌细胞来源的TREM2可以促使梗死边缘区心肌细胞表达CyclinA2。
CyclinA2在DNA复制和转录中发挥着重要的作用,调节细胞周期并且促进成年心肌细胞增殖和心肌再生[16]。原代大鼠心肌细胞体外转染CyclinA2基因后,心肌细胞有丝分裂指数明显升高,且多数细胞形成双核[17]。本研究发现TREM2基因敲除后梗死区和梗死边缘区CyclinA2的蛋白表达水平明显减少,梗死区炎症细胞浸润增加,梗死边缘区胶原纤维含量显著增加,纤维化程度增加。这进一步表明了TREM2可能通过激活心肌细胞CyclinA2的表达,在MI后通过增加心肌细胞再生发挥心脏保护作用。
本研究表明,MI后尽管梗死区出现大量心肌细胞死亡,但是心脏启动自我修复机制,通过TREM2激活梗死边缘区心肌细胞CyclinA2的表达,促进梗死边缘区的心肌细胞重新进入细胞周期。本研究的发现有利于进一步阐明TREM2作为一种保护性因子参与MI后心脏修复的分子机制。但是TREM2引起激活心肌细胞CyclinA2表达增加的具体机制有待深入研究。
