谷氨酸棒杆菌中L-半胱氨酸外排蛋白的鉴定及应用
2023-12-18乔晋芳杜焕敏刘川祁玉婷吴硕徐宁戴玉杰邵丽刘君
乔晋芳,杜焕敏,刘川,祁玉婷,吴硕,徐宁,戴玉杰,邵丽,刘君*
1(天津科技大学 生物工程学院,天津,300457)2(中国科学院天津工业生物技术研究所,天津,300308)3(东北农业大学 生命科学学院,黑龙江 哈尔滨,150038)
L-半胱氨酸是一种重要的含硫氨基酸,被广泛用于医药制造、食品加工及饲料生产等领域[1-4]。全球每年L-半胱氨酸需求超过4 000 t,市场前景十分光明[5]。目前,L-半胱氨酸的工业生产仍采用盐酸水解毛发的传统生产模式[6],但这种方法有很大的局限性,如收率低和环境污染严重。微生物发酵法具有原料来源广泛、生产条件温和、环境友好和过程容易控制等优势,越来越受到各国的重视。
微生物发酵法生产L-半胱氨酸常用的菌株主要是大肠杆菌(Escherichiacoli)和谷氨酸棒杆菌(Corynebacteriumglutamicum)[7-9]。由于L-半胱氨酸代谢合成网络复杂且具细胞毒性[3,10-11],建立高效L-半胱氨酸生产菌株面临困难。因此,降低细胞毒性是微生物发酵法高效生产L-半胱氨酸的一种有效策略。早期的研究报道,有效的外排系统可以维持细胞内氨基酸的稳态,降低反馈抑制和细胞毒性,并进一步提高生产能力[5,12-13]。LIU等[14]在大肠杆菌中发现了一种新的L-蛋氨酸外排蛋白YjeH,它显著提高了L-蛋氨酸的转运能力,并将L-蛋氨酸的产量提高了70%。ZHANG等[15]在谷氨酸棒杆菌中发现了一种新的L-丝氨酸转运蛋白SerE,SerE过表达极大地提高了菌株对L-丝氨酸的耐受性,并进一步提高了L-丝氨酸的产量。外排系统在L-半胱氨酸的生产中也发挥着重要作用,能够显著增强L-半胱氨酸的分泌能力和耐受性,从而进一步提高L-半胱氨酸生产能力[5,16]。在大肠杆菌中已鉴定出至少5种L-半胱氨酸外排蛋白,包括EamA、EamB、Bcr、CydDC和TolC[2]。过表达上述外排蛋白后,胞内L-半胱氨酸水平显著降低,同时L-半胱氨酸耐受性和生产能力显著提高[17]。此外,CefA和CefB被鉴定为菠萝泛菌的L-半胱氨酸外排蛋白,过表达这些蛋白可降低生长抑制效应并促进胞外L-半胱氨酸积累[18]。
谷氨酸棒杆菌作为一种重要的食品安全级工业微生物,被认为是生产各种氨基酸的理想菌株[19-20]。在谷氨酸棒杆菌中,约750种膜蛋白涉及17个转运蛋白家族作为氨基酸候选转运蛋白。然而,很少有关于谷氨酸棒杆菌L-半胱氨酸转运蛋白的研究。为了提高谷氨酸棒杆菌L-半胱氨酸的生产能力,寻求其自身的L-半胱氨酸转运蛋白具有重要意义。因此,本研究通过转录组分析寻找谷氨酸棒杆菌中潜在的L-半胱氨酸转运蛋白,然后测试不同候选基因缺失突变体的L-半胱氨酸耐受性和外排能力,最终确定Cg1298-Cg1299为谷氨酸棒杆菌的L-半胱氨酸外排蛋白,并通过发酵实验探究了转运蛋白对L-半胱氨酸发酵的影响。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒
表1列出了本研究中使用的所有菌株。其中大肠杆菌DH5a与谷氨酸棒杆菌ATCC 13032均由中国科学院天津工业生物技术研究所保藏。
本研究中使用的质粒列于表2。大肠杆菌-谷氨酸棒杆菌穿梭载体pECXK-99E用于基因表达,pCRD206用于基因敲除。

表2 本研究所用的质粒
1.1.2 工具酶及试剂
T4DNA连接酶、Eco31 I、XbaI、BamH I、Phusion DNA聚合酶,Thermo Fisher公司;质粒提取试剂盒和胶回收试剂盒,天根生物公司;卡那霉素,索莱宝生物科技有限公司;L-半胱氨酸,上海阿拉丁生化科技股份有限公司;琼脂粉、脑心浸液、胰蛋白胨、酵母提取物、葡萄糖、尿素、山梨醇、玉米浆,天津百赛斯生物科技有限公司;其他试剂(如NaCl、K2HPO4、MgCl2等)均为国产分析纯。
1.1.3 培养基及培养条件
Luria-Bertani(LB)(g/L):酵母提取物 5,胰蛋白胨 10,NaCl 10。LBHIS(g/L):酵母提取物 2.5,胰蛋白胨 5,脑心浸液 18.5,NaCl 5,山梨醇 91。CGXII(g/L):葡萄糖 5,NH4Cl 20,尿素 5,KH2PO41,K2HPO41.3,MgCl20.25,CaCl210 mg/L,3-吗啉丙磺酸42,生物素0.2 mg/L,维生素B10.1 mg/L,原儿茶酸0.03 mg/L,FeCl210 mg/L,MnCl210 mg/L,ZnCl21 mg/L,CuCl20.2 mg/L,NiCl20.02 mg/L。种子培养基(g/L):葡萄糖 30,玉米浆 20,(NH4)2SO45,尿素 2,MgSO40.5,KH2PO40.5。发酵培养基(g/L):葡萄糖 80,玉米浆 30,Na2S2O320,KH2PO41,MgSO40.5,L-蛋氨酸 0.5,L-异亮氨酸 0.5,MnSO40.01,FeSO40.01,维生素B11 mg/L,生物素0.2 mg/L。此外,向发酵培养基中添加20 g/L CaCO3以缓冲pH。PBS(pH=7.2)(g/L):NaCl 8,KH2PO40.2,Na2HPO4·12 H2O 2.9,KCl 0.2。其中固体培养基加20 g/L琼脂粉。
大肠杆菌DH5a为宿主细胞,在37 ℃ LB培养基中进行基因克隆。谷氨酸棒杆菌ATCC 13032在32 ℃ LBHIS培养基中培养。如有抗生素需求,将50 μg/L或25 μg/L卡那霉素分别添加到培养基中,用来培养大肠杆菌和谷氨酸棒杆菌。
1.2 实验方法
1.2.1 基因敲除
利用特异性引物以谷氨酸棒杆菌ATCC 13032基因组DNA为模板扩增目标基因。PCR扩增使用Phusion DNA聚合酶。通过Gibson组装方法将纯化的产物克隆到目标载体中[21],并获得重组质粒。根据OKIBE等[22]报道的方法,通过两步同源重组法构建谷氨酸棒杆菌的基因缺失菌株。
1.2.2 转录组测序分析
将过夜培养谷氨酸棒杆菌ATCC 13032按照初始OD600值为0.1的接种量转接至新鲜LBHIS培养基,向体系中添加不同浓度的L-半胱氨酸(5、20、50 mmol/L)。当菌株生长到对数中期时,立即采集样本进行RNA提取。RNA制备纯细胞/细菌试剂盒用于分离提纯总RNA。转录组测序在北京诺禾致源科技股份有限公司完成,参考基因组为(https://www.genome.jp/dbget-bin/get_linkdb?-t+genes+gn:T00244)。转录组测序结果已上传NCBI SRA数据库,登录号:PRJNA942449。
1.2.3L-半胱氨酸耐受性分析
琼脂平板中随机选择单克隆,在32 ℃ LBHIS培养基中培养过夜。洗涤并收集菌体,PBS重悬,将重悬后的菌液转接到新鲜的LBHIS培养基中(含有0、2.5、5、7.5、10 mmol/LL-半胱氨酸),初始OD600值为0.1。32 ℃,200 r/min培养定时取样,使用紫外分光光度计(中国上海鑫茂仪器)在600 nm处检测吸光度值。
1.2.4 二肽摄取和L-半胱氨酸外排测定
为了表征野生型和缺失突变体的外排性能,使用二肽Cys-Tyr测试L-半胱氨酸的外排能力[23]。菌株在LBHIS培养基中32 ℃过夜培养。低速离心收菌、重悬并转接至新鲜CGXII培养基中,初始OD600值为0.1。菌体达到中期生长阶段,立即收菌并用32 ℃预热的PBS将其重悬至OD600= 10。将重悬物转接到32 ℃预热的CGXII培养基中,并加入10 mmol/L的Cys-Tyr,在200 r/min,32 ℃条件下培养10 min取样,测定细胞外L-半胱氨酸浓度。
1.2.5 摇瓶发酵
挑选单菌落WT、cg1298-R、cg1299-R和cg1298-1299-R接种至5 mL LBHIS 液体培养基中,200 r/min,32 ℃过夜培养。以5%接种量接种至20 mL种子培养基中,200 r/min,32 ℃培养12 h后,转接至发酵培养基进行发酵生产L-半胱氨酸,控制初始OD值为1,发酵时长为72 h。
1.2.6L-半胱氨酸测定方法
使用GAITONDE[24]的标准方法测定L-半胱氨酸的浓度。茚三酮溶液与L-半胱氨酸发生特异性反应,形成的粉红色产物在560 nm处可检测到吸收光。
2 结果与分析
2.1 L-半胱氨酸对谷氨酸棒杆菌生长的影响
L-半胱氨酸的细胞毒性被认为是微生物法发酵生产L-半胱氨酸的一个限制因素[3,17,23]。为了研究这一毒性机制对谷氨酸棒杆菌的影响,我们首先监测了在不同浓度L-半胱氨酸(0、2.5、5、7.5、10 mmol/L)胁迫下谷氨酸棒杆菌的生长能力。如图1所示,谷氨酸棒杆菌生物量随L-半胱氨酸浓度的增加而降低,尤其在添加10 mmol/LL-半胱氨酸压力下,该菌株的生物量仅为对照组的44%。

图1 谷氨酸棒杆菌在不同浓度L-半胱氨酸胁迫下的细胞生长测定
2.2 转录组分析L-半胱氨酸对谷氨酸棒杆菌的影响
为了探究谷氨酸棒杆菌的L-半胱氨酸解毒机制,我们对其进行了不同浓度L-半胱氨酸 (5、20、50 mmol/L)的胁迫,并做转录组测序分析。
2.2.1 转录组分析L-半胱氨酸生物合成途径基因变化
为了进一步了解L-半胱氨酸对谷氨酸棒杆菌的影响,我们分析了L-半胱氨酸生物合成途径相关基因的表达变化。谷氨酸棒杆菌中L-半胱氨酸的合成途径包括碳模块和硫模块,其中硫模块分为硫酸盐同化途径和硫代硫酸盐同化途径。在谷氨酸棒杆菌中硫酸盐同化途径比较清晰,但是硫代硫酸盐同化途径鲜有报道。如图2所示,受到L-半胱氨酸胁迫时,谷氨酸棒杆菌硫酸盐同化途径的关键基因表达量都显著下降,这将会降低其硫同化的速度,进而影响L-半胱氨酸的生物合成。另一方面,L-半胱氨酸碳模块的基因表达量也都下调,使得更少的代谢流流向L-半胱氨酸合成途径,进一步影响合成L-半胱氨酸。以50 mmol/LL-半胱氨酸处理组为例,与对照组相比,硫酸盐同化途径基因cysD、cysN、cysH、cysI和cysJ分别下降93.1%、94.5%、93.7%、91.1%和84.7%;L-半胱氨酸的碳模块基因serA、serC、serB、cysE和cysK分别下降27.0%、26.6%、39.0%、16.8%和78.5%。由于L-半胱氨酸具有细胞毒性,使得谷氨酸棒杆菌不能积累过量的L-半胱氨酸,这成为以谷氨酸棒杆菌为底盘菌株生产L-半胱氨酸不可避免的问题。先前的研究报道,将L-半胱氨酸从体内转运到体外可以降低L-半胱氨酸对细胞的毒害作用[25],从而提高菌株对L-半胱氨酸的耐受性,因此,寻找合适的L-半胱氨酸外排蛋白显得尤为重要。

图2 转录组分析L-半胱氨酸生物合成途径基因表达水平变化
2.2.2 谷氨酸棒杆菌外排蛋白筛选
谷氨酸棒杆菌中对L-半胱氨酸转运蛋白的研究甚少,本研究通过转录组测序,以转运蛋白基因在3个L-半胱氨酸胁迫条件下的表达量变化为依据,寻找谷氨酸棒杆菌中潜在的L-半胱氨酸外排蛋白。为了进一步筛选谷氨酸棒杆菌中的天然L-半胱氨酸外排蛋白,使用火山图分析了L-半胱氨酸胁迫下实验组中的差异表达基因,如图3-a所示,与野生型谷氨酸棒杆菌ATCC 13032相比,在5、20、50 mmol/LL-半胱氨酸处理组中分别有131、245、303个基因上调,122、198、262个基因下调。其中,与转运蛋白相关的差异表达基因131个,其中表达上调基因有32个,结合KEGG注释从差异表达基因中选出14个候选的L-半胱氨酸外排蛋白基因cg2812、cg2279、cg1664、cg1100、cg0314、cg3321、cg3245、cg2339、cg2301、cg2277、cg1288、cg0456、cg1298和cg1299(表3、图3-b),其中实验室前期已经对候选基因cg1298和cg1299进行了初步的探究[26]。
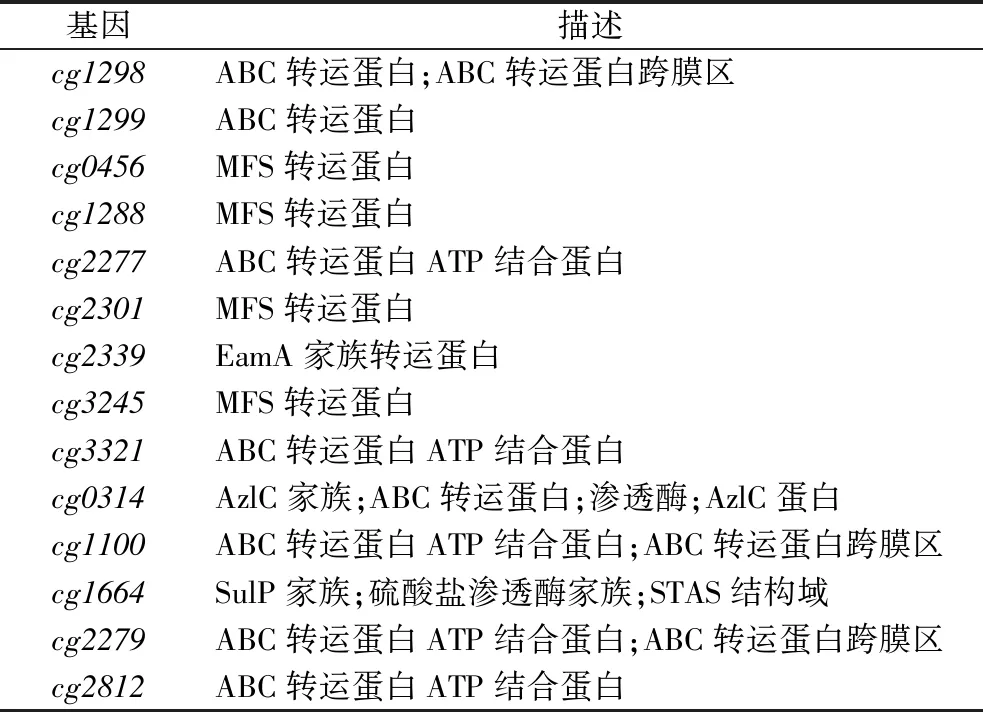
表3 L-半胱氨酸转运蛋白候选基因
2.3 谷氨酸棒杆菌L-半胱氨酸外排蛋白功能鉴定
2.3.1L-半胱氨酸候选蛋白对谷氨酸棒杆菌生长影响
为了探究候选外排蛋白的L-半胱氨酸转运功能,我们对野生型谷氨酸棒杆菌ATCC 13032中15个候选基因分别进行敲除,将所得菌株在含有0 mmol/L和7.5 mmol/LL-半胱氨酸的LBHIS培养基中培养,培养8 h后测定其细胞生长。如图3-c所示,在0 mmol/LL-半胱氨酸处理组中,所有菌株的生长没有明显差异。然而在7.5 mmol/LL-半胱氨酸处理组中,cg1298和cg1299缺失菌株的生物量显著减少,与野生型谷氨酸棒杆菌ATCC 13032菌株相比分别下降了13.5%和16.7%。
生物信息学分析发现,cg1298和cg1299在基因组上有重叠区域(图3-d),推测其可能协同发挥功能。因此,对cg1298和cg1299同时进行敲除,并研究了该双敲菌株对L-半胱氨酸的耐受性。结果表明,与单敲菌株相比,双敲菌株对L-半胱氨酸更加敏感,与野生型谷氨酸棒杆菌ATCC 13032菌株相比,其生长降低了24.2%(图3-c)。为了进一步研究cg1298和cg1299的功能,对双敲菌株进行了基因的回补,得到其回补菌株Δcg1298-cg1299-R,并进行生长测试(图3-e)。如图3-e所示,回补菌株的生长与野生型谷氨酸棒杆菌ATCC 13032的基本一致,证明了回补菌株恢复了其对L-半胱氨酸的抗性。
2.3.2 Cg1298-Cg1299对L-半胱氨酸外排能力测定
外排能力被认为是外排蛋白的一项重要指标。为更好地了解候选蛋白Cg1298-Cg1299对L-半胱氨酸的转运能力,使用二肽Cys-Tyr检测3种缺失菌(Δcg1298、Δcg1299 和Δcg1298-cg1299)的L-半胱氨酸外排能力。二肽转运原理如图4-a所示,Cys-Tyr穿过细胞膜经过细胞代谢分解成氨基酸后,L-半胱氨酸通过外排蛋白排出胞外。

a-L-半胱氨酸外排示意图;b-胞外L-半胱氨酸含量
由图4-b可知,与野生型谷氨酸棒杆菌ATCC 13032相比,3株缺失菌株的L-半胱氨酸转运能力都有不同程度下降,尤其是双敲菌株,其L-半胱氨酸的外排能力下降了26.3%。综上所述, Cg1298和Cg1299具有L-半胱氨酸的外排功能。接着,以谷氨酸棒杆菌 ATCC 13032为研究对象,利用网站https://blast.ncbi.nlm.nih.gov/Blast.cgi?PAGE=Proteins& 对Cg1298和Cg1299进行同源性分析,发现Cg1298和Cg1299与大肠杆菌中CydDC具有一定的同源性,相似性分别为29%和29%(表4)。早期研究指出,CydDC属于ABC转运蛋白家族,具有转运谷胱甘肽和半胱氨酸的能力,其主要形成一个复合体行使转运功能[27-29]。因此,推测Cg1298-Cg1299具有与大肠杆菌CydDC相似的功能,可能也以复合体的形式行使转运功能,这也与本实验结果相一致(图3-e、图4-b)。
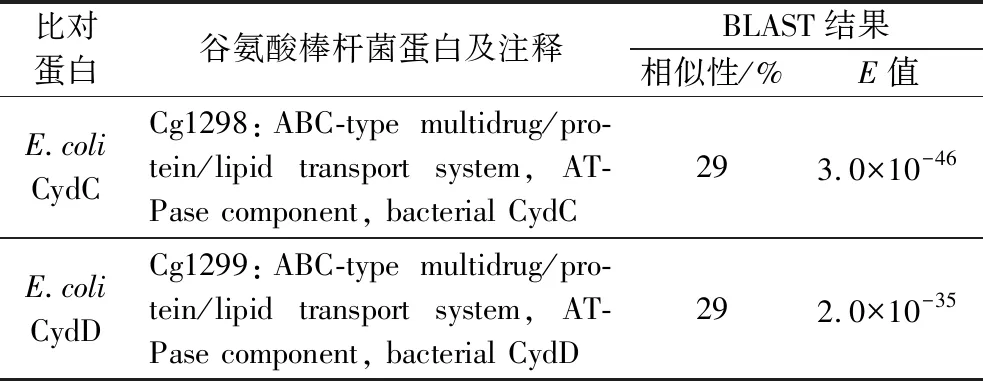
表4 谷氨酸棒杆菌中L-半胱氨酸外排蛋白的同源性分析
2.3.3 Cg1298-Cg1299对L-半胱氨酸发酵影响
由于cg1298-cg1299双敲菌株显著降低了L-半胱氨酸的耐受性及转运能力,推测Cg1298-Cg1299是谷氨酸棒杆菌中与L-半胱氨酸外排相关的转运蛋白。研究指出,L-半胱氨酸的外排可以增强菌株对L-半胱氨酸的耐受性,提高L-半胱氨酸的产量[23]。在本研究中,将cg1298、cg1299和cg1298-cg1299分别在L-半胱氨酸底盘菌株Q中过表达[3],成功构建了3株工程菌株(Q-cg1298、Q-cg1299、Q-cg1298-1299)。结果表明,与对照菌株相比,3株菌株的细胞生长在培养前48 h无明显差异,然而48 h后生物量均略微下降(图5-a)。如图5-b所示,过表达菌株Q-cg1298-1299的L-半胱氨酸产量在摇瓶发酵中产量达到466 mg/L,比对照菌株(398 mg/L)提高约17.1%,这与L-半胱氨酸的耐受性和外排能力一致(图3、图4),从而进一步证明了Cg1298-Cg1299是谷氨酸棒杆菌的L-半胱氨酸外排蛋白。
3 结论与讨论
如今,随着代谢工程和合成生物学的蓬勃发展,微生物已经成为了生产各种产品的一个有前景的工具[30-32]。针对产品毒性和产量问题,外排系统对产量提高的重要性日益明显,尤其是氨基酸生产[33-35]。在对Cg1298-Cg1299的详细研究中,根据以下证据确定其为谷氨酸棒杆菌中新的L-半胱氨酸外排蛋白:(a)转录组分析得出无论以高浓度还是低浓度L-半胱氨酸刺激,cg1298和cg1299的基因表达量都被上调;(b)cg1298-cg1299双敲菌株对L-半胱氨酸的敏感性显著增强,而回补菌株则恢复了对L-半胱氨酸的抗性;(c)与野生型谷氨酸棒杆菌 ATCC 13032相比,cg1298-cg1299双敲菌株对L-半胱氨酸的外排能力显著降低;(d)在L-半胱氨酸生产菌株中过表达cg1298-cg1299显著提高了L-半胱氨酸的产量,从应用的角度证明其外排功能。
先前的研究报道,外排系统在氨基酸积累中起着关键作用。MALLA等[36]通过功能性宏基因组学分析发现了一种L-赖氨酸外排蛋白MglE,通过过表达该外排蛋白使大肠杆菌对L-赖氨酸的耐受性提高了40%,并将谷氨酸棒杆菌中L-赖氨酸产量提高了7.8%。WEI等[3]在谷氨酸棒杆菌中表达了大肠杆菌来源的L-半胱氨酸外排蛋白Bcr,该菌株的L-半胱氨酸产量显著增加,约为对照菌株的2倍。本研究在L-半胱氨酸底盘菌中过表达了外排蛋白Cg1298-Cg1299,发酵72 h后L-半胱氨酸产量比对照组提高约17.1%。综上所述,本研究鉴定了一种新的L-半胱氨酸外排蛋白,在谷氨酸棒杆菌中挖掘半胱氨酸转运蛋白有助于了解菌株对L-半胱氨酸的耐受机制,为进一步构建高效L-半胱氨酸细胞工厂提供了新的参考。
