2.856 GHz和9.375 GHz微波复合暴露致大鼠记忆功能障碍及海马组织结构损伤的定量化研究
2023-12-16赵海霞赵江豪岳含霖徐新萍姚斌伟王浩宇杜秀敏彭瑞云
赵海霞, 赵江豪, 岳含霖, 董 霁, 徐新萍,赵 黎, 张 静, 王 惠, 姚斌伟, 王浩宇,杜秀敏, 彭瑞云
(1. 河北大学 教育学院, 河北 保定 071002;2.军事科学院 军事医学研究院 辐射医学研究所, 北京 100850)
0 引言
微波是指频率为0.3~300 GHz的电磁波,目前被广泛应用于军事、医疗、工农业生产和日常生活[1-2]等领域。在对现代社会做出重大贡献的同时,微波辐射对健康的潜在影响也引起了广泛关注。既往研究表明,脑是微波辐射最敏感的靶器官之一[3-4].单一频段微波辐射可导致脑损伤,进而引发包括记忆功能在内的多种认知功能障碍[5-12]。当前,随着微波应用日益遍及,无论是职业人员还是公众,在实际工作和生活中接触到的往往是不同频段微波复合暴露的环境[13-15]。因此,相较于单一频段微波辐射,针对不同频段微波复合暴露生物损伤效应及相关防治方法的研究已成为当前焦点。2.856 GHz和9.375 GHz是在通信领域中常用的两个微波频率。但到目前为止,2.856 GHz和9.375 GHz微波复合暴露对记忆功能的影响及其组织结构基础尚不明确。
本文将针对2.856 GHz和9.375 GHz微波复合暴露对大鼠记忆功能及海马组织结构的影响开展研究。为实现上述目标,首先采用新物体识别(novel object recognition,NOR)行为学实验范式检测2.856 GHz和9.375 GHz微波单一及其复合暴露后大鼠记忆功能改变情况,来揭示2.856 GHz和9.375 GHz微波单一及其复合暴露对大鼠记忆功能的影响规律。其次,采用苏木素-伊红染色(hematoxylin-eosin staining,HE)技术、尼氏染色(Nissl staining)技术以及透射电子显微镜(transmission electron microscopy,TEM)技术分别对各组大鼠海马神经元显微结构、海马神经元尼氏体含量以及海马超微结构进行定量和定性分析,来揭示2.856 GHz和9.375 GHz微波单一及其复合暴露所致记忆功能障碍的组织结构基础。本研究有助于理解2.856 GHz和9.375 GHz微波单一及其复合暴露对记忆功能的影响规律和组织结构基础,能够为开发不同频段微波复合暴露所致记忆功能障碍的相关诊断和防治方法奠定基础。
1 材料与方法
1.1 实验动物及分组
将32只清洁级(specific pathogen free,SPF)雄性Wistar大鼠(北京维通利华实验动物技术有限公司,中国),体重为280±20 g,随机分为4组(n=8),分别为假辐射组(Sham组)、2.856 GHz微波辐射组(S组)、9.375 GHz微波辐射组(X组)以及2.856 GHz和9.375 GHz微波复合暴露组(SX组)。
实验期间所有大鼠均按照统一的条件饲养:温度为22~24 ℃,湿度为45%~55%,照射条件为12 h光照12 h黑暗循环,光照时间为8:00-20:00,大鼠可以自由活动并获取食物和水。行为学检测在光照时段进行。所有实验均遵循实验动物伦理3R原则。
1.2 微波辐射方法
分别将各组大鼠等间距放置于专用的圆形照射盒中,之后将圆形照射盒放置于照射台上,对S组大鼠进行2.856 GHz微波单次全身均匀辐射,辐射时间为30 min,平均功率密度为50 mW/cm2;对X组大鼠进行9.375 GHz微波单次全身均匀辐射,辐射参数同S组;对SX组大鼠先进行2.856 GHz微波辐射,随后进行9.357 GHz微波辐射,辐射参数同单一辐射组,两次辐射间隔较短,可忽略不计。辐射期间,为了确保同组大鼠的辐射剂量均匀,照射台以180°/min的速度匀速旋转。Sham组大鼠除不接受微波辐射外,其余条件均与复合暴露组相同。辐射完成后将各组大鼠放回饲养笼。
1.3 新物体识别(novel object recognition,NOR)实验
采用NOR行为学实验对各组大鼠记忆功能相关行为学指标偏好指数(Preference Index,PI)进行检测。该实验共分为3个阶段,分别为适应阶段、学习阶段和测试阶段,具体实验过程如图1A所示。

图1 2.856 GHz和9.375 GHz微波单一及其复合暴露导致大鼠记忆功能障碍A:NOR实验流程示意图;B:代表性大鼠新旧物体探索时间热图;C-D分别表示偏好指数和平均速度比较结果*表示与Sham组相比,p < 0.05;&表示与X组相比,p < 0.05
微波辐射后当天进行适应阶段。将大鼠面向墙壁放置于一个由黑色塑料板组成的旷场内(50 cm×50 cm×50 cm),其内不放置任何物体,任由大鼠自由探索5 min以适应实验流程和环境。大鼠适应实验结束后,将其放回饲养笼。用75%乙醇溶液喷洒、擦拭旷场后再进行下一只大鼠的适应操作,以避免上一只大鼠残留的气味对后续适应环节产生干扰。微波辐射后1 d,在适应阶段结束24 h后进行学习阶段。实验开始前,在旷场内放置两个完全相同的物体。实验开始后,任由大鼠自由探索、识记物体5 min。其余程序均与适应阶段相同。微波辐射后2 d,在学习阶段结束24 h后进行测试阶段。实验开始前,将其中一个旧物体替换为新物体,其余程序均与学习阶段相同。
采用Anymaze动物行为学分析软件(Stoelting,美国)分别记录大鼠头部进入新物体和旧物体外围2 cm范围内的时间,并将该时间分别定义为大鼠探索新物体的时间(T新物体)和探索旧物体的时间(T旧物体)。运用如下公式计算PI:
PI=T新物体/(T新物体+T旧物体)
(1)
此外,记录和分析大鼠在旷场中运动的平均速度(Speed),从而排除运动能力可能会对行为学结果产生的影响。
1.4 大鼠海马神经元苏木素-伊红染色(hema-toxylin-eosin staining,HE)观察和定量分析
通过HE染色技术,借助光学显微镜对各组大鼠的海马神经元显微结构(细胞核是否固缩深染)进行观察,使用Image J软件(Media Cybernetics,USA)对海马神经元核固缩深染数量进行定量分析。
当NOR实验结束后,用1%戊巴比妥钠溶液(国药集团化学试剂有限公司,中国)腹腔注射麻醉大鼠后,断头取脑,取左侧半脑浸入10%福尔马林溶液(国药集团化学试剂有限公司,中国)中固定。
把脑组织置于福尔马林溶液中固定3周后,进行石蜡切片制备。首先,将大鼠左侧半脑从福尔马林溶液中取出,切取2 mm厚切块放入包埋盒中,流水冲洗过夜;之后,用全自动脱水机(Sakura,日本)进行脱水、透明和浸蜡;其次,用石蜡包埋机(Leica,德国)对组织块进行包埋;最后,待石蜡块完全干燥后脱离包埋盒,用全自动石蜡切片机(Leica,德国)切取3 μm厚的切片,将切片平铺于载玻片上,置于60 ℃烤片箱(Leica,德国)内干燥过夜。
石蜡切片制备完成后,进行HE染色。首先,将切片先后置于二甲苯和系列浓度梯度的乙醇中脱蜡至水,结束后用蒸馏水冲洗30 s;其次,将切片依次进行苏木素染液染色10 min、温水冲洗1 min、1% 盐酸乙醇分化5 s、温水反蓝40 s和伊红染液染色3 min;再次,用二甲苯和系列浓度梯度的乙醇对切片进行脱水透明;最后,采用中性树脂胶将切片封片,待自然晾干后于光学显微镜下观察并拍照分析。
1.5 大鼠海马神经元尼氏染色(Nissl staining)观察和定量分析
通过尼氏染色技术,借助光学显微镜对各组大鼠的海马神经元尼氏体含量进行观察,使用Image J软件(Media Cybernetics,USA)对海马区神经元尼氏体平均光密度(mean optical density,MOD)进行定量分析。组织取材、固定以及切片制备方法均与HE染色实验相同。
石蜡切片制备完成后,进行尼氏染色。首先,将切片放入甲苯胺蓝染液中染色10 min;其次,在95%乙醇溶液中分化3 s;再次,用二甲苯和系列浓度梯度的乙醇将切片脱水透明;最后,采用中性树脂胶将切片封片,待自然晾干后于光学显微镜下观察并拍照分析。
1.6 透射电子显微镜(Transmission Electron Microscope,TEM)观察大鼠海马超微结构
通过TEM样品制备技术,借助TEM对各组大鼠的海马超微结构进行观察,并进行定性分析。
当NOR实验结束后,用1%戊巴比妥钠溶液(国药集团化学试剂有限公司,中国)腹腔注射麻醉大鼠后,断头取脑。首先,将右侧半脑的海马组织取出,并从中间切取1 mm厚横截面,先后经由2.5%戊二醛磷酸缓冲固定液固定、0.1 mol/L磷酸缓冲液冲洗以及1%锇酸固定。其次,将固定好的组织经梯度乙醇脱水、丙酮和包埋液浸透包埋后,制作为半薄切片。再次,对半薄切片进行HE染色,借助光学显微镜对组织进行定位,并制作超薄切片。最后,超薄切片经醋酸铀和硝酸铅染色后,在TEM下观察并拍照分析。
1.7 数据统计和分析
所有实验数据均采用均值±标准差(M±SD)的方式呈现。所有定量化指标均使用SPSS 22.0软件(IBM,America)进行单因素方差分析,事后检验采用LSD方法。
2 结果
2.1 2.856 GHz和9.375 GHz微波单一及其复合暴露导致大鼠记忆功能障碍


表1 2.856 GHz和9.375 GHz微波单一及其复合暴露后大鼠NOR实验结果
2.2 2.856 GHz和9.375 GHz微波单一及其复合暴露导致海马神经元显微结构损伤
如图2所示,Sham组(图2A-B)大鼠海马神经元排列整齐,染色质均匀分布,细胞核表现为大、圆且淡染,无异常。S组(图2C-D)、X组(图2E-F)和SX组(图2G-H)大鼠海马神经元表现出核固缩深染现象。

图2 2.856 GHz和9.375 GHz微波单一及其复合暴露导致海马神经元显微结构损伤A-H分别表示 Sham、 S、 X 和 SX 组大鼠HE染色结果,Scale Bars1= 50 μm,红色箭头指向核固缩深染现象;I表示各组海马神经元核固缩深染数量比较结果。*表示与Sham组相比,p < 0.05;***表示与Sham组相比,p < 0.001;#表示与S组相比,p < 0.05;&&表示与X组相比,p < 0.01
2.856 GHz和9.375 GHz微波单一及其复合暴露后HE染色定量分析结果如表2所示。使用单因素方差分析对各组大鼠海马神经元核固缩深染情况进行统计分析,结果显示,大鼠海马神经元核固缩深染组间差异显著,F(3,11)= 9.687,P= 0.005,ηp2=0.784。事后检验结果显示,与Sham组相比,S组大鼠和SX组大鼠海马神经元核固缩深染数量均显著增加(S组:P= 0.043,SX组:P<0.001)。与S组大鼠相比,SX组大鼠海马神经元固缩深染数量显著增加(P= 0.024)。与X组大鼠相比,SX组大鼠海马神经元固缩深染数量也显著增加(P= 0.005)。
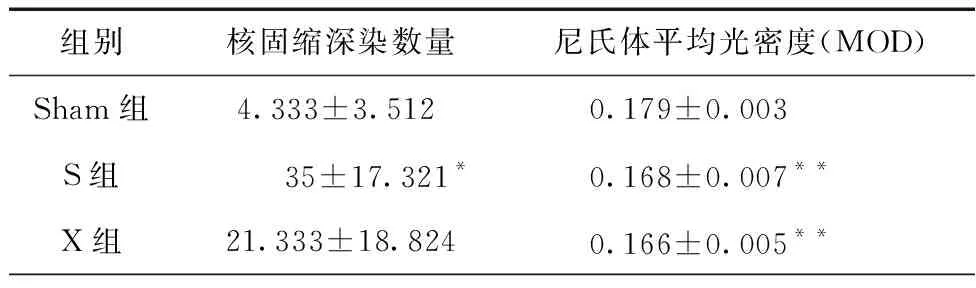
表2 2.856 GHz和9.375 GHz微波单一及其复合暴露后大鼠HE和尼氏染色定量分析结果
2.3 2.856 GHz和9.375 GHz微波单一及其复合暴露导致海马神经元尼氏体含量下降
如图3所示,Sham组(图3A-B)大鼠海马神经元尼氏体含量丰富。S组(图3C-D)和X组(图3E-F)大鼠海马神经元尼氏体含量相对减少。SX组(图3G-H)大鼠海马神经元尼氏体含量明显减少。
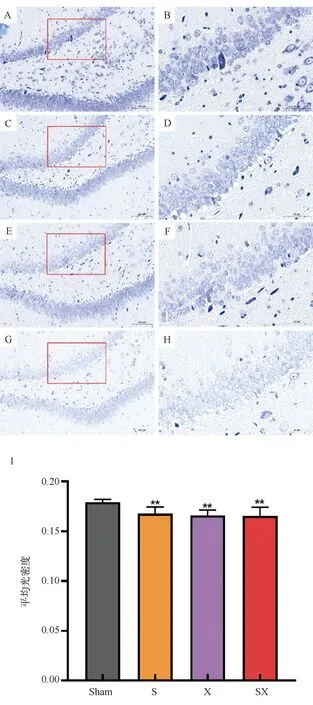
图3 2.856 GHz和9.375 GHz微波单一及其复合暴露导致大鼠海马尼氏体含量下降A-H分别表示Sham、S、X和SX组大鼠尼氏染色结果,Scale Bars 1 = 50 μm;I表示各组海马神经元尼氏体平均光密度比较结果。**表示与Sham组相比,P < 0.01
2.856 GHz和9.375 GHz微波单一及其复合暴露后大鼠海马区尼氏染色定量分析结果如表2所示。使用单因素方差分析对各组大鼠海马神经元尼氏体MOD进行统计分析,结果显示大鼠海马神经元尼氏体MOD组间差异显著,F(3,11)= 6.514,P= 0.003,ηp2=0.494。事后检验结果显示,与Sham组相比,S组、X组和SX组大鼠海马神经元尼氏体MOD均显著降低(S组:P= 0.005,X组:P= 0.001,SX组:P= 0.001)。
2.4 2.856 GHz和9.375 GHz微波单一及其复合暴露导致大鼠海马超微结构损伤
2.856 GHz和9.375 GHz微波单一及其复合暴露后各组大鼠海马超微结构观察结果如图4所示,Sham组(图4A-C)大鼠海马超微结构正常。与Sham组相比,S组(图4D-F)大鼠海马线粒体嵴断裂、肿胀空化、突触间隙模糊、血管周间隙增宽;X组(图4G-I)大鼠海马线粒体嵴断裂、突触间隙模糊、血管周间隙未见异常;SX组(图4J-L)大鼠海马线粒体嵴断裂、肿胀空化、突触间隙模糊、血管周间隙增宽。

图4 2.856 GHz和9.375 GHz微波单一及其复合暴露导致大鼠海马超微结构损伤A-C分别表示Sham组大鼠线粒体、突触间隙和血管周间隙超微结构,Scale Bars 1 = 50 nm;D-F分别示S组大鼠大鼠线粒体、突触间隙和血管周间隙超微结构,Scale Bars 1 = 50 nm;G-I分别示X组大鼠大鼠线粒体、突触间隙和血管周间隙超微结构,Scale Bars 1 = 50 nm;J-L分别示SX组大鼠大鼠线粒体、突触间隙和血管周间隙超微结构,Scale Bars 1 = 50 nm
3 讨论
随着相关技术的不断成熟和纵深发展,微波应用日益遍及,越来越多的人被动的暴露于多种不同频段微波复合暴露的环境中。既往流行病学和动物实验研究结果表明,单一频段微波辐射会导致脑损伤,进而导致记忆功能障碍[16-18]。例如,Wang等研究表明S频段微波辐射(辐射频率为2.856 GHz,辐射功率为50 mW/cm2,辐射次数为单次,辐射时间为6 min)能够导致大鼠记忆功能障碍[8]。Sharma等研究发现X频段微波辐射(辐射频率为10 GHz,辐射功率为0.25 mW/cm2,辐射时间为2 h/d,长期辐射30 d)会导致小鼠记忆功能障碍[12]。然而,既往研究大多以单一频段微波辐射为主,可能与实际生活和工作情景存在差异。因此,探究不同频段微波复合暴露对健康的危害十分必要。本实验运用NOR行为学实验分别对辐射后大鼠的记忆功能进行检测,发现2.856 GHz微波单一辐射以及2.856 GHz和9.375 GHz微波复合暴露均可导致大鼠行为学实验中新物体偏好指数PI值显著下降(S组:P< 0.05;SX组:P< 0.05)。而与X组相比,SX组大鼠PI值也显著降低(P< 0.05)。上述结果提示,2.856 GHz微波单一辐射以及2.856 GHz和9.375 GHz微波复合暴露均可造成大鼠记忆功能损伤。且相较于9.375 GHz微波辐射,2.856 GHz和9.375 GHz复合暴露损伤显著。
海马在记忆功能执行中发挥着关键作用[19-23]。大量研究表明,微波辐射可以导致海马神经元显微结构损伤。Xiong等运用HE染色对暴露于30 mW/cm2、2.856 GHz微波辐射环境中的大鼠的海马神经元进行观察,结果显示,微波辐射后海马神经元显微结构明显受损,具体表现为神经元排列紊乱、神经元核固缩深染等[24]。Narayanan等运用尼氏体染色对暴露于900 MHz微波辐射的大鼠的脑组织切片进行观察,结果显示,微波辐射后海马背侧CA3亚区椎体神经元尼氏体MOD显著减少,提示海马CA3椎体神经元显微结构损伤。该研究认为,海马组织结构改变可能是微波辐射致使大鼠记忆功能障碍的原因之一[25]。既往研究表明,微波辐射也可以导致海马超微结构损伤。Xiong等运用TEM发现微波辐射后大鼠海马区突触间隙模糊[24]。赵黎等发现微波辐射后大鼠海马线粒体超微结构改变,具体表现为线粒体嵴不规则、肿胀以及空泡化[26]。本实验运用HE染色技术、尼氏染色技术以及TEM技术,分别对辐射后大鼠海马神经元显微结构、海马神经元尼氏体含量及海马超微结构进行观察和分析,发现2.856 GHz和9.375 GHz微波单一及其复合暴露均会导致大鼠海马神经元核固缩深染、海马神经元尼氏体MOD降低,导致海马组织线粒体嵴断裂、肿胀空化、突触间隙模糊、血管周间隙增宽等,提示海马组织结构造成损伤,且较单一频段微波辐射,微波复合暴露造成的损伤更重。
4 结论
2.856 GHz和9.375 GHz微波单一及复合暴露均可导致大鼠记忆功能障碍和海马组织结构损伤。且复合暴露所致损伤效应重于单一频段微波辐射。本研究不仅有助于理解单一频段微波辐射以及不同频段微波复合暴露对记忆功能的影响规律及其组织结构基础,而且能够为开发微波复合暴露所致记忆功能障碍的相关诊断和防治方法奠定基础。
