基因枪介导的冬小麦临汾5064 遗传转化体系构建
2023-12-15乔麟轶郝宇琼张晓军畅志坚郑兴卫
乔麟轶 ,李 锐 ,郝宇琼 ,乔 玲 ,李 欣 ,张晓军 ,畅志坚 ,郑兴卫
(1.山西农业大学 农学院/作物遗传与分子改良山西省重点实验室,山西 太原 030031;2.山西农业大学 小麦研究所,山西 临汾 041000)
小麦是我国的主粮作物。新中国成立以来,育种家通过选育和推广高产品种,实现了小麦产量飞跃式增长。然而,随着人口持续增加以及耕地面积逐渐缩小,小麦增产在长期内仍是一个主要的育种目标[1];此外,全球气候变化造成极端天气频发,对小麦抗旱、耐热、耐涝、抗穗发芽等方面提出了更高要求,而常规育种技术在选育突破性高产抗逆小麦品种工作中表现出一定的局限性,因此,必须结合高效生物技术,进一步发掘小麦增产和抗逆潜力,才能满足今后育种需求、保障粮食安全[2]。
植物遗传转化技术自1983年问世以来,被广泛应用于农业育种领域,并在玉米、大豆、棉花、油菜等作物中获得成功[3]。1992年,VASIL 等[4]利用基因枪介导法获得了世界上第1 例小麦转基因植株。然而,小麦为异源六倍体,基因组庞大且复杂、再生能力差,且不同品种的转化效率存在差异,一度限制了遗传转化技术的应用[5]。国内外最常用的转化载体品种为农艺性状较差的春小麦品种Fielder[6]和Bobwhite[7]。近年来,小麦分子技术发展迅速,完成重测序的我国小麦品种达100 余份,遗传转化技术也不断完善[8-9]。因此,我国育种家开始将当地主栽品种作为载体品种,通过优化组培条件和转化条件,建立对应的遗传转化体系。如中国农业科学院构建的科农199 遗传转化体系[10]、江苏省农业科学院构建的宁麦13 遗传转化体系[11]、西北农林科技大学构建的小偃22 遗传转化体系[12]等。
山西省地理位置独特,种植区域多为典型半干旱地区,小麦品种历来以耐逆、优质著称[13],如长6878、晋麦47、临汾5064 等品种均具有很好的代表性。其中,临汾5064 作为我国小麦优质骨干亲本,具有矮秆、早熟、千粒质量高、品质好等特点,已育成衍生品种(系)80 多个,其中,济南17 和济麦19 在黄淮北片大面积推广,分别获得国家科技进步二等奖;新麦26 是当前黄淮南片主推品种,是我国加工品质最好的品种;农大152、农大135 和农大1195 等也在北部冬麦区生产上得到应用。这些衍生品种不仅生产上表现突出,也是当前小麦品质育种的主要亲本,是我国小麦品质改良的基础[14]。
本研究通过设置不同的培养基激素浓度和轰击压力参数,构建了临汾5064 幼胚遗传转化体系,以期搭建适合山西省小麦育种需求的技术平台,并为其后代衍生品种的转基因育种提供有价值的信息。
1 材料和方法
1.1 试验材料
基因枪转化的受体材料为山西冬小麦品种临汾5064(2n=6x=42,AABBDD),由山西农业大学小麦研究所提供。
用于转化的测试质粒为pCAMBIA-Pubi-ERF8-E9[15],包含ERF8基因编码区(全长762 bp),由山西农业大学小麦研究所小麦细胞工程与分子育种实验室提供。金粉购自Bio-Rad 公司(美国),所有引物由上海生工生物工程有限公司合成。
1.2 试验方法
田间试验在山西农业大学东阳示范基地温室进行;组培试验在作物遗传与分子改良山西省重点实验室完成;基因枪轰击试验在山西农业大学小麦研究所小麦细胞工程与分子育种实验室完成。
1.2.1 幼胚处理 将临汾5064 分3 批种植于温室,每批播种期相差7 d。在植株开花14 d 后剪取麦穗带回实验室收获未成熟籽粒,用70%乙醇对籽粒表面消毒10 min,再用无菌水冲洗2 次备用。
1.2.2 不同激素浓度诱导培养 在超净台中将处理好的籽粒幼胚盾片平面向上接种于诱导培养基,每个培养皿(90 mm)约接种60 个幼胚,于25 ℃暗培养,14 d 后统计出愈率。诱导培养基中的激素质量浓度设置3 种处理:1.5(A1)、2.0(A2)、2.5(A3)mg/L 的2,4-D,其余成分为MS+200 mg/L 水解酪蛋白+100 mg/L 肌醇+30 g/L 蔗糖+2 g/L 植物胶,pH 值为5.8。
1.2.3 不同激素浓度分化培养 将幼胚愈伤移入分化培养基,于23 ℃、16 h光/8 h暗条件下培养14 d,统计分化率。再生培养基中的激素浓度设置4 种处理:0.2 mg/L 2,4-D+0.2 mg/L 6-BA(B1)、0.2 mg/L 2,4-D+0.5 mg/L 6-BA(B2)、0.5 mg/L 2,4-D+0.2 mg/L 6-BA(B3)和0.5 mg/L 2,4-D +0.5 mg/L 6-BA(B4)。其余成分为MS+0.15 g/L 天冬酰胺+40 g/L 麦芽糖+2 g/L 植物胶,pH 值为5.8。
1.2.4 不同激素浓度生根培养 将分化出芽的愈伤组织转移至生根培养基,于23 ℃、16 h 光/8 h 暗条件下培养,28 d后统计生根率。生根培养基中的激素浓度设置4 种处理:0.1 mg/L 2,4-D+0.1 mg/L 6-BA(C1)、0.1 mg/L 2,4-D(C2)、0.1 mg/L 6-BA(C3)和无激素(C4)。其余成分为MS+0.075 g/L天冬酰胺+20 g/L 麦芽糖+2 g/L 植物胶,pH 值为5.8。
1.2.5 不同轰击压力转化 基于上述优化后的再生培养体系,将愈伤组织移入高渗培养基(含9%甘露醇的诱导培养基),于25 ℃暗培养4 h。使用0.6 μm 金粉(Bio-Rad,美国)制备20 mg/mL 金粉悬浮液,加入1/50 体积的1 μg/μL 质粒溶液,将包被有DNA 的金粉悬浮液混匀后涂于微弹载片,每片10 μL,待干燥后用PDS-1000/He 基因枪(Bio-Rad,美国)轰击,每次涂液前将悬浮液漩涡处理混匀。设3 个轰击压力分别为650(D1)、900(D2)、1 100(D3)psi,每皿轰击一次。将轰击后的愈伤组织先后移入分化培养基和生根培养基,完成植株再生。
1.2.6 PCR 检测 剪取再生植株的叶片,采用CTAB 法提取基因组DNA。根据ERF8基因外显子序列,在跨内含子处设计检测引物F:5′-CGCTG AGGAACAAGGGAGG-3′和R:5′-CCGAACGG CAGGTTGACAG-3′,预期产物片段为421 bp。PCR反应体系为10 μL:ddH2O 3.5 μL,PCR Mixture 5 μL(生工生物,中国上海),上下链引物各0.25 μL,DNA 模板(100 ng/μL) 1.0 μL。PCR 扩增程序:95 ℃预变性5 min;95 ℃变性25 s,58 ℃复性25 s,72 ℃延伸25 s,共30 个循环;72 ℃延伸5 min,10 ℃保存。PCR 产物在1.2%琼脂糖凝胶中电泳。
1.3 数据分析
采用Microsoft Excel 2010 软件进行数据处理。
2 结果与分析
2.1 激素浓度对愈伤诱导率的影响
临汾5064 幼胚在3 种激素浓度的诱导培养基中均可形成愈伤组织,但出愈率不同。其中,在含1.5 mg/L 2,4-D 的诱导培养基(A1 处理)条件下,300 个参试幼胚中有203 个形成了愈伤组织,占比67.7%;在含2.0 mg/L 2,4-D 的诱导培养基(A2 处理)条件下,300 个参试幼胚中有249 个形成了愈伤组织,占比83.0%;在含2.5 mg/L 2,4-D 的诱导培养基(A3 处理)条件下,300 个参试幼胚中有220 个形成了愈伤组织,占比73.3%。当诱导培养基中的2,4-D 质量浓度为2.0 mg/L 时,幼胚愈伤诱导率最高(表1)。

表1 培养基激素浓度对诱导幼胚愈伤的影响Tab.1 Effects of hormone concentrations in culture medium on the induction of immature embryo calli
2.2 激素浓度对分化率的影响
将临汾5064 幼胚愈伤组织分别移到4 种激素浓度的分化培养基中(B1~B4 处理),每个处理组含150 个愈伤组织。在14 d 后,各个处理组均有再生芽产生(表2)。
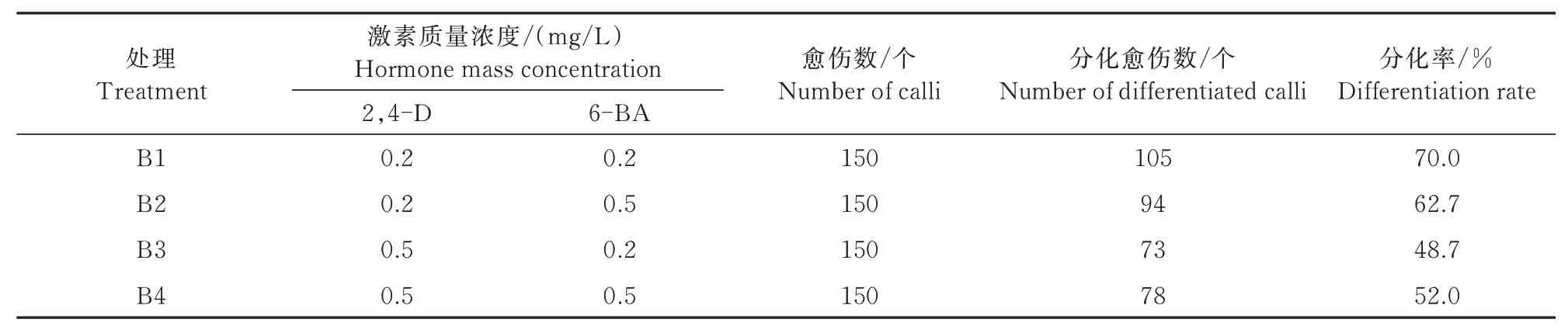
表2 培养基激素浓度对愈伤分化的影响Tab.2 Effects of hormone concentrations in culture medium on the differentiation of calli
由表2可知,当分化培养基包含0.2 mg/L 2,4-D和0.2 mg/L 6-BA 时(B1 处理),发生分化的愈伤组织数为105个;当包含0.2 mg/L 2,4-D和0.5 mg/L 6-BA 时(B2 处理),分化愈伤组织数为94 个;当包含0.5 mg/L 2,4-D 和0.2 mg/L 6-BA 时(B3 处理),分化愈伤组织数为73 个;当包含0.5 mg/L 2,4-D 和0.5 mg/L 6-BA 时(B4 处理),分化愈伤组织数为78 个。不同浓度处理的分化率从高到低依次为70.0%(B1)、62.7%(B2)、52.0%(B4)和48.7%(B3)。分化培养基中,2,4-D 质量浓度为0.2 mg/L 时的愈伤分化率高于0.5 mg/L,并且当6-BA 质量浓度也为0.2 mg/L 时具有最多的分化愈伤数。
2.3 激素浓度对生根率的影响
将临汾5064 分化愈伤组织分别移到4 种激素浓度的生根培养基中(C1~C4 处理),每个处理组含80 个分化愈伤组织。在28 d 后,每种处理均有根生成,但生根率差异较大(表3)。当生根培养基包含0.1 mg/L 2,4-D 和0.1 mg/L 6-BA 时(C1 处理),生根愈伤组织数为31 个;当生根培养基只包含0.1 mg/L 2,4-D 时(C2 处理),生根愈伤组织数为62 个;当生根培养基只包含0.1 mg/L 6-BA 时(C3 处理),生根愈伤组织数为26 个;当生根培养基中不添加2,4-D 和6-BA 时(C4 处理),生根愈伤组织数为57 个。不同处理愈伤组织的生根率从高到低依次为77.5%(C2)、71.3%(C4)、38.8%(C1)和32.5%(C3)。生根培养基中不添加6-BA 时的生根率高于添加0.1 mg/L 6-BA,此时,2,4-D 质量浓度造成的生根率变化不大,分别为77.5%(0.1 mg/L 2,4-D 处理)和71.3%(不添加2,4-D 处理)。然而,C2 处理下的植株可以生成3~4 个根,而C4 处理下的植株只生成1~2 个根(图1),因此,生根最适培养基为0.1 mg/L 2,4-D 且不添加6-BA。

图1 不同激素浓度下的再生植株根部Fig.1 Roots of regenerated plants under different hormone concentrations

表3 培养基激素浓度对愈伤生根的影响Tab.3 Effects of hormone concentrations in culture medium on the rooting of calli
2.4 基因枪轰击压力对转化率的影响
利用上述优化激素浓度的培养基对临汾5064幼胚开展基因枪介导的遗传转化,在轰击步骤设置650、900、1 100 psi 共3 个压力处理组(D1~D3),分别导入测试质粒PCAMBIA-Pubi-ERF8-TE9,结果显示(表4),在650 psi 轰击压力(D1)下最终获得187 株再生植株,但通过PCR 检测均没有扩增出ERF8的测试片段;在900 psi 轰击压力(D2)下获得192 株再生植株,其中有4 株成功扩增出目标条带,遗传转化率为0.50%;在1 100 psi 轰击压力(D3)下则获得226 株再生植株,其中有1 株PCR 阳性株,转化率为0.13%。因此,900 psi 是更合适临汾5064幼胚转化的基因枪轰击压力。

表4 再生优化体系下轰击压力对转化率的影响Tab.4 Effects of bombardment pressure on transformation rate under optimized regeneration system
3 结论与讨论
遗传转化技术是过表达基因和基因编辑的前提,也是生物分子育种的基础。在小麦中,遗传转化主要采用基因枪法和农杆菌介导法。与后者相比,基因枪法具有转化受体广泛的优点,应用更为普遍[16]。最早被用于基因枪遗传转化的小麦品种为美国春小麦Bobwhite[4],通过不断优化遗传转化体系,其转化效率从0.1%~0.2%[17-18]提高到0.3%~1.0%[19-21];另一个常用转化载体品种为春小麦Fielder,其转化效率达到了0.7%~2.5%[6]。这些体系的建立实现了在小麦中观察基因对植株或器官表型的影响,促进了小麦基因的功能解析和育种应用。然而,该转化体系具有一定的局限性,如用于编辑的靶基因在Bobwhite 和Fielder 中可能是无功能的等位变异,而且这2 个品种春性较强,在我国北方田间的耐寒性和农艺性状较差,对阳性株表型的观察会受到影响。因此,发掘不同遗传背景的小麦转化载体品种尤为重要。
近年来,国内多个单位基于当地育种和科研需求,建立了针对特定小麦品种的遗传转化体系,转化成功的小麦品种有济麦20、鲁麦14、扬麦158、科农199、新春9 号、石4185、豫麦66 等[5]。山西省小麦种质资源以抗旱和优质著称,部分种质如临汾5064 曾为提高全国小麦产量和品质作出了重要贡献。本研究通过优化组培和转化条件,建立了临汾5064 的基因枪遗传转化体系:幼胚于含2.0 mg/L 2,4-D 的诱导培养基中25 ℃暗培养14 d;将诱导的愈伤组织移入高渗培养基(添加了9%甘露醇的诱导培养基)于25 ℃暗培养4 h;使用0.6 μm 金粉与目标质粒溶液混匀制备微弹,利用基因枪在900 psi 压力下将微弹轰击到愈伤组织;将轰击后的愈伤组织移入含0.2 mg/L 2,4-D+0.2 mg/L 6-BA 的分化培养基中,于23 ℃、16 h 光/8 h 暗条件下培养14 d;将分化出芽的愈伤组织转移至含0.1 mg/L 2,4-D的生根培养基,于23 ℃、16 h 光/8 h 暗条件下培养28 d;检测再生植株中的阳性株。本研究结果将有助于优异基因的发掘和功能解析、以及不利基因的定点编辑和定向改良,从而创制突破性新种质,实现小麦种质资源的快速更新换代。
组织培养体系是遗传转化体系的基础。在农杆菌介导的宁麦13 遗传转化体系中,共涉及预培养培养基、侵染培养基、共培养培养基、诱导培养基、分化培养基、生根培养基、LB 培养基和YEP 培养基等8 种培养基[11]。总体而言,基因枪法所涉及的组培培养基比农杆菌法较为简单,通常只需要诱导培养基、分化培养基、高渗培养基和生根培养基。为了建立冬小麦品种临汾5064 的组培体系,本研究对不同阶段的培养基分别设置多个激素浓度处理,总结了临汾5064 的幼胚最适组培体系:诱导培养基含2.0 mg/L 2,4-D;分化培养基含0.2 mg/L 2,4-D+0.2 mg/L 6-BA;生根培养基含0.1 mg/L 2,4-D。此外,有研究报道向培养基中添加一些化学成分也可以提高转化率。如GREER 等[22]将诱导培养基中硝酸铵浓度增加了1 倍,从而使基因枪介导的小麦幼胚转化率提高了2~3 倍,推测硝酸铵有助于增加外源DNA 稳定性以及向小麦染色体上整合的效率。
除培养基激素浓度以外,转化轰击压力是影响基因枪法转化效率的另一个重要因素[8,10,23-25]。在优化后的组培体系基础上,分别设置3 个轰击压力并测试转化效率,再生植株获得率达23.4%~28.3%,但其中的阳性株少,最高转化率只有0.5%,表明其他轰击参数也需要进一步优化,例如金粉粒径、质粒浓度、轰击距离等[10,26-27]。通常情况下,金粉粒径大、轰击距离近、轰击强度高会使外源基因瞬时表达量增加,但也会导致愈伤组织损伤,影响再生能力[28-29]。此外,轰击距离过近还会造成金粉分布不均匀的问题[30]。国外实验室基于Fielder、Bobwhite 等春小麦品种,总结了基因枪转化小麦的主要轰击参数:金粉粒径0.6 μm、质粒浓度294 ng/枪、轰击距离12 cm、轰击强度650~900 psi[27,30]。闵东红等[10]、贺晓岚等[31]则先后以科农199 为受体材料对基因枪转化小麦的影响因素进行了优化,认为在金粉颗粒0.6 μm、质粒浓度250~500 ng/枪、轰击距离6~12 cm、轰击强度650 psi 的条件下,转化效果最佳。本研究同样选用了0.6 μm 金粉,制备的质粒浓度约200 ng/枪,轰击距离12 cm、轰击强度900 psi。由于目前公认0.6 μm 金粉是更适合转化小麦的粒径,今后将重点测试不同质粒浓度和轰击距离对转化率的影响,以期优化临汾5064 幼胚的基因枪轰击参数。
