结直肠癌经自然腔道取标本手术Ⅰ式的可行性及安全性研究
2023-12-13高小尚江亮胡荣祥邱镔夏霞芬
高小尚 江亮 胡荣祥 邱镔 夏霞芬
结直肠癌(colorectal cancer, CRC)是我国乃至全球第三大高发恶性肿瘤癌症, 属消化道肿瘤, 每年约有180 万新发病例, 死亡人数超过180 万, 且有随着生活水平提高、饮食结构改变而逐渐增加发病率的趋势[1]。结直肠癌以大便次数增多或形状改变、肛门不适或异物感、腹泻与便秘交替等为早期临床表现, 易被忽视[2]。其治疗主要有手术、放化疗及靶向治疗3 大类,以手术为结直肠癌患者的首选方法, 但不同类型和分期的结直肠癌手术方式不尽相同[3]。虽然随着消化道肿瘤外科技术的不断进步, 患者的术后生存率有所提高, 但在早期结直肠癌的治疗中, 术中获取标本是一个棘手的问题[4]。既往, 常规腹腔镜手术在结直肠癌中的应用较广, 其手术效果、治疗准则及安全性均被临床肯定, 且兼具恢复期短、创伤小等优势[5]。但该术式取标本的方式需要在下腹壁开切口及置放吻合器抵钉座, 患者术中容易出现切口疼痛和出血;其次是由于手术需要较长的手术时间, 这无疑增加了切口感染、降低患者免疫功能的几率, 导致患者术后恢复时间延长, 同时也不满足患者对腹壁的美容学要求[6]。研究发现, 结合经自然腔道内镜手术理念发展而来的经自然腔道取标本手术(natural orifice specimen extraction surgery, NOSES)可规避传统腹壁切口问题, 其可在内镜辅助下, 在直肠、阴道、膀胱等空腔脏器壁上穿孔,且术后疼痛感更轻, 腹部并发症更低[7]。因此本研究就结直肠癌NOSESⅠ式的可行性及安全性展开研究。现报告如下。
1 资料与方法
1.1 一般资料 本研究经院内伦理委员会审核批准,选取本院2018 年6 月~2022 年6 月收治的62 例结直肠癌患者, 采用随机数字表法分为对照组和研究组, 每组31 例。两组患者一般资料比较差异无统计学意义(P>0.05), 具有可比性。见表1。
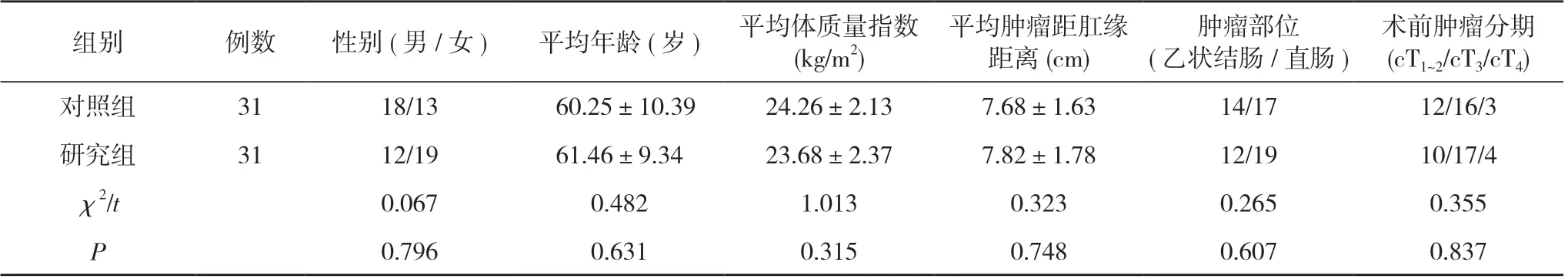
表1 两组患者一般资料比较(n, x-±s)
1.2 纳入及排除标准
1.2.1 纳入标准 ①符合《中下段结直肠癌外科治疗规范》[8]诊断标准, 且均经病理学检测确诊为结直肠癌;②ECOG 评分≤2 分;③肿瘤未转移或侵犯相邻器官;④均为首次确诊, 年龄35~75 岁。
1.2.2 排除标准 ①无腹部手术史者;②本研究手术不耐受者;③肠管系膜肥厚、肠道梗阻或穿孔者;④局部切除术者;⑤合并其他肿瘤者;⑥凝血功能障碍者。
1.3 方法
1.3.1 对照组 给予患者常规腹腔镜手术。常规术前准备, 行气管插管全身麻醉, 常规五孔法手术, 取截石位, 经脐戳孔建立二氧化碳气腹, 气腹压12~14 mm Hg(1 mm Hg=0.133 kPa), 腹腔镜进入腹腔后, 探查病灶位置、大小及周围组织, 于左、右麦氏点分别作一操作孔, 左下腹脐耻连线中点作观察孔。于左下腹腹壁切开5 cm 的切口再撑开, 后抽出肿瘤、肠管, 近端2~3 cm 处切断肠管后完成吻合, 放置引流管, 缝合切口。
1.3.2 研究组 给予患者NOSESⅠ式。常规术前准备,行气管插管全身麻醉, 常规五孔法手术, 取截石位, 经脐戳孔建立二氧化碳气腹, 气腹压12~14 mm Hg, 腹腔镜进入腹腔后用超声刀处理腹膜及间隙, 后清扫淋巴结, 将吻合预切定线定位;注射肌松剂后扩肛至4 指,置入无菌塑料保护套于预切定线处切割, 外翻直肠并从肛门处拉出, 于肿物下1~2 cm 处切断肠管, 后拿出抵钉座连接杆, 放置引流管, 缝合切口。
1.4 观察指标及判定标准 比较两组手术相关临床病理参数, 术后疼痛程度评分, 术前及术后免疫功能指标, 术后炎性指标和肠道屏障功能指标, 并发症发生情况。
1.4.1 手术相关临床病理参数 包括手术时间、淋巴清扫数目、术中出血量、肿瘤最大横径、术后首次排气时间、术后离床活动时间、术后排便时间和住院时间。
1.4.2 疼痛程度评分 采用疼痛数字评分法(numeric rating scale, NRS)[9]评价术后第1、3、5 天疼痛程度,点状标尺头尾分别表示不疼与疼痛难忍, 由患者从标尺0~10 上选取代表疼痛的数值, 分值与疼痛程度呈正比。
1.4.3 免疫功能指标 抽取所有受试者清晨空腹静脉血5 ml, 静置2 h 后, 放入速率为2500 r/min 的离心机中离心10 min, 分离后取血清, 立即检测或置于-20℃下冷冻储存备测。于术前及术后3 d 选取BioTek ELx800 全自动酶标仪(美国BioTek 公司), 采用酶联免疫法(ELISA)检测血清IgG、IgM、IgA 水平。
1.4.4 炎性指标 术后第1 天及术后第5 天选取BioTek ELx800 全自动酶标仪, 采用ELISA 法检测白细胞计数(white blood cell count, WBC)、血清降钙素原(procalcitonin, PCT)水平。
1.4.5 肠道屏障功能指标 选取购自庆九州通医药有限公司(北京中生)的肠道屏障功能生化指标分析系统(型号:JY-DLT), 采用分光光度法于术后第1 天及术后第5 天检测血浆D-乳酸与二胺氧化酶(diamine oxidase, DAO)水平, 分光光度法试剂盒购自上海尚宝生物科技有限公司。
1.4.6 并发症 包括输尿管损伤、肠梗阻、吻合口瘘、切口感染、尿滞留等发生情况。
1.5 统计学方法 采用SPSS21.0 统计学软件对研究数据进行统计分析。计量资料以均数±标准差( x-±s)表示, 采用t 检验;计数资料以率(%)表示, 采用χ2检验。P<0.05 表示差异具有统计学意义。
2 结果
2.1 两组手术相关临床病理参数比较 研究组术后首次排气时间、术后离床活动时间、术后排便时间和住院时间均显著短于对照组, 差异具有统计学意义(P<0.05);两组手术时间、淋巴清扫数目、术中出血量、肿瘤最大横径比较差异均无统计学意义(P>0.05)。见表2。
表2 两组手术相关临床病理参数比较( ±s)

表2 两组手术相关临床病理参数比较( ±s)
注:与对照组比较, aP<0.05
组别例数手术时间(min)淋巴清扫数目(枚)术中出血量(ml)肿瘤最大横径(cm)术后首次排气时间(d)术后离床活动时间(d)术后排便时间(d)住院时间(d)对照组31140.78±21.62 14.47±2.64 32.14±5.694.32±0.352.73±0.252.66±0.244.02±0.449.83±1.36研究组31138.77±20.39 14.35±2.28 30.52±5.744.37±0.27 1.87±0.16a 1.68±0.14a 3.25±0.37a 7.53±1.18a t 0.3770.1921.1160.63016.13219.6387.4577.112 P 0.7080.8490.0000.5310.0000.0000.0000.000
2.2 两组术后NRS 评分比较 术后第1、3、5 天, 研究组NRS 评分均显著低于对照组, 差异具有统计学意义(P<0.05)。见表3。
表3 两组术后NRS 评分比较( ±s, 分)
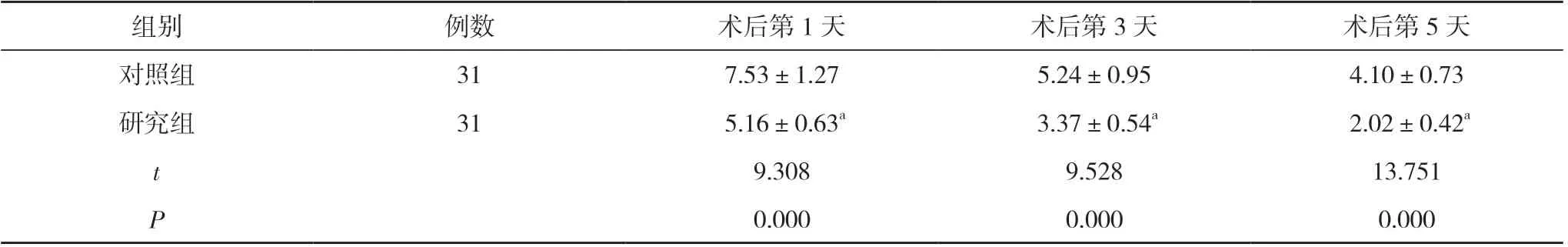
表3 两组术后NRS 评分比较( ±s, 分)
注:与对照组比较, aP<0.05
组别例数术后第1 天术后第3 天术后第5 天对照组317.53±1.275.24±0.954.10±0.73研究组31 5.16±0.63a 3.37±0.54a 2.02±0.42a t 9.3089.52813.751 P 0.0000.0000.000
2.3 两组术前及术后免疫功能指标比较 术前, 两组血清IgG、IgM、IgA 水平比较差异无统计学意义(P>0.05);术后3 d, 研究组血清IgG、IgM、IgA 水平均显著高于对照组, 差异具有统计学意义(P<0.05)。见表4。
表4 两组术前及术后免疫功能指标比较( ±s, U/ml)

表4 两组术前及术后免疫功能指标比较( ±s, U/ml)
注:与对照组术后3 d 比较, aP<0.05
组别例数IgG IgM IgA术前术后3 d术前术后3 d术前术后3 d对照组31137.93±34.26117.33±18.96175.58±28.36148.27±14.76155.28±35.61132.92±20.45研究组31136.71±31.38 128.75±20.18a 174.16±30.52 166.43±21.27a 153.75±33.94 146.67±24.82a t 0.1462.2960.1903.9050.1732.381 P 0.8840.0250.8500.0000.8630.020
2.4 两组术后炎性指标及肠道屏障功能指标比较 术后第1、5 天, 研究组的WBC、PCT、D-乳酸、DAO 水平均显著低于对照组, 差异具有统计学意义(P<0.05)。见表5。
表5 两组术后炎性指标及肠道屏障功能指标比较( ±s)
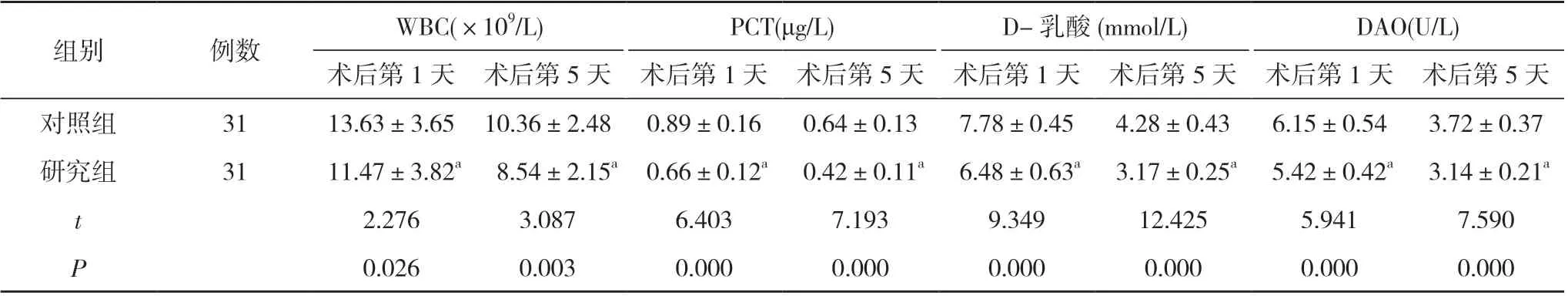
表5 两组术后炎性指标及肠道屏障功能指标比较( ±s)
注:与对照组比较, aP<0.05
组别例数WBC(×109/L)PCT(μg/L)D-乳酸(mmol/L)DAO(U/L)术后第1 天 术后第5 天 术后第1 天 术后第5 天 术后第1 天 术后第5 天 术后第1 天 术后第5 天对照组3113.63±3.65 10.36±2.48 0.89±0.160.64±0.137.78±0.454.28±0.436.15±0.543.72±0.37研究组31 11.47±3.82a 8.54±2.15a 0.66±0.12a 0.42±0.11a 6.48±0.63a 3.17±0.25a 5.42±0.42a 3.14±0.21a t 2.276 3.087 6.403 7.193 9.349 12.425 5.941 7.590 P 0.026 0.003 0.000 0.000 0.000 0.000 0.000 0.000
2.5 两组并发症发生情况比较 两组并发症发生率比较差异无统计学意义(P>0.05)。见表6。
3 讨论
微创术式在结直肠癌中的应用是近年来临床研究的热点, NOSES 通过自然腔道在微创术式的基础上,将标本通过人体自然腔道提出, 仅在腹壁上留有微小的Trocar 孔瘢痕, 在有效切除病灶、提升微创手术效果的基础上减轻了手术创伤[10]。且NOSES 可减少标本取材的创伤, 标本经提前后可明确肿瘤范围、淋巴结转移情况和远处转移情况[11]。而NOSES 与常规腹腔镜手术对患者疼痛、术后康复以及安全性方面的差异, 仍值得展开进一步的细致研究。
本研究中对照组给予常规腹腔镜手术, 研究组给予NOSESⅠ式。结果显示:研究组术后首次排气时间、术后离床活动时间、术后排便时间和住院时间分别为(1.87±0.16)、(1.68±0.14)、(3.25±0.37)、(7.53±1.18)d,均显著短于对照组的(2.73±0.25)、(2.66±0.24)、(4.02±0.44)、(9.83±1.36)d, 差异具有统计学意义(P<0.05)。术后第1、3、5 天, 研究组NRS 评分分别为(5.16±0.63)、(3.37±0.54)、(2.02±0.42)分, 均显著低于对照组的(7.53±1.27)、(5.24±0.95)、(4.10±0.73)分, 差异具有统计学意义(P<0.05)。证实NOSES Ⅰ式不仅术后康复效果较好, 对于患者术后疼痛感的控制更为明显,这与苏汝平等[12]认为NOSES 可缩短合适的手术适用患者的住院时间, 减轻其术后切口疼痛感的研究结论一致。证实NOSES Ⅰ式在结直肠癌患者中具有较好的可行性, 这可能与NOSES Ⅰ式最大程度地保护了肛门括约肌, 损伤更小有关[13]。同时也得益于NOSES Ⅰ式为微创手术, 无明显切口, 术中出血量少, 对机体创伤较小, 利于患者术后恢复, 从而有效缩短了患者术后下床时间和首次排气时间, 减少了住院时间[14]。
同时, 本研究结果还显示:术后3 d, 研究组血清IgG、IgM、IgA 水平分别为(128.75±20.18)、(166.43±21.27)、(146.67±24.82)U/ml, 均显著高于对照组的(117.33±18.96)、(148.27±14.76)、(132.92±20.45)U/ml,差异具有统计学意义(P<0.05)。术后第1、5 天, 研究组的WBC、PCT、D-乳酸、DAO 水平均显著低于对照组, 差异具有统计学意义(P<0.05)。究其原因分析如下:①当机体发生特异性感染时, 导致体内免疫球蛋白(如IgG、IgM、IgA)含量显著增加, 同时还会激活B 细胞产生大量抗体, 其可反映机体体液免疫功能[15]。结直肠癌患者因肿瘤疾病本身以及手术创伤引起的氧化应激导致机体免疫功能紊乱, 而NOSESⅠ式术后IgG、IgM、IgA 免疫功能指标水平与术前差异更小, 证实NOSES Ⅰ式可保护结直肠癌患者机体免疫功能;②D-乳酸是人体内广泛存在的有机酸, 也是细菌代谢分解的直接产物, 它在人体内广泛存在, 主要集中在肝脏、肾脏、肺和骨骼肌等组织中, 当肠黏膜细胞受损其可经受损黏膜入血导致水平升高, 加重机体炎症反应, 其在氧化代谢过程中会释放出一种强碱性的活性物质DAO, DAO 分解二胺基团生成相应的活性物质,从而又使体内的D-乳酸浓度升高, 二者相辅相成。正常情况下, 血浆中DAO 的浓度很低, 当机体发生急性炎症时, 组织损伤产生大量自由基, 自由基与血液中的物质发生反应, 生成具有生物活性的DAO, 其含量也随之增加[16]。血清中DAO 的升高幅度与肠道组织损伤严重程度呈正比关系。因此, 当血液中 DAO 含量升高时, 血浆D-乳酸也随之升高, 二者能反映出机体的严重炎症和组织损伤。因此, 二者可作为衡量肠道屏障功能的一个重要指标。通常外科手术后, 患者的肠道免疫屏障功能均受到一定程度的影响, 而NOSESⅠ式对患者机体应激反应的影响更小, 加之操作过程中无明显外伤口, 对直肠远端切缘定位更准确, 外科损伤更低, 因此术后炎症反应更轻, 由此可能对肠道微生物组成及功能的损伤也会更轻, 因而其炎性指标和肠道屏障功能指标较常规腹腔镜手术组更低。这与谢伟等[17]认为采用经肛门自然腔道标本取出较常规腹腔镜结直肠癌根治术的术后应激炎症反应更轻的研究报告一致。
另一方面, 本研究中, 两组手术时间、淋巴清扫数目、术中出血量、肿瘤最大横径比较差异均无统计学意义(P>0.05)。这可能与NOSES Ⅰ式切除肿瘤以及缝合, 均需主刀医师操作, 其所需的时间类似有关[18]。而两组术后并发症包括吻合口瘘、切口感染等均经保守治疗后缓解, 但在常规腹腔镜手术中观察到1 例输尿管损伤, 而NOSES Ⅰ式没有发生, 虽然二者并发症发生率暂无明显差异, 但随着病例的扩增和积累,后期可能会变得明显。这可能与我国从2018 年开始实行《结直肠手术应用加速康复外科理念中国专家共识》[19], 其中对医院医护人员的相关业务进行了大量培训与普及, 因此无论哪种手术, 在临床上均能有效进行干预, 切实有效降低并发症的发生有关。
最后, NOSES Ⅰ式不需要腹部作任何切口, 兼具良好的美容性和减轻术后疼痛, 其作为一种新型的微创手术, 但该术式可能需要多种手术先决条件, 因此手术前有必要作进一步的检查以确定这种技术的适应证[20]。
值得关注的是, 在欧美发达国家, NOSES Ⅰ式已被证实是一种安全可行的结直肠癌手术方式。然而在亚洲, 由于经济因素及腹腔镜技术的发展等因素,NOSES Ⅰ式技术尚不成熟, 仅有少数中心开展其临床试验, 但均处于早期发展阶段。且国内关于NOSESⅠ式的技术和相关设备也仍需要进一步完善, 其对设备要求和医生技术要求较高, 大量推行仍需一段时间, 加上本研究属于单中心研究, 加上样本数量有限, 随访时间不足, 后期值得增加样本量就复发率等一系列数据作进一步研究。
综上所述, NOSES Ⅰ式可促进结直肠癌患者术后康复, 还可保护其机体免疫功能, 减轻其疼痛感, 且不会增加并发症发生风险, 值得临床推广。
