东方百合两个SERKs基因的克隆及表达分析
2023-12-13郑梓唯荣朵艳廖晓珊张邦跃
郑梓唯,荣朵艳,廖晓珊,张邦跃
(1.湖南工业大学 生命科学与化学学院,湖南 株洲 412007;2.百合种质资源创新与深加工湖南省工程研究中心,湖南 株洲 412007;3.株洲市农业科学研究所,湖南 株洲 412007)
1 研究背景
体细胞胚发生类受体激酶(somatic embryo genesis receptor-like kinases,SERKs) 属 于 富含亮氨酸重复序列受体激酶(leucine-rich repeat sequence receptor-like kinases,LRR-RLKs)家族成员[1],其蛋白结构包含一个由5 个富含亮氨酸重复序列(LRR)组成的细胞外结构域、一个跨膜结构域和一个细胞内激酶结构域[2]。SERK 基因最初是从胡萝卜细胞培养物中分离出来的,并在单细胞胚胎形成中起重要作用[3]。后来,陆续在其他的植物中筛选到SERK 基因家族,例如,拟南芥[4]、水稻[5]、玉米[6]、大麦[7]、小麦[8]、苹果[9]等,表明SERK蛋白广泛地分布在植物中,并在植物的生长、发育及防御反应中等方面发挥重要的作用。
目前,SERK 功能的研究主要是利用模式植物拟南芥来开展的。拟南芥中有5 个SERKs 家族成员,从AtSERK1~AtSERK5,其中在Col-0 背景下AtSERK1~AtSERK4 具有激酶活性并参与了多种生命活动,而AtSERK5 在Ler背景下才具有激酶活性[10]。研究表明,SERK 作为共受体(Coreceptor),与不同的受体蛋白一起感受细胞外不同的配体分子,形成“配体-受体-共受体”的模式,进而激活相应的细胞信号转导、调控生命活动[11]。分泌肽TPD1(tapetum determinant 1) 与膜受体EMS1(excess microsporocytes 1)胞外结构域结合后,EMS1 招募AtSERK1 或AtSERK2 形成异源二聚体,并调控绒毡层细胞发育[12],进而调控雄配子体的形成,而拟南芥atserk1、atserk2 双突变表现为雄性不育[13]。AtSERK3, 也称为BAK1(BRI1-associated receptor kinase 1),能够在植物激素BR(brassinosteroid,油菜素类固醇)与膜受体BRI1(brassinosteroid insensitive 1)结合后快速地被招募形成“BR-BRI1-SERK3”复合物,进而调控BR介导的植物生长发育[14]。 除了AtSERK3 外,AtSERK1 和AtSERK4 也在BR信号中发挥功能冗余的作用,拟南芥atserk1、atserk3、atserk4 三突变体对BR处理完全不敏感[15]。AtSERK3 与AtSERK4 一起,还介导了植物的免疫反应[16]。AtSERK3 和AtSERK4 能够分别与膜受体FLS2(flagellin-sensing 2)、EFR(elongation factor-Tu receptor)或PEPR1/2(PEP1 receptor 1/2)形成异源二聚体,并分别感受病原性蛋白flg22(一个22 个氨基酸残基多肽)、elf18(一个18 个氨基酸残基多肽)及植物内源多肽Pep1(peptide 1)信号分子,进而起始植物的免疫反应[17]。拟南芥atserk3、atserk4 双突变体持续激活水杨酸依赖的防御途径,导致活性氧的持续生成及幼苗致死[18]。拟南芥AtSERK1~AtSERK4冗余地与受体HAE(HAESA)或HLS2(HAE-like 2)结合,并共同介导分泌多肽IDA(inflorescence deficient in abscission)调控的花器官脱落,atserk1、atserk2、atserk3 或atserk1、atserk3、atserk4 三 突变体表现出花器官不脱落的表型[19]。此外,拟南芥SERKs 还参与了调控其他生长发育进程,比如气孔模式(stomatal patterning)形成[20-21]、根的生长[22]、胁迫响应[11]等。
在其他植物中,也证实了SERKs 在介导植物生长发育及免疫反应过程中的功能保守性。水稻(Oryza sativa)OsSERK2 能够与免疫受体XA21、XA3 和OsFLS2 互作,参与对水稻黄单胞菌(Xanthomonas oryzaepv.oryzae)抗性的建立[23-25]。而OsSERK1 和OsSERK2 都能与受体OsBRI1 互作,并介导BR信号响应[24-25]。本生烟草(Nicotianabenthamiana)NbSERK3A 和NbSERK3B 与NbFLS2 互作,并感受病原体分子INF1,进而激活细胞抵御马铃薯晚疫病毒(Phytophthorainfestans)的侵染[26-27]。此外,番茄、棉花、土豆等植物SERKs 参与免疫响应、配子体发育、BR响应的功能也被发现[28-29]。
百合是世界上最受欢迎的花卉之一,其花香浓郁、花朵较大、花色多样[30]。百合的成熟花药中会释放出大量的油性花粉粒,这会污染花瓣和衣物,降低其商品价值,因此在销售前需要采用人工去雄方法去掉未成熟雄蕊。在规模化生产中,百合容易受到真菌、细菌及病毒等的侵染,严重影响产量及品质,降低其经济价值。因此,开展百合花粉发育及抗病分子机制的研究,以便通过分子育种生产无花粉和抗病性强的百合,在生产上具有重要意义[29]。SERKs 已经被证实参与了植物包括雄配子发育、免疫响应等在内的多种生命活动,目前在百合中并没有相关的报道。本研究从东方百合“西伯利亚”中克隆到了2 个SERK 同源基因,分别命名为LoSERK1 和LoSERK2。利用生物信息学方法对LoSERKs 进行了分析,同时采用实时定量PCR 技术对SERKs 在不同组织中的表达进行了分析,实验结果可为进一步了解百合中SERKs 的功能奠定基础。
2 材料与方法
2.1 实验材料
实验材料为东方百合“西伯利亚”种,盆栽于湖南工业大学百合工程研究中心。植物多糖多酚总RNA提取试剂盒购自北京艾德莱生物科技有限公司,PrimeSTAR GXL DNA 聚合酶购自宝日医生物技术(北京)有限公司;PCR 产物磁珠回收试剂盒、无缝连接试剂盒和M-MuLV 逆转录酶购自生工生物工程(上海)股份有限公司。实时荧光定量PCR 购买自上海罗氏生物公司。
2.2 总RNA 提取
利用RNA 试剂盒提取“西伯利亚”总RNA,然后进行电泳检测(1%琼脂糖),以总RNA 为模板,利用Oligo dT18 引物和M-MuLV 逆转录酶合成第一链cDNA,于-20 ℃下保存备用。
2.3 LoSERKs 的基因克隆
根据百合转录组测序结果,课题组发现了2 个SERK 同源基因序列,这2 个基因包含有完整的开放阅读框(open reading frame,ORF),长度分别是1 875 bp 和1 887 bp,分别命名为LoSERK1 和LoSERK2。利用Primer Premier 5.0 设计这2 个基因的特异引物LoSERK1-LP/LoSERK1-RP 和LoSERK2-LP/LoSERK2-RP(见表1),用于扩增LoSERK1 和LoSERK2 基因cDNA 序列。以cDNA 第一链为模板,利用PrimeSTAR GXL DNA 聚合酶扩增LoSERK1和LoSERK2 基因cDNA 序列。PCR 反应体系为25 mmol/L dNTP Mixture 2.0 μL,GXL buffer 5.0 μL,GXL DNA Polymerase 0.5 μL,Template 0.3 μL, 正向引物0.7 μL,反向引物0.7 μL,ddH2O 补足至25.0 μL。扩增程序:95 ℃下扩增预变性2 min;98 ℃下扩增10 s,60 ℃下扩增15 s,68 ℃下扩增2 min,进行32 个循环;68 ℃延伸5 min,12 ℃保存。PCR产物经琼脂糖凝胶电泳检测后,挑取条带大小正确的目的片段送至生工生物工程(上海)股份有限公司进行双向测通,以确定转录组数据中LoSERK1 和LoSERK2 基因cDNA 序列的正确性。
2.4 生物信息学分析
利用DNAMAN 9.0 对LoSERK1 和LoSERK2 基因的ORF 及其编码氨基酸序列进行分析;利用NCBI数 据 库 的BLASTp(https://blast.ncbi.nlm.nih.gov/Blast.cgi)对LoSERK1 和LoSERK2 的同源氨基酸序列进行搜索;利用BioEdit 7.0 对不同物种SERKs 氨基酸序列进行多重比对,并利用MEGA 11.0 的邻接法(neighbor joining)构建系统发育进化树;并用在线软件NetPhos 3.1(https://services.healthtech.dtu.dk)预测磷酸化位点,使用纽普生物(https://www.novopro.cn/tools/)对其进行跨膜结构和信号肽的预测;使用SWISS-MODEL(https://swissmodel.expasy.org/)进行三级结构预测。
2.5 LoSERKs 的定量分析
提取百合的不同组织,即在西伯利亚百合形成花苞时取其未开的花瓣及未成熟的花药,迅速液氮速冻,保存至-80 ℃冰箱中。而后等到花瓣完全展开后1 d 取其开放的花瓣和成熟的花药并采取叶片,材料液氮速冻后,保存至-80 ℃冰箱中。后文出现两个不同时间节点不同组织则为此两个时间段材料的总RNA,使用逆转录酶试剂盒进行百合First-Strand cDNA 的合成,根据LoSERKs 基因的序列,使用Primer Premier 6.0 软件设计qRT-PCR 引物,以百合β-Actin基因为内参,引物序列见表2。

表2 qRT-PCR 分析的引物序列Table 2 Primer sequences for qRT-PCR analysis
将cDNA 母液稀释10 倍作为qRT-PCR 反应体系中的模板,采用qRT-PCR 的技术检测两个LoSERKs 基因在百合不同组织中的表达量。反应体系为SYBR Premix Ex Taq II 10.0 μL,正向引物1.0 μL,反向引物1.0 μL,cDNA 5.0 μL,ddH2O 补足至20.0 μL。该反应程序为:95 ℃下10 min;95 ℃下10 s,60 ℃下15 s,72 ℃下20 s,40 个循环后绘制熔解曲线,95 ℃下10 s,65 ℃下60 s,72 ℃下20 s。每个基因做3 次生物学重复以及技术性重复,添加以无菌水为模板的空白对照,按照2-ΔΔCT法计算基因的相对表达量。
3 结果与分析
3.1 LoSERKs 基因克隆及序列分析结果
基于东方百合西伯利亚的转录组测序数据,从中筛选出2 个体细胞胚发生类受体激酶SERK 的同源基因。以百合叶片的cDNA 的第一条链为模板,分别用特异引物对LoSERK1-LP/LoSERK1-RP和LoSERK2-LP/LoSERK2-RP 进行PCR 扩增。获得LoSERK1 和LoSERK2 基因的cDNA 序列,PCR 扩增产物用1% 琼脂糖凝胶电泳检测,结果显示目标扩增条带LoSERK1 约为2 200 bp,LoSERK2 约为2 400 bp,这与预期结果相符(见图1,其中M 为DL5000 DNA Maker)。
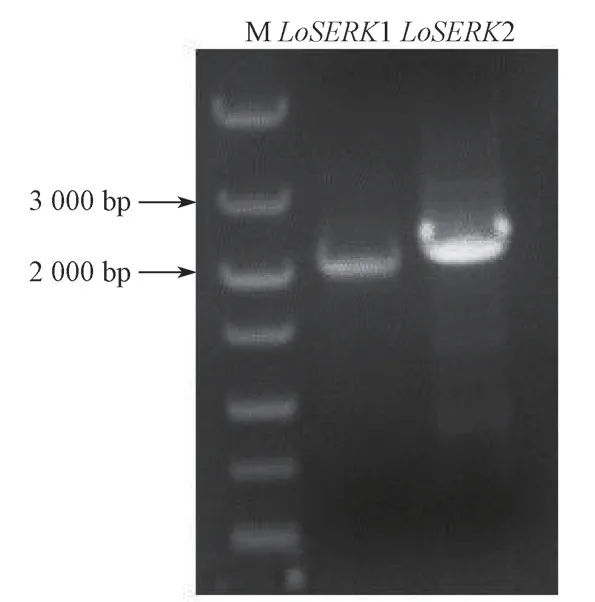
图1 LoSERKs 的cDNA 序列PCR 电泳扩增Fig.1 PCR electrophoresis amplification of cDNA sequences of LoSERKs
测序结果显示,LoSERK1 和LoSERK2 基因cDNA 序列与转录组测序结果一致,包含完整ORF序列,其中LoSERK1 基因ORF 全长为1 875 bp 与编码624 个氨基酸残基(见图2,其中,圆圈为磷酸化位点预测),LoSERK2 基因ORF 全长为1 887 bp,编码628 个氨基酸残基(见图3,其中,圆圈为磷酸化位点预测)。
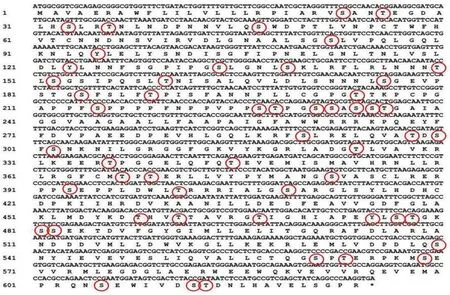
图2 LoSERK1 核苷酸与编码的氨基酸残基序列Fig.2 LoSERK1 nucleotide and encoded amino acid residues sequence
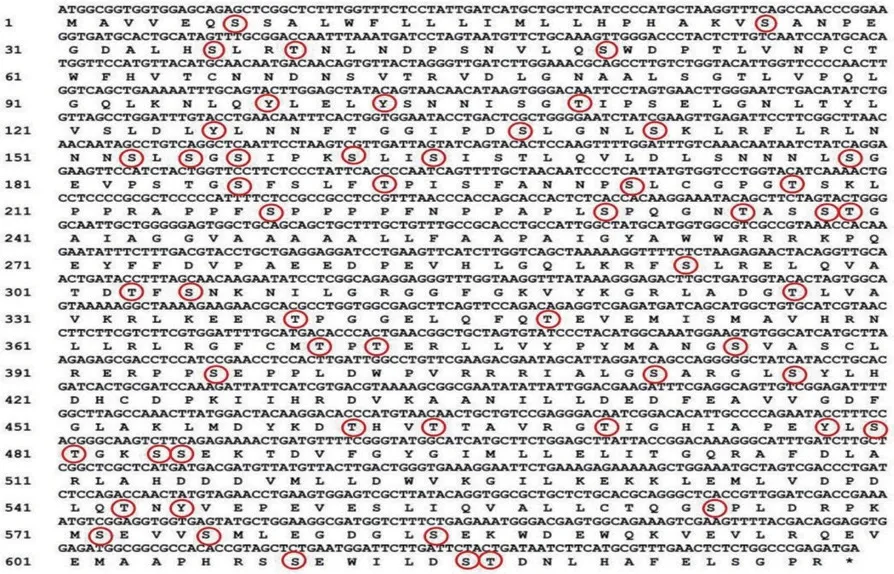
图3 LoSERK2 核苷酸与编码的氨基酸残基序列Fig.3 LoSERK2 nucleotide and encoded amino acid residues sequence
3.2 LoSERKs 信号肽、跨膜结构及三级结构预测
使用DNAMAM9.0 软件分析,LoSERK1 蛋白质的相对分子质量为68 591.0,平均等电点(PI)为5.35,GC 含量为48.27%;LoSERK2 蛋白质相对分子质量为68 933.2,平均等电点(PI)为5.50,GC 含量为47.38%。通过在线软件由图4a 和图6 知LoSERK1 有信号肽的概率为:99.32%,信号肽类型为SP(Sec/SPI);切割位点:24~25,概率为87.67%信号肽序列;MAVAERAWFLILVLLLRPIARVSA。由图4c 可知,LoSERK1 含有一个跨膜区,位点在242~262。 由图4b 可知,LoSERK2 有信号肽的概率为99.82%,信号肽类型为SP(Sec/SPI);切割位点:27~28 的概率为90.90%。信号肽序列为MAVVEQSSALWFLLLIMLLDPLAKVSA, 由图4d 可知,LoSERK2 含有一个跨膜区,其位点从239~261。LoSERK1 有53 个磷酸化位点(图2),LoSERK2 有55 个磷酸化位点(图3)。LoSERK1和LoSERK2 三级结构预测如图5所示,两者以玉米SERK 为模板,使用SWISS-MODEL 进行预测。发现其同源相似性高达90%。也同时与氨基酸同源序列比对结果相似。表明SERK 较为稳定,不易突变,保守性高。
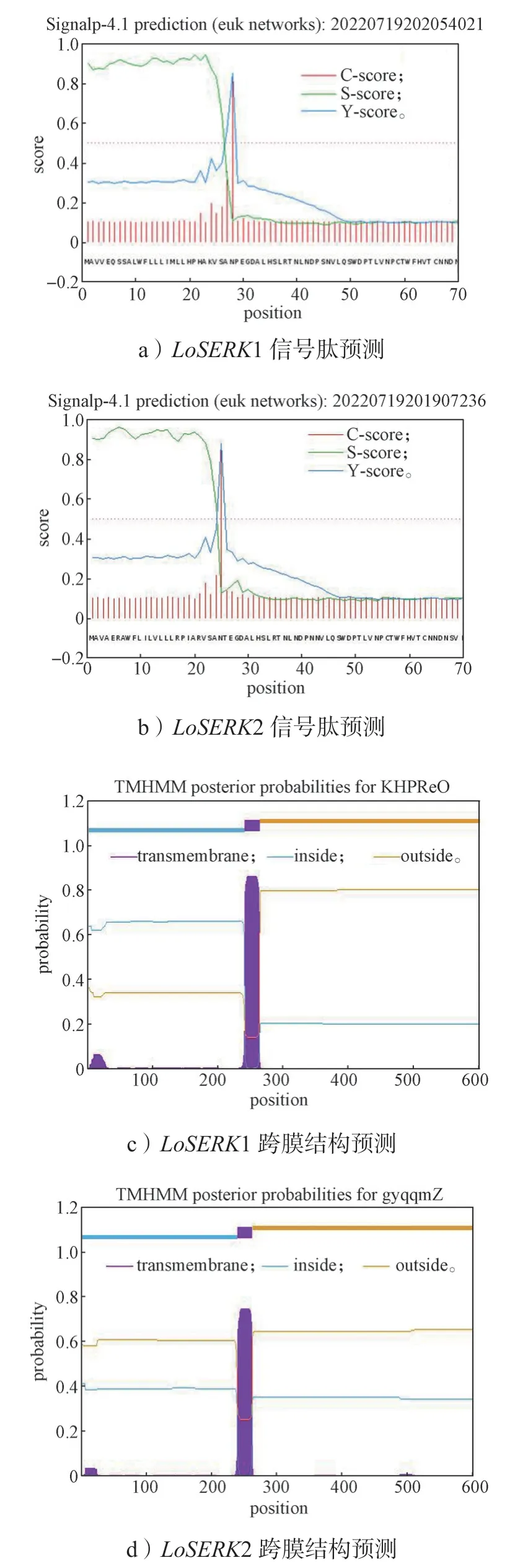
图4 LoSERKs 信号肽及跨膜结构预测结果Fig.4 LoSERKs signal peptide and transmembrane structure prediction
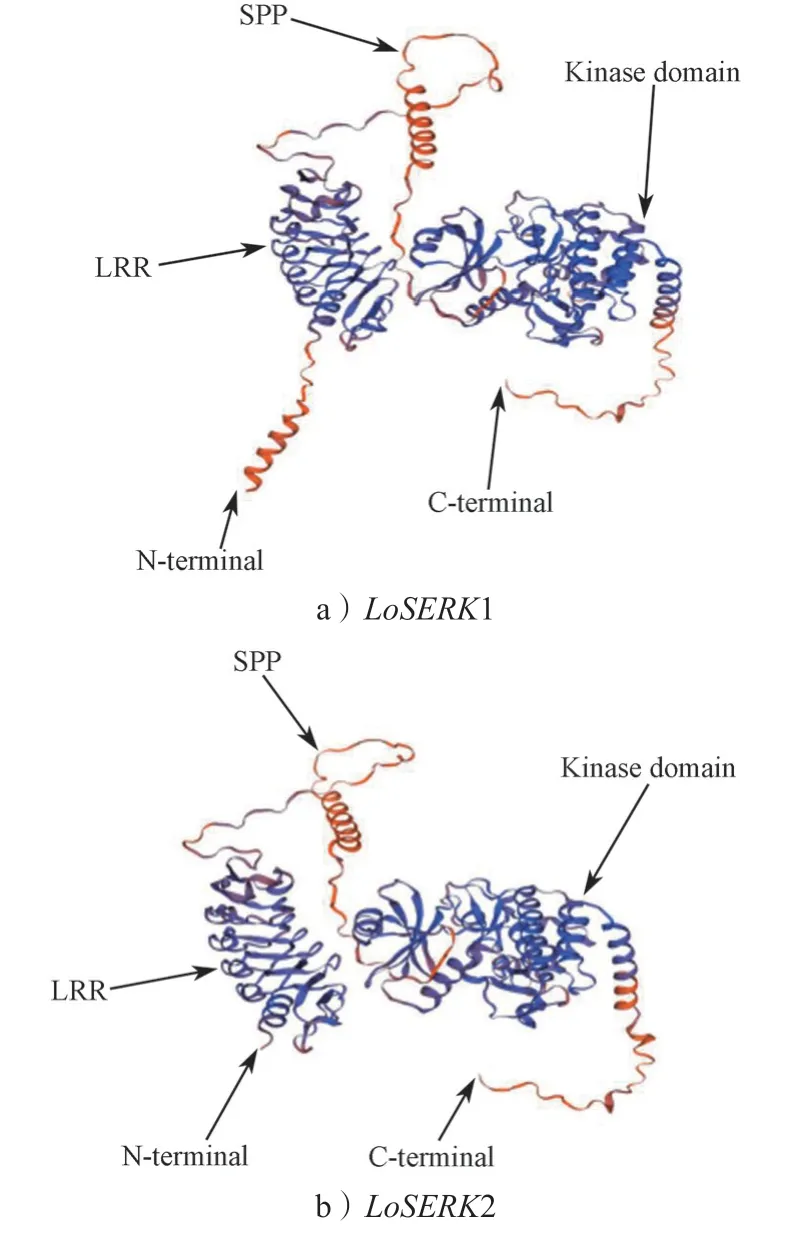
图5 LoSERKs 三级结构预测Fig.5 LoSERKs tertiary structure prediction
3.3 同源性比对分析及系统进化树构建结果
为了研究百合SERK 的氨基酸序列在进化过程中的保守性及多样性,将LoSERK1 和LoSERK2 氨基酸序列与其他植物的SERKs 氨基酸序列进行比对,包括拟南芥(Arabidopsisthaliana)、水稻(Oryza sativa)、 凤梨(Ananascomosus)、 油棕(Elaeis guineensis)、 茶树(Camelliasinensis)、 沉水樟(Cinnamomummicranthum)、可可树(Theobroma cacao)。 结果显示,LoSERK1 和LoSERK2 的氨基酸序列相似度达到90.22%,两者与其他种类的SERKs 氨基酸序列的相似性也比较高,与凤梨、油棕等单子叶植物的SERKs 氨基酸序列相似程度为92.74~93.21%。与双子叶植物茶树等的相似度也高达90%(图6)。
通过NCBI(https://www.ncbi.nlm.nih.gov/Structure)分析发现LoSERKs 有两个超家族成员,分别为PLN00113 superfamily、PKc_like superfamily( 见图6)。其中PLN00113 superfamily 是富含亮氨酸重复序列区域(LRR),PKc_like superfamily 为激酶结构域。同时基于与拟南芥AtSERK1~AtSERK5 和水稻OsSERK1、OsSERK2 进行系统进化树构建,由图7可知,LoSERK1 与LoSERK2 分别与水稻的OsSERK1和OsSERK2 相似性较高。
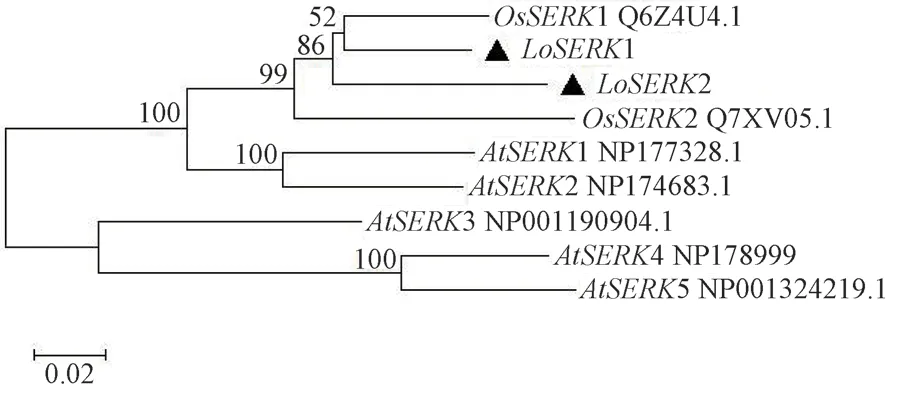
图7 基于拟南芥、水稻及百合SERKs 系统发育树的构建Fig.7 Construction of SERKs phylogenetic tree based on Arabidopsis thaliana,Oryza sativa and Lilium
3.4 LoSERKs 实时定量PCR 分析
为了研究百合SERKs 在花器官中的表达模式,以百合叶片中LoSERK1、LoSERK2 基因表达量为1.00,系统比较两个LoSERKs 基因在叶子、未开放的花瓣、已开放的花瓣、未成熟的花药、已成熟的花药中的相对表达量。结果发现,两个LoSERKs 基因在不同器官中的表达量存在差异,LoSERK1 基因(图8a,其中,L 为叶片;UF 为未开放的花瓣;OF 为开放的花瓣;IA 为未成熟的花药;MA 为已成熟的花药)在未成熟的花药中的相对表达量最高,为叶片中的14.39 倍;其在已开放的花瓣中表达含量也高达10.76,未开放的花瓣和已成熟的花药中相对表达量,分别为4.43 和4.98。LoSERK2 基因(图8b)在已开放的花瓣中的相对表达量(4.10)显著高于叶(1.00)、未成熟的花药(0.79)、已成熟的花药(0.44)、未开放的花瓣(0.40);而LoSERK2 基因在未成熟的花药与已开的花药中的相对表达量差异只有0.35;该基因在未开的花瓣中的相对表达量最低为0.40。
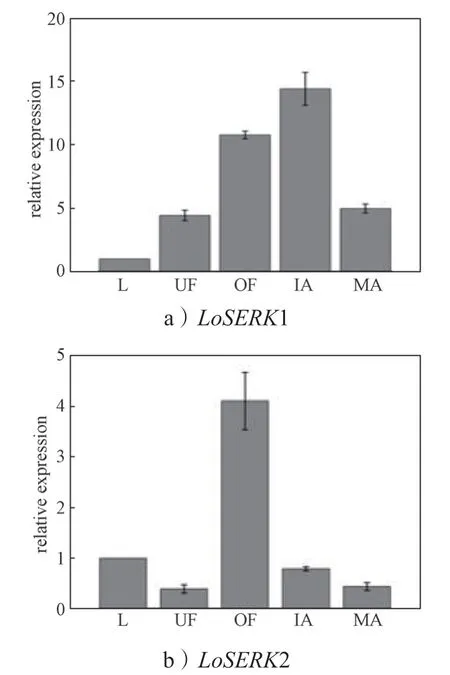
图8 不同组织中LoSERKs 的相对表达量Fig.8 Relative expression levels of LoSERKs in different tissues
4 讨论
SERK 是植物特有的膜受体激酶,其以共受体的形式和其他膜受体激酶一起形成异源二聚体,共同感受外源或内源分子信号,进而激活酶联受体介导的信号转导途径,例如MAPK信号通路。由于与SERK互作的受体激酶及信号分子具有的多样性,这决定了SERK 激酶参与多元化的生物学功能,如激素信号转导、免疫反应[17]、雄配子体发育[13]、花器官脱落等多方面的生理功能[19]。SERK 在植物中广泛存在,且其介导的信号调控模式在不同植物间具有相对保守性。例如,介导激素BR(BR-BRI1-SERKs)[14]和病原菌诱导的免疫响应(flg22-FLS-SERKs)信号模式被证实存在于拟南芥、水稻和番茄中[11],而调控花器官脱落的“IDA1-HAE/HSL2-SERKs”信号模式保守地存在于拟南芥和烟草中[19-20]。通过对模式植物中SERK 相关功能的研究,为其他植物中开展SERK功能研究提供了重要参考。
本文基于百合转录组测序数据,克隆了2 个东方百合SERK 同源基因LoSERK1 和LoSERK2,分别编码624 和628 个氨基酸,两者氨基酸序列相似性非常高,达90.22%。LoSERK1 和LoSERK2 氨基酸序列与其他植物氨基酸序列相似性很高,例如与AtSERK1、AtSERK2、OsSERK1、OsSERK2 的序列相似性均高于90.28%。同时LoSERK1 和LoSERK2 氨基酸序列长度与其他植物中SERKs 氨基酸长度很接近,例如拟南芥AtSERK1(625)、AtSERK2(628)、OsSERK1(624)、OsSERK2(628)。通过生物信息学分析,发现蛋白具有信号肽,且预测到跨膜结构域,推测这两个蛋白为细胞质膜定位蛋白[21]。在其三级结构中,LoSERK1 和LoSERK2 均以玉米ZmSERK1为模板进行三级结构预测,其相似程度都为90%以上。此外,LoSERK1 和LoSERK2 的氨基酸序列中都具有5 个典型的LRR结构域和胞内的激酶结构域,这表明了SERK 在生物进化过程中的保守性。系统进化树研究也表明,LoSERK1 和LoSERK2 与双子叶拟南芥AtSERK1 和AtSERK2 分为一支,与水稻中的OsSERK1 和OsSERK2 相似,这表明单子叶植物中可能并不存在与双子叶拟南芥AtSERK3 和AtSERK4 亲缘性很近的SERK。单子叶植物中的SERK 数量可能要少于双子叶植物,例如水稻、玉米和百合中发现2个SERKs,而拟南芥有5 个[31]、苜蓿有6 个[32]、苹果有12 个[3]、大豆有25 个[12]。SERK 受体与其他不同的受体(如BRI1、EMS1、FLS、HAE)一起感受不同的细胞外信号分子,进而引起受体胞内激酶结构域的磷酸化及转磷酸化,通过改变受体的激酶活性,从而激活细胞内的信号转导[9]。在进行百合LoSERK1 和LoSERK2 氨基酸序列分析时,也发现了这两个蛋白质的激酶结构域分别有28 个和29 个潜在磷酸化位点,这些磷酸化位点可能与胞质激酶活性有关[22]。
百合观赏性强,但其生产中也面临一些问题,例如,百合花粉量大且容易污染花瓣及衣物、百合花瓣过早脱落、百合种植过程中容易染病等,这些都会影响其产业发展。在拟南芥中AtTPD1 能够被定位在绒毡层前体细胞和绒毡层细胞质膜上的受体激酶AtEMS1 的胞外区所感知,并快速招募AtSERK1 或AtSERK2,进而引起受体间相互磷酸化,将信号传递到下游,最终决定花药绒毡层的命运及雄配子体的发育[32],拟南芥atserk1、atserk2 双突变会导致雄配子败育[13]。棉花中GhSERK1 也被发现能控制花粉发育,RNAi 干扰GhSERK1 基因的表达会导致雄性不育的表型[11]。对不同时期百合花药的表达分析表明,LoSERK1 在未成熟和成熟花药中的相对表达量均高于叶片中,其中未成熟花药(14倍)和成熟花药(5倍),而LoSERK2 在花药中的相对表达量略低于叶片中,这暗示LoSERK1 在雄配子体形成过程中的重要性可能更大。之前研究表明,AtHAE及其同源基因AtHSL2 在花器官分离时期的离层区细胞中表达[21-22],AtSERK1~AtSERK4 基因也在花器官离层区细胞中有表达[24],分泌型小肽AtIDA能被受体激酶AtHAE和AtHSL2 的胞外区感知[27],AtHAE/AtHSL2 和共受体AtSERKs形成异源二聚体,通过磷酸化作用激活下游MKK4/MKK5-MPK3/MPK6,进而通过调控细胞壁重塑酶基因的表达来调控花器官脱落[24,27]。拟南芥AtSERK1~AtSERK4 冗余地参与花器官脱落调控,其中AtSERK1 发挥最重要的功能,atserk1、atserk2、atserk3 或atserk1、atserk3、atserk4 三重突变体都会导致花器官不脱落[17]。两个百合LoSERKs 均在已经完全开放的花瓣中表达量显著高于未开放花瓣和叶片,由此推测,LoSERK1 和LoSERK2 可能会与花器官脱落有关,但还需要进一步证实。根据系统进化树的分析结果,百合与水稻的SERKs 亲缘性更近,预示着LoSERKs 有在免疫反应及激素BR响应的功能。未来,利用基因编辑或者RNA 沉默的方法将这两个百合SERKs 基因进行干扰、敲除或突变,可能会获得无花粉的百合,或者抗病性改变、花器官不脱落、植株生长改变等新表型的百合材料。
5 结语
本文基于转录组测序结果,对百合体细胞胚发生类受体激酶同源基因LoSERK1 和LoSERK2 进行了克隆,并通过生物信息学预测其功能,实时定量分析其在花器官中的表达情况。结果表明,百合LoSERK1和LoSERK2 分别编码624 和628 个氨基酸,且两个百合SERKs 在进化过程中具有高度的保守性,主要体现为蛋白质胞外LRR重复单元和胞内激酶结构域的保守性。百合与水稻的SERKs 之间亲缘关系很近,暗示百合SERKs 可能参与激素BR和免疫响应。百合LoSERK1 基因在花药成熟过程的表达量很高,预示LoSERK1 基因在雄配子形成中发挥功能。LoSERK1 和LoSERK2 基因在成熟花瓣中的表达量都很高,推测两个LoSERKs 基因可能参与了花器官的脱落。本研究可为进一步开展百合SERKs 功能研究及育种应用创造条件。
