产铁载体真菌Ti-11的筛选鉴定及应用
2023-12-13任新萍齐一霖曾晓希
任新萍,李 胜,齐一霖,冉 松,张 程,曾晓希
(湖南工业大学 生命科学与化学学院,湖南 株洲 412007)
0 引言
铁是自然界中常见的一种金属,也是生物体所必需的矿质元素之一,在光合作用、呼吸作用、固氮作用、三羧酸循环、氧化磷酸化等生理代谢过程中发挥着重要的作用[1-2]。由于绝大部分的铁处于中性或碱性的有氧环境中,会形成难溶的Fe3+化合物,抑制生物体对其的利用,导致农业生产中植物缺铁现象比较普遍,影响农作物的产量、品质[3-5]。为了适应高氧低铁的胁迫条件,大多数微生物和禾本科植物会诱导自身产生铁载体,一种强金属螯合剂,在缺铁环境下能与Fe3+螯合成铁-铁载体复合物,将Fe3+转运至胞内并还原成Fe2+供生物体利用[6-7]。由于铁载体与铁离子具有强螯合作用,当发生螯合时就能阻止病原菌对铁的吸收,从而达到生物防治作用[8]。铁载体根据螯合基团的化学性质不同可分为三大类:儿茶酚型(Catecholates)、异羟肟酸型(Hydroxamates)和羧酸型(Carboxylates)[9-10]。
近年来,铁载体在病原菌抑制、植物生长调控、环境污染修复等方面受到广泛的关注。朱慧明等[11]研究发现,铜绿假单胞菌Z158 对金黄色葡萄球菌、普通变形杆菌等病原菌具有抑菌作用,可作为生防菌株用于植物疾病防控。彭雯杰等[12]筛选得到一株阿斯青霉菌XK-12,研究发现其能产生异羟肟酸型铁载体,铁载体发酵液对病原菌具有抑制作用,对葡萄座腔菌的抑制率达到了100%。王东升等[13]发现铁载体可显著提高龙葵的生物量,与对照组未接菌相比,接种产铁载体菌后的实验组的茎叶干重分别增加1.55,1.47 倍,根干重增加2.45,2.28 倍。赵锐名等[14]研究发现,产铁载体细菌可以通过产生铁载体,并通过铁载体螯合Pb2+来提高受铅胁迫芒草幼苗的耐受性,降低根系铅的富集程度。因此,对产铁载体微生物的筛选及铁载体相关应用进行研究,能丰富产铁载体微生物资源,进一步了解分泌性铁载体在医药、环境保护和农业等各个领域的应用,对于铁载体研究有一定的基础意义。
1 实验
1.1 材料
1.1.1 菌种来源
采集校园内叶片发黄具缺铁症状的植物根际土壤,加入无菌水振荡,从菌悬液中进行菌种筛选。金黄色葡萄球菌(StaphyloccocusaureusRosenbach)和大肠杆菌(Escherichiacoli)均为湖南工业大学生命科学与化学学院微生物实验室保藏菌种。
1.1.2 培养基
MKB 培养基:甘油15 mL、酸水解酪蛋白5 g、磷酸氢二钾2.5 g、硫酸镁1 g,溶于1 L 水中,pH 自然,121 ℃温度下灭菌20 min。
CAS 固体培养基:质量分数为10%的酸水解酪蛋白30 mL、质量分数为20%的蔗糖溶液10 mL、0.1 mol/L 磷酸盐缓冲液5 mL、1 mmol/L CaCl21 mL、CAS 染液50 mL、琼脂18 g,溶于1 L 水中,121℃温度下灭菌20 min。
CAS 双层固体培养基:两层培养基,上层为MKB 固体培养基,下层为CAS 固体培养基
PDA 培养基:马铃薯浸粉5 g、葡萄糖20 g、氯霉素0.1 g、琼脂18 g,溶于1 L 水中,pH 自然,121℃温度下灭菌20 min。
LB 培养基:蛋白胨5 g、酵母浸粉10 g、NaCl 5 g、琼脂 18 g,加水定容至1 L,121℃温度下灭菌20 min。
1.1.3 主要试剂
CAS(铬天青)染液:A 液,CAS 0.605 g,100 μL 浓盐酸,100 mL 浓度为1 mmol/L 的氯化铁,500 mL 去离子水;B 液,CTAB 0.729 g,400 mL 去离子水;A 液倒入B 液混匀。
质量分数为10%的酸水解酪蛋白:称取10 g 酸水解酪蛋白粉末溶于100 mL 水中。
质量分数为20%的蔗糖溶液:称取20 g 蔗糖溶于100 mL 水中。
柠檬酸缓冲液(pH 值为4):84.7 mL 浓度为0.1 mol/L醋酸与15.3 mL浓度为0.25 μmol/L醋酸钠混匀。
钼酸盐溶液:100 g 硝酸钠、100 g 钼酸钠,定容至1 000 mL。
1 mmol/L AgNO3:称取AgNO30.169 88 g,定容至1 000 mL。
0.1 mol/L 磷酸盐缓冲液(pH 值为6.8):Na2HPO4·12H2O 24.27 g、NaH2PO4·2H2O 5.905 g、KH2PO40.75 g、NH4Cl 2.5 g、NaCl 1.25 g,溶于1 L水中。
琼脂、蛋白胨、酵母浸粉、氯化钙、甘油、蔗糖、3,5-二硝基水杨酸,上海生工生物工程有限公司;葡萄糖,天津大茂化学试剂厂;无水乙醇,湖南汇虹试剂有限公司;硝酸钠、硝酸银、钼酸钠、酸水解酪蛋白、磷酸氢二钾,国药集团化学试剂有限公司;以上试剂均为分析纯。
1.2 实验方法
1.2.1 菌株筛选
1)初筛。取土样5 g 溶于100 mL 的锥形瓶中,振荡培养30 min,使样品充分混合均匀。采用浓度梯度稀释法,稀释成10-2,10-3,10-4,10-5g·mL-14 个浓度梯度备用;采用涂布平板法,取各浓度的菌悬液各100 μL,涂布在CAS 双层平板上,倒置培养3~5 d,待有菌落出现,挑取周围产生棕黄色或红色螯合圈的菌落进行反复划线分离,将分离后得到的纯菌株进行复筛并保藏。
2)复筛。采用CAS 平板检测法和CAS 液体显色法进行复筛,将初筛菌株用接种环点接到CAS 固体培养基上,在30 ℃倒置培养7 d,观察菌落透明圈的颜色和大小。将初筛菌株接种于MKB 培养基中,在30 ℃、180 r/min 培养7 d,取发酵液用多层纱布过滤菌体,将上清液与CAS 染液1:1 混匀,观察混合液的颜色变化。
1.2.2 菌株鉴定
1)形态学鉴定。参考《微生物学实验教程》[15],将活化后的菌株稀释涂布至PDA 培养基上,在30 ℃温度下倒置培养3~7 d,观察菌落形成过程及菌落特征。
2)分子生物学鉴定。提取真菌RNA,逆转录生成cDNA 后以真菌通用引物进行PCR 扩增[16],将PCR 扩增产物送至上海生工测序,测序结果利用NCBI-BLAST 进行序列比对,并利用MEGA 软件构建系统发育进化树。
1.2.3 菌株铁载体曲线测定
将活化后的菌株接种至发酵培养基MKB 培养基上,在30℃、180 r/min 的摇床上培养7 d。用无菌纱布进行过滤,得到发酵上清液,吸取2 mL 发酵上清液并加入等体积的CAS 染液,混合均匀后测定其OD630值,记作As;测定空白培养基的OD630值,记作Ar;铁载体活性单位[17]记作SU(%),表示铁载体产量,计算公式为SU=(Ar-As)/Ar×100%。
1.2.4 铁载体类型鉴定
铁载体类型鉴定,分别采用Arnow 实验检验儿茶酚型铁载体,FeCl3实验检验异羟肟酸型铁载体或儿茶酚型铁载体,分光光度法鉴定是否羧酸型铁载体[18-19]。
Arnow 实验。取1 mL 发酵上清液和未接菌的培养基分别加入2 根试管中,再向两根试管中分别加入1 mL浓度为0.5 mol/L盐酸和1 mL钼酸盐溶液。若此时溶液颜色变黄,再加入1 mL 浓度为1 mol/L的氢氧化钠溶液;若溶液颜色由黄变红,并且红色保持一个小时不会消失,说明产生的铁载体为儿茶酚型铁载体。
FeCl3实验。取1 mL 发酵上清液和未接菌的培养基分别加入2 根试管中,再加入2 g/L 的FeCl3溶液,一次加入1 mL,总共加入5 mL。若加入1 mL FeCl3溶液后立即变红,则为异羟肟酸型铁载体;若加入多于1 mL FeCl3溶液才发生颜色变化,则为儿茶酚型铁载体。
分光光度法。取1 mL 发酵上清液于试管中,依次加入1 mL 浓度为0.25 μmol/L 的CuSO4溶液和1 mL(pH 值为4.0)醋酸盐缓冲液,将其在紫外分光光度计下进行全波长扫描,若在190~280 nm 之间有吸收峰出现,说明产生的铁载体为羧酸型铁载体。
1.2.5 菌株产铁载体条件优化
以MKB 液体培养基为基础,选择不同碳源、氮源和初始pH 值进行菌株产铁载体的条件优化。
最佳碳源选择。选择果糖、乳糖、可溶性淀粉、蔗糖、葡萄糖和甘油作为不同的碳源进行优化,在装液量为100 mL 的锥形瓶中,培养条件如下:以2%的量接种、培养温度为30 ℃、转速为180 r/min 和初始pH 值为7 进行接种,并摇床培养7 d。测定不同条件下菌株的生长量和铁载体产量。选择最佳碳源种类,将其浓度分别设置为5,10,15,20,25 g/L 的浓度梯度进行优化,采用上述培养条件,测定不同碳源浓度下菌株的生长量和铁载体产量。
最佳氮源选择。选择半胱氨酸、酸水解酪蛋白、(NH4)2SO4、KNO3、谷氨酸作为不同的氮源进行优化,在装液量为100 mL 的锥形瓶中,在上述培养条件下培养。测定不同条件下菌株的生长量和铁载体产量。选用最佳氮源种类,将其质量浓度分别设置2,3,4,5,6 g/L 的浓度梯度进行优化,培养条件同上所述,测定不同氮源浓度下菌株的生长量和铁载体产量。
最佳初始pH 值选择。选择初始pH 值为5,6,7,8,9 共5 个梯度,在装液量为100 mL 的锥形瓶中,按照上述培养条件培养。测定不同初始pH 条件下菌株的生长量和铁载体产量。
1.2.6 探究铁载体对病原菌的抑制作用
本实验取目标菌株发酵至铁载体活性最大时的发酵液,取发酵上清液来探究铁载体对金黄色葡萄球菌和大肠杆菌的抑制作用,金黄色葡萄球菌和大肠杆菌为实验室保藏的菌株活化后备用。
1)铁载体添加量对抑菌效果的影响。将提取出的铁载体粗提取液与活化后的两种菌液分别按比例混合,使铁载体添加量梯度分别为0%,10%,20%,30%,40%。混合后将混合液放置于恒温摇床培养1 h后,用稀释涂布平板法将两种菌株接于平板中培养。观察菌落的数目并记录。
2)铁载体粗提取液与病原菌培养时间对抑菌效果的影响。将提取出的铁载体发酵液与活化后的两种菌液分别按最优添加量混合,混匀后将其置于恒温摇床分别培养1,3,5,8,12,24 h 后,用稀释涂布平板法将两种菌株接于平板中培养。观察菌落数目并记录。
2 结果与分析
2.1 产铁载体菌株的筛选
利用CAS 双层平板进行初筛,对图1a 中产生了橙红色的菌群进行分离纯化,对初筛后的单菌株进行CAS 平板复筛,结果如图1b所示,菌株Ti-11 在平板上出现了明显的透明圈并且出现橙红色色晕,初步鉴定有铁载体产生。将菌株Ti-11 的发酵液离心处理后,取上清液与CAS 染液1:1 混合,实验结果如图1c所示,左边为空白对照组,右边为实验组,实验组中的液体逐渐从蓝色转变为红色,这进一步证明该菌株有产生铁载体的能力。

彩图
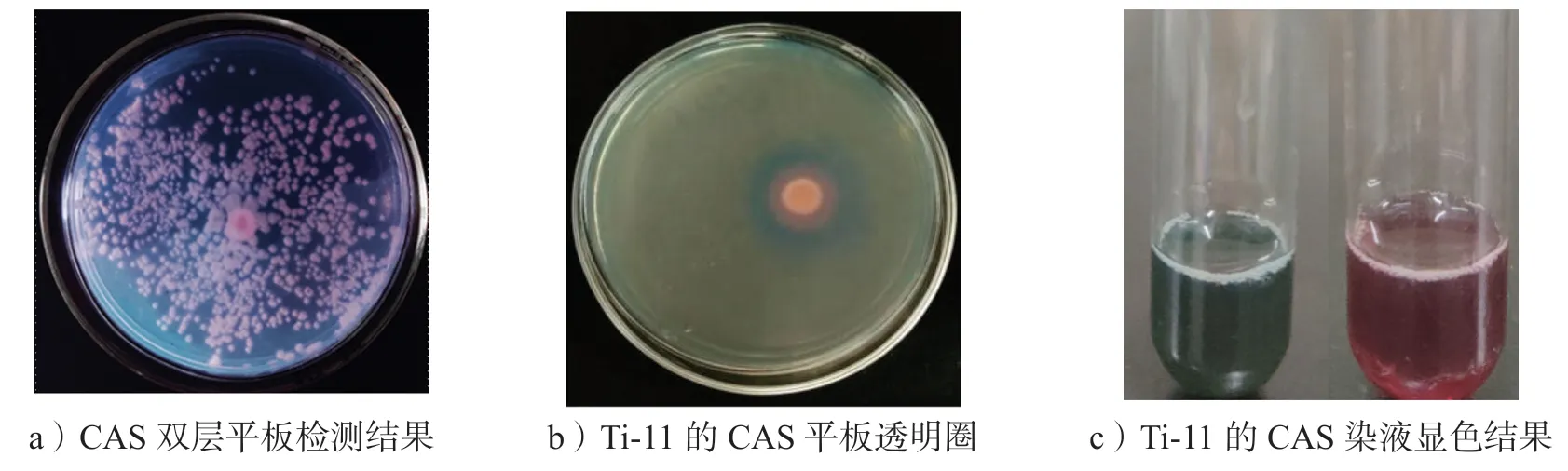
图1 产铁载体菌株Ti-11的筛选结果Fig.1 Screening of iron producing carrier strain Ti-11
2.2 菌株的鉴定
2.2.1 形态学鉴定
Ti-11 菌株在PDA 培养基上培养,菌落表面隆起并形成白色菌丝(图2)。生长后期出现深绿色的孢子,深绿色的孢子会把附近菌落的菌丝染成深绿色,菌株背面呈现发散状,边缘呈现锯齿状,且与培养基紧密贴合,质地较硬。在显微镜下该真菌的菌丝为比较细长、表面光滑、边缘整齐的单条管状有隔膜的细丝。

彩图
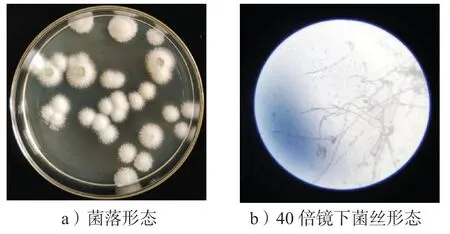
图2 Ti-11 的菌株形态Fig.2 Strain morphology of Ti-11
2.2.2 分子生物学鉴定
提取Ti-11 的RNA,逆转录生成cDNA 后以真菌通用引物进行PCR,PCR 产物凝胶电泳验证后送至上海生工测序,将测序结果利用NCBI-BLAST 进行序列比对,选取同源性高的序列进行系统发育进化树的构建。Ti-11 系统发育树结果如图3所示,与菌株Ti-11 同源性最高的为Penicilliumoxalicum,即为草酸青霉菌。再结合以上形态学鉴定结果可以综合得出Ti-11 为草酸青霉菌。
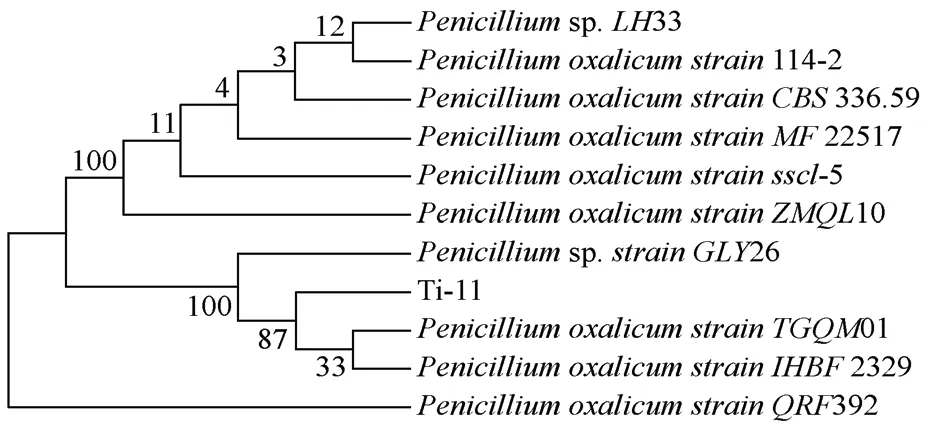
图3 Ti-11 系统发育树Fig.3 Phylogenetic tree of Ti-11
2.3 菌株产铁载体曲线测定
利用紫外分光光度法测定菌株的产铁载体能力,每隔1 d 测定其铁载体活性,结果如图4所示。
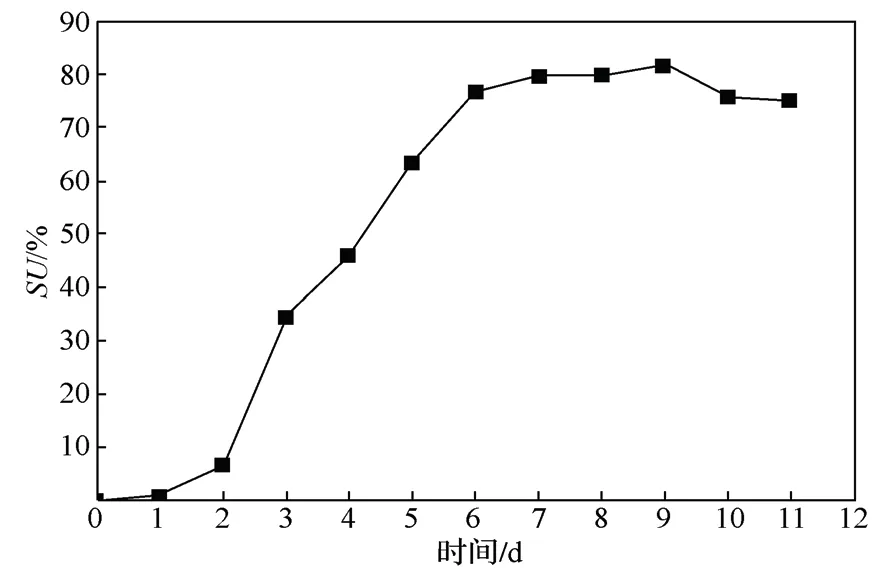
图4 菌株Ti-11 产铁载体变化曲线Fig.4 Iron production carrier curve of strain Ti-11
Ti-11 的产铁载体周期较长,在1~7 d 呈现稳步上升的趋势,在第9 d 达到最大值,铁载体活性达84.13%,比曹宏丽等[20]筛选得到的恶臭假单胞菌培养48 h 的产铁载体含量增长了30.69%。且在7~9 d保持相对稳定,之后随着时间的增大,菌株产生的代谢废物不断增加,抑制菌株的生长和铁载体的产生,呈现缓慢下降的趋势。
2.4 菌株产铁载体类型鉴定
采用Arnow 实验鉴定该菌株产铁载体是否为儿茶酚型铁载体,结果如图5a所示(左边为对照组,右边为实验组),加入铁载体的实验组未出现显色反应,故该铁载体不为儿茶酚型铁载体。加入1 mL 和3 mL FeCl3均未出现变红反应(图5b),说明该铁载体不为异羟肟酸型铁载体和儿茶酚型铁载体。紫外分光光度法鉴定该菌株产铁载体是否为羧酸型铁载体,结果如图5c所示,该反应液在190~280 nm之间出现吸收峰,证明菌株Ti-11 所产铁载体类型为羧酸型铁载体。

彩图

图5 Ti-11 产铁载体类型鉴定结果Fig.5 Identification of Ti-11 iron production carrier types
2.5 菌株产铁载体条件优化
干重可以直接表明菌株的生长状况,而铁载体活性单位则可以表明菌株在此条件下产铁载体的情况。如图6所示,Ti-11 菌株的最佳碳源是葡萄糖,最佳葡萄糖浓度为15 g/L。如图7所示,Ti-11 菌株的最佳氮源是酸水解酪蛋白,其最佳浓度为6 g/L。
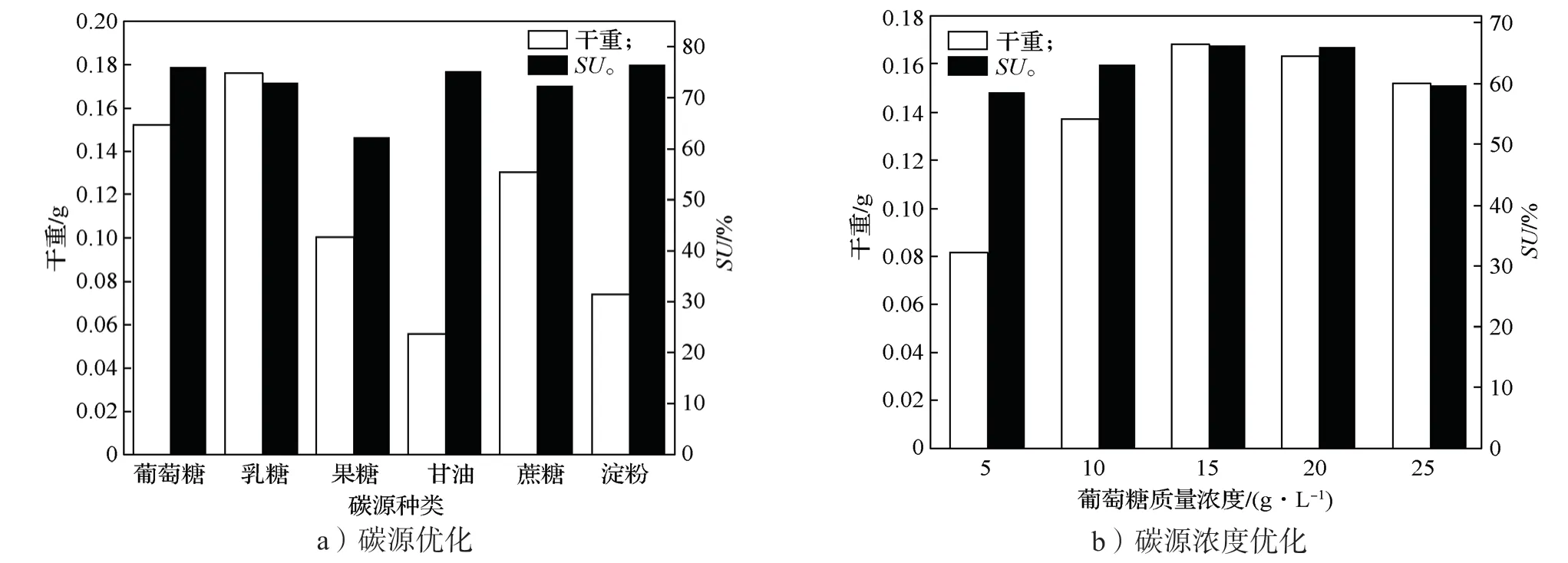
图6 碳源及碳源浓度优化结果Fig.6 Carbon source and carbon source concentration optimization results
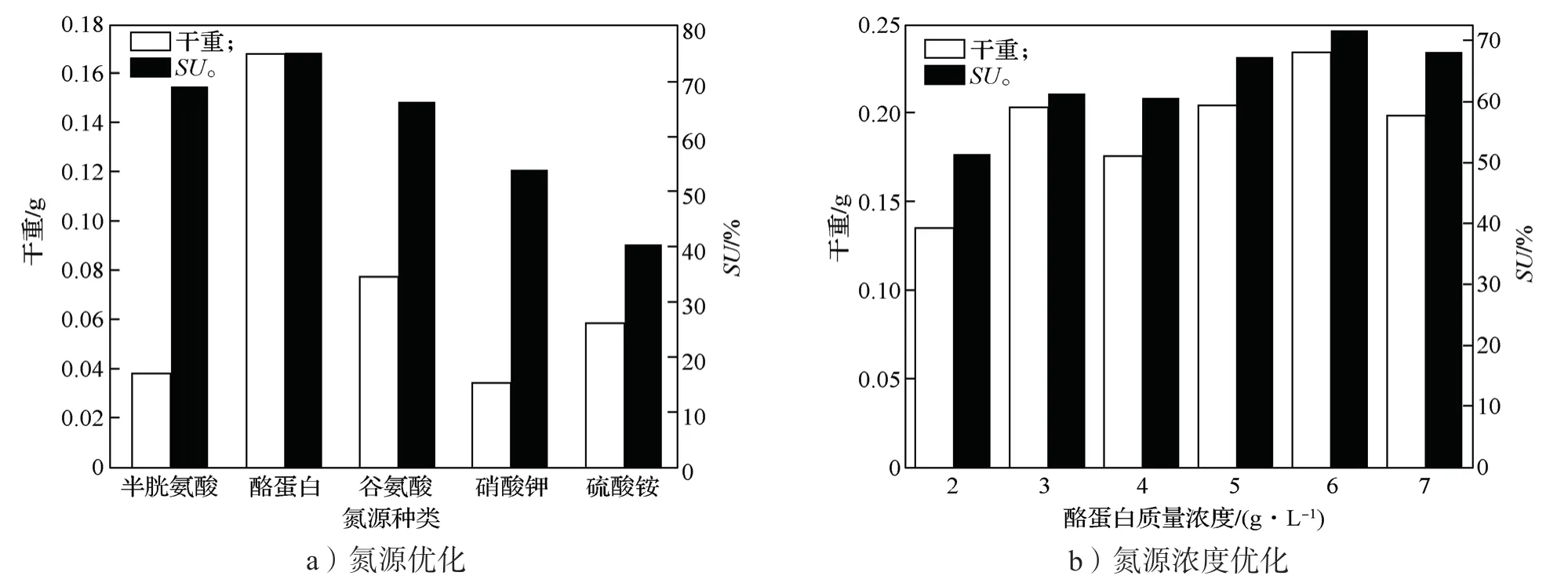
图7 氮源及氮源浓度优化结果Fig.7 Nitrogen source and nitrogen source concentration optimization results
如图8所示,初始pH 值为8 时,铁载体活性最高,可达76.95%,但是干重在pH 值为6~7 时最大,说明Ti-11 菌株在酸性的条件下生长较好,但是在偏碱性的初始pH 值环境下铁载体产量较高。
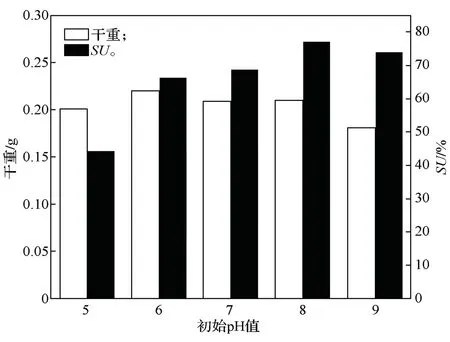
图8 初始pH 值优化结果Fig.8 Initial pH optimization
2.6 铁载体对病原菌的抑制作用探讨
1)铁载体添加量对抑菌效果的影响。铁载体对金黄色葡萄球菌具有一定的抑菌效果,且效果随浓度逐渐增加,如图9(上)所示,从左至右添加量依次为0%,10%,20%,30%,40%,明显看出随着添加量的增大,菌落数量不断减少,大于30%后抑菌效果没有较大提升。铁载体对大肠杆菌无明显抑菌效果,如图9(下)所示,从左至右添加量依次为0%,10%,20%,30%,40%,但菌落数无明显差异。
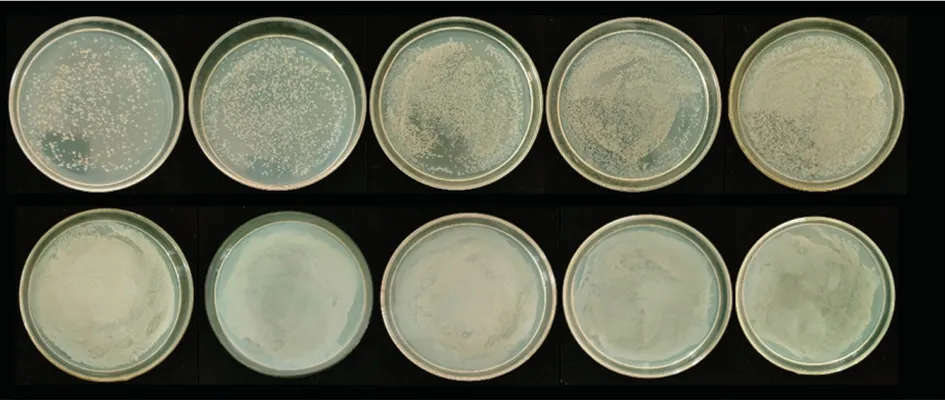
图9 铁载体添加量对金黄色葡萄球菌(上)和大肠杆菌(下)的抑制作用Fig.9 Inhibitory effects of Fe-carrier supplementation on Staphylococcus aureus (top) and Escherichia coli (bottom)
2)铁载体粗提液与病原菌培养时间对抑菌效果的影响。该铁载体粗提液对于金黄色葡萄球菌有一定的抑制作用。继续探讨30%添加量下,不同反应时间对抑制效果的影响,结果如图10所示,从左到右分别为处理1,3,5,8,24 h,可以明显看出随着反应时间的增长,菌落数显著减少。
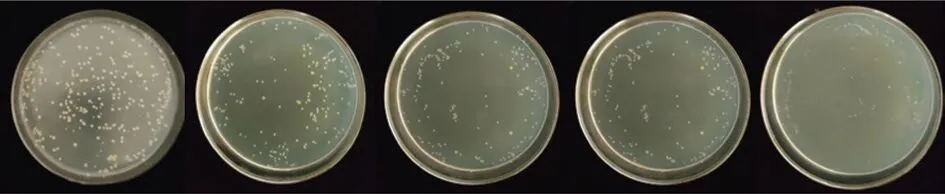
图10 反应时间对金黄色葡萄球菌的抑制作用Fig.10 Inhibitory effect of reaction time on Staphylococcus aureus
3 结语
本研究从植物根际土壤中筛选得到一株高产铁载体真菌Ti-11,经鉴定为草酸青霉菌(Penicillium oxalicum)。测定其产铁载体曲线,在第9 d 达到最大产量,为84.13%。通过单因素试验确定产铁载体最佳培养条件为:10-3mol/L Fe3+能促进菌株生长,葡萄糖为最佳碳源,酸水解酪蛋白为最佳氮源,最佳初始pH 值为8.0。以大肠杆菌和金黄色葡萄球菌为抑菌实验对象,发现该含铁载体的上清液能显著抑制金黄色葡萄球菌,且处理24 h 时的抑菌效果最好。本研究为微生物产铁载体提供了新资源,为铁载体的广泛应用提供了新思路。
