铁铬电解液中游离酸的测试方法研究
2023-12-12车莹华蔓杨合雄宋德生肖晋宜
车莹,华蔓,杨合雄,宋德生,肖晋宜
(斯瑞尔环境科技股份有限公司,广东 惠州 516267)
0 引言
在当今社会背景下,风能、太阳能为代表的可再生清洁能源受到了社会广泛的关注,并在近些年取得了阶段性的成果及应用。由于风能、太阳能的不稳定性、间歇性,需要采用大规模储能系统将产生的电能进行储存后再转化成稳定的电能。铁铬液流电池,作为最早出现的一种大规模液流电池技术,采用价格低廉的金属铁和铬离子作为活性物质,已在商业化应用中取得了重大进展,有望成为高性价比的储能装备[1]。
目前,铁铬电解液的产品标准尚未制定,各项主要成分亦未有明确的测试方法,尤其是游离酸的测试方法。铁铬电解液中有大量金属离子,容易在酸碱滴定过程中发生水解,且铬离子颜色较深,容易干扰滴定终点颜色的判断,使得酸碱滴定时难以选择合适的指示剂。CN 112326875 A[2]专利中,采用甲基红为指示剂,加入F-络合Cr3+、Fe2+,进行酸碱滴定,但Cr3+、Fe2+与F-络合能力差,且甲基红变色不明显,导致测试结果准确度差。铁铬电解液中游离酸的测试问题一直困扰着业内人士,笔者研究了返滴定法和电位滴定法测试铁铬电解液中的游离酸,两种方法均取得了较好的效果。
1 返滴定法测试铁铬电解液中游离酸
1.1 方法原理
铁铬电解液的主要成分是CrCl3、FeCl2和HCl,由于电解液容易氧化,电解液中还包含少量FeCl3。Fe3+水解pH 为1.9~3.2,Fe2+水解pH 为7~9,Cr3+水解pH为4.3~5.6,所对应的离子浓度均为:10-1~10-5mol/L,离子浓度越高,水解pH 值越低,酚酞变色pH 为8~10,由无色变为紫红色。由此可知在pH 为10 时,Fe3+、Fe2+、Cr3+均处于水解沉淀状态,因此,选择返滴定法测试铁铬电解液中的游离酸。加入过量的氢氧化钠,使溶液中的Fe3+、Fe2+、Cr3+均处于水解沉淀状态,酚酞显紫红色,不断滴加盐酸标液,直至pH 值下降到10 以下时,酚酞迅速转变成无色,终点突变明显,易于判断。在滴定终点时,溶液中的Fe3+、Fe2+、Cr3+依然处于水解沉淀状态,可计算出3 种金属离子全部水解所消耗的氢氧化钠,再结合盐酸滴定量和氢氧化钠用量,算出铁铬电解液中游离酸。
1.2 试剂选择
试验试剂:氢氧化钠标液浓度≈0.25 mol/L;盐酸标液浓度0.05~0.50 mol/L;酚酞指示剂浓度≈0.1 g/L。
1.3 分析步骤
称取0.8~1.2 g 铁铬电解液样品于250 mL 锥形瓶中,边摇边加入50.00 mL 氢氧化钠标液,加入水至约100 mL,加入2 滴酚酞指示剂,用盐酸标液滴定至酚酞的紫红色消失,由于溶液有灰蓝色或褐色沉淀的干扰,所以滴定终点以酚酞的紫红色消失为准。
1.4 计算方法
游离酸以(HCl)的质量分数计,数值以%表示,按式(1)计算:
式中:VNaOH为滴定试验中加入的氢氧化钠标准溶液的体积(mL);CNaOH为滴定试验中加入的氢氧化钠标准溶液的浓度(mol/mL);VHCl为滴定试验中加入的盐酸标准溶液的体积(mL);CHCl为滴定试验中加入的盐酸标准溶液的浓度(mol/mL);ωFe3+为滴定试验用电解液样品中Fe3+的浓度(%);ωFe2+为滴定试验用电解液样品中Fe2+的浓度(%);ωCr3+为滴定试验用电解液样品中Cr3+的浓度(%);m为称取的电解液样品的质量(g)。
1.5 试验条件与讨论
1.5.1 样品取样量
称取1g 铁铬电解液,电解液中铁、铬浓度约为5%,加入100 mL 水后,水溶液中铁、铬离子浓度由理论计算得约10-2mol/L,此浓度的铬、铁在pH 值为10 时是处于水解沉淀状态。经称取0.2~1.5 g 铁铬电解液用本测试方法进行测试,以验证不同的取样量对游离酸测试结果的影响,表1 为测试结果。
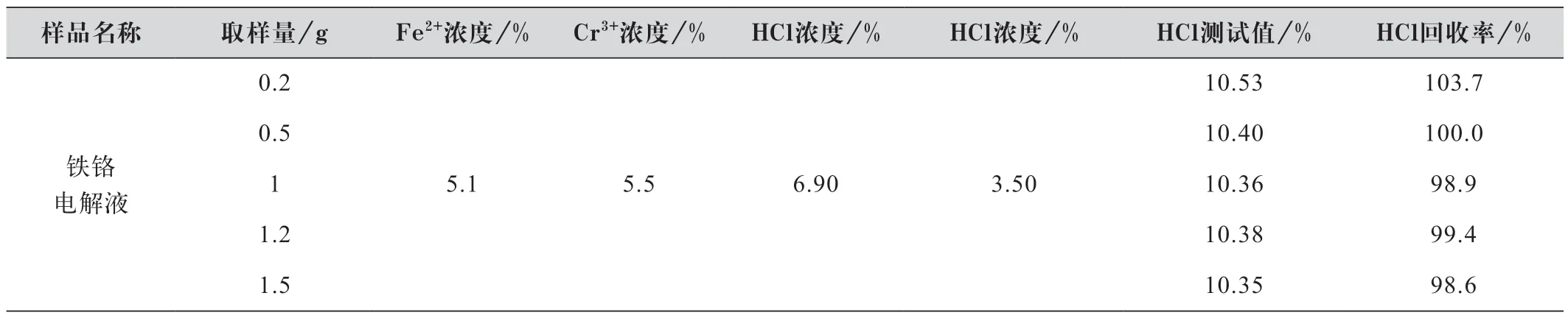
表1 不同取样量对铁铬电解液游离酸测试结果的影响
由表1 测试结果可知,铁铬电解液取样量在0.2~1.5 g 时,HCl 的加标回收率为98.6%~103.7%,均在合格范围内,测量准确度较高。电解液取样量可在较大范围变化,亦说明了此方法适用的电解液各成分浓度范围较宽。
1.5.2 氢氧化钠用量
当铁铬电解液取样量为1 g 时,中和溶液中的游离酸及让铁、铬水解需0.25 mol/L 氢氧化钠溶液约27.8 mL,因此,氢氧化钠的用量要大于30 mL。称取1 g 已知游离酸理论值为6.9%的电解液用本方法进行测试,以验证0.25 mol/L 氢氧化钠的用量对游离酸测试结果的影响,表2 为测试结果。

表2 氢氧化钠的用量对游离酸测试结果的影响
由表2 数据可知,当氢氧化钠添加量为30 mL,过量较少,导致盐酸标液滴定量较少,测试结果偏差较大,而添加量在35~50 mL 时,偏差均较小。鉴于电解液中Fe2+、Cr3+、H+浓度波动,再考虑氢氧化钠准确移取需用单标线分刻度移液管,故定氢氧化钠取样量为50.00 mL。
1.5.3 酚酞添加量
由于酚酞是一种弱有机酸,因此在酸碱滴定中需控制用量。称取1 g 已知游离酸理论值为6.9% 的电解液用本方法进行测试,以验证0.1 g/L 酚酞不同的添加量对游离酸测试结果的影响,表3 为测试结果。

表3 酚酞不同的添加量对游离酸测试结果的影响
由表3 数据可知,0.1 g/L 酚酞用量为2~10 滴时,游离酸测试偏差较小,当酚酞用量增加至15 滴时,游离酸测试结果明显偏高,因此,需要控制酚酞的用量在10 滴以内。
1.5.4 盐酸标液的浓度对游离酸测试结果的影响
选择标准溶液浓度的大小,通常要考虑下面几个因素:(1) 滴定终点的敏锐程度;(2) 测量标准溶液体积的相对误差;(3) 对分析准确的要求。显而易见,若标准溶液较浓,则最后一滴标准溶液会使指示剂发生的变化信号更为明显,因为它所含的标准物质较多,但标准溶液越浓,由1 滴或半滴过量所造成的相对误差就越大。所以为了保证测量时的相对误差不大于±0.1%,所用标准溶液的体积一般不小于20 mL,而又不得超过50 mL,否则会引起读数次数增多而增加视差。另一方面,在确定标准溶液浓度大小时,还需考虑一次滴定所消耗的标准溶液的量要适中。
称取1 g 已知游离酸理论值为6.9%的电解液用本方法进行测试,以验证盐酸标液浓度对游离酸测试结果的影响,表4 为测试结果。
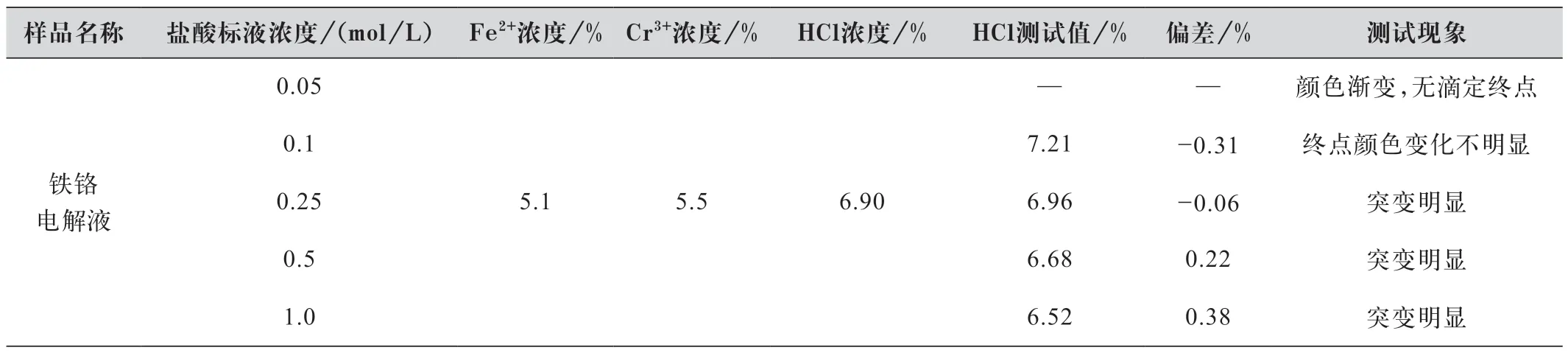
表4 盐酸标液浓度对游离酸测试结果的影响
由表4 实验数据及现象可知,当使用浓度低的标准溶液时,由于每滴所包含的标准物质较少,且溶液本身就有颜色的,临近终点时就会出现颜色渐变的特征,肉眼难以准确判断终点,此时测试偏差较大。当标准溶液浓度过高时,最后1 滴或半滴过量较多,使得游离酸测试结果偏小。综合测试准确度及终点突变性,盐酸标液浓度最佳为0.25 mol/L。
1.6 试验条件验证
1.6.1 方法精密度
分别称取0.8~1.2 g 5 种不同离子浓度的铁铬电解液于250 mL 锥形瓶中,边摇边滴加50.00 mL的氢氧化钠标液( 浓度≈0.25 mol/L),加入蒸馏水至约100 mL,加入2~5 滴0.1 g/L 的酚酞指示剂,用0.25 mol/L 的盐酸标准溶液滴定至紫红色消失,每个样品测试6 次,计算平均值和相对标准偏差,表5为测试结果。
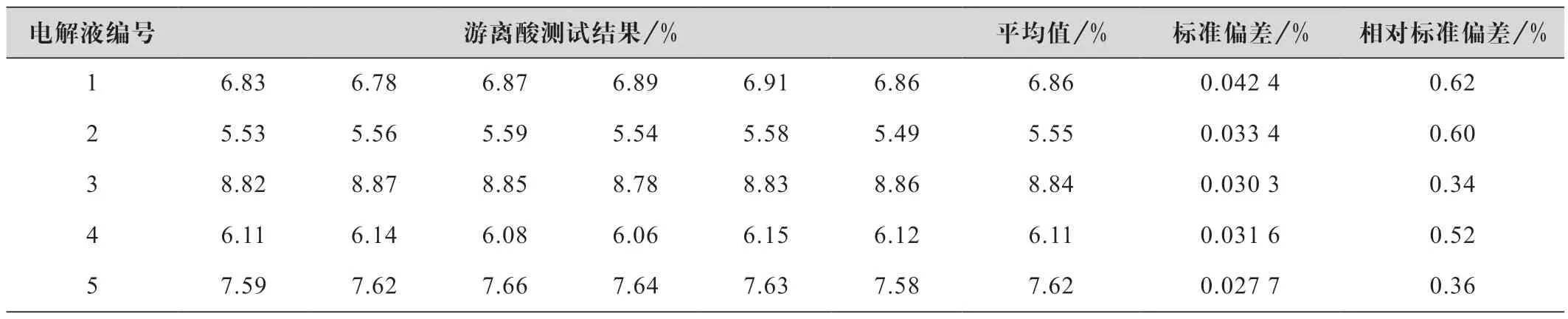
表5 返滴定法精密度实验结果
由表5 中不同含量的电解液游离酸测试结果可知,测试结果的标准偏差<0.05%,相对标准偏差在0.34%~0.62%之间,方法精密度较好,满足分析测试要求。
1.6.2 方法加标回收率
分别称取0.8~1.2 g 5 种不同离子浓度的铁铬电解液于250 mL 锥形瓶中,加入不同的HCl 量,按照返滴定方法进行测试,表6 为测试结果。
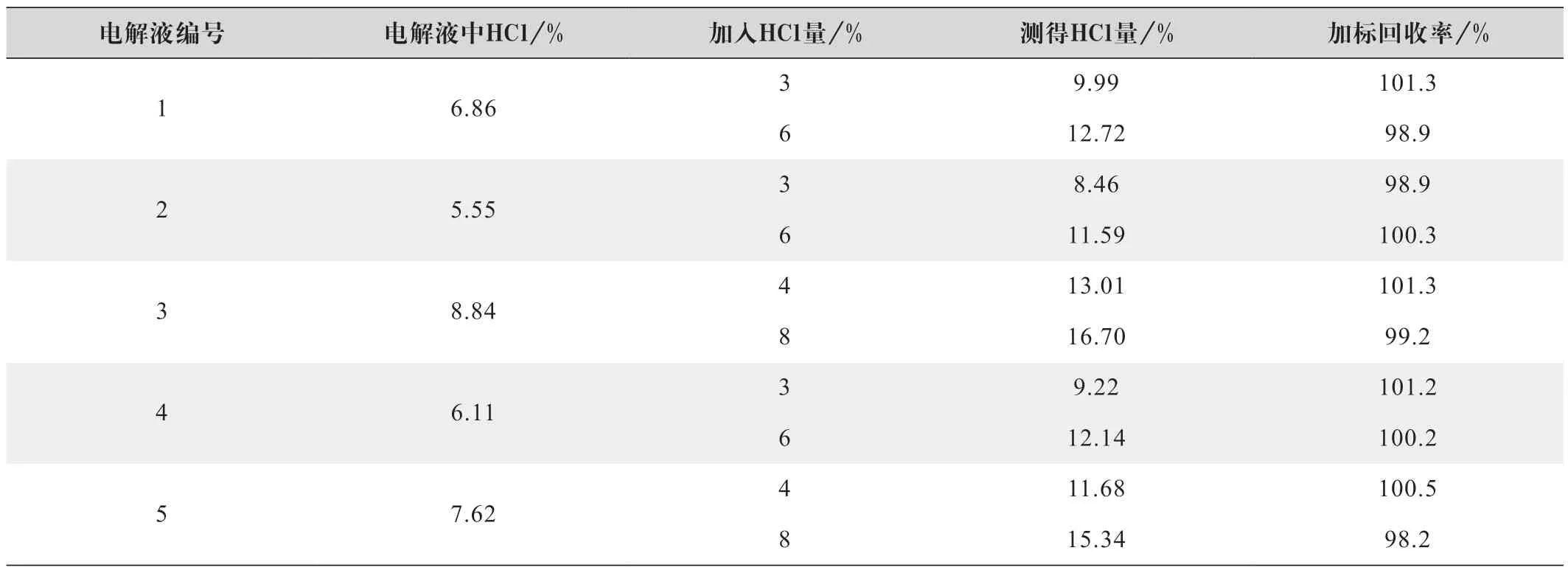
表6 返滴定法加标回收率结果
由表6 数据可知,HCl 加标回收率在98.2%~101.3%之间,说明本测试方法的准确度非常高。
2 电位滴定法测试铁铬电解液中游离酸
铁铬电解液直接用酸碱滴定法测试,尝试了甲基红、甲基橙、刚果红、溴酚蓝作为指示剂,由于溶液本身显绿色,导致指示剂变色不明显,不容易判断滴定终点,无法准确测得结果。
电位滴定法比起用指示剂的容量分析法优势在于:(1)可用于有色或混浊溶液的滴定,使用指示剂是不行的;(2)在没有或缺乏指示剂的情况下,用此法解决;(3)灵敏度和准确度高,并可实现自动化和连续测定[3]。由于电位滴定法的准确程度取决于pH 计,因此,进行测试前必须用标准缓冲溶液对pH 计进行校准。
2.1 电位滴定法测试终点的pH 值
使用电位滴定仪测试游离酸时,由于Fe2+、Cr3+离子水解pH 值>4.3,当pH 值>4.3 时,HCl <0.000 3%,实际应用时可忽略此酸度的影响。因此,设定小于4.3不同的pH 值作为滴定终点,进而选择合适的pH 值。
使用电位滴定仪进行测试,称取约1 g 已知游离酸理论值为6.9% 的电解液于100 mL 测试杯中,加入50 mL 蒸馏水,预设不同的pH 值作为滴定终点,用0.25 mol/L 的盐酸标准溶液滴定,表7 为测试结果。

表7 铁铬电解液以不同pH 作为滴定终点的测试结果
由表7 数据可知,当设定终点pH 值为3.4 时,HCl 测试值与理论值最接近,故选择pH 值为3.4 作为滴定终点。在pH 值为3.2~3.6 时,HCl 测试值的偏差在0.13% 以内,偏差较小,即使pH 计灵敏度稍有波动亦不影响最终的检测结果。
2.2 电位滴定法的精密度
分别称取0.8~1.2 g 3 种不同离子浓度的铁铬电解液于100 mL 测试杯中,加入蒸馏水至约50 mL,用0.25 mol/L 的氢氧化钠标准溶液进行滴定测试,每个样品测试6 次,计算平均值和相对标准偏差,测试结果见表8。
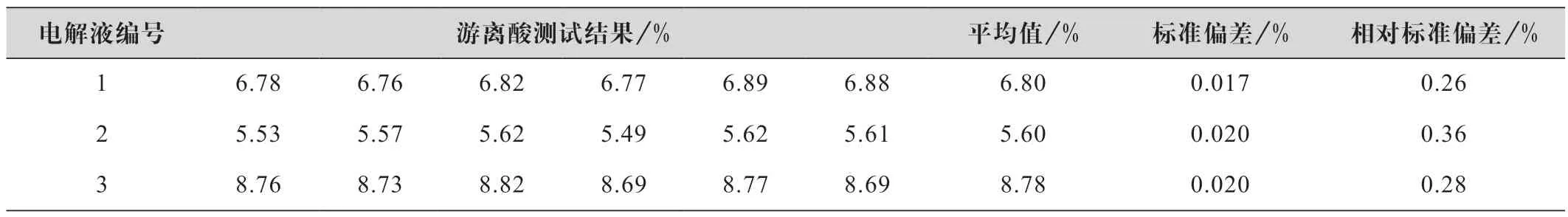
表8 电位滴定法精密度实验结果
由表8 数据可知,相对标准偏差0.26%~0.36%之间,方法精密度较好,满足分析测试要求。电位滴定法的相对标准偏差比返滴定法的要低很多,分析原因为:电位滴定仪滴定过程自动控制,数据由设备程序进行处理,自动读出滴定终点,与手工滴定管滴定过程相比,极大地降低了人为误差,提高了检测速度和检测精度。
2.3 电位滴定法的加标回收率实验
分别称取0.8~1.2 g 3 种不同离子浓度的铁铬电解液于100 mL 测试杯中,加入不同的HCl 量,按照电位滴定法进行测试,测试结果如表9 所示。
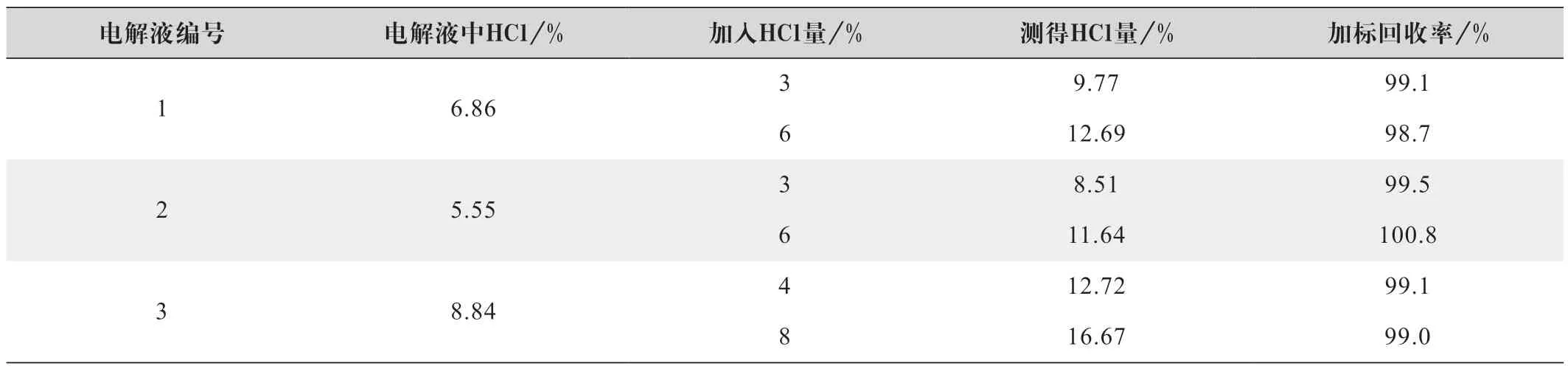
表9 电位滴定法加标回收率实验结果
由表9的回收率结果可知,加标回收率在98.7%~100.8%,说明测试方法准确度较高。
2.4 改进电位滴定法测试含Fe3+铁铬电解液中的游离酸
直接采用电位滴定法测试时,若铁铬电解液中存在较多的Fe3+,由于Fe3+在pH 值为1.9~3.2 时已发生水解,消耗了氢氧化钠,使得游离酸测试结果偏高,经理论计算,当Fe3+浓度为0.2% 时,游离酸测试结果偏高约5%,因此,当Fe3+浓度大于0.2% 时,不适合直接用电位滴定法,需选择返滴定法进行测试。
由GB/T 4482—2018 《水处理剂 氯化铁》中游离酸测试方法可知,加入KF 和Fe3+形成络合物六氟合铁酸三钾(K3FeF6),在酸碱滴定时Fe3+未形成Fe(OH)3沉淀,不影响游离酸的测试结果,因此,可借鉴此方法原理来消除铁铬电解液中三价铁对游离酸测试的干扰,改进电位滴定法。
2.4.1 KF 用量的确定
含Fe3+的铁铬电解液用电位滴定法测试步骤为:选择1 个Fe3+浓度为3% 的电解液,称取约1 g 电解液于测试杯中,加入1~10 mL 刚调至微红的500 g/L的KF 溶液[4],补水至约50mL,设置终点pH 为3.4 进行测试结果如表10 所示。

表10 KF 用量对铁铬电解液中游离酸测试结果的影响
1 mol 的Fe3+和6 mol 的F-络合,按理论计算,1 g 含3%Fe3+的电解液只需要加入0.13 mL 500 g/L的氟化钾即可,但加入量为1 mL 时依然不能完全络合Fe3+,说明KF 需大大过量才能将Fe3+完全络合。加入3~10 mL 的测试值和理论值接近,考虑到铁铬电解液取样量及Fe3+的浓度变化,为了节约试剂,确定KF 的取样量为5 mL。
2.4.2 改进的电位滴定法和返滴定法测试结果比对
选择3 个不同Fe3+浓度的电解液,按照电位滴定法和返滴定法进行测试,表11 为测试结果。

表11 含Fe3+的铁铬电解液电位滴定法和返滴定法测试结果
由表11 数据可知,测试选择的3 个电解液样品,中Fe3+浓度从1%~3%,包含的范围较广,含Fe3+的电解液用改进后的电位滴定法测试值和返滴定法测试值接近,和理论值的偏差均在0.12%以内,两种测试方法准确度均较高,均可用于Fe3+较高的电解液中游离酸的测试。
3 结语
经深度分析测试原理及误差来源,针对铁铬电解液游离酸的测试中遇到的溶液颜色深、酸碱指示剂变色不明显、含Fe3+、基体成分容易水解等问题,开发出返滴定法和电位滴定法两种测试方法,并加入KF掩蔽Fe3+以改进电位滴定法。两种测试方法均能准确测出铁铬电解液中的游离酸,方法加标回收率在98.2%~101.3% 范围内、精密度在0.26%~0.62% 范围内,方法准确度高,测试结果稳定,适用范围广,具有推广意义。
