漆酶及其对染料废水处理的研究进展
2023-12-11陈砚君丁益文刘家扬张雪英
王 滨,陈砚君,丁益文,关 健,刘家扬,张雪英
(南京工业大学 环境科学与工程学院,江苏 南京 211800)
染料在皮革鞣制、纺织、食品、造纸、油漆、印刷、塑料、化妆品和制药等行业具有广泛的用途[1]。工业染料多是化学合成物,化学结构复杂且稳定性高,多数染料具有生态毒性和致癌、致畸性,降解困难[2]。目前,世界上使用的合成染料超过1万种,并广泛用于染料和印刷行业,据统计,每年生产的70万t染料中,有2%~50%未使用而随废水排放[3]。
染料废水具有优良的色牢度、光解稳定性和抗微生物降解性,为传统处理方法带来了极大的挑战[4]。常见的染料脱色物化方法包括膜过滤、沉淀、混凝-絮凝、浮选、吸附、离子交换、萃取、超声矿化、电解和高级氧化(氯化物、漂白、臭氧氧化)等方法[5]。由于染料结构复杂,并且常见的染料脱色方法效率低、成本高、易产生有毒的副产品[6]。因此,开发一种新型绿色的染料废水处理方法具有重要意义。生物法具有脱色率高、运行成本低和环保等优点,是处理染料废水的有效手段[7]。特别是氮还原酶、漆酶和过氧化物酶能够有效地降解染料[8]。
漆酶作为一种天然的绿色催化剂,可将一些合成染料降解和脱色,减轻其生物毒性,是一种有前途的生物催化剂。漆酶因能够分解一系列难降解的芳香族化合物而吸引了越来越多的关注[9]。漆酶在染料废水脱色、环境污染物降解和土壤修复等领域具有良好的应用前景[10],已成为环境保护用酶的研究热点之一。与物理吸附、化学混凝-絮凝等方法相比,漆酶具有应用效率高、成本低、无毒性、能源需求低和对生态系统影响小等特点[11]。本文就漆酶的来源、结构、催化机制及应用研究等方面进行综述,并结合现有工艺对该领域的研究进行展望。
1 漆酶的来源
漆酶按照来源分为三大类:植物漆酶、真菌漆酶和细菌漆酶[12]。尽管漆酶存在于多种植物中,但植物漆酶并未被广泛应用,主要是植物漆酶很难被检测和纯化,其应用成本高。目前,研究和应用最广泛的是担子菌亚门(Basidiomycotina),尤其是白腐真菌所分泌的漆酶。常见的白腐真菌有栓菌属(Trametes)、侧耳属(Pleurotus)、木耳属(Auricularia)、密孔菌属(Pycnoporus)和伞菌属(Agaricus)等[13]。在白腐真菌属中较为经典的是黄孢原毛平革菌(Phanerochaetechrysosporium)[14]。
1.1 植物漆酶
漆酶最早发现于日本漆树Rhusvernicifera中。后又来发现了其他植物漆酶:Rhussuccedanea、Acerpseudoplatanus、Pinustaeda、Populuseuramericana、Liriodendrontulipifera和Nicotianatabacum[15-16]。所有植物漆酶均为单体蛋白,分子量为90 000~130 000,碳水化合物含量高(质量分数达22%~45%)。但是,高等植物中的漆酶的研究相对较少。
1.2 真菌漆酶
真菌漆酶是一种由500~550个氨基酸组成的酸性等电点单体糖蛋白,分子量为50 000~90 000[17],碳水化合物含量较少(10%~30%)[18]。少数真菌仅分泌一种漆酶,而大多数真菌则分泌两种或两种以上的漆酶同工酶。漆酶同工酶的分子量、活性和等电点非常相似,最大的差异在于表达量和稳定性[19]。此外,即使相同的真菌以不同的形式生长,产生的漆酶也会不同。如,香菇子实体中有分泌漆酶LCC1和非分泌漆酶LCC4,这可能是真菌适应环境的一种生存机制[20]。
据统计,目前已经发现了一千多种能产生漆酶的真菌,并分离和纯化了一百多种漆酶[21]。在真菌中,漆酶主要存在于担子菌[22]和曲霉菌[23]中,其中担子菌中的白腐真菌(WRF)是唯一能够利用自身氧化酶系统将木质纤维素转化为CO2的真菌,是真菌漆酶的主要生产和研究对象[24]。白腐真菌可以有效地降解木材中的木质素,可以使腐烂的木材变得潮湿、柔软,外观呈现白色或黄色。近年来,研究发现WRF不仅能降解木质素,还能降解各种环境污染物,如合成染料、工业废水和芳香族农药等,具有很大的应用潜力[25]。在白腐真菌降解木材的过程中,存在多种不同的木质素降解酶,包括漆酶(Lac, E.C. 1.10.3.2)、木质素过氧化物酶(Lip, E.C. 1.1 1.1.14)、锰过氧化物酶(MnP, E.C. 1.1 1.1.13)和多功能过氧化物酶(VP, E.C. 1.1 1.1.16)[26]。表1总结了产生漆酶的典型真菌类型、生产条件和应用情况。

表1 产生漆酶的典型真菌类型及其应用Table 1 Typical types of laccase producing fungi and their applications
1.3 细菌漆酶
1993年,Panwar等[31]从Azospirillumlipoferum中纯化并表征了一种具有漆酶活性的蛋白,标志着细菌漆酶研究的开始。最近的研究也证实了不同细菌漆酶的活性,目前已分离出并鉴定了一百多种细菌漆酶[31]。细菌漆酶也是一种糖蛋白,通常以单体蛋白的形式存在,由一条肽链组成,含有约500~600个氨基酸残基。从分子组成上看,细菌漆酶相对简单,没有经过糖基化修饰,这与其他漆酶有很大不同。只有少数细菌漆酶是寡聚体酶,如来自灰色链霉菌和脂肪状偶氮螺菌的漆酶,分为同质三聚体和异质三聚体[31]。因此,总体来说,细菌漆酶的组成较简单,其分子量小于其他来源的漆酶。
目前,对枯草芽孢杆菌孢子衣蛋白CotA的研究较多[32],其结构类似于聚对苯二甲酸氧化酶,具有抵抗紫外线和H2O2氧化的动能。CotA蛋白是枯草芽孢杆菌的孢子囊蛋白成分,也具有漆酶活性。由于孢子的特殊结构,CotA具有良好的耐温性,在80 ℃下半衰期为2 h,最适温度为75 ℃。细菌漆酶的优点是在高温、高盐和碱性等极端条件下具有良好的稳定性,与真菌漆酶相比具有更好的工业应用特性[33]。表2总结了产生漆酶的典型细菌类型、生产条件和应用情况。

表2 产生漆酶的典型细菌类型及其应用Table 2 Typical types of laccase producing bacteria and their applications
2 漆酶的结构、性能及漆酶-介体系统(LMS)的催化机制
2.1 漆酶的结构、特性及催化机制
漆酶是一种单电子氧化还原酶,典型的漆酶(蓝色漆酶)是一种单体胞外糖蛋白,分子量为60 000~80 000,碳水化合物含量为15%~20%。绝大多数漆酶的活性中心含有4个铜原子,根据磁学和光谱学性质不同可将其分成3个不同的铜中心[18](Ⅰ、Ⅱ和Ⅲ型,图1):Ⅰ型(T1)或蓝色铜中心,Ⅱ型(T2)或正常铜中心,Ⅲ型(T3)或双核铜中心。光谱特征显示,漆酶的T1位点使酶溶液呈现浅蓝色,这证实了在大约600 nm处存在光吸收[10]。T2位点在电子吸收光谱中不可见,T3位点可以通过330 nm附近的肩带的存在来识别[38]。T1位点的铜原子负责酶的颜色(蓝色),而Ⅱ型和Ⅲ型中心的铜原子则参与各种底物的催化反应。一种缺乏T1位点的非典型漆酶被称为黄色漆酶。在漆酶的活性部位,铜原子被还原,同时底物在单核铜中心失去电子并被氧化,而O2在三核铜中心获得电子并被还原成H2O(图2)[18]。
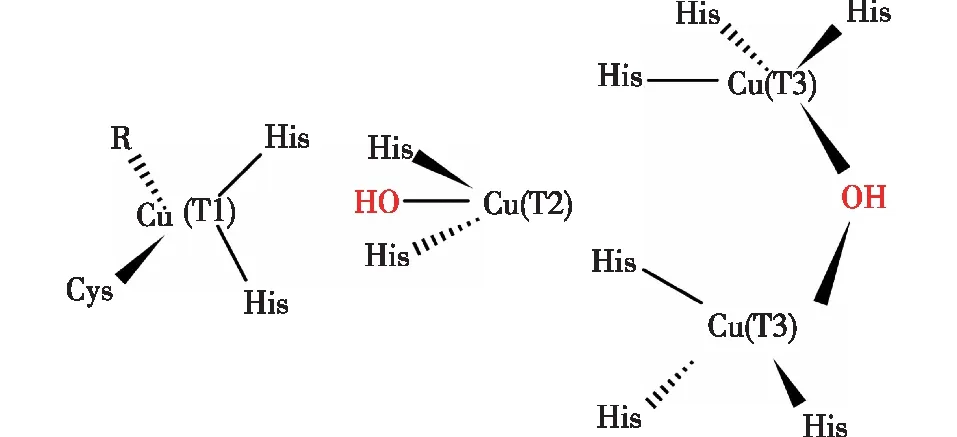
图1 漆酶的活性点位分布图[18]Fig.1 Schematic diagram of laccase activity site distribution[18]
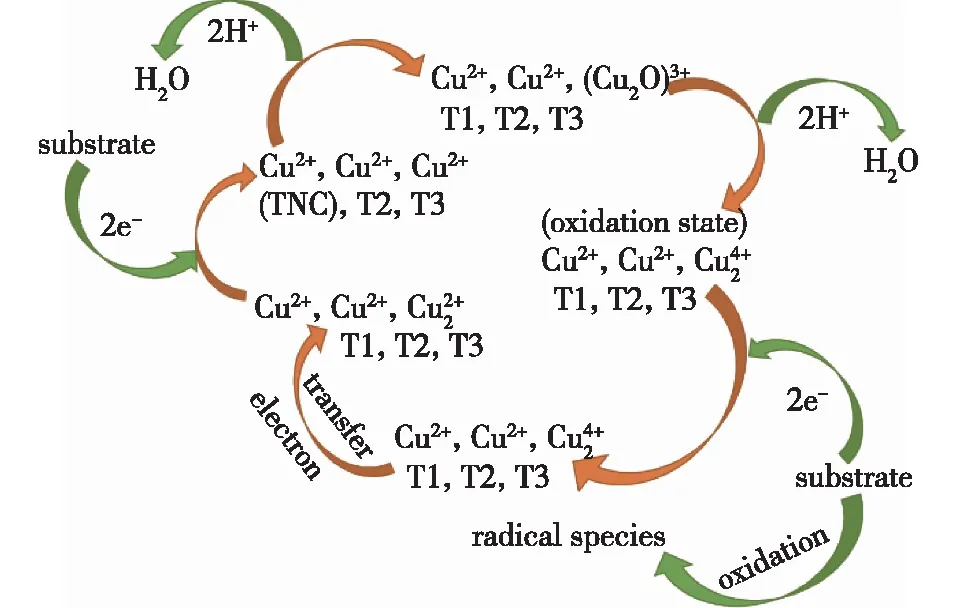
TNC:T2Cu与T3Cu形成的三核铜中心图2 漆酶活性点位催化机制[18] Fig.2 Mechanism of laccase activity site catalysis[18]
漆酶具有广泛的底物谱,尤其是在还原性介质存在的条件下,漆酶的底物范围更广,通过与漆酶介质结合,可以扩大底物范围。漆酶能以分子氧为电子受体催化氧化各种酚类化合物及其衍生物和非酚类化合物,包括单酚、邻苯二酚和对苯二酚[10]。被氧化的介质是一个非常活跃的分子,能够作用于更复杂的底物,并在氧化后返回到原来的还原形式,从而启动一个新的降解循环(图3)[18]。
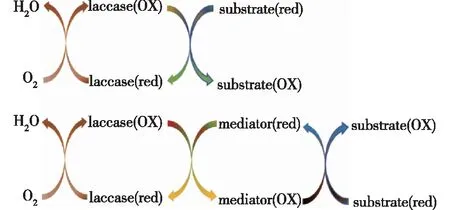
图3 漆酶催化氧化反应机制[18]Fig.3 Mechanism of laccase catalyzed oxidation reaction[18]
2.2 漆酶-介体系统(LMS)的催化机制
漆酶可以氧化多种有机污染物,包括染料、多环芳烃(PAH)、内分泌干扰物(EDCs)和药物活性化合物(PhACs),但漆酶本身很难氧化具有高氧化还原电位的难降解底物(如非酚类物质),因此为了达到更高的降解率和增强漆酶的氧化活性,需要引入介体。漆酶-介体系统(LMS)可以使用一些可扩散的低分子量化合物(氧化还原介质),例如2, 2′-重氮双(3-乙基-苯并噻唑-6-磺酸)二胺盐(ABTS)、1-羟基苯并三唑(HBT)、N-羟基邻苯二甲酰亚胺(NHPI)、乙酰丁香酮(AS)和紫尿酸(VLA)等(图4)[39]。这些底物很容易被酶氧化,产生阳离子中间自由基,然后以非生物的方式进一步氧化该化合物。目前,对漆酶的研究主要集中在LMS上,特别是寻找天然廉价高效的介体是当前研究的一个热点[40]。

图4 LMS的常见有效化学介质[39]Fig.4 Common mediators for LMS[39]
3 漆酶对染料的脱色与脱毒
3.1 合成染料的结构和分类

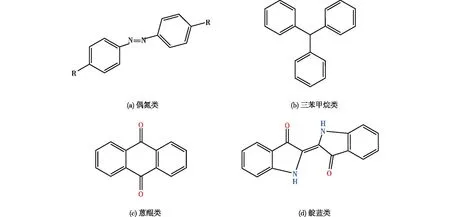
图5 常见的染料核心结构Fig.5 Main structures of common dye
与偶氮染料不同,羰基在蒽醌结构中充当电子受体,因此,需要电子供体反应来破坏该结构。此外,大多数蒽醌染料是以蒽醌磺酸为原料,通过磺化或硝酸酯化制备的,蒽结构之间的共振效应使得蒽醌染料比偶氮染料更难降解,所以不易选择合适的降解方法[43]。
3.2 漆酶对染料的脱色
3.2.1 真菌漆酶对染料的脱色
真菌漆酶由于其优良的催化性能和广泛的底物特性,被广泛用于去除环境中的各种难降解有机污染物。如,Hidayat等[44]用从印度尼西亚库隆林杰尼国家公园中分离得到的菌株Cerrenasp.BMD.TA.1对活性艳蓝KN-R(RBBR)进行脱色,结果发现,在低质量浓度(100 mg/L)和高质量浓度(1 000 mg/L)下,经过72 h的脱色,脱色率达到80%。真菌漆酶的最佳反应pH为4~6,最佳反应温度为30~50 ℃[44]。大多数真菌漆酶在50 ℃以上容易失活,即它的稳定性不强。真菌漆酶在中酸性条件下能有效地使合成染料脱色。来自野外的Panusrudis产漆酶对染料的最佳脱色pH为3.5~4.5[45]。在pH为5.0的情况下,Trametesversicolor所产漆酶对蒽醌类染料的脱色率超过90.0%,而在pH为7.0的情况下则低于10.0%[46]。不同类型的真菌漆酶对染料的脱色作用见表3。

表3 不同类型的真菌漆酶对染料的脱色作用Table 3 Decolorization of dyes by different types of fungal laccase
3.2.2 细菌漆酶对染料的脱色
由于真菌漆酶的最适pH一般为偏酸性,大多数工业废水具有高温和碱性的特点。与真菌漆酶相比,在碱性条件下,细菌漆酶表现出较高的稳定性。如,在pH为9.5的条件下,固定化枯草芽孢杆菌漆酶蛋白的半衰期为67 h,而固定化细菌漆酶对纺织染料进行脱色,60 ℃下反应90 min后脱色率达到99.0%[55]。Martins等[56]发现,枯草芽孢杆菌衣壳蛋白的CotA具有比真菌漆酶更强的热稳定性,在80 ℃时半衰期为2 h,最佳反应温度为75 ℃,研究发现,该漆酶在40 ℃、pH为7.0~9.0时稳定,对甲基橙、活性红等偶氮染料的脱色率为68.0%~90.0%。不同类型的细菌漆酶对染料的脱色作用见表4。
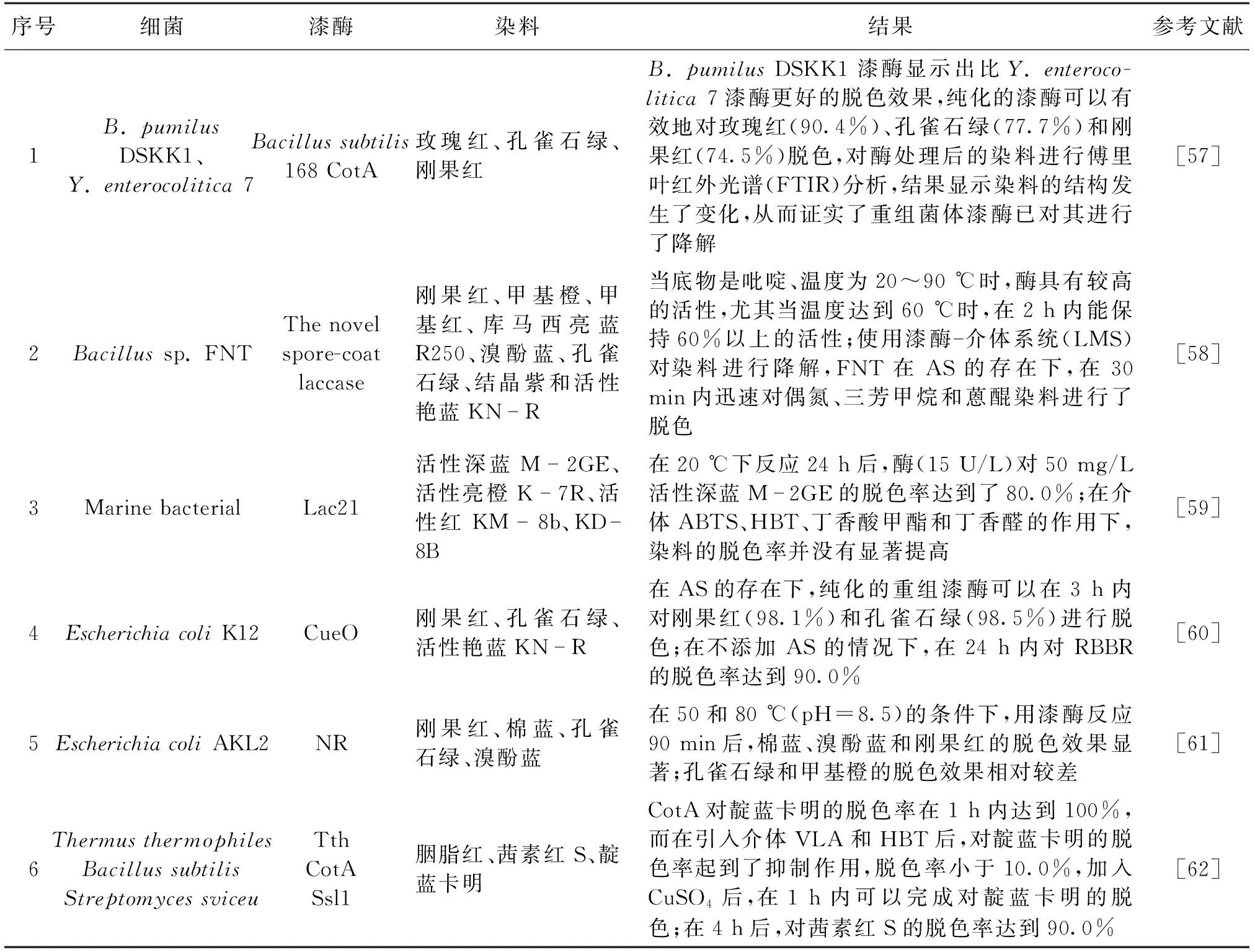
表4 不同类型的细菌漆酶对染料的脱色作用Table 4 Decolorization of dyes by different types of bacterial laccase
3.2.3 影响漆酶对染料脱色的因素
用漆酶处理染料废水时,要考虑单一因素或多种因素的影响,包括温度、pH、时间、染料结构、漆酶活力、介体浓度和染料浓度等,都会在不同程度上影响脱色效率,对这些参数的研究,将有助于漆酶在染料废水处理中的实际应用。
1)温度以两种方式影响酶促反应的速率。提高温度会增加底物分子的热能,增加反应速率。但温度的升高增加了构成酶本身的蛋白质结构的分子热能,即增加了维持整个酶的三维结构的非共价键的断裂,导致酶的变性。
2)pH的影响。真菌漆酶一般在酸性环境(pH 3.0~6.0)中具有良好的催化性能,当pH超过7.0时,其活性明显下降。然而,细菌漆酶在碱性pH条件下相对稳定,并且比真菌漆酶有更好的耐热性。因为酶分子活性位点上的氨基酸侧链基团可以随着pH的变化而解离,形成不同的正负高价离子或等价电荷状态,这将直接影响酶的活化和酶与底物的亲和力。另外,pH直接影响底物的带电状态,有可能使其无法与酶结合。
3)反应时间的影响。随着反应时间的延长,漆酶的活性会逐渐下降。因此,应确定一个最佳的反应时间,以确保最佳的脱色效果。
4)漆酶活力的影响。一般来说,酶的数量决定了催化反应的速度,能与底物结合的活性位点的数量随着酶的数量增加而增加。在底物饱和的情况下,酶浓度增加则会加速反应。
5)介体的影响。漆酶-介体系统可以促进木质素的降解,还可以显著提高漆酶对染料的脱色率。漆酶可以直接对多种染料进行脱色,但由于漆酶的氧化还原电位较低,一些难降解染料无法脱色,而利用LMS系统可以有效实现染料的脱色,天然介体也可以帮助漆酶对染料进行脱色处理。
6)染料浓度的影响。当染料浓度增加时,反应速率先迅速上升,然后缓慢上升,在染料浓度较高时,达到一个极限值,这是因为游离的酶分别与底物固定形成配位化合物,溶液中游离的酶越来越少,染料浓度的增加会抑制中间化合物向底物的转化。

8)固定化作用的影响。固定化酶的最大优点是提高酶的稳定性和重复利用率。在工业废水处理中,使用固定化酶可以提高酶的稳定性,减少酶的损失,从而有利于降低处理成本。
9)辅助化合物(金属离子和表面活性剂等)的影响。加入Cu2+可以提高漆酶的活性,Cu2+是漆酶的活性中心,也是漆酶分子的重要组成部分;Mg2+是许多氧化还原酶的催化激活剂,漆酶是其中之一;其他金属离子可能通过与漆酶活性位点周围的氨基酸残基或无羧基阴离子的结合而影响漆酶的分子电荷分布来影响漆酶的活性。
3.3 漆酶对染料的脱毒评价
与其他有机污染物相比,染料及其衍生物在毒理学和生态毒理学方面的研究相对较少[63]。评估染料及其降解产物的生态风险极其重要。在不同的水平和不同的指示生物中,各种方法已被广泛用于评估染料和降解产物的毒性,常用的评估方法见图6。

图6 常用毒性评估方法Fig.6 Common toxicity assessment methods
图6中的这些方法基本上采用原生生物或真核生物,包括细菌(单一形式)、活性污泥(混合培养)、藻类、植物和动物(主要是原生动物)[64]。由于不同受试生物对污染物的敏感程度不同,使用不同的方法则产生不同的毒性评价结果,如费氏弧菌(V.fischeri)的半最大效应浓度(EC50)可能是藻类S.capricornutum的500倍[63-64]。根据试验周期,可采用适当的模式生物进行急性和慢性毒性实验。藻类是众多染料毒性评价模型中最敏感的一种[64]。
各评价系统都有其优点和缺点,可根据具体的实验目的来选择。一种物质的生物毒性在很大程度上取决于所应用的模型生物和所采用的标准,主要是因为其对污染物的敏感性不同。然而,无论应用何种单一的模式生物,有些染料总是显示出最大的毒性[64]。对于微生物的毒性,在染料溶液和酶降解的染料溶液中培养后,可以计算菌株的细胞数。作为一种快速、可靠的风险评估初步试验,费氏弧菌(V.fischeri)已通过生物发光法被广泛用于急性毒性评估[65]。通过将费氏弧菌暴露在各种染料溶液中仅需15 min,就可以快速获得发光率(发光抑制)[64-65]。从短时间内的发光率变化来判断毒性,只能作为筛选测试,而降解后的产品慢性毒性则无法判断。
藻类作为浮游植物存在于淡水中,通常作为慢性毒性评价的模型[63]。除了叶绿素a外,还可以在一系列的染料溶液处理中记录藻类密度(细胞数),从中可以得到72或96 h内的生长效果(对生物量的影响和对生长速度的影响)。大量应用的藻类物种包括剑鱼草[63]、小球藻[66]和角鲨[64],以甲壳动物大型溞作为常见的淡水模型,通过记录大型溞的死亡情况,可以在24或48 h内获得急性毒性结果[63]。对于植物和种子,可以通过观察发芽率、根长和芽高以及叶绿素含量来判断其毒性程度(植物毒性)[67]。种子在试验前必须提前清洗,以避免在发芽和生长过程中受到污染。此外,斑马鱼也常被用来进行毒性评估:斑马鱼胚胎透明,并且经历了外植体的形成,使得活体感知非常方便;另外,胚胎的生长和发育相对较快,对水质要求不严格;不过,斑马鱼的胚胎相对脆弱,在移植时容易损坏。
4 结论与展望
为了积极响应国家提出的“碳达峰、碳中和”的战略目标,促使从业者寻找技术上可行、高效和低成本的手段来处理染料废水。虽然厌氧-好氧生物处理是当前的常规技术,但其缺点也显而易见,如处理时间长、能耗高和剩余污泥量大等。漆酶-介体的脱色与脱毒过程具有催化效率高、反应条件温和及不产生污泥等特点,可作为染料废水的预处理而缓解上述缺点,其进一步结合活性污泥工艺有望实现印染废水的高效低碳处理。
尽管漆酶对模拟废水的脱色与脱毒效率较高,但应用于复杂多变的工业废水则明显受限,废水中含有的染料、精炼剂、乳化剂、洗涤剂溶剂、表面活性剂、固色剂、增稠剂、软化剂和其他难处理的有机物均会降低酶促反应效率。因此,未来的研究可从以下几个方面开展:①寻找高效处理不同类型染料废水的漆酶-介体系统(LMS),研究该体系如何作为预处理手段并联合好氧活性污泥法进而减少能耗与污泥产量;②利用酶的固定化技术提高酶的稳定性并重复使用,提升回收效率;③筛选高产漆酶活力菌株,在特定条件下对印染废水进行脱色和脱毒。
