催化光度法测定伊文思蓝褪色反应速率常数
——推荐一个物理化学新实验
2023-12-11徐俊晖戢凌俊孙琳杨玉蓉钟敏王亚珍
徐俊晖,戢凌俊,孙琳,杨玉蓉,钟敏,王亚珍
江汉大学光电材料与技术学院,武汉 430056
丙酮碘化反应是物理化学实验课程内的一个重要实验项目[1],但在教学过程中常存在由于反应速率较快、实验数据采集麻烦[2],以及碘水溶性差、易附着在容量瓶及比色皿内壁不易清洗等问题。作为复杂反应动力学研究的一个经典学生实验,自将测量方法从目视比色法或滴定法改成分光光度法后[3,4],很少有人探讨本实验的进一步改进措施或者替代方案。催化动力学光度法是在普通光度法基础上发展起来的一种高灵敏度分析方法,其基本原理是:基于反应速率与具有催化效果的待测物浓度之间的定量关系,通过测量与反应速率成比例的吸光度来计算待测物的浓度[5]。催化动力学光度法一般用于物质浓度分析,较少用于化学动力学的研究。本实验基于催化动力学光度法的原理,提出了一个亚硝酸钠作用下溴酸钾氧化伊文思蓝褪色反应体系,通过测量不同初始浓度及温度下反应系统吸光度的变化来计算相应的化学反应速率常数,可以促进学生对影响化学反应速率的因素、活化能、催化作用等动力学知识的理解。另外,所用染料水溶性好、分子量大、溶液配制方便,而且反应速率可以通过改变亚硝酸钠浓度来调控,在实际教学中可以便于学生记录实验数据,提高实验效率。
1 教学内容
1.1 实验目的
(1) 查阅文献,了解催化光度法的基本原理;
(2) 熟悉超级恒温槽、紫外-可见分光光度计的使用方法;
(3) 掌握测定伊文思蓝褪色反应表观速率常数和表观活化能的方法。
1.2 实验原理
伊文思蓝(Evans Blue,EB)是一种人工合成的水溶性偶氮类染料,其结构如图1所示。在酸性介质中,伊文思蓝能被溴酸钾氧化褪色。在室温下反应速率非常慢,反应可表示为:
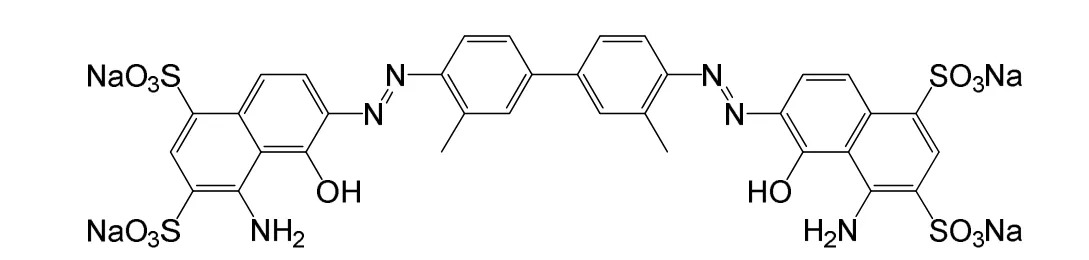
图1 伊文思蓝(EB)
若有微量亚硝酸根存在,则反应速率显著增加。结合关于催化光度法研究的相关报道[6,7]可知,存在亚硝酸根时,除存在上述反应外,可能涉及的反应还有:
该反应的机理非常复杂。实验证实,在一定反应物浓度范围内,该反应在初期对伊文思蓝和溴酸钾均近似为一级。当溴酸钾大大过量时,其浓度在反应过程中基本不变,可合并到表观速率常数里,则速率方程可表示为:
或
式中:[EB]0为t= 0时伊文思蓝的浓度,[EB]为t时刻伊文思蓝的浓度。伊文思蓝及其氧化产物在可见光区有宽的吸收带,在此吸收带中硫酸、溴酸钾、亚硝酸钠等没有明显的吸收,因此可通过系统吸光度的变化来度量反应的进程。
按朗伯-比尔定律,在较低的浓度范围内,伊文思蓝及其氧化产物的吸光度分别与其浓度成正比,反应系统的吸光度则为两者贡献之和。若反应时间为0、t、∞时溶液的吸光度分别为A0、At、A∞,b为溶液厚度(光径长度),则
可知A0-A∞= (ε1-ε2)b[EB]0、At-A∞= (ε1-ε2)b[EB],代入公式(8)有
将上式改写成:
由式(10)可以看出,如以ln(At-A∞)对t作图可得一条直线,根据其斜率即可求得反应的表观速率常数k。其中,A∞可通过测量存在过量NaNO2时,反应一段时间后系统的吸光度获得。
在其他条件不变的情况下,改变溴酸钾浓度,以lnk对lnc(KBrO3)作图拟合直线,可根据该直线斜率确定溴酸钾的分级数。
若由实验求得不同温度下的反应速率常数,根据公式(11),可计算反应的表观活化能:
1.3 实验仪器和试剂
主要仪器:721E型可见分光光度计(带恒温夹套) (上海光谱仪器有限公司),超级恒温槽(南京桑力电子设备厂),电子分析天平(上海精密仪器仪表有限公司)。
主要试剂:浓硫酸、亚硝酸钠、溴酸钾、抗坏血酸等均为分析纯,伊文思蓝为色谱纯,均购于国药集团化学试剂有限公司。
1.4 实验步骤
1.4.1 溶液的配制
分别配制0.5 mol·L-1硫酸、0.5 g·L-1伊文思蓝、0.1 mol·L-1溴酸钾、5 mg·L-1亚硝酸钠储备溶液。向25 mL比色管中,依次加入蒸馏水20 mL、0.5 mol·L-1硫酸溶液0.50 mL、0.5 g·L-1伊文思蓝溶液0.60 mL、0.1 mol·L-1溴酸钾溶液1.0 mL,适当摇匀溶液后加入5 mg·L-1亚硝酸钠溶液0.50 mL并开始计时,用蒸馏水定容。根据需要在此基础上改变溶液用量,配制其他组成的反应溶液进行测量。
1.4.2 吸收曲线的测量
按照上述方法分别配制以下各组成的反应溶液:
(a) 0.01 mol·L-1硫酸 + 12 mg·L-1伊文思蓝;
(b) a + 4 mmol·L-1溴酸钾;
(c) b + 0.1 mg·L-1亚硝酸钠;
(d) b + 1 mg·L-1亚硝酸钠。
静置反应20 min后,加入少量抗坏血酸使反应停止,取样加入到1 cm比色皿中,在440-760 nm范围内,采用721E型可见分光光度计依次测量吸收曲线,波长测量间隔为10 nm。
1.4.3 反应速率常数的测量
为了解决粮食水分及质量检测方面的问题,应当从引进先进的检测设备、技术和人员方面入手,提升粮食检测方面的科学性、准确性及有效性,为后续的粮食管理工作提供参考性数据[11]。有条件的企业应当结合自身的粮食仓储类型进行新型检测设备的研发,结合现有的检测设备及技术,对其中存在的问题进行处理和改良,对粮食当中的水分及其他成分进行测量,结合测量结果给出科学的粮食存储方案,避免粮食由于存储方面的问题而变质,造成成本流失[12]。
在恒温25 °C、选定的工作波长下,维持其他组分浓度不变,分别测量溴酸钾溶液用量为0.25、0.50、1.0、2.0 mL时吸光度随时间的变化,一般间隔0.5-1 min记录吸光度数值,一共记录10-20 min,若反应较慢时增大时间间隔并延长记录时间。按照类似方法分别测量亚硝酸钠溶液用量为0、0.10、0.20、0.50、1.0、2.0 mL时吸光度随时间的变化。
1.4.4 活化能的测量
分别将恒温槽温度设定为25、35、45 °C,测量不同温度下当亚硝酸钠溶液用量分别为0及0.50 mL时吸光度随时间的变化。
1.5 注意事项
(1) 硫酸溶液的配制应在通风橱中进行,搅拌下缓慢将浓硫酸加入水中;(2) 亚硝酸钠溶液采用逐级稀释法配制;(3) 配制反应溶液时,蒸馏水、储备溶液以及比色皿均需要预恒温;(4) 测量吸收曲线时,每次改变波长后均需重新校正分光光度计。
2 实验组织运行安排
2.1 开设对象及学时安排
本实验以物理化学中的化学动力学理论为基础,面向化工、材料、药学、环境等专业的二年级本科生开设,学生一般2人为一小组;共计12学时,分3次课完成,每次课主要内容为:第一次课,教师讲授实验原理和方法并检查学生预习情况,学生实验内容包括测量吸收曲线、改变溴酸钾初始浓度进行动力学测量;第二次课,学生实验内容为改变亚硝酸钠的初始浓度进行动力学测量;第三次课,学生实验内容为改变温度进行动力学测量。
2.2 实验预习要求
实验教学开始前,要求学生查阅资料,完成如下预习要求:(1) 复习反应级数的确定、活化能、催化剂等化学动力学相关知识;(2) 了解伊文思蓝的性质,理解催化动力学光度法的基本原理;(3) 了解721E型分光光度计的使用方法;(4) 计算溶液配制所需各试剂和溶液的用量,撰写预习报告。
2.3 实验数据处理要求
(1) 绘制不同反应溶液的吸收曲线,确定工作波长;(2) 根据不同溴酸钾初始浓度下的动力学数据绘图,推导伊文思蓝和溴酸钾的分级数;(3) 根据不同亚硝酸钠初始浓度下的动力学数据,绘图并计算反应速率常数,讨论亚硝酸钠对反应的加速作用;(4) 根据不同温度下的动力学数据计算活化能。
3 结果与讨论
3.1 不同反应溶液的吸收曲线
伊文思蓝的硫酸溶液呈蓝色。不同反应系统的吸收曲线如图2所示。从图中可以看出,伊文思蓝在可见光区有很宽的吸收带,最大吸收波长约610 nm,在后续动力学测量中选择该值为工作波长;存在溴酸钾时吸收略有减小,说明反应较慢;若同时存在亚硝酸钠,实验中观察到溶液逐渐变为蓝紫色,吸收曲线形状基本不变,但吸光度显著下降,说明反应速率较快;若存在高浓度亚硝酸钠,溶液颜色迅速从蓝色变成淡紫红色,说明反应速率非常快,吸收曲线形状明显变化,最大吸收波长紫移至约520 nm,吸光度大大下降。以上结果表明亚硝酸根能显著加速伊文思蓝的褪色反应。由于存在1 mg·L-1亚硝酸钠时,氧化产物在610 nm也有一定的光吸收但基本不再随时间变化(约为0.1),因此可近似认为反应完全,溶液吸光度可视为A∞。

图2 不同反应溶液的吸收曲线
3.2 反应级数的确定
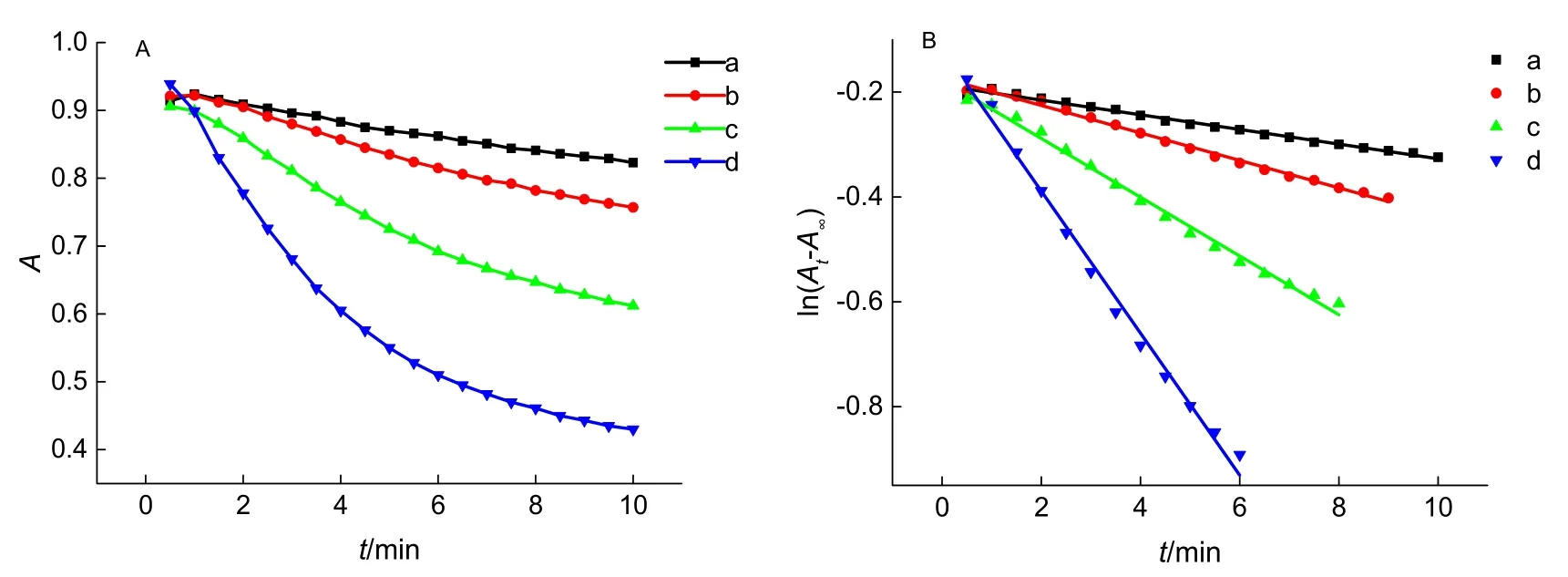
图3 KBrO3浓度的影响
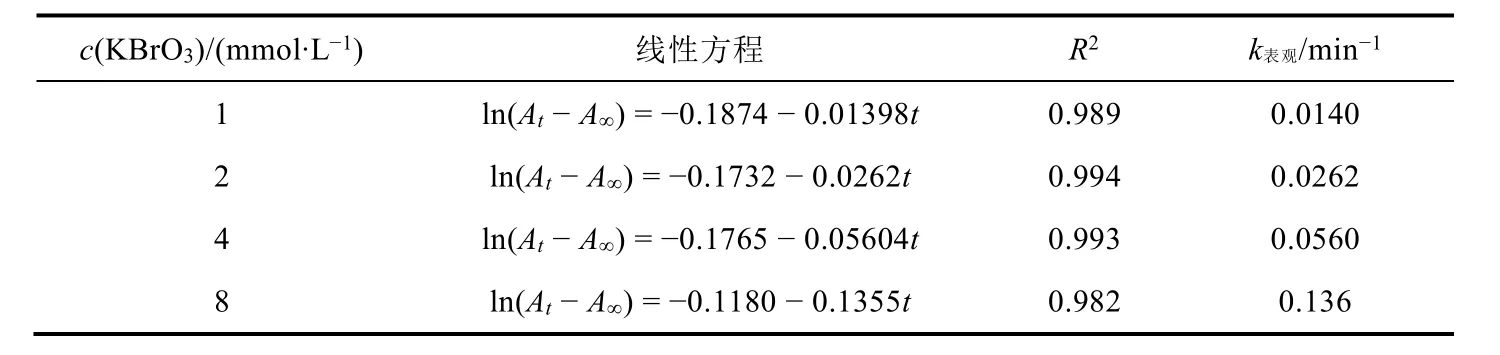
表1 不同KBrO3初始浓度下的表观反应速率常数
3.3 亚硝酸钠的影响
不同亚硝酸钠浓度下反应溶液吸光度随时间的变化情况如图4A所示。没有亚硝酸钠存在时反应速率很小;加入亚硝酸钠后,溶液吸光度下降速率随其浓度增加而迅速增加。ln(At-A∞)与反应时间呈较好直线关系(图4B),根据各直线的斜率可以求得相应的表观反应速率常数,结果见表2。在较低亚硝酸钠浓度范围内,表观速率常数与其浓度基本呈线性关系,进一步说明亚硝酸根对伊文思蓝的褪色反应具有加速作用。在本反应中,亚硝酸根参与反应的具体机理尚待进一步证实,但是亚硝酸根能显著加速溴酸钾氧化伊文思蓝的反应,说明亚硝酸根参与了反应,改变了反应途径,起到了类似于催化剂的作用。
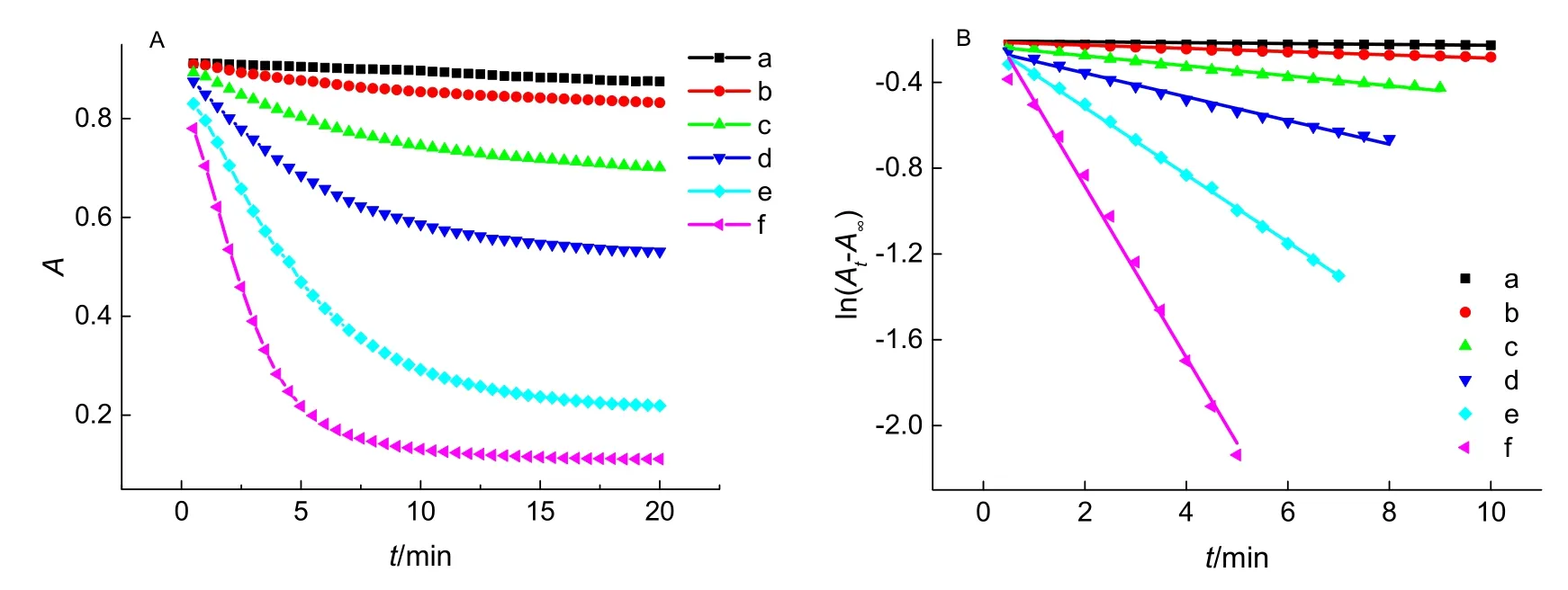
图4 NaNO2浓度的影响
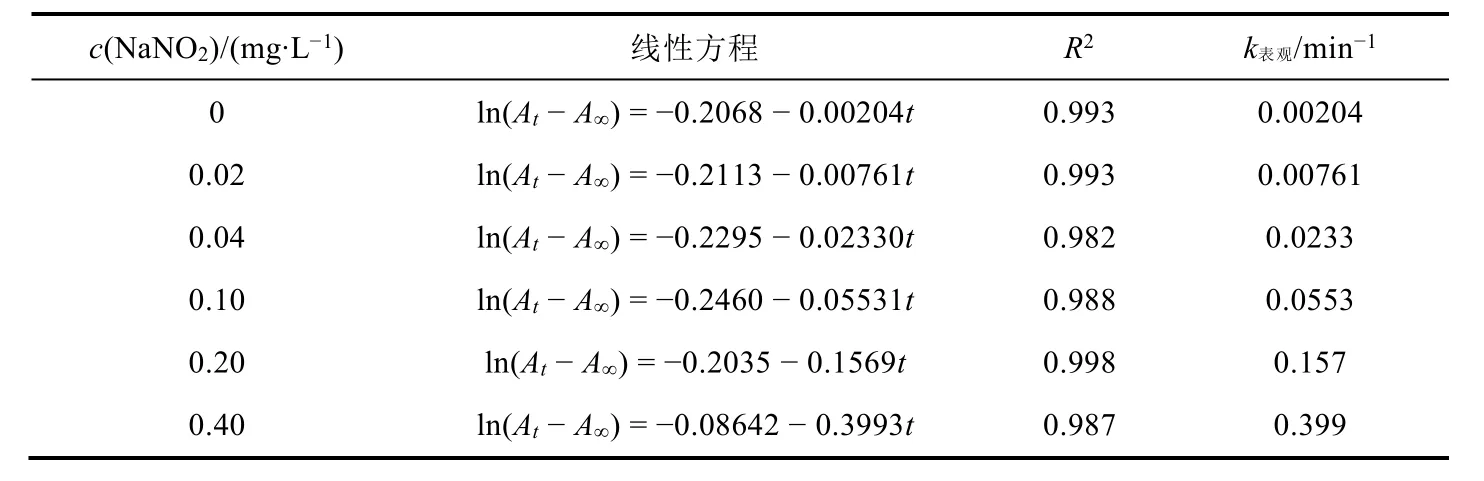
表2 不同NaNO2初始浓度下的表观反应速率常数
3.4 活化能的计算
图5A给出了含或不含亚硝酸钠时反应溶液吸光度随时间的变化关系。在研究的温度范围内,随着温度升高,两种反应系统吸光度下降速率均加快。由ln(At-A∞)对反应时间拟合直线斜率的变化,更直观反映了温度对表观反应速率常数的影响(见图5B)。根据各直线的斜率可以求得相应的表观反应速率常数,结果见表3;将不同温度下的表观速率常数代入公式(11),可以计算得两种反应体系的活化能;活化能的参考值分别约为71 kJ·mol-1和45 kJ·mol-1,说明加入亚硝酸钠后改变了反应途径,活化能显著下降。
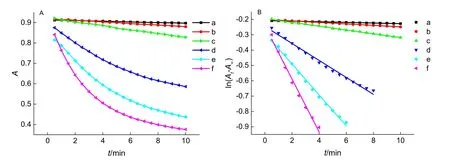
图5 温度的影响

表3 不同温度下两种反应系统的表观反应速率常数
4 教学效果和反思
本实验已于2022年春季和秋季分别应用于化工、新能源材料与器件等专业物理化学实验课程的教学,累计6个班217名学生参加了学习。从实验完成情况来看,约78%的学生能在规定的时间内完成实验,不能顺利完成实验的主要原因是溶液配制操作不熟练,甚至出错导致重做。由于在第一次课时学生的操作相对不够熟练,将前两次课安排在同一天上下午进行,有利于学生合理分配时间,提高实验效率;若多个班级连续进行该实验,由指导教师事先配制好储备溶液可以明显提高学生的完成度,并较好地提高学生实验数据的一致性。
从实验结果来看,所有同学都能得出该反应在初始阶段对伊文思蓝和溴酸钾均近似为一级、亚硝酸根对反应有加速作用等正确结论;与活化能参考值相比,约52%的学生实验结果相对误差低于20%,约87%的学生实验结果相对误差低于50%。在同学期进行的丙酮碘化反应实验中,反应初始时刻系统的吸光度就比较小,且由于要在碘浓度适中的基础上保证催化剂及丙酮大大过量,反应速率在室温时就比较快,若反应温度较高,学生配制反应溶液操作稍慢就难以记录到足够的有效实验数据;与之相比,本实验中反应速率可以通过改变亚硝酸钠浓度来调控,从而在温度较高时仍有比较适中的反应速率,学生更容易顺利记录实验数据。其次,在没有催化剂时丙酮碘化反应速率极慢,很难通过实验来求算反应活化能,学生对加入催化剂前后活化能的变化幅度缺乏直观认识;而本实验中不存在亚硝酸钠时仍有一定的反应速率,且活化能比较适中,可以通过不同温度下的实验数据来求算反应活化能,有助于学生进一步理解催化剂改变反应途径、降低活化能的内涵。最后,在丙酮碘化反应实验中碘残留污染比色皿的现象比较严重,而本实验中使用的伊文思蓝水溶性非常好,基本不存在比色皿被污染变色的现象,有利于重复使用。从以上分析来看,本实验可望在适当简化后作为丙酮碘化反应实验的替代项目。
本实验涵盖了简单级数反应的动力学特征、反应级数的确定方法、活化能、催化动力学等众多知识点,并涉及较多化学试剂的规范使用、溶液配制的规范操作等内容,以及大量的实验数据处理。学生通过本实验的学习,加深了对上述理论知识的理解和实验操作技能的掌握,并能锻炼运用专业软件处理实验数据的能力。在实验教学过程中适当介绍亚硝酸盐等的危害,有利于引导学生养成绿色化学思维。本实验将化学动力学的理论知识与化学实验实践技能有机结合,促进了学生严肃认真、积极探索的科学态度的形成以及分析问题、解决问题能力的培养;在教学过程中,筛选了3名优秀学生参加了第三届化学实验创新设计大赛,荣获华中赛区竞赛一等奖。
5 结语
本文以伊文思蓝为指示剂,提出了一个基于催化光度法的动力学实验项目。在反应初始阶段,溴酸钾氧化伊文思蓝反应对溴酸钾和伊文思蓝均近似为一级,亚硝酸根的加入大大降低了反应的活化能,对该反应有显著的加速效果。教学实践结果表明,本实验可繁可简,既可作为综合研究性物理化学实验项目,又可简化替代经典的复杂反应动力学实验项目——丙酮碘化反应。通过本实验的教学,不仅能促进学生对反应级数的确定方法、浓度对化学反应速率的影响以及活化能的理解,还能加强学生对催化剂“改变反应途径,降低活化能”的理解。
