干燥方式对三七叶主要活性成分、体外抗氧化、α-葡萄糖苷酶抑制活性、挥发性成分和代谢物的影响
2023-12-11李云嵌何霞红吴光顺满金花张雪春王振兴
李云嵌,何霞红,吴光顺,满金花,张雪春,王振兴,*
(1.西南林业大学 云南省林下资源保护与利用重点实验室,西南山地森林资源保育与利用教育部重点实验室,云南 昆明 650224;2.西南林业大学生命科学学院,云南 昆明 650224)
三七(Panax notoginseng(Burk.) F. H. Chen)为五加科人参属多年生草本植物,主产于云南省文山州,主要以其干燥根茎入药,具有化瘀止血、活血镇痛等功效,是我国传统名贵中药材[1]。三七叶(P. notoginsengleaves,PNL)是三七地上主要部分,也是三七生产的主要副产物,其富含皂苷、多酚、多糖、黄酮等活性成分,具有很高的食用和药用价值[1]。云南当地一直有食用PNL的传统,2016年云南省卫生计生委正式批复同意将其作为普通地方特色食品原料[2]。《本草纲目》记录PNL具有“治折伤、跌扑出血,敷之即止,青肿经夜即散,余功同根”的功能,现代药理学研究表明其具有抗炎、抗氧化、抗衰老、止血等功效[1,3]。Liu Fang等[4]利用超高效液相色谱-四极杆-飞行时间串联质谱从PNL甲醇提取物中检测到人参皂苷Rb1、Rc、Rb2、Rb3以及三七皂苷Fc、Fe、Fd。但目前大部分PNL未被利用,常被丢弃,造成PNL资源的极大浪费。三七的主要收获季节集中在每年10月至次年1月,此间采收的大量新鲜PNL水分含量较高,采摘后容易发生萎蔫、腐烂,极大地限制了PNL的贮藏和加工利用。干燥是一种最常见的植物采摘后预处理和加工贮藏手段,对PNL进行及时的干燥处理可避免其品质劣变,有效延长其保藏时间,有利于其运输和加工,对PNL的综合利用有重要意义。目前已有学者利用干燥PNL开发了气泡水饮料[5]、醋[6]、桃酥[7]等产品。
在干燥过程中,植物原料中的热敏性成分在热、光等作用下会发生不同程度的降解与转化[8]。不同干燥方式的处理条件和干燥机理不一致,因此具有不同的干燥效果,使得原料的化学成分、生物活性及感官特征存在差异。此外,干燥方式也影响着原料的挥发性成分以及代谢物的种类和含量。林羡等[9]比较了热风干燥(hot air drying,HAD)、真空微波干燥及真空冷冻干燥对辣木叶营养活性成分、抗氧化活性及色泽的影响,结果表明真空微波干燥更适合作为辣木叶的干燥方式。赵珊等[10]研究发现真空冷冻干燥和蒸干结合HAD的甘薯叶中总酚含量(total phenolic content,TPC)和总黄酮含量(total flavonoids content,TFC)较高,且具有较强的抗氧化能力。真空冷冻干燥、远红外干燥等新型干燥方式虽然可较好地保持样品的品质和活性,但存在设备昂贵或加工成本高等缺点。传统晒干处理的干燥效率较低,产品质量不佳,且受天气影响较大。HAD、真空干燥(vacuum drying,VD)、热泵干燥(heat pump drying,HPD)等基于热加工的干燥处理方式凭借设备简单、效率高、成本低等特点,仍是目前较常用的处理手段。安朝丽门等[11]研究了HAD、HPD和微波干燥对滑子蘑中滋味物质的影响;王兆凯等[12]综述了预处理与干燥方式对枸杞干燥特性及品质的影响,结果表明HPD可同时控制干燥湿度和干燥环境气体种类,可替代商业生产中的传统太阳能干燥及HAD。但目前关于干燥方式尤其是热处理对PNL的化学成分、功能活性、挥发性成分等方面的影响鲜有报道。
本研究以新鲜PNL为原料,分别采用HAD、HPD、VD对其进行干燥处理,测定不同干燥方式下PNL的主要化学成分含量、体外抗氧化活性和α-葡萄糖苷酶抑制活性,采用高效液相色谱法(high-performance liquid chromatography,HPLC)分析单体皂苷含量,并采用气相色谱-离子迁移谱联用(gas chromatography-ion mobility spectrometry,GC-IMS)分析不同干燥方式对其挥发性成分的影响,从而筛选出PNL的最适干燥方式,然后使用基于超高效液相色谱-四极杆-轨道阱质谱联用技术的非靶向代谢组学分析干燥前后PNL的代谢物变化情况,对差异代谢物进行京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)分析,探讨PNL在干燥过程中可能的代谢途径,以期为PNL的干燥提供理论依据。
1 材料与方法
1.1 材料与试剂
新鲜PNL于2021年11月采收于云南省昆明市寻甸县羊街镇丰乐林下三七种植基地,选择长度范围为5~9 cm、宽度范围为3~4 cm的叶片用于实验。
纤维素酶(50 U/mg) 山东西亚化学工业有限公司;没食子酸 天津市大茂化学试剂厂;果胶酶(500 U/mg)、D(+)-无水葡萄糖(纯度≥98%)、2,2’-联氮-双-3-乙基苯并噻唑啉-6-磺酸(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)、阿卡波糖、对硝基苯基-α-D-吡喃葡萄糖苷(4-nitrophenylα-D-glucopyranoside,PNPG)、VC、三七总皂苷(P. notoginsengleaves saponins,PNLS)(纯度≥90%)、人参皂苷Rb1(纯度≥98%)、人参皂苷Rb3(纯度≥97%)、三七皂苷Fc(纯度≥98%)、三七皂苷Fe(纯度≥98%) 上海源叶生物科技有限公司;α-葡萄糖苷酶(700 000 U/mL) 北京索莱宝科技有限公司;芦丁(纯度≥95%)、2,4,6-三(2-吡啶基)三嗪(2,4,6-tripyridin-2-yl-1,3,5-triazine,TPTZ) 上海阿拉丁生化科技股份有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 西格玛奥德里奇(上海)贸易有限公司;2,6-二叔丁基对甲酚(2,6-di-tert-butyl-4-methylphenol,BHT) 上海麦克林生化科技有限公司;其余试剂均为国产分析纯。
1.2 仪器与设备
DHG-9240A电热恒温鼓风干燥箱 上海齐欣科学仪器有限公司;FD-304真空冷冻干燥机 济南骏德仪器有限公司;DNF-4K智能热泵烘干设备 北京东南风科技有限公司;DZF-6090真空干燥箱 上海一恒科学仪器有限公司;SB-400DTY超声波清洗机 宁波新芝生物科技股份有限公司;SHZ-D(III)循环水式真空泵 巩义市予华仪器有限责任公司;旋转蒸发仪 艾卡(广州)仪器设备有限公司;Infinite F50酶标仪 帝肯(上海)贸易有限公司;SC-80色差计 北京康光光学仪器有限公司;DZKW-4电热恒温水浴锅 北京中兴伟业仪器有限公司;1260 HPLC仪 安捷伦科技(中国)有限公司;Flavour Spec®风味分析仪 德国G.A.S.公司;Nexera X2 LC-30AD超高压液相色谱仪 日本岛津公司;Q Exactive Plus高分辨质谱仪 赛默飞世尔科技(中国)有限公司;Concentrator plus真空离心浓缩仪 艾本德中国有限公司。
1.3 方法
1.3.1 PNL的不同干燥处理
分别称取150 g左右的新鲜PNL,将其平铺于不锈钢托盘内进行不同干燥处理,厚度约为0.3 cm,干燥至水分质量分数10%以下,为保证干燥充分和统一干燥条件,所有干燥处理均在50 ℃下进行24 h,为排除各样品组之间因水分质量分数不同造成的差异,后续所有计算均以样品的干质量计。样品分组如下:1)新鲜(fresh,F)组,新鲜未经处理的PNL;2)VD组,将PNL置于真空干燥箱中,温度50 ℃,真空度65 Pa,干燥时间24 h,粉碎并过60 目筛后备用;3)HPD组,将PNL置于智能热泵烘干设备中,温度50 ℃,相对湿度0~5%,风速0.8 m/s,干燥时间24 h,粉碎并过60 目筛后备用;4)HAD组,将PNL置于电热鼓风干燥箱中,温度50 ℃,干燥时间24 h,风速0.8 m/s,粉碎并过60 目筛后备用。
1.3.2 水分质量分数的测定
采用GB 5009.3—2016《食品安全国家标准 食品中水分的测定》[13]中的直接干燥法测定水分质量分数。
1.3.3 色泽的测定
使用色差仪分别测定新鲜PNL和干燥PNL的色泽(L*值(亮度)、a*值(红绿度)、b*值(黄蓝度)),按式(1)计算色差ΔE。
式中:L*、a*、b*值分别为PNL干燥处理后的亮度、红绿度、黄蓝度;值分别为新鲜PNL的亮度、红绿度、黄蓝度。
1.3.4 PNL提取物的制备
采用超声波辅助复合酶解法提取PNL中的活性成分[14]。将不同处理组的PNL粉末按料液比1∶8(m/V)加入蒸馏水,使用1 mol/L的盐酸调节pH值至4.5后加入质量分数为0.03%的纤维素酶和质量分数为0.028%的果胶酶,50 ℃水浴超声(160 W、40 kHz)酶解2 h,然后按料液比1∶32(m/V)加入无水乙醇,同样条件下超声提取1 h,抽滤后滤渣按料液比1∶40(m/V)加入体积分数80%的乙醇溶液,重复提取1 次。合并2 次滤液,于50 ℃下真空浓缩至浸膏,冻干,即得到PNL提取物,使用时用体积分数80%乙醇溶液配制成合适的质量浓度。
1.3.5 PNLS含量的测定
采用香草醛-高氯酸-冰乙酸法测定PNLS含量[15]。取40 μL样品溶液置于80 ℃水浴锅恒温加热,蒸干溶剂后加入20 μL 50 g/L香草醛-冰乙酸溶液和80 μL高氯酸,60 ℃水浴恒温15 min,冰浴5 min后加入200 μL冰乙酸停止反应,在540 nm波长处测定吸光度。在同等条件下测定质量浓度分别为10、50、100、150、200、250、300 μg/mL PNLS溶液的吸光度,以PNLS质量浓度为横坐标,吸光度为纵坐标,得到标准曲线方程Y=2.525 2X+0.003 4(R2=0.996 6),根据标准曲线方程计算PNLS含量。
1.3.6 多糖含量的测定
采用苯酚-硫酸法测定PNL多糖(P. notoginsengleaves polysaccharide,PNLP)含量[16]。取50 μL样品溶液,加入50 μL 50 g/L苯酚溶液,随后缓慢加入250 μL浓硫酸,于40 ℃恒温水浴10 min,冷却后于490 nm波长处测定吸光度。在同等条件下测定质量浓度分别为20、40、60、80、100 μg/mLD(+)-无水葡萄糖溶液的吸光度,以D(+)-无水葡萄糖质量浓度为横坐标,吸光度为纵坐标,得到标准曲线方程Y=3.981 3X+0.029 8(R2=0.995 9),根据标准曲线方程计算PNLP含量。
1.3.7 TPC的测定
采用福林-酚法测定TPC[17]。取50 μL样品溶液,加入125 μL 0.1 mol/L福林-酚溶液,最后加入100 μL 75 g/L Na2CO3溶液,避光反应30 min后于765 nm波长处测定吸光度,以100 μL蒸馏水代替Na2CO3溶液作为样品对照组。在同等条件下测定质量浓度分别为20、40、60、80、100 μg/mL没食子酸溶液的吸光度,以没食子酸质量浓度为横坐标,吸光度为纵坐标,得到标准曲线方程Y=0.010 7X+0.003(R2=0.997 5),根据标准曲线方程计算TPC。
1.3.8 TFC的测定
采用NaNO2-Al(NO3)3法测定TFC[18]。取40 μL样品溶液,加入20 μL 50 g/L NaNO2溶液,室温反应6 min,加入20 μL 100 g/L Al(NO3)3溶液,室温反应6 min,加入140 μL 40 g/L NaOH溶液,室温反应15 min,于510 nm波长处测定吸光度。以体积分数80%乙醇溶液代替同样体积的NaNO2溶液、Al(NO3)3溶液和NaOH溶液作为样品对照组。在同等条件下测定质量浓度分别为10、20、40、60、80、100 μg/mL芦丁溶液的吸光度,以芦丁质量浓度为横坐标,吸光度为纵坐标,得到标准曲线方程Y=0.001 3X-0.005 4(R2=0.99),根据标准曲线方程计算TFC。
1.3.9 HPLC分析
1.3.9.1 标准品及样品溶液的制备
精准称取人参皂苷Rb1、Rb3和三七皂苷Fc、Fe标准品各1 mg,使用色谱级甲醇配制成质量浓度为500 μg/mL的混合标准品母液,再稀释成质量浓度分别为50、100、200、300、400 μg/mL的标准品溶液,备用。分别称取不同方式干燥PNL提取物20 mg,使用色谱级甲醇配制质量浓度为20 mg/mL的样品溶液,备用。
1.3.9.2 HPLC条件
按照1.3.9.1节方法配制标准品溶液和PNL提取物溶液,过0.22 μm有机系滤膜,采用HPLC法分析不同处理组PNL中皂苷的分布情况。色谱柱为Silgreen C18(4.6 mm×250 mm,5 μm);流动相为乙腈(A)和体积分数0.1%甲酸溶液(B);检测波长为203 nm;质量分数10%以下,为保证干燥充分和统一干燥条件,所有干燥处理均在50 ℃下进行24 h,为排除各样品组之间因水分质量分数不同造成的差异,后续所有计算均以样品的干质量计。样品分组如下:1)新鲜(fresh,F)组,新鲜未经处理的PNL;2)VD组,将PNL置于真空干燥箱中,温度50 ℃,真空度65 Pa,干燥时间24 h,粉碎并过60 目筛后备用;3)HPD组,将PNL置于智能热泵烘干设备中,温度50 ℃,相对湿度0~5%,风速0.8 m/s,干燥时间24 h,粉碎并过60 目筛后备用;4)HAD组,将PNL置于电热鼓风干燥箱中,温度50 ℃,干燥时间24 h,风速0.8 m/s,粉碎并过60 目筛后备用。
1.3.2 水分质量分数的测定
采用GB 5009.3—2016《食品安全国家标准 食品中水分的测定》[13]中的直接干燥法测定水分质量分数。
1.3.3 色泽的测定
使用色差仪分别测定新鲜PNL和干燥PNL的色泽(L*值(亮度)、a*值(红绿度)、b*值(黄蓝度)),按式(1)计算色差ΔE。
式中:L*、a*、b*值分别为PNL干燥处理后的亮度、红绿度、黄蓝度;值分别为新鲜PNL的亮度、红绿度、黄蓝度。
1.3.4 PNL提取物的制备
采用超声波辅助复合酶解法提取PNL中的活性成分[14]。将不同处理组的PNL粉末按料液比1∶8(m/V)加入蒸馏水,使用1 mol/L的盐酸调节pH值至4.5后加入质量分数为0.03%的纤维素酶和质量分数为0.028%的果胶酶,50 ℃水浴超声(160 W、40 kHz)酶解2 h,然后按料液比1∶32(m/V)加入无水乙醇,同样条件下超声提取1 h,抽滤后滤渣按料液比1∶40(m/V)加入体积分数80%的乙醇溶液,重复提取1 次。合并2 次滤液,于50 ℃下真空浓缩至浸膏,冻干,即得到PNL提取物,使用时用体积分数80%乙醇溶液配制成合适的质量浓度。
1.3.5 PNLS含量的测定
采用香草醛-高氯酸-冰乙酸法测定PNLS含量[15]。取40 μL样品溶液置于80 ℃水浴锅恒温加热,蒸干溶剂后加入20 μL 50 g/L香草醛-冰乙酸溶液和80 μL高氯酸,60 ℃水浴恒温15 min,冰浴5 min后加入200 μL冰乙酸停止反应,在540 nm波长处测定吸光度。在同等条件下测定质量浓度分别为10、50、100、150、200、250、300 μg/mL PNLS溶液的吸光度,以PNLS质量浓度为横坐标,吸光度为纵坐标,得到标准曲线方程Y=2.525 2X+0.003 4(R2=0.996 6),根据标准曲线方程计算PNLS含量。
1.3.6 多糖含量的测定
采用苯酚-硫酸法测定PNL多糖(P. notoginsengleaves polysaccharide,PNLP)含量[16]。取50 μL样品溶液,加入50 μL 50 g/L苯酚溶液,随后缓慢加入250 μL浓硫酸,于40 ℃恒温水浴10 min,冷却后于490 nm波长处测定吸光度。在同等条件下测定质量浓度分别为20、40、60、80、100 μg/mLD(+)-无水葡萄糖溶液的吸光度,以D(+)-无水葡萄糖质量浓度为横坐标,吸光度为纵坐标,得到标准曲线方程Y=3.981 3X+0.029 8(R2=0.995 9),根据标准曲线方程计算PNLP含量。
1.3.7 TPC的测定
采用福林-酚法测定TPC[17]。取50 μL样品溶液,加入125 μL 0.1 mol/L福林-酚溶液,最后加入100 μL 75 g/L Na2CO3溶液,避光反应30 min后于765 nm波长处测定吸光度,以100 μL蒸馏水代替Na2CO3溶液作为样品对照组。在同等条件下测定质量浓度分别为20、40、60、80、100 μg/mL没食子酸溶液的吸光度,以没食子酸质量浓度为横坐标,吸光度为纵坐标,得到标准曲线方程Y=0.010 7X+0.003(R2=0.997 5),根据标准曲线方程计算TPC。
1.3.8 TFC的测定
采用NaNO2-Al(NO3)3法测定TFC[18]。取40 μL样品溶液,加入20 μL 50 g/L NaNO2溶液,室温反应6 min,加入20 μL 100 g/L Al(NO3)3溶液,室温反应6 min,加入140 μL 40 g/L NaOH溶液,室温反应15 min,于510 nm波长处测定吸光度。以体积分数80%乙醇溶液代替同样体积的NaNO2溶液、Al(NO3)3溶液和NaOH溶液作为样品对照组。在同等条件下测定质量浓度分别为10、20、40、60、80、100 μg/mL芦丁溶液的吸光度,以芦丁质量浓度为横坐标,吸光度为纵坐标,得到标准曲线方程Y=0.001 3X-0.005 4(R2=0.99),根据标准曲线方程计算TFC。
1.3.9 HPLC分析
1.3.9.1 标准品及样品溶液的制备
精准称取人参皂苷Rb1、Rb3和三七皂苷Fc、Fe标准品各1 mg,使用色谱级甲醇配制成质量浓度为500 μg/mL的混合标准品母液,再稀释成质量浓度分别为50、100、200、300、400 μg/mL的标准品溶液,备用。分别称取不同方式干燥PNL提取物20 mg,使用色谱级甲醇配制质量浓度为20 mg/mL的样品溶液,备用。
1.3.9.2 HPLC条件
按照1.3.9.1节方法配制标准品溶液和PNL提取物溶液,过0.22 μm有机系滤膜,采用HPLC法分析不同处理组PNL中皂苷的分布情况。色谱柱为Silgreen C18(4.6 mm×250 mm,5 μm);流动相为乙腈(A)和体积分数0.1%甲酸溶液(B);检测波长为203 nm;体积分数80%甲醇溶液,冰浴超声30 min后-20 ℃静置2 h,然后在4 ℃环境下离心(16 000×g、20 min)取上清液。将上清液在高速真空浓缩离心机中挥发蒸干,加入100 μL体积分数50%甲醇溶液复溶,在4 ℃环境下离心(20 000×g、20 min)取上清液用于质谱分析,同时从每个样品中取等体积样品混匀制备质量控制(quality control,QC)样品,以验证系统的稳定性和可重复性。
超高效液相色谱条件:ACQUITY UPLC®HSS T3色谱柱(2.1 mm×100 mm,1.8 μm);柱温40 ℃;流动相A为0.1%甲酸溶液,流动相B为乙腈;梯度洗脱程序如下:0~2 min,0 B;2~6 min,0~48% B;6~10 min,48%~100% B;10~12 min,100% B;12~12.1 min,100%~0 B;12.1~15 min,0 B;流速0.3 mL/min;进样量6 μL。整个分析过程中样品一直置于4 ℃自动进样器中。
质谱条件:样品采用电喷雾电离(electrospray ionization,ESI)进行正离子和负离子模式检测。正离子模式喷雾电压为3 800 V,负离子模式为3 200 V;离子传输管温度为320 ℃;母离子扫描范围为m/z70~1 050 。
数据处理:原始数据采用MSDIAL软件进行峰对齐、保留时间校正和峰面积提取。代谢物结构鉴定采用精确质量数匹配(质量偏差小于20×10-6Da)和二级谱图匹配(质量偏差小于0.02 Da)的方式,检索HMDB、MassBank等公共数据库及自建数据库。对提取得到的数据,删除组内缺失值超过50%的离子峰;对正、负离子数据分别进行总峰面积归一化,整合正、负离子峰并应用R软件进行模式识别,数据经方差缩放(unit variance scaling)预处理后进行后续数据分析。
1.4 数据统计与分析
所有实验重复3 次,结果表示为平均值±标准偏差。使用Origin 2018和GraphPad Prism 8软件对数据进行计算和绘图,使用SPSS 25.0软件中的单因素方差进行差异显著性分析,以P<0.05表示样品间差异显著。使用OmicStudio云平台(https://www.omicstudio.cn/tool)和欧易集团云平台(https://cloud.oebiotech.cn/task/)进行热图、火山图、相关性以及主坐标分析。
2 结果与分析
2.1 不同干燥方式对PNL色泽和水分质量分数的影响
L*值表示明亮度(0~100表示由黑色到白色),a*值表示红绿度(正值表示红色,负值表示绿色)、b*值表示黄蓝度(正值表示黄色,负值表示蓝色),ΔE表示色差值,其值越小,说明样品的色泽与对照组的色泽越接近。由表1可知,干燥对PNL的色泽具有显著影响(P<0.05),相较于F组,3 种干燥方式均显著降低了PNL的L*值,说明干燥后PNL亮度降低;VD组的a*值与F组接近,其余两组显著降低;3 种干燥方式下b*值均显著升高。ΔE从大到小依次为HPD组>HAD组>VD组,说明相较于F组,HPD组和HAD组PNL色泽变化更为明显,而VD组色泽变化相对较小。PNL色泽的变化与干燥过程中温度、氧气浓度等因素密切相关,3 种干燥方式均在50 ℃下进行,在此温度下,样品容易发生美拉德反应及焦糖化反应等,从而导致样品色泽变得暗淡,L*值降低。此外,温度、氧气浓度等因素也会影响叶绿素的分解,从而改变样品色泽[24]。干燥可降低叶片等原料的水分质量分数,从而降低其酶活力,抑制微生物繁殖,因此可在一定程度上缓解叶片的腐败变质问题,延长其贮存期[25]。如表1所示,F组水分质量分数为84.15%,说明PNL水分质量分数较高,不利于贮藏。经干燥后,各组水分质量分数均降至10%以下,其中HAD组的水分质量分数最低。

表1 不同干燥方式对PNL色泽和水分质量分数的影响Table 1 Effects of different drying methods on the color and moisture content of PNL
2.2 不同干燥方式对PNL主要化学成分的影响
如表2所示,干燥方式对PNLS、PNLP含量及TPC、TFC均有较大影响。与F组相比,干燥组的PNLS含量更高,这是因为PNL中皂苷类成分复杂多样,而温度、酶活性等因素会促使皂苷发生脱羧、脱糖、脱水反应而发生转化,最终导致PNLS含量发生变化。王红等[26]采用超高效液相色谱-四极杆-轨道阱质谱技术研究发现人参在烘干或冻干后部分皂苷含量明显上升,但也有部分皂苷含量降低。干燥后各组PNLP含量均升高,PNLP含量依次为HPD组>HAD组>VD组,这与干燥过程中湿度、氧气浓度等因素发生变化,进而导致其溶出程度改变有关。陈璁等[27]研究发现HPD双孢蘑菇粗多糖溶出量高于HAD。相比F组,VD组的TPC显著降低(P<0.05),而HAD组和HPD组无显著变化;干燥后VD组、HAD组和HPD组的TFC均显著降低(P<0.05),其中VD组最低,可能是因为在干燥过程中,总酚、总黄酮等功能成分会受到温度、氧分压、水分活度等因素的影响,发生氧化、聚合或分解等反应[28-30]。
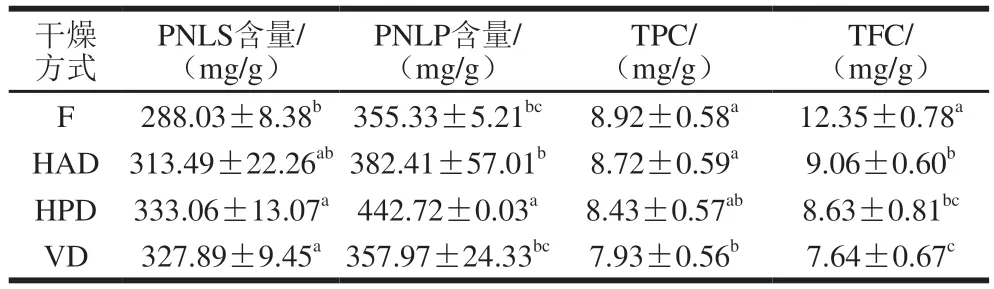
表2 不同干燥方式对PNL中主要化学成分的影响Table 2 Effects of different drying methods on major chemical components of PNL
2.3 不同干燥方式对PNL单体皂苷含量和功能活性的影响
皂苷是苷元为三萜或者螺旋甾烷类化合物的一类糖苷,具有抗炎、抗氧化、抗衰老、止血等多种功效[31]。前人研究表明PNL中含有人参皂苷Rb1、Rb3和三七皂苷Fc、Fe等多种皂苷[4]。混合标准品和不同处理组样品的HPLC图谱见附图1,通过比对峰形和保留时间,共鉴定出4 种皂苷类化合物,分别为人参皂苷Rb1、Rb3和三七皂苷Fc、Fe。如图1A、B所示,相比于F组,三七皂苷Fc、Fe含量在VD组中分别显著增加至46.40 mg/g和32.44 mg/g,在HAD组中无显著变化,但在HPD组中分别显著降低至32.41 mg/g和22.04 mg/g;此外,由图1C、D可知,3 种干燥方式对人参皂苷Rb1、Rb3的含量无显著影响。
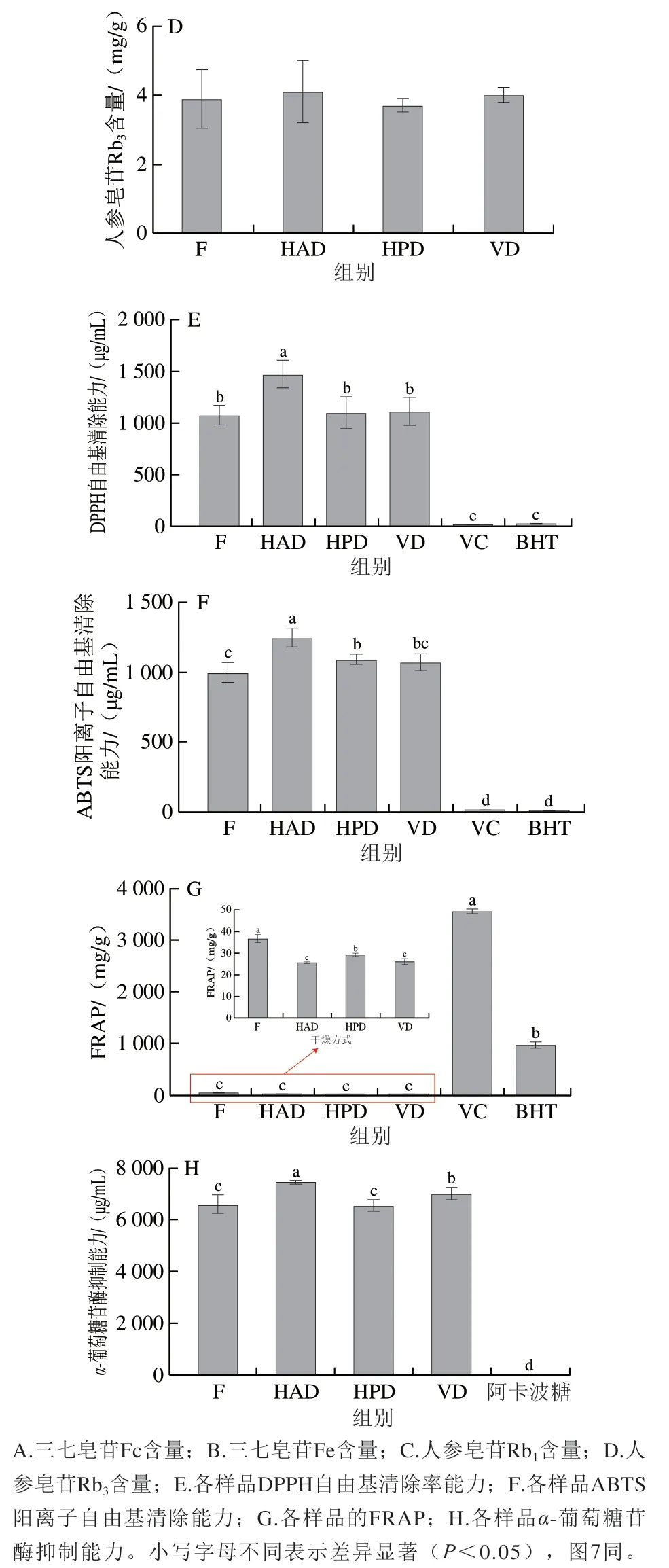
图1 不同干燥方式对PNL中皂苷含量及功能活性的影响Fig. 1 Effects of different drying methods on saponin contents and functional activities of PNL

由于抗氧化作用机理复杂,因此可选择多种不同作用原理的抗氧化方法对PNL的抗氧化能力进行综合评价[32]。由图1E、F、G可知,经干燥处理后,PNL的抗氧化能力均有不同程度的下降,其中,HPD组和VD组的DPPH自由基清除能力与F组无显著差异,HAD组显著下降,HPD组表现出最强的DPPH自由基清除能力(IC50为1 098.96 μg/mL)。此外,VD组表现出最强的ABTS阳离子自由基清除能力(IC50为1 071.65 μg/mL),与F组相当(P>0.05);HPD组ABTS阳离子自由基清除能力仅次于VD组,两者之间无显著差异,但均弱于F组;而HAD组的ABTS阳离子自由基清除能力最弱。3 个干燥组的FRAP均显著弱于F组,其中HPD组FRAP最高(29.39 mg/g)。陈璁等[27]研究表明,HPD处理的双孢蘑菇提取液的DPPH自由基和ABTS阳离子自由基清除能力以及FRAP均显著高于HAD组,本研究结果与之类似。α-葡萄糖苷酶是2型糖尿病的重要靶标[33],寻找天然高效、无毒副作用的α-葡萄糖苷酶抑制剂具有重要意义。由图1H可知,HAD和VD处理均使PNL的α-葡萄糖苷酶抑制能力显著下降,而HPD组的α-葡萄糖苷酶抑制能力(IC50为6 542.38 μg/mL)与F组无显著差异。综合以上结果,HPD对PNL功能活性的保持效果最好。
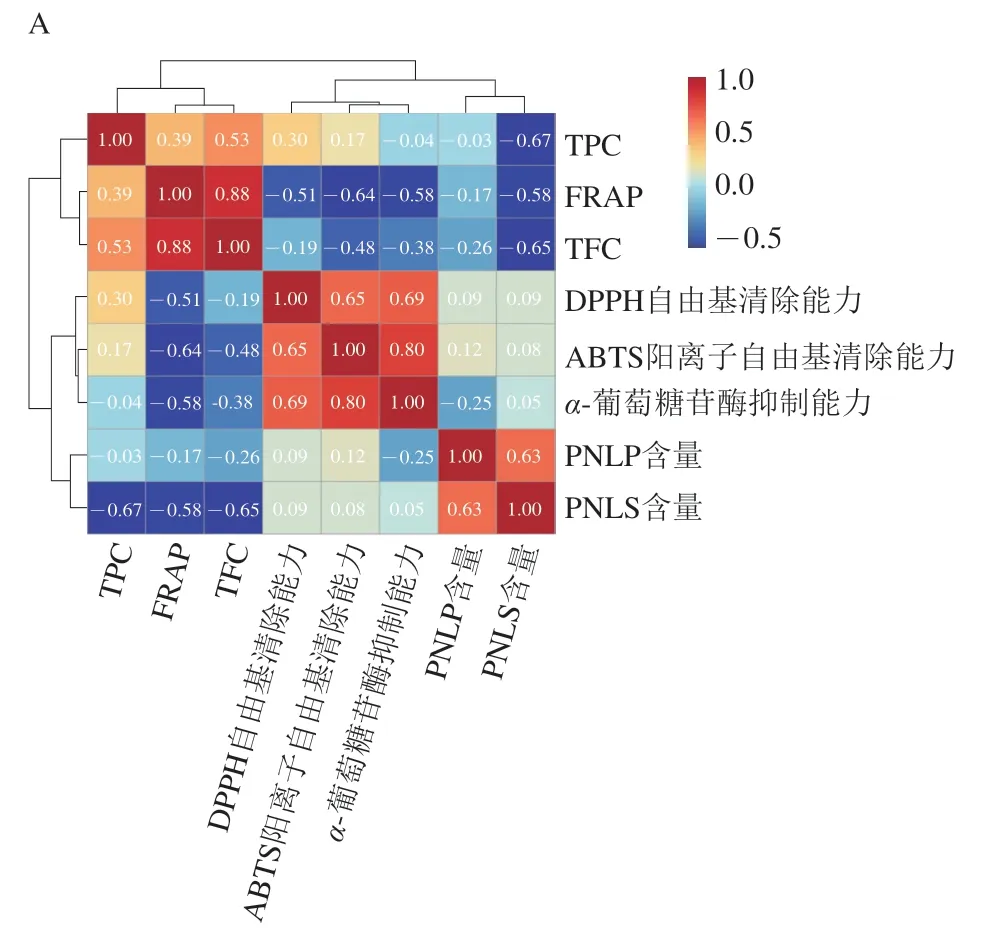
为进一步阐明PNL中化学成分含量与功能活性之间的关系,本研究对各指标进行了相关性分析。如图2A所示,抗氧化指标与TFC之间相关性较高,说明黄酮类化合物是PNL抗氧化活性的主要贡献者;而α-葡萄糖苷酶抑制能力受到TFC、PNLP含量的影响,但不完全由它们决定。综合来看,PNL的功能活性是其各种成分综合作用的结果,并非主要由单一类型成分决定,这也体现了PNL多成分、多作用靶点的特点。此外,为探讨干燥方式与PNL中化学成分含量和功能活性的联系,本研究进行了主坐标分析,如图2B所示,HPD组、VD组与F组在PC1上距离较相近,其中HPD组与F组最为接近,而HAD组距离F组最远,这也进一步说明HPD和VD处理对PNL的化学成分及其功能活性可以起到较好的保护作用。
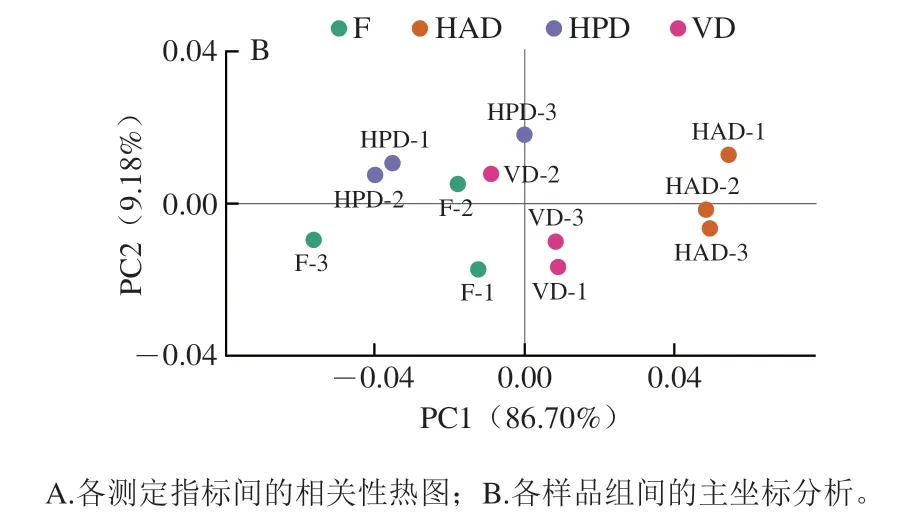
图2 各测定指标间的相关性热图和各样品组间的主坐标分析Fig. 2 Heatmap showing correlation between measured indexes and principal coordinate analysis plot of fresh and dried samples
2.4 不同干燥方式对PNL挥发性成分的影响
采用GC-IMS从PNL中一共检测出85 种挥发性化合物,包括19 种醛类、22 种醇类、17 种酮类、5 种酯类、3 种呋喃类、2 种酸类以及17 种数据库中未匹配到的物质,其中在F、HAD、HPD、VD组中分别检测到80、79、80、78 种挥发性成分,各组样品的挥发性成分基本一致(附表1)。
整体来看,新鲜的PNL中挥发性成分主要以醛、醇和酮类化合物为主,其分别约占总挥发性化合物的18%、33%和30%。其中醛类化合物主要来源于氨基酸及脂肪酸的代谢[34-35],包括青叶醛、己醛、反式-2-戊烯醛等,其中青叶醛呈现强烈的青草气味,己醛则呈现叶香、水果香、木香[36]。醇类化合物主要来源于萜类化合物、苯丙氨酸和脂肪酸的代谢[34],包括正己醇、正戊醇等,其中正己醇具有嫩枝叶气味,而正戊醇则呈现出杂醇油的气味,对风味有不利影响[37]。酮类化合物中的短链酮类具有脂香和焦香香气,长链酮类则呈现出花香气息[38]。PNL中的酮类化合物主要为乙偶姻、丙酮等,其中乙偶姻具有甜味及奶油香味。经过干燥处理后,PNL中醛类化合物的相对含量明显增加,而醇类和酮类化合物的相对含量明显下降。同时,酯类化合物相对含量明显下降,而酸类化合物相对含量明显提高。不同处理组之间的差异图谱(图3A)和指纹图谱(图3C)清楚地展示了这些变化,图3A中,相比于未经处理的F组,3 个处理组部分挥发性成分相对含量升高,部分挥发性成分相对含量降低,且变化趋势类似。对所测得的挥发性成分进行定性分析(图3B)。将每组中所有挥发性成分的含量变化进行可视化分析(图3C),区域a中的物质干燥后相对含量大幅降低;区域b中大部分挥发性成分相对含量降低,其中异戊醇、正丙醇、正戊醇等在干燥后相对含量明显降低;区域c中挥发性成分在干燥后相对含量明显升高,包括异丁酸、正庚醛、正戊醛、醋酸等。造成这些变化的主要原因是干燥过程中温度、氧气浓度、光照等因素导致PNL发生美拉德反应、脂质氧化反应以及前体物质的降解和转化,使原料中的挥发性成分种类和含量发生变化[39]。马琦等[40]发现杏鲍菇经不同干燥处理后醛类化合物含量有所升高。此外,干燥过程中酶失活以及香气前体物质的损失也会导致醇类化合物含量的降低[41]。
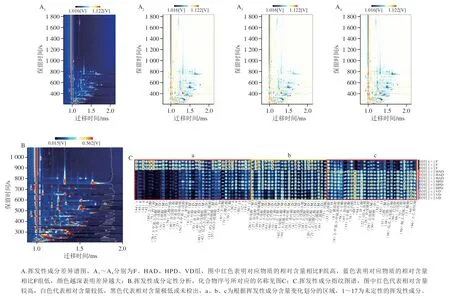
图3 不同干燥方式下PNL挥发性成分的定性分析及差异分析Fig. 3 Qualitative analysis and difference analysis of volatile components in PNL dried by different methods
对各组样品挥发性成分的相对含量分布、差异物质进行分析,如图4所示,不同干燥方式下PNL挥发性成分的相对含量不同。对3 种主要挥发性成分(醇类、醛类和酮类)进行比较分析,发现HPD组的醇类和醛类化合物相对含量最高,而酮类化合物最低,说明经HPD处理的PNL草木香味最浓、焦香味最淡,有利于加工成PNL食品。主坐标分析显示F组在PC1上与各干燥样品组距离较远,说明干燥使PNL中挥发性成分的相对含量发生明显改变,其中HPD组与F组挥发性成分的相对含量较为接近。选择PNL挥发性成分中相对含量具有显著变化的物质进行热图分析,发现干燥后PNL中大部分挥发性成分相对含量显著降低,主要包括醇类、酮类、酯类,而部分醛类、酸类、呋喃类成分相对含量显著增加。
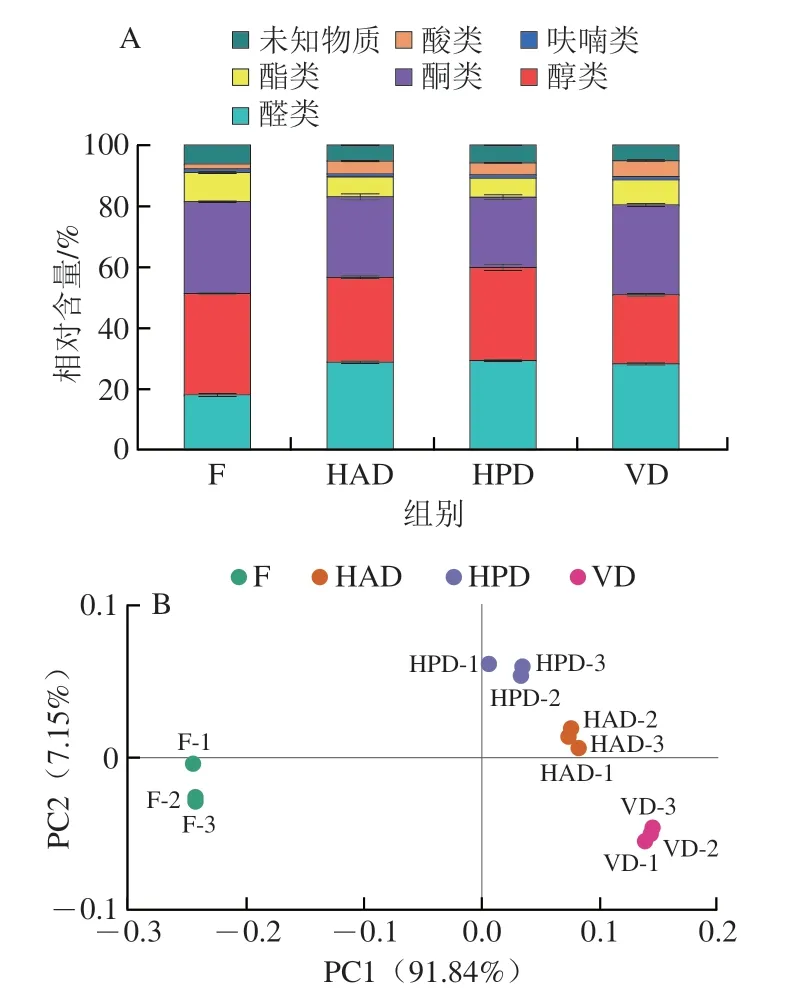
图4 不同干燥方式下PNL挥发性成分组成及差异物质分析Fig. 4 Analysis of volatile components and differential substances of PNL dried by different methods
2.5 代谢组学分析
基于2.2、2.3、2.4节的实验结果进行综合分析,发现HPD组对PNL的化学成分和功能活性保持最好,因此选择HPD作为本研究中PNL的最佳干燥方式。为进一步阐明PNL在干燥过程中的代谢物变化和代谢机制,采用基于超高效液相色谱-四极杆-轨道阱质谱的非靶向代谢组学对干燥前后的PNL(F组和HPD组)进行分析。一共从PNL中鉴定出659 种代谢物,其中正离子模式下检测到409 种,负离子模式下250 种。这可能是因为在质谱检测中,碱性化合物对正离子模式更敏感,而负离子模式更适合检测酸性化合物[42]。为了更直观地展示这些代谢物的组成和分类,绘制了相应的饼状图。如图5所示,饼状图中不同颜色代表不同分类,面积代表分类中代谢物所占比例。PNL中的代谢物在超类水平上主要包括脂质和类脂分子、有机酸及其衍生物、有机杂环化合物;在类水平上主要包括羧酸及其衍生物、异戊烯醇脂;在亚类水平上以氨基酸、肽和肽类似物为主。
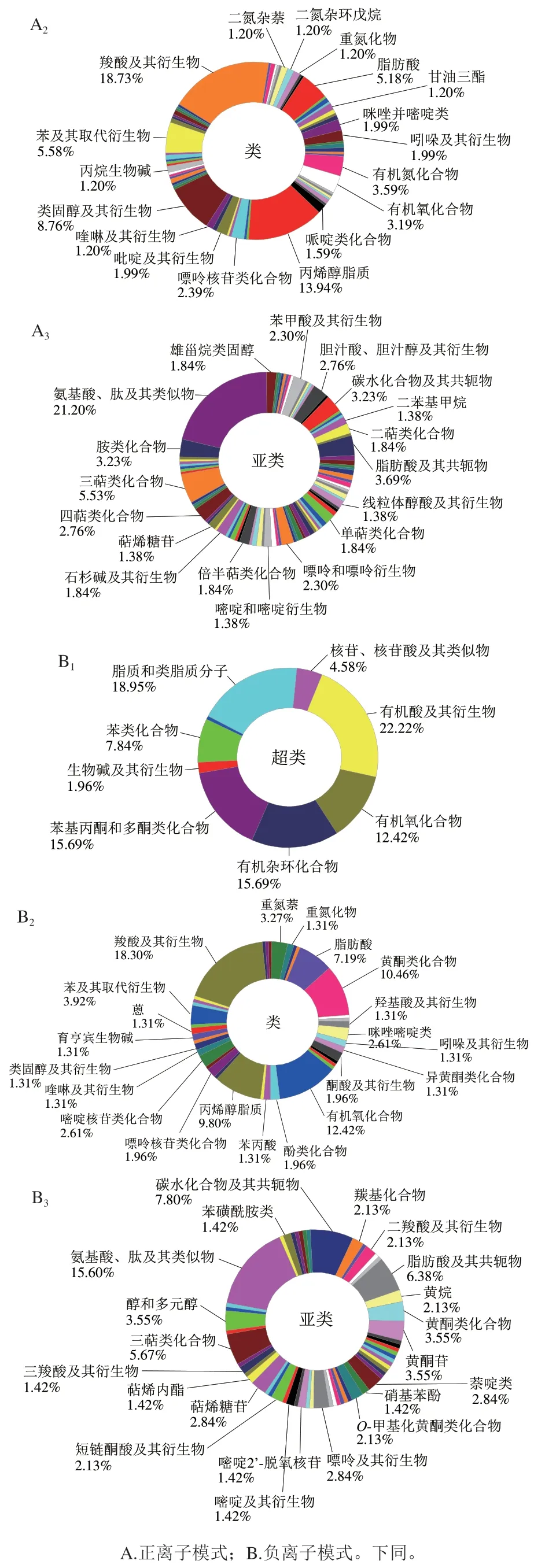
图5 PNL代谢物分类Fig. 5 Metabolite classification of PNL
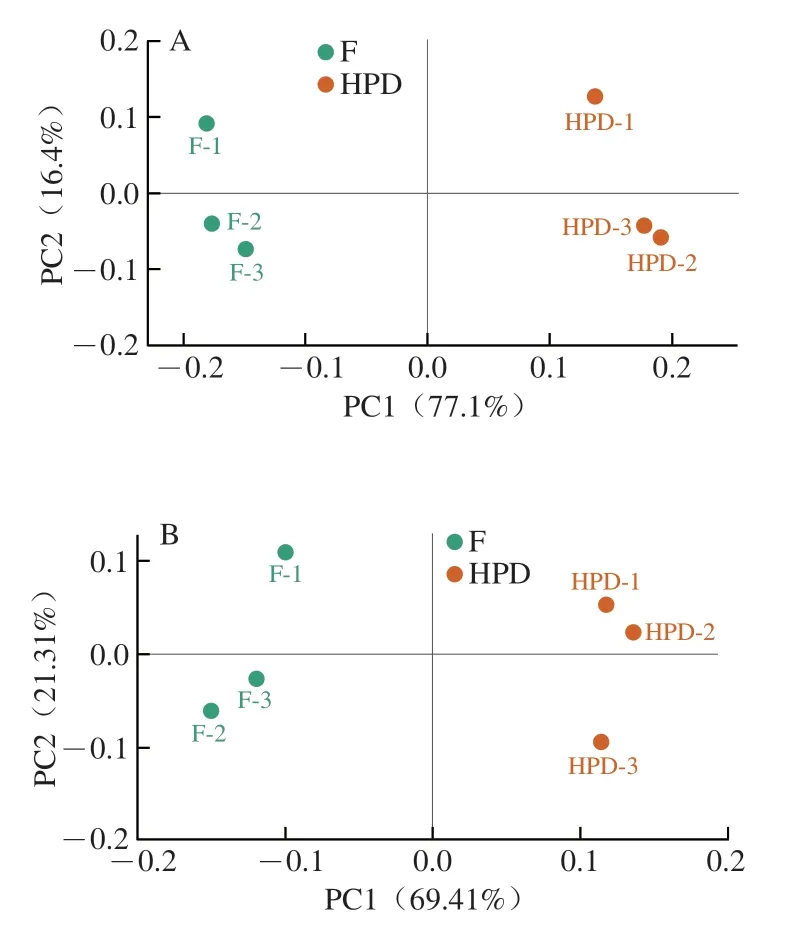
对这些代谢物进行主坐标分析(图6A、B),F组和HPD组在正、负离子模式下均可明显区分,说明干燥后PNL的代谢物表达量发生了明显变化。对PNL干燥前后的差异代谢物进行进一步分析,并根据P<0.05和│log2差异倍数(fold change,FC)│≥2构建火山图(图6C、D)。结果表明,正离子模式下有113 种代谢物表达显著上调,98 种表达显著下调;负离子模式下有68 种代谢物表达显著上调,31 种表达显著下调,这些差异代谢物主要为脂质和类脂分子、有机杂环化合物、有机酸及其衍生物等,正、负离子模式下干燥后表达上调的代谢物均明显多于表达下调的代谢物,说明HPD处理能够转化PNL中的非挥发性代谢物,这可能是因为在干燥过程中适度的热处理会促进PNL中这些非挥发性代谢物的水解、取代、异构化、氧化还原以及其他热物理和化学反应[43]。根据正交偏最小二乘法判别分析获得的投影中变量重要性(variable important in projection,VIP)值,选择VIP值排在前50 位的代谢物绘制聚类热图(图6E、F),发现干燥前后发生变化的代谢物主要集中在一些氨基酸、生物碱、碳水化合物、酶、脂类、黄酮类化合物以及萜类化合物等。在干燥过程中,PNL中的蛋白质发生部分水解,促进氨基酸形成。而氨基酸又与可溶性糖等产生反应,进而产生美拉德反应产物;同时,PNL中的黄酮苷也可以被降解成黄酮苷元和葡萄糖配基,从而降低其苦涩味。这也进一步解释了干燥后PNL化学成分和风味变化的原因。

图6 PNL干燥前后代谢物的变化Fig. 6 Changes in metabolite composition of PNL before and after drying
此外,在主要差异代谢物中发现了人参皂苷CK、人参皂苷Re等皂苷类化合物。由于皂苷被认为是三七中最主要的活性成分,因此针对代谢物中的所有皂苷类化合物进行检索。一共鉴定到24 种皂苷类化合物(附表2),其中正离子模式下鉴定到13 种,负离子模式下鉴定到11 种,并发现其中8 种皂苷类化合物经干燥后相对含量发生了显著变化(图7)。由图7可知,只有人参皂苷CK相对含量显著降低,而人参皂苷Re、人参皂苷F1、5,6-脱氢人参皂苷Rd等7 种皂苷相对含量均显著降低,这与HPLC的分析结果相印证。人参皂苷CK属二醇型皂苷,虽然在天然人参、三七等药材中的含量极低,但其具有良好的水溶性,是其他含量较高的人参皂苷(如Rb1和Rb2等)在人体肠道内的主要降解产物和最终吸收形式,具有很高的抗肿瘤、降血糖、增强免疫等生物活性[44]。已有研究报道热处理可以将普通皂苷转化为稀有皂苷,从而使其具有更好的药理活性[45-46]。余潇苓等[47]报道人参皂苷在受热后会发生不同程度的降解,其中三醇类皂苷较二醇类皂苷对热更为敏感。由表2可知,经干燥后PNL中PNLS含量总体显著提高,因此,在PNL的HPD过程中同样存在着皂苷类物质的转化。
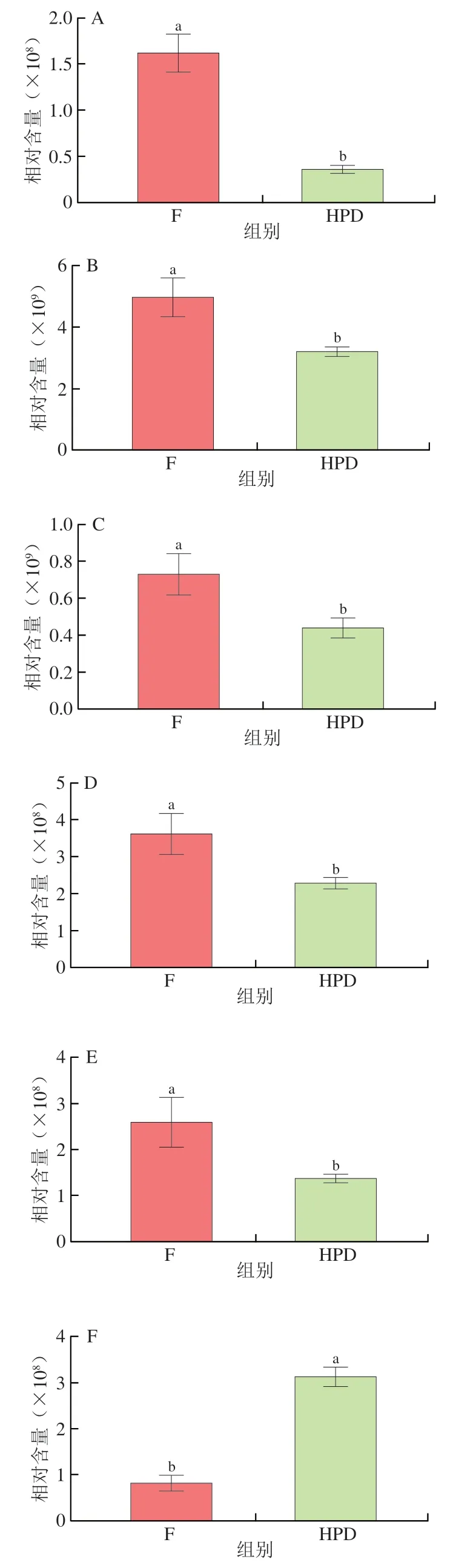
图7 PNL干燥前后的差异性皂苷类化合物Fig. 7 Differential saponin compounds in PNL before and after drying
进一步对PNL的功能活性与代谢物进行Spearman相关性分析(图8),由图8C、D可知,没有代谢物与DPPH自由基清除能力显著相关,只有少量代谢物与ABTS阳离子自由基清除能力、FRAP和α-葡萄糖苷酶抑制能力显著相关,且这些相关代谢物的种类多样,这说明PNL的功能活性是由不同化合物综合决定的。
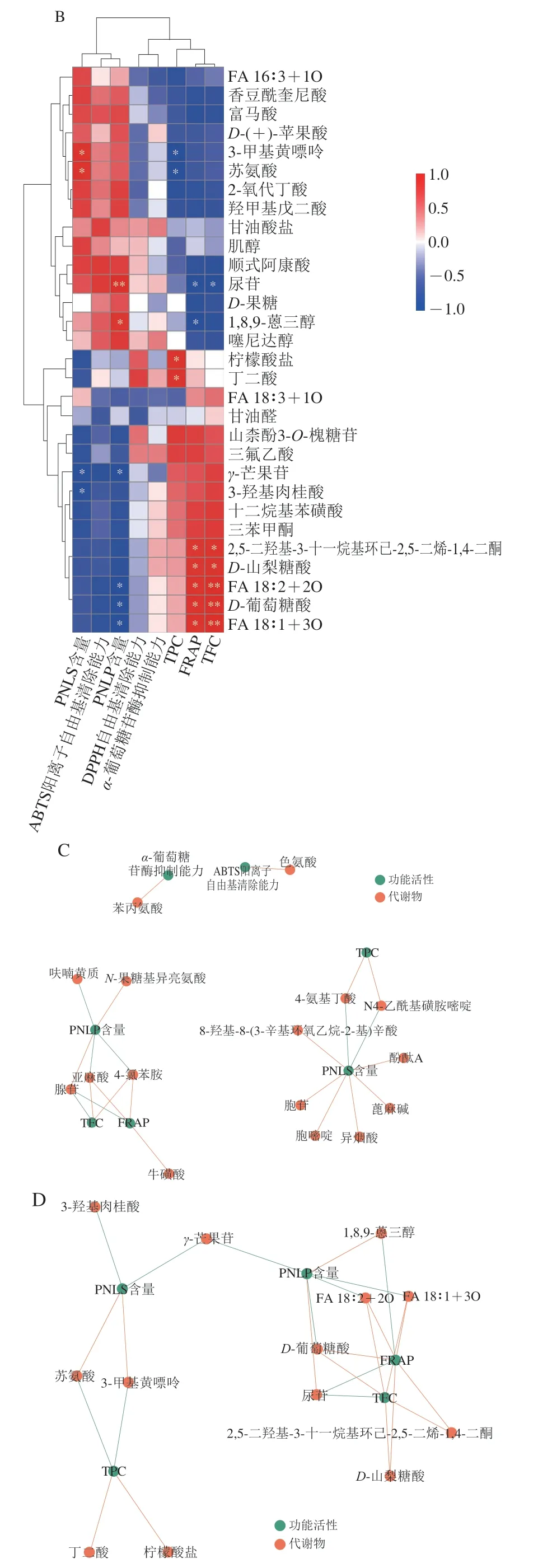
图8 PNL功能活性与代谢物之间的相关性分析以及PNL中差异代谢物的富集途径分析Fig. 8 Correlation analysis between functional activities and metabolites of PNL and pathway enrichment of differential metabolites in PNL
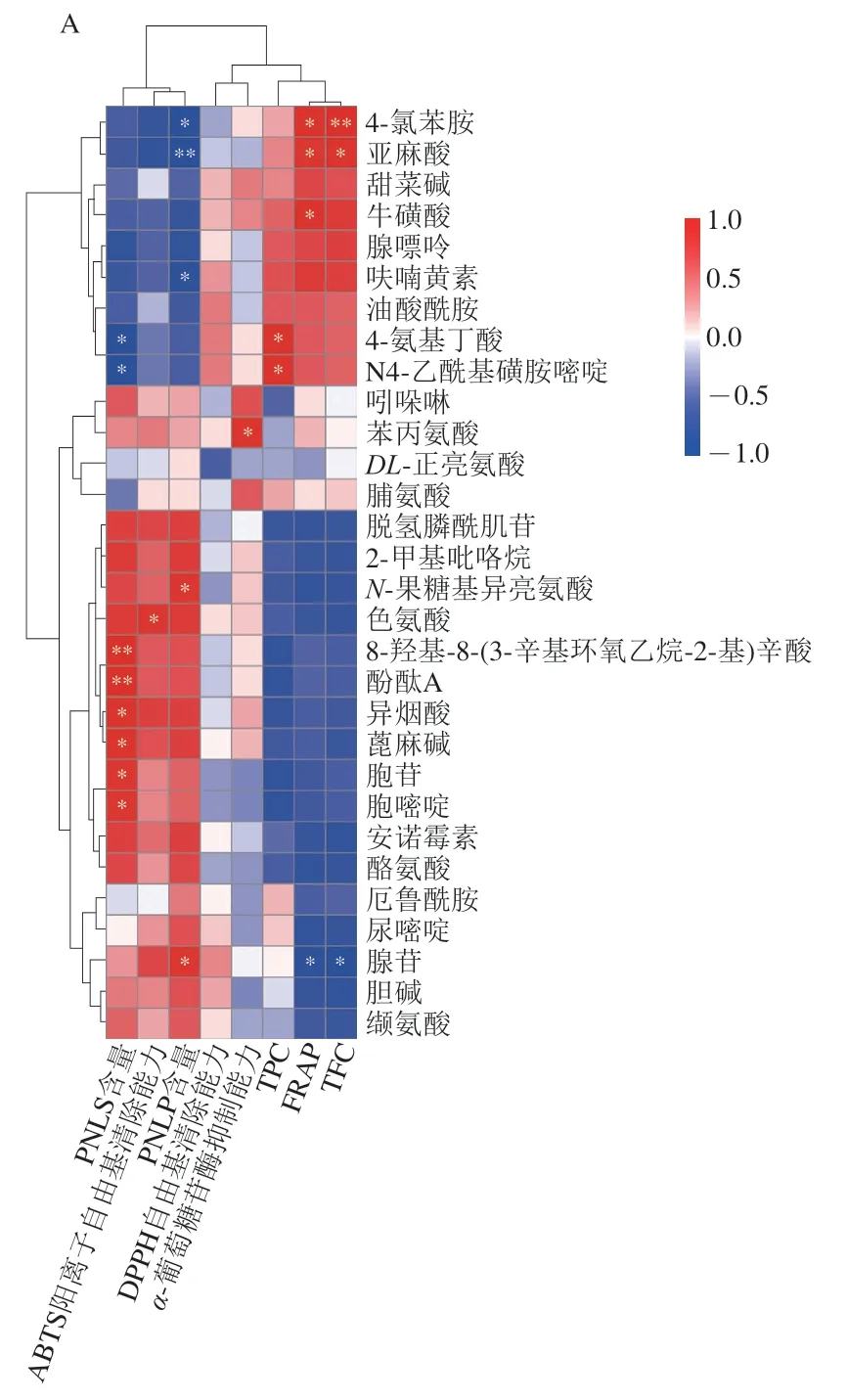
对差异代谢物参与的通路进行KEGG富集分析,结果如图8E所示。由于本研究主要关注的是PNL在干燥过程中代谢物的变化,因此,针对代谢(M)类型进行分析。由图8E可知,氨基酸的生物合成、2-氧羧酸代谢、辅助因子的生物合成等是PNL在HPD过程中最可能的代谢通路,其富集到的代谢物数目分别为11、10、12 个。其中,氨基酸的生物合成涉及到氨基酸的合成;2-氧羧酸代谢通过氨基酸和糖类的代谢来完成;辅助因子是一类对细胞代谢和生理功能有重要影响的生物分子,对氨基酸代谢、脂类代谢、植物次生代谢等有重要作用。KEGG富集结果充分解释了PNL在干燥后的代谢物变化情况,并揭示了其代谢途径。
3 结 论
本研究以PNL为原料,分别采用HAD、HPD、VD对其进行干燥处理,研究不同干燥方式对PNL化学成分、功能活性和挥发性成分的影响,确定适宜的PNL干燥方法,并采用非靶向代谢组学技术揭示干燥前后的代谢物变化情况,阐明代谢机制。结果表明:3 种干燥方式均可明显提高PNLS和PNLP含量,降低TPC和TFC,其中HPD组的PNLS和PNLP含量最高,而HAD组的TPC和TFC较高;采用HPLC法从PNL中共检测出4 种皂苷,分别为三七皂苷Fc和Fe以及人参皂苷Rb1和Rb3,其中HPD显著降低了三七皂苷Fc、Fe的含量,而VD与之相反;3 种干燥方式对人参皂苷Rb1和Rb3含量均无显著影响。抗氧化活性测定结果表明,经干燥后,PNL的功能活性均发生了不同程度的下降。其中,HPD组清除DPPH自由基和ABTS阳离子自由基的IC50分别为1 098.96 μg/mL和1 091.49 μg/mL,优于HAD组,与VD组无显著差异。HPD组的FRAP最强,为29.39 mg/g。HPD组还具有最强的α-葡萄糖苷酶抑制能力,其IC50为6 542.38 μg/mL,与新鲜PNL无显著差异。因此,本研究中,HPD处理对于PNL的主要化学成分含量和功能活性具有最好的保持效果。采用GC-IMS在PNL中共检测出85 种挥发性成分,3 种干燥方式均对PNL中挥发性成分的相对含量有明显影响,且不同处理组之间有明显区别。其中,HPD组的醇类和醛类化合物相对含量最高,而酮类化合物最低,说明其能较好地保留PNL的草木味,产生的焦香味最淡,有利于PNL的进一步加工利用。非靶向代谢组学分析揭示了PNL在干燥过程中的代谢物变化,干燥后表达上调的代谢物数量明显多于表达下调的代谢物,主要集中于氨基酸、生物碱、碳水化合物、酶、脂类、黄酮类化合物以及萜类化合物等,说明HPD过程中PNL中产生了大量上述非挥发性代谢物,导致其化学成分和挥发性风味成分发生变化。针对PNL中皂苷类化合物的相对含量进行进一步分析,结果也证明了人参皂苷Re、人参皂苷F1、5,6-脱氢人参皂苷Rd等皂苷类化合物发生了转化。KEGG富集分析表明,氨基酸的生物合成、2-氧羧酸代谢、辅助因子的生物合成是PNL在HPD过程中主要的代谢途径。
综上,HPD在本研究所选3 种干燥方式中对PNL的化学成分和功能活性具有最好的保持效果,可以作为PNL在加工应用中的优选干燥方式。在干燥过程中,其可通过多个作用途径改变PNL的代谢物组成,并影响其挥发性成分含量。在今后的工作中,可以针对干燥过程中代谢物的变化,尤其是常见皂苷转化为稀有皂苷进行深入研究,并运用细胞、动物模型对其生理活性进行更多地探讨。本研究结果可为PNL的采后干燥加工提供科学依据,对于PNL的开发利用、促进三七产业发展具有一定意义。
