基于植物-土壤反馈原理的退化草原免耕补播修复物种选择研究
2023-12-08郭美琪刘琳荆晶莹杨高文张英俊
郭美琪,刘琳,荆晶莹,2,杨高文,2,张英俊,2*
(1. 中国农业大学草业科学与技术学院,北京 100193;2. 农业农村部草地管理与合理利用重点实验室,北京 100193)
免耕补播是退化草地植被修复的有效手段之一[1-2],与普通的补播修复技术相比,免耕补播可以在不破坏或少破坏原生植被的前提下播种一些适应性强、营养价值高的优良物种,补播成功即可快速提高退化草地的生产力和牧草品质[3],同时减少水土流失、提高草原碳汇功能[4-5]。但补播面临的难题之一就是补播种难以在退化草地中存活[6-8],因此补播物种选择是补播成功与否的关键。建立具有普适性的补播物种选择方法,对减少补播成本、提高补播成功率具有重要意义。
研究表明,在陆地生态系统中,植物和微生物在土壤环境中的相互作用会影响植物群落的组成和后续物种的建植[9-10]。草地退化表现为植物群落种类组成发生变化,以羊草(Leymus chinensis)为优势种的植物群落会逐渐退化成以杂类草-冷蒿(Artemisia frigida)为主的植物群落,甚至被重度退化标志植物-星毛委陵菜(Potentilla acaulis)所取代[11],在退化草地形成斑块状分布。这种退化标志性物种高度聚集的小尺度草地斑块(面积为0.5~100 m2)的形成[12],会对土壤化学性质产生特定的影响,比如退化草地斑块的形成会降低土壤pH 值[13],以家畜不喜食草种占优势的斑块土其有机碳含量和总氮含量显著高于喜食草种占优势的斑块土[14];同时退化斑块中的土壤微生物群落结构也会发生显著改变,随退化梯度的增加,细菌丰富度增加,真菌丰富度降低[13,15-16],植物病原真菌的相对丰度显著增加[15]。这种由退化导致的养分限制和土壤微生物群落结构的改变都会影响后续物种建植和生长[17-18],但其如何影响后续物种的反馈,可能取决于哪些机制对特定植物重要,以及这些机制对特定养分变化的相对响应[18-20]。因此在对退化草地进行补播修复前,有必要对拟补播物种和退化草地土壤进行植物土壤反馈(plant-soil feedback, PSF)试验,确定生物因子和非生物因子对后续补播物种生长的相对贡献,提高补播修复成功概率。
本课题组前期研究提出了免耕补播物种选择假说[2],对退化草原进行补播时,需要选择具有中性或正PSF 的物种,即退化草地土壤对补播种的生长没有抑制作用。本研究基于该假说,以内蒙古不同斑块土为研究对象,基于植物-土壤反馈原理对拟补播物种进行筛选研究,分别利用人工短期驯化土壤和长期驯化斑块土壤进行植物生长试验,探究影响补播物种生长的主要生物与非生物因子,为不同退化草地筛选出适宜补播的物种,进一步完善退化草原植被免耕补播修复技术。
1 材料与方法
1.1 研究区概况
本研究所用土壤取自中国科学院植物研究所多伦恢复生态学研究站(42°02′ N,116°16′ E)。该地区属温带大陆性半干旱气候,夏季湿润温暖,冬季寒冷干燥,海拔1344 m,年均气温1.6 ℃,年均降水量385 mm。草地类型为典型草原,主要植物种类为羊草、针茅(Stipa capillata)、冷蒿、星毛委陵菜等,土壤类型为栗钙土。
1.2 试验设计
本研究共包括2 个试验,分别探究人工短期驯化土壤与长期驯化的斑块土壤对补播物种生长产生的影响,进而为不同退化草地的物种选择提供参考。具体试验设计与处理方法如下:
1.2.1 人工短期驯化土壤对补播物种的反馈作用 利用内蒙古典型草原3 种优势种:羊草、针茅和冷蒿短期驯化土壤,探究不同草地优势种短期驯化对土壤养分与微生物产生的特异性影响,以及对后续补播物种生长状况的影响,同时以补播物种对土壤进行驯化作为对照。补播物种选择常用补播种:胡枝子(Lespedeza bicolor)、紫花苜蓿(Medicago sativa)、黄花苜蓿(Medicago falcata)、羊草、冰草(Agropyron cristatum)和无芒雀麦(Bromus inermis)。补播种子来自宁夏农林科学院、正道种业以及呼伦贝尔特尼河牧场等。
试验于2021 年2 月1 日- 6 月20 日(共20 周)在中国农业大学草业科学与技术学院人工气候室内进行,盆栽用土为中国科学院植物研究所多伦恢复生态学研究站典型草原表层0~20 cm 土壤,其pH 为7.09,总碳含量为11.023 mg·g-1,总氮含量为0.99 mg·g-1。土壤过筛后装入花盆(高10 cm、口径15 cm、底径10 cm),每盆1.5 kg,浇水至土壤完全湿润。在取土点周围采集3 种植物(羊草, 针茅, 冷蒿)的种子,种植前种子进行吸胀处理和表面消毒,分别用10%的NaClO 和75%的乙醇消毒10 min,用蒸馏水冲洗干净并选择预处理后饱满度一致的种子进行单独播种,培养条件为25 ℃(光照16 h),20 ℃(黑暗8 h)。生长期采用称重法控制土壤水分,保持土壤水分在田间持水量的80%左右。出苗3 周后进行间苗处理,每盆保留6 株长势一致的幼苗。间苗16 周后,去除花盆内全部植物(包括地上与地下根系部分),保留土壤部分即人工短期驯化土壤。盆内土壤按各自驯化处理充分混匀,去除土壤中残留的植物根系进行取样,土样一部分在-80 ℃保存,用于微生物高通量测序分析,一部分保存在-20 ℃冰箱用于测定土壤速效氮含量,一部分土样风干后研磨,过2 mm 筛用于测定土壤相关非生物特性指标,剩余土壤用于反馈阶段。
2021 年7 月8 日- 9 月1 日,开展8 周的反馈试验,探究各优势种人工短期驯化土壤对补播物种生长的反馈作用,反馈阶段设置4 个重复,种植方式与培养环境均与驯化阶段保持一致。2021 年9 月,对所有植物样品进行采集,将全部花盆内的植物(包括地上与地下根系部分)装入纸袋中,于烘箱中65 ℃烘干至恒重,称重记录并保存。
1.2.2 长期驯化的斑块土壤对补播物种生长的影响 本试验于中国科学院植物研究所多伦恢复生态学研究站内选择羊草、冷蒿、星毛委陵菜斑块(面积>1 m2)进行取土,探究长期驯化的斑块土壤间土壤养分及微生物的差异对补播物种生长的影响。取土厚度为表层0~5 cm 土壤,去除地上植物部分并轻微抖掉松散土壤后得到根土混合样品。将土壤过2 mm 筛去除枯枝落叶及碎石后进行取样保存,方式同1.2.1,剩余新鲜土壤用于补播阶段。
2021 年7 月8 日-9 月1 日,开展8 周的物种补播筛选试验,探究长期驯化的斑块土壤对胡枝子等上述6 种补播物种生长的影响。种子播种、培养条件及取样方式均与1.2.1 保持一致。
1.3 测定方法
采用Sartorius 普及型pH 计PB-10(德国)测定土壤pH;采用元素分析仪(Vario Macro, Elementar,德国)测定土壤全氮(total nitrogen, TN)、全碳(total carbon, TC)以及有机碳(organic carbon, SOC)含量[21];采用流动分析仪(Auto Analyser 3,Seal Analytical,德国)测定土壤速效氮(available nitrogen, AN)、铵态氮、硝态氮含量[22];采用Olsen 等[23]的方法测定土壤速效磷(available phosphorus, AP)含量。
根据E.Z.N.A.® soil DNA kit(Omega Bio-tek, Norcross, GA,美国)说明书进行微生物DNA 抽提,使用1%的琼脂糖凝胶电泳进行DNA 质量的检测、使用NanoDrop 2000(美国)进行DNA 浓度和纯度的检测; 使用细菌引物338F(5′-ACTCCTACGGGAGGCAGCAG-3′)、806R(5′-GGACTACHVGGGTWTCTAAT-3′)和真菌引物ITS1-F(CTTGGTCATTTAGAGGAAGTAA)、ITS2-R(GCTGCGTTCTTCATCGATGC),分别对16S rRNA 基因V3~V4 区域和ITS 基因ITS2 区域进行PCR 扩增,扩增产物于4 ℃保存。PCR 反应体系: 4 μL 5×TransStart FastPfu 缓冲液,2 μL 2.5 mmol·L-1dNTPs,0.8 μL 上游引物(5 μmol·L-1),0.8 μL 下游引物(5 μmol·L-1),0.4 μL TransStart FastPfu DNA 聚合酶,提取的DNA 样品10 ng,用无菌水将反应体系补足至20 μL。每个样本3 次重复。将同一样本的PCR 产物混合并使用2%琼脂糖凝胶进行回收,利用AxyPrep DNA Gel Extraction Kit(Axygen Biosciences,美国)进行纯化,2%琼脂糖凝胶电泳进行检测,使用Quantus™ Fluorometer(Promega,美国)对回收产物进行检测定量并用NEXTFLEX Rapid DNA-Seq Kit 进行建库。利用Illumina 公司的Miseq PE300 平台进行测序(上海美吉生物医药科技有限公司)。
1.4 统计分析
1.4.1 土壤化学性质、微生物多样性和物种生物量分析 用单因素方差分析(One-way ANOVA)比较土壤驯化处理对土壤化学性质及补播物种生物量的影响。原始数据用Microsoft Excel 2010 进行整理和初步分析,统计分析软件为SPSS 26.0,绘图软件为R 3.5.2 与SigmaPlot 14.0。使用UPARSE 软件,根据97%的相似度对质控拼接后的序列进行操作分类单元(operational taxonomic unit, OTU)聚类并剔除嵌合体。采用Wilxocon 秩和检验来比较不同斑块微生物α 多样性的差异。使用vegan 包进行非度量多维尺度分析(non-metric multi-dimensional scaling, NMDS)阐明土壤间微生物群落组成的差异。使用Car、Relaimpo 包进行多元回归分析(multiple regression analysis)并判断解释变量的相对重要性,探讨土壤化学性质及微生物群落对补播物种生物量的影响程度。所有数据均满足方差齐性及正态分布,直接用于统计分析。
1.4.2 植物-土壤反馈作用分析 植物-土壤反馈指数(plant-soil feedback effect value, PSF)用于判断植物-土壤反馈的方向[15,24],计算公式如下:
式中:Biomasshomesoil表示植物在自身驯化土壤中的生物量;Biomassawaysoil表示植物在退化土壤中的生物量。PSF>0 时,表示该补播物种在自身驯化土壤中的生长表现优于在退化土壤中的生长表现,所以退化土壤对补播物种存在负反馈效应;PSF<0 时,表示补播物种在自身驯化土壤中的生长表现差于退化土壤,退化土壤对补播物种存在正反馈效应;PSF=0 时,表示补播物种在退化土壤与自身驯化土壤中生长表现没有差异,为中性反馈。采用Duncan 新复极差法检验不同驯化土壤处理间因变量的显著性,并将PSF与0 进行单样本t检验,显著性水平设定为P<0.05。
2 结果与分析
2.1 人工短期驯化土壤属性变化和对补播物种的反馈效应
不同植物短期驯化对土壤全碳、全氮、有机碳、土壤速效氮、速效磷含量及pH 值均无显著影响(P>0.05,表1),但显著改变了土壤微生物群落α 多样性(表2)。对于细菌而言,针茅短期驯化土的Shannon 指数和Chao1 指数显著高于冷蒿短期驯化土(P<0.05),但二者与羊草短期驯化土之间均没有显著差异;对于真菌而言,针茅短期驯化土的Shannon 指数显著低于冷蒿短期驯化土和羊草短期驯化土。对羊草、针茅及冷蒿短期驯化土壤进行NMDS 分析,结果显示,短期驯化未对细菌β 多样性产生显著影响,但土壤真菌群落结构差异显著(P<0.05,图1),表明真菌群落对植物短期驯化的响应比细菌更敏感。综上,短期驯化主要改变土壤生物因子。

图1 不同驯化土壤细菌和真菌β 多样性的NMDS 分析Fig.1 NMDS analysis of bacteria and fungi β-diversity in different domesticated soils
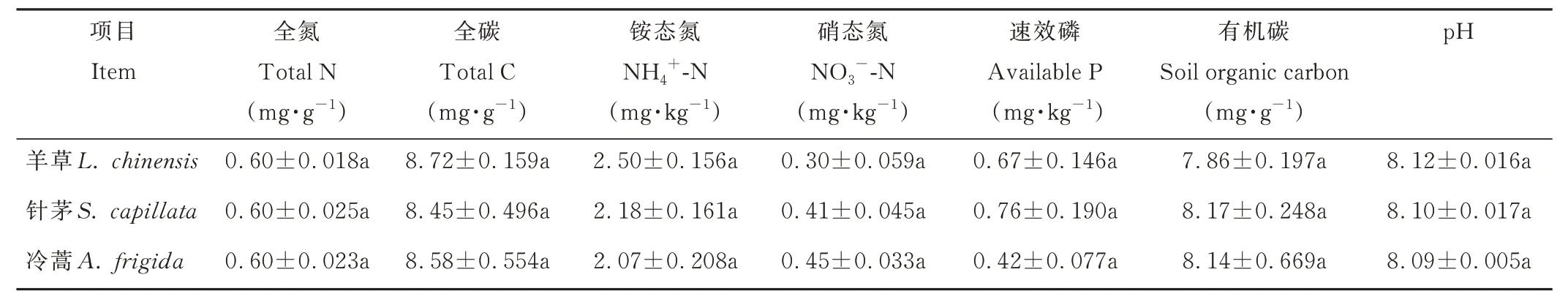
表1 不同植物驯化土壤理化性质Table 1 Soil physicochemical properties in different plant domestication

表2 不同植物驯化土壤细菌和真菌α 多样性Table 2 α -diversity of soil microbial in different plant domestication
补播物种对短期驯化土壤的反馈存在显著差异(P<0.05,图2),根据前述定义,PSF 为负表示该物种更适宜选作补播种。胡枝子和冰草在针茅和冷蒿短期驯化土中为正反馈,在羊草短期驯化土中为中性反馈;紫花苜蓿在3 种短期驯化土中均为中性反馈;黄花苜蓿和无芒雀麦在羊草短期驯化土中为负反馈,在针茅和冷蒿短期驯化土中为中性反馈;羊草在针茅和冷蒿短期驯化土中为负反馈。

图2 植物-土壤反馈指数Fig.2 Plant-soil feedback index
2.2 长期驯化的斑块土壤对补播物种生长的影响
不同斑块土壤的理化性质和微生物群落结构均差异显著(P<0.05,表3 和表4)。羊草斑块土壤硝态氮、AP 以及有机碳含量均显著高于其他斑块类型,而星毛委陵菜斑块土壤pH 值、铵态氮、总氮以及总碳含量最高(P<0.05)。细菌群落Shannon指数表现为冷蒿斑块显著低于羊草和星毛委陵菜斑块;真菌群落Shannon 指数表现为星毛委陵菜斑块显著低于羊草和冷蒿斑块;Chao1 指数均未发现显著改变(P>0.05);不同斑块土壤微生物β 多样性差异显著(P<0.05,图3),各斑块细菌、真菌群落分布较分散,分别聚成不同的簇(clusters)。其中,冷蒿斑块与星毛委陵菜斑块土壤真菌群落距离较近,两者结构较相似(图3b)。

图3 不同斑块土壤细菌和真菌群落β 多样性的NMDS 分析Fig.3 NMDS analysis of bacteria and fungi communities β-diversity in different patches

表3 长期驯化形成的斑块草地土壤非生物特性Table 3 Soil abiotic characteristics of grassland in different patches
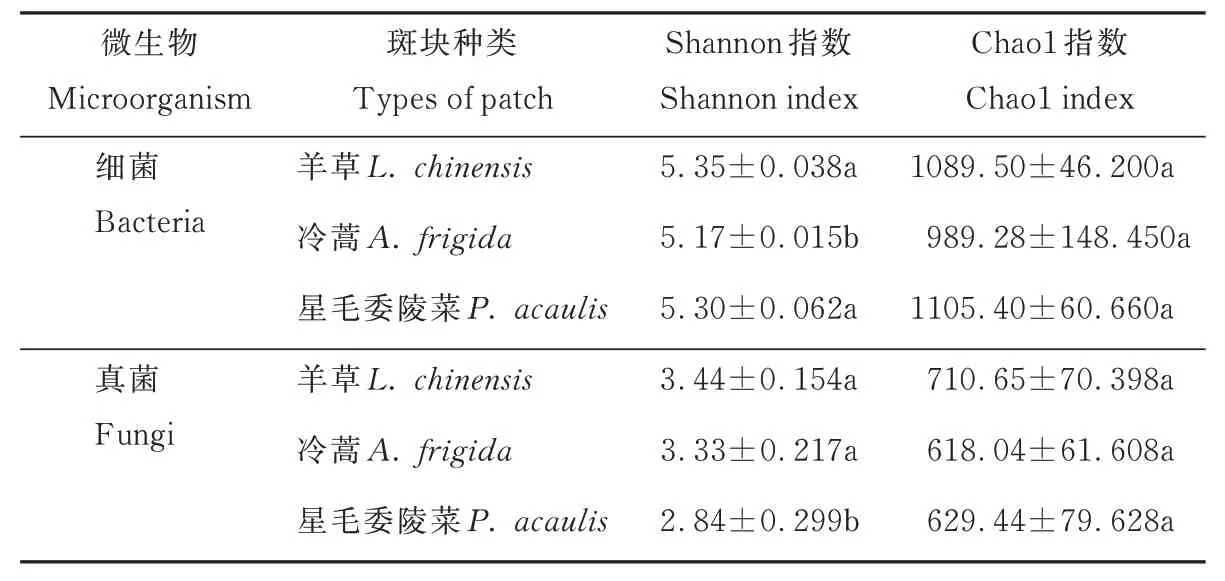
表4 长期驯化形成的斑块土壤微生物α 多样性Table 4 α-diversity of soil microbial in different patches
冰草在3 种植物斑块中生物量无显著差异;胡枝子生物量在羊草与冷蒿斑块中无显著差异,但都显著高于星毛委陵菜斑块(P<0.05);其他补播物种的生物量都随退化梯度的增加呈递减趋势(P<0.05,图4)。

图4 不同斑块土壤补播总物种生物量Fig.4 Reseeding species biomass in different patches
为了确定长期驯化的斑块土壤的生物因子和非生物因子对补播物种生物量的相对贡献度,对土壤因子和补播物种生物量进行了多元逐步回归分析,结果显示(图5),土壤pH 显著影响了羊草、紫花苜蓿和无芒雀麦的生物量,分别可解释生物量变化的37.08%(P<0.05)、50.83%(P<0.01)和56.42%(P<0.001)。黄花苜蓿与羊草的生长受到AN、AP、有机碳以及微生物群落α 多样性的影响。胡枝子、冰草对各土壤因子响应均不明显,表明其植株生长对土壤环境条件并不敏感。
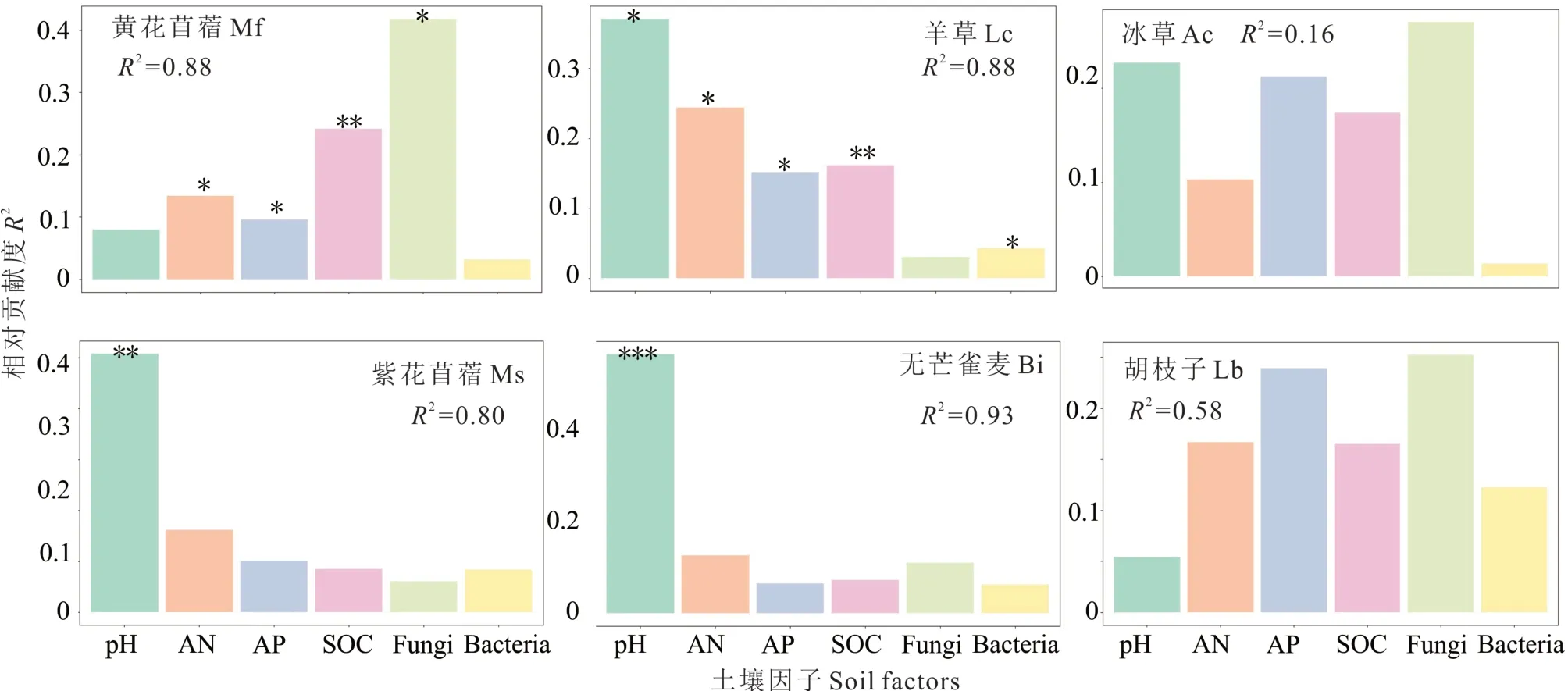
图5 各土壤因子对补播物种生物量的相对贡献度Fig.5 The relative contribution values (R2) of soil factors to the biomass of reseeding species
本研究综合短期驯化的PSF 指数,长期驯化的补播物种生物量以及其对土壤因子响应差异进行物种选择(表5):黄花苜蓿、无芒雀麦在羊草短期驯化土中生长时均不受抑制,且在羊草斑块中获得最高生物量,因此适宜用于以羊草为优势种草地的改良,补播黄花苜蓿时要考虑退化土壤真菌群落的影响,补播无芒雀麦时要考虑土壤pH 值;羊草在针茅短期驯化土中生长时不受抑制,适宜用于以针茅为优势种的退化草地改良,但补播时要考虑土壤pH 值及土壤氮磷等养分;羊草、紫花苜蓿在冷蒿短期驯化土中生长时不受抑制,但其在不同斑块土壤中生物量差异显著,因此补播时要对土壤pH 和速效氮等土壤养分进行调控,提高补播成功率;胡枝子在冷蒿退化草地土壤的生物量差异不显著,可直接选择用于以冷蒿为优势种退化草地的恢复治理;冰草对土壤属性变化的敏感度低,生物量无显著差异,可直接用于以星毛委陵菜为优势种退化草地的恢复治理。
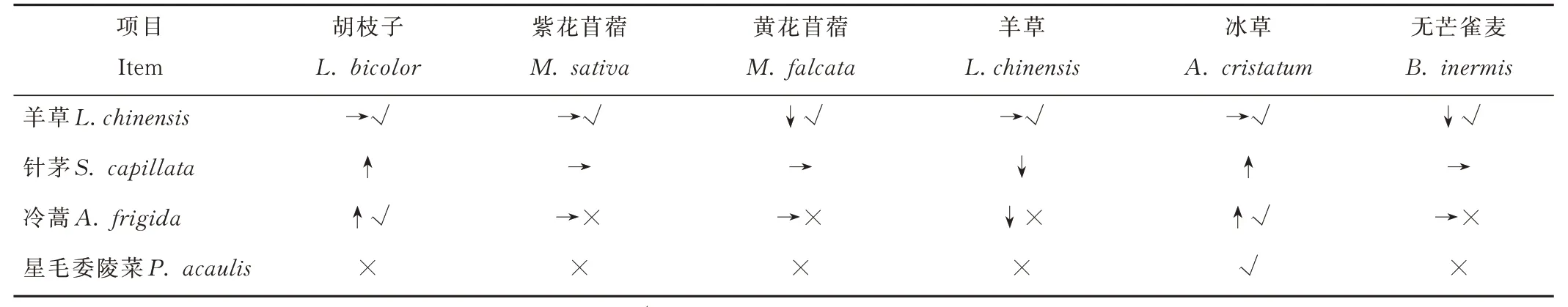
表5 退化草地补播物种筛选方法Table 5 Methods of reseeding species selection in degraded grasslands
3 讨论
随草地退化梯度的增加,土壤养分含量逐步下降[15],土壤微生物量和活性降低,同时微生物群落结构也会发生改变[25]。这种由退化导致的土壤环境(包括养分有效性和土壤生物区系)的改变,可以反馈给补播物种的生存和生长[26],因此在对不同退化程度的草地进行补播修复时,利用PSF 试验来选择恰当的补播物种,是提高补播成功率的一种可靠方法。
利用不同退化程度草地优势种对土壤进行短期驯化主要改变土壤微生物群落结构,而原位收集的长期驯化斑块土壤其理化性质和微生物群落结构均发生改变,这与苏纪帅[27],曲耀冰等[28]的研究结果相同,不同植物对土壤的驯化结果可能与驯化时间长短有关。结合本研究结果,补播物种在长期驯化斑块土壤中的生物量趋势和其对短期驯化土壤表现的PSF 结果并不一致,证明了补播物种在不同退化梯度的生长状况和存活概率除了受前茬植物塑造的土壤微生物区系的影响外,很大程度上还取决于退化草地土壤理化性质的改变,这与Nuske等[29]的研究结果一致,入侵植物对原生植被土壤反馈的结果有很显著的环境依赖性,某些土壤非生物条件会影响入侵种对土壤微生物的响应。Liu 等[30]研究还发现,土壤非生物特性对植被生物量沿退化梯度的变化有54.78%的解释度,土壤含水量、有机碳、土壤全氮等大部分土壤理化性质对地上生物量有正向影响,只有土壤pH 对其有轻微的负向影响。Jiang 等[31]则研究发现,植物的生物量与土壤有机碳含量呈显著负相关,与速效磷含量呈显著正相关。但与此同时,Cheeke 等[32]的研究表明,对一些植物而言,即使在营养富集的土壤中,植物的生长对土壤生物群的响应也是连续的,因此不同补播物种对土壤环境因子可能有特异性表现,既可能受生物因子的制约也可能受非生物因子的影响。本研究结果与前人基本相同,不同植物对土壤属性的响应差异较大,有些植物对土壤化学性质变化敏感,但有些植物对土壤微生物变化较敏感。所以在对退化草地进行补播物种筛选时,除了利用退化草地优势种进行PSF 试验外,还需要收集原位退化土壤做进一步的反馈试验,确定对于特定补播物种而言相对重要的土壤因子。同时结合长期驯化和短期驯化的结果,优先选择对退化草地优势种驯化的土壤生物区系有正反馈或不敏感的物种,再根据长期驯化结果,对所选补播物种影响较大的土壤因子进行改良,比如补播对土壤养分较为敏感的物种时,需要在补播同时进行施肥以保障补播成功率。
草地退化首先表现为草地生产力的下降,但土壤全氮、全磷养分等土壤属性具有相对的稳定性,短期内不会下降[33-34],如詹天宇等[34]对青藏高原不同退化梯度草地的植被和土壤属性差异进行研究,发现轻度退化草地其土壤属性与未退化草地间无显著差异,重度退化则严重降低了土壤养分含量。与此同时植被生产力的减少限制了新鲜植物碳源向土壤的输入[35],会导致土壤微生物群落结构的改变和某些功能的丧失[36-37],因此植被群落组成的变化会迅速导致土壤微生物组成的变化[38],本研究中不同物种短期驯化土壤微生物α 和β 多样性均差异显著也证明了这一点。因此对于轻度退化草地而言,补播时可以通过PSF 试验,筛选出适当的补播物种便可对退化草地进行修复;但随退化梯度的增加,养分限制逐步加重,此时仅依靠补播物种的生物特性进行植被修复存在难度,应该将影响补播物种生长状况的土壤生物因子和非生物因子综合考虑,适当的补充土壤养分,才能更好地提高补播成功率。
4 结论
本研究提出了一种普适性的退化草地补播物种选择方法:对某一特定退化草地,选择该草地优势种与拟补播物种进行植物土壤反馈试验;同时将不同退化优势种草地的斑块土壤取回,进行补播种植试验,测定各物种的生物量和其对土壤因子的响应。根据植物土壤反馈结果和生物量差异进行物种确定,优先选择该退化草地对补播物种存在正反馈或中性反馈且生物量没有显著差异的物种。该研究进一步完善了退化草原植被免耕补播修复理论,对退化植被生态修复时物种筛选具有重要指导作用。
