免疫巩固治疗前NLR、PLR与Ⅲ期老年非小细胞肺癌病人预后的相关性
2023-12-07王天叶劲军李慧时书童张治周国仁王强张熔熔何侠
王天 叶劲军 李慧 时书童 张治 周国仁 王强 张熔熔 何侠
我国肺癌新发人群中≥65岁的病人约占3/4,且这类病人病死率更高[1]。由于老年NSCLC病人大多合并基础疾病,器官功能下降、体质较差且合并认知功能障碍,对治疗的耐受程度不一,往往是临床研究的排除对象。而Ⅲ期NSCLC作为一种异质性疾病,需要多学科评估,制定个体化的治疗方案[2]。PECIFIC研究中,度伐利尤单抗的引入彻底改变了不可手术Ⅲ期NSCLC的治疗方法,使病人有了潜在治愈的可能[3]。然而人体的免疫活性会随着年龄增长而降低,这可能导致老年NSCLC病人的免疫治疗获益减少[4]。目前针对Ⅲ期老年NSCLC病人免疫治疗预后相关因素的研究甚少。本研究回顾性分析Ⅲ期老年NSCLC病人根治性放化疗(radical chemoradiotherapy,CRT)后接受程序性死亡受体1 (PD-1)抑制剂巩固治疗的疗效,并探究血液学参数中性粒细胞计数与淋巴细胞比值(NLR)和血小板与淋巴细胞比值(PLR)等与预后的相关性。
1 资料与方法
1.1 一般资料 共收集2017年8月至2022年2月间就诊于江苏省肿瘤医院放疗科的83例老年NSCLC病人。年龄65~90岁,平均(71±5)岁。其中男72例(86.7%),女11例(13.3%);鳞癌68.7%、腺癌31.3%;ⅢA期37.3%、ⅢB期45.8%、ⅢC期16.9%。
1.1.1 纳入标准:(1)年龄≥65岁;(2)病理诊断明确为鳞状细胞癌或腺癌;(3)临床诊断明确为不可手术的Ⅲ期NSCLC;(4)接受PD-1抑制剂治疗前无疾病进展;(5)功能状态评分(KPS)≥70分;(6)病历资料完整,具有可用于评估临床疗效的影像学检查。
1.1.2 排除标准:(1)PD-1抑制剂治疗1个月内出现炎症性疾病;(2)基因检测有EGFR、ALK、ROS突变;(3)在接受PD-1抑制剂前1周行输血、促红细胞生成素、粒细胞集落刺激因子或其他影响血液学指标的支持治疗;(4)中性粒细胞计数(ANC)≤1.5×109/L、PLT≤100×109/L、Hb<90 g/L;(5)处于慢性乙型或丙型肝炎活动期;(6)预计生存期<6个月;(7)5年内明确诊断有第二原发肿瘤;(8)既往使用过PD-1抑制剂。
1.2 治疗及随访 化疗方案为铂类联合紫杉醇或培美曲塞,允许单药铂类/紫杉醇/培美曲塞化疗。放疗则采用三维适行调强放射治疗(intensity modulated radiationtherapy,IMRT),根据CT所示原发肿瘤和转移淋巴结勾画大体肿瘤靶区(gross target volume,GTV),临床靶体积(clinical target volume,CTV)根据病理类型由GTV外扩获得(原发灶鳞癌外扩6 mm、腺癌8 mm),放疗剂量范围为45~66 Gy(肺平均剂量≤13 Gy、V20≤25%或两者兼之)。PD-1抑制剂治疗方案为每3周接受1次信迪利单抗或卡瑞丽珠单抗或帕博利珠单抗200 mg静脉滴注,或特瑞普利单抗240 mg静脉滴注,允许因不良反应导致的药物减量或暂停。
1.3 疗效及随访 无进展生存期(PFS)定义为首次应用PD-1抑制剂到疾病进展的时间;总生存期(OS)是从免疫治疗开始到死亡的时间。通过电子病历或电话随访收集病人的一般临床资料和血液学参数,包括年龄、性别、KPS评分、CRT方案、PD-1抑制剂种类、复发或转移情况及ANC、PLT和淋巴细胞计数(ALC)等。
1.4 统计学分析 采用SPSS 26.0软件进行数据分析与绘图。计数资料采用频数和百分比(n,%)表示,组间比较采用卡方检验。利用美国耶鲁大学X-tile 3.6.1软件[5]在所有病人的生存数据中选择NLR、PLR的最佳临界值,使用Kaplan-Meier法绘制生存曲线,使用log-rank检验比较亚组的OS和PFS,并使用Cox回归模型估计风险比(HR)。应用Cox回归分析预后的影响因素。P<0.05为差异有统计学意义。
2 结果
2.1 临床疗效 随访截至2022年11月,所有病人的中位随访时间为16.3个月,无失访病人。根据Kaplan-Meier曲线分析,83例病人中位PFS为15.2个月,1、2年PFS率分别为57.5%、29.6%;中位OS为29.0个月,1、2年OS率分别为87.9%、63.8%。21例 (25.3%)病人发生区域淋巴结的进展,12例 (14.5%)病人出现远处转移,其中肺内转移、脑转移和肾上腺转移各3例,发生恶性胸腔积液、肝转移和骨转移各1例。18例 (21.7%)病人死于肿瘤或肿瘤并发症,2例病人 (2.4%)因感染新型冠状病毒死亡。
2.2 NLR、PLR与PFS和OS的相关性 应用X-title软件计算得到NLR和PLR的最佳临界值分别是3和196。据此,将病人分为高NLR组(>3)、低NLR组(≤3)和高PLR组(>196 )、低PLR组(≤196)。低NLR组的中位PFS比高NLR组更长(18.6个月比 9.7个月,P<0.001,HR=0.33,95%CI:0.18~0.61);低PLR组的中位PFS与高PLR组相比也更长(22.5个月比 10.9个月,P<0.001,HR=0.32,95%CI:0.18~0.58)。低NLR组的中位OS未达到,高NLR组的中位OS为25.2个月(P=0.026,HR=0.35,95%CI:0.15~0.85);低PLR组的中位OS比高PLR组延长(36.8个月比23.6个月,P=0.003,HR=0.22,95%CI:0.09~0.54)。见图1。
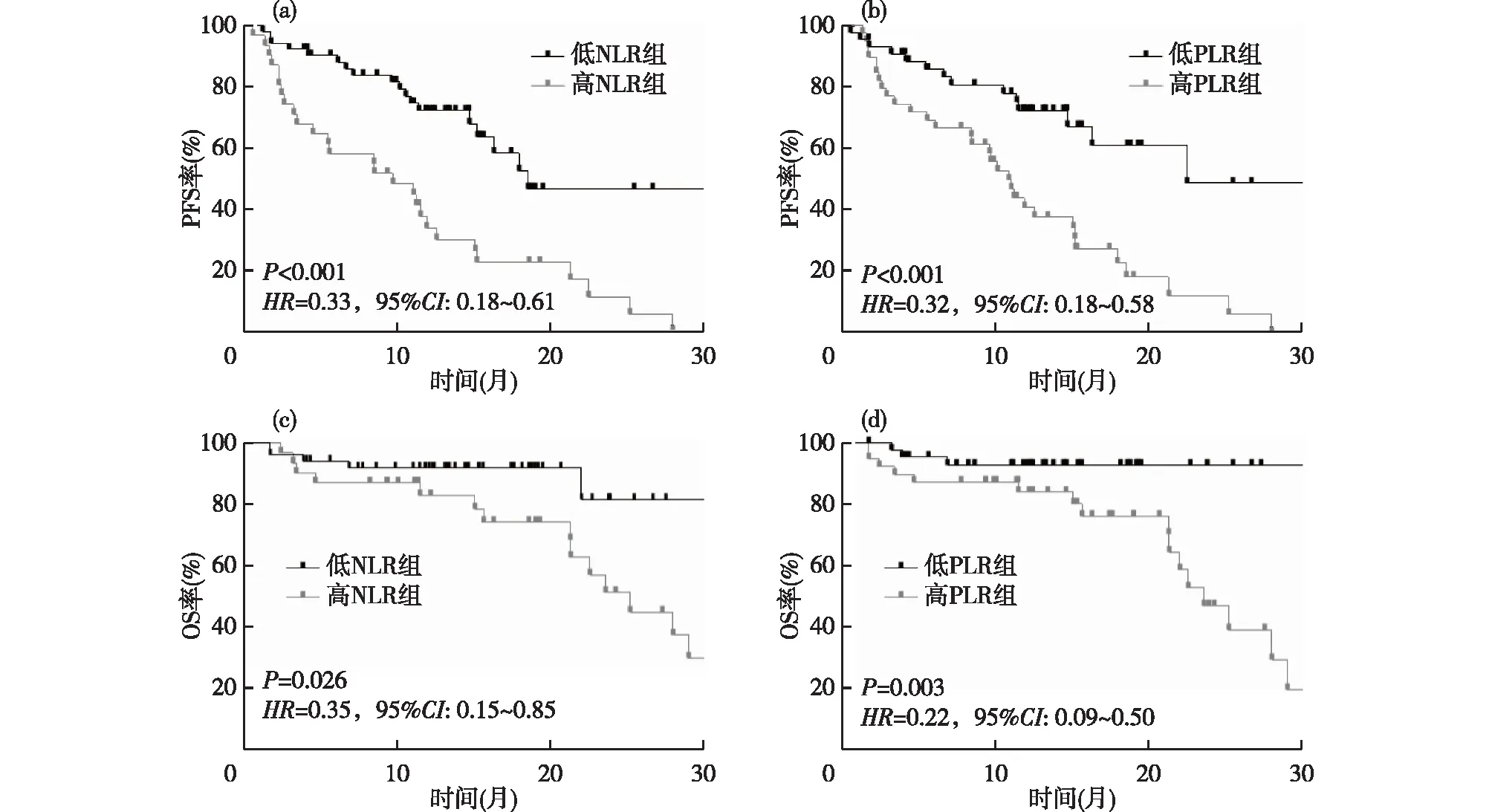
图1 老年NSCLC病人不同亚组PFS率和OS率的Kaplan-Meier曲线
2.3 Ⅲ期老年NSCLC病人PFS和OS影响因素的单因素及多因素Cox回归分析 单因素分析中ANC≤3.7×109/L、ALC>1.0×109/L、NLR≤3和PLR≤196与较好的PFS相关,ALC≤1.0×109/L、NLR>3和PLR>196的老年NSCLC病人OS较短;多因素Cox回归分析结果显示,PLR(P=0.01,HR=0.33,95%CI:0.14~0.77)是PFS的独立预后因素,ALC(P=0.02,HR=4.95,95%CI:1.30~18.87)是OS的独立预后因素。见表1,2。
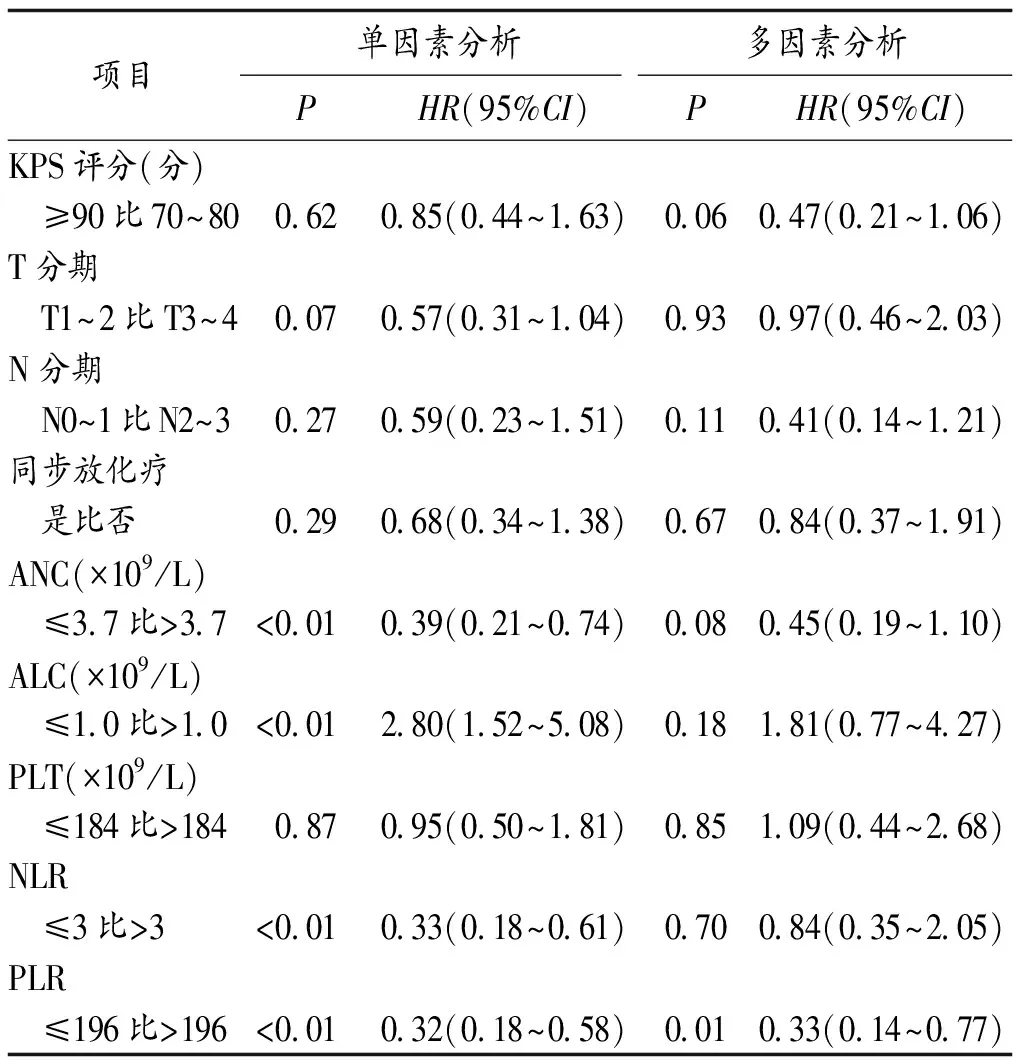
表1 老年Ⅲ期NSCLC病人PFS的单因素与多因素Cox回归分析
3 讨论
免疫抑制剂已被证明对Ⅲ期NSCLC病人的治疗有显著的疗效[6]。目前,PD-L1表达和肿瘤突变负荷(tumor mutation burden,TMB)是预测NSCLC免疫治疗疗效最常见的生物标志物[7]。与PD-L1、TMB相比,血液中炎症标志物不仅检测方便,也在各种实体肿瘤中被证实能够预测预后[8]。本研究也发现,NLR、PLR与Ⅲ期老年NSCLC病人的预后相关。
随着年龄的增加,机体适应性免疫中淋巴细胞(T细胞和记忆B细胞)受体的多样性在血液中会减少2~5倍,并通过各种复杂的机制导致免疫功能减弱,这种“免疫衰老”的核心是系统性的低度慢性炎症[9-10]。而在老年人群中,慢性炎症部位或由炎症细胞和介质支持的促炎症微环境都可引起肿瘤的发生[11]。衰老、炎症、肿瘤三者之间有着错综复杂的联系。作为炎症相关指标,ALC通过释放淋巴因子杀死肿瘤细胞,激活抗肿瘤免疫反应。ANC通过抑制肿瘤微环境(TME)中适应性免疫反应的功能来促进肿瘤进展。PLT作为各种因子的动态储存库,可分泌大量细胞因子和转化生长因子,进而刺激肿瘤细胞生长[12]。由三者组成的NLR、PLR则反映了肿瘤发展和肿瘤抑制之间的平衡。因此,NLR、PLR的升高可能是由ANC、PLT的活化和ALC的耗竭导致。近期的一项研究表明,局部晚期NSCLC病人接受PD-L1抑制剂维持治疗前,其较低的NLR和PLR与较好的OS相关[13]。本研究发现,治疗前NLR≤3、PLR≤196、ALC>1.0×109/L与接受PD-1抑制剂的老年NSCLC病人较长的生存时间相关。同时,PLR、ALC是Ⅲ期老年NSCLC病人接受PD-1抑制剂治疗的独立预后因素。有综述报道,接受免疫治疗的NSCLC病人NLR和PLR的临界值分别为2.8~5和169~262[14]。本研究选择的临界值为3和196,但仍存在一些问题:本研究中老年病人的血液学参数是根据本院检验科报告获得的,与其他医院可能存在差异;NLR、PLR的最佳临界值目前尚不统一;炎症与肿瘤之间是相互促进的,并且炎症是动态变化的,基线血液学参数指标预测老年病人预后是否可靠?基于这些问题,对于本研究中相关血液学指标得出的结论还需进一步证实。
免疫治疗改变了局部晚期NSCLC放化疗治疗的方案,但对于≥65岁的老年病人疗效和安全性仍缺乏足够的临床数据,这可能与老年病人的体能状态、营养、合并基础疾病等相关。CheckMate026试验[15]的单个亚组分析显示,年龄≤65岁和>65岁的局部晚期NSCLC病人中,纳武力尤单抗在PFS方面与铂类化疗相当。PECIFIC研究[16]中,≥70岁的Ⅲ期NSCLC病人同步CRT后度伐利尤单抗免疫维持治疗与安慰剂组相比,度伐利尤单抗改善了PFS(HR=0.62,95%CI:0.41~0.95)和OS(HR=0.78,95%CI:0.50~1.22)。在本研究中,老年肺癌病人的中位PFS为15.2个月,中位OS为29.0个月,与既往单用放疗或放化疗方案[17]相比,生存期明显延长。但是,目前大型Ⅲ期临床试验中PD-1抑制剂对Ⅲ期老年NSCLC病人的疗效数据大都来自亚组分析,且生存结果存在矛盾,需进一步针对老年NSCLC病人免疫治疗的疗效开展大型临床研究。
综上,本研究结果显示,治疗前高NLR和低ALC与Ⅲ期老年NSCLC病人接受PD-1抑制剂治疗较差的预后相关,可以辅助临床医生为老年病人制定个性化治疗方案并预测预后。本研究的主要局限性在于这是一项单中心小样本的回顾性研究,并且随访时间较短,没有记录病人免疫治疗的相关不良反应。
