齐墩果酸经肠道菌群抑制去卵巢小鼠骨丢失的作用机制
2023-12-05马承红王姜俨苏丹丹谢佑红唐琳周天宇董群伟孙平
马承红,王姜俨,苏丹丹,谢佑红,唐琳,周天宇,董群伟,孙平
1.广东药科大学附属第一医院内分泌科,广东 广州 510062;
2.广东药科大学附属第一医院信息科,广东 广州 510062;
3.广东药科大学附属第一医院骨科,广东 广州 510062;
4.广东省云浮市中医院,广东 云浮 527300
绝经后骨质疏松症(postmenopausal osteoporosis,PMO)是一种因雌激素降低导致低骨量及骨折风险显著增加为特点的代谢性骨病[1]。已证实,肠道菌群是造成PMO骨代谢异常的重要因素。雌激素缺乏会导致肠道中有益菌群定植减少,有害菌定植增加,从而引发一系列促进骨吸收的免疫炎症反应[2-4]。“肾藏精、主骨、生髓”是中医经典理论之一。补肾中药是治疗PMO的常见中药类型,其在影响肠道菌群防治骨质疏松中发挥了重要作用[5]。齐墩果酸(oleanolic acid,OA)是补肾中药女贞子、墨旱莲等的主要活性成分之一,具有潜在的抗炎、抗氧化作用。研究表明其对骨质疏松症的治疗起到积极作用[6-10]。本研究以去卵巢(OVX)小鼠构建PMO模型,通过观察OA干预后OVX小鼠骨量、炎性因子及肠道菌群的变化,进一步探讨OA防治OVX小鼠骨量丢失的效果及其作用机制,以期为OA防治PMO提供新的思路。
1 材料与方法
1.1 实验动物、材料与试剂 19 只SPF 级11 周龄C57BL6/J雌性小鼠购于南方医科大学实验动物管理中心,动物许可证号:SYXK(粤)2017-0124。置于广东药科大学附属第一医院实验动物中心SPF级环境中进行饲养:给予小鼠普通饲料,室温(22±2)℃,相对湿度40%~65%,12 h 光照,12 h 黑暗,保持良好通风,定时紫外线消毒,自由进水和进食。OA 试剂购于上海麦克林生化科技有限公司(CAS 号508-02-1);二甲基亚砜由天津市大茂化学试剂厂提供(批号00001);水合氯醛由深圳希景生物提供(批号Lot.22S04X17);0.9%氯化钠溶液由四川科伦药业股份有限公司提供(批号国字准号H20083400);ELISA检测试剂盒购于江苏酶免实业有限公司(批号20211123M)。
1.2 实验动物分组及造模 所有小鼠适应性喂养7 d 后随机分为假手术组(SHAM 组,n=6)、OVX 组(n=6)和OA 组(n=7)。10%水合氯醛以4 μL/g 麻醉OVX组和OA组小鼠,取背部正中旁侧1 cm切口进入腹腔,结扎双侧输卵管并切除双侧卵巢。SHAM 组按上述方法进行手术,保留双侧卵巢,切除卵巢旁边同卵巢等大的脂肪组织。OA组腹腔注射OA(10 mg/kg)[8],SHAM 组和OVX 组腹腔注射等剂量生理盐水。隔日1次,实验期12周。实验结束后,无菌环境下取小鼠粪便用于16S rRNA 基因测序;小鼠眼眶血行ELISA 检测;左侧股骨行Micro-CT测定。本研究中关于动物的处置和操作均符合广东药科大学附属第一医院动物实验伦理要求。
1.3 左侧股骨Micro-CT测定 将肌肉筋膜剔除干净的小鼠左侧股骨统一方向摆入西门子Inveon Micro-CT 仪,以管电压80 kV、管电流500 μA 为扫描参数对其进行扫描,扫描仪自带软件分析所获取的图像信息。从股骨远端生长板远端0.5 mm 为起点,提取其上方80 层骨组织的图像信息,对去除皮质骨的感兴趣区域(region of interest,ROI)行三维重建并分析以下指标:骨密度(bone mineral density,BMD)、骨体积分数(bone volume/tissue volume,BV/TV)、骨表面积骨体积比值(bone surface/bone volume,BS/BV)、骨小梁数量(trabecular number,Tb.N)、骨小梁厚度(trabecular thickness,Tb.Th)及骨小梁分离度(trabecular separation,Tb.Sp)。
1.4 ELISA测定 采用摘眼球法收集小鼠血液,4℃、6 000 r/min离心10 min分离获得血清。小鼠血清细胞因子的含量采取ELISA测定方法,具体操作步骤按试剂盒说明书进行。测量指标如下:β-胶原降解产物(β-collagen degradation products,β-CTX)、1 型原胶原氨基端前肽(procollagen type 1 N-prepeptide,P1NP)、抗酒石酸酸性磷酸酶5b(tartrate resistant acid phosphatase 5b,TRACP5b)、肿瘤坏死因子-α(tumor necrosis factorα,TNF-α)、白细胞介素-10 (interleukin-10,IL-10)、白细胞介素-6(interleukin-6,IL-6)和脂多糖(lipopolysaccharide,LPS)。
1.5 肠道菌群16S 扩增子测序 收集小鼠粪便于无菌EP管中,-80℃条件下冷冻保存,粪菌样本使用E.Z.N.A.®soil DNA ki (Omega Bio-tek Norcross,GA,U.S.)提取DNA,对符合条件的DNA 用PCR 仪(ABI GeneAmp®9700型)扩增16S rRNA基因中的V3-V4区域,每个样本重复3次,最后置于4℃保存。引物为:上游引物338F (5'-ACTCCTACGGGAGGCAGCAG-3')、下游引物806R (5'-GGACTACHVGGGTWTCTAAT-3')。2%琼脂糖凝胶回收同一样本的PCR 产物混合物,并对其进行检测和提纯。纯化后的PCR 产物用NEXTFLEX®Rapid DNA-Seq Kit 进行建库,Illumina 公司Miseq PE300平台测序。
1.6 统计学方法 Micro-CT 和ELISA 数据采用R软件分析,样本符合正态分布和方差齐性时,组间比较采用单因素ANOVA 检验;否则,组间比较采用Kruskal-Wallis 秩和检验。肠道菌群数据于美吉生物云平台上分析,Ace、Chao和Shannon 指数采用mothur软件计算Alpha 多样性;采用基于Bray-Curtis 距离矩阵算法的主坐标分析(PCoA 分析)检验样本间微生物群落结构的差异性。组间微生物群落结构差异程度采用ANOSIM 非参数检验;Alpha 多样性和菌群丰度的组间差异采用Wilxocon 秩和检验。以P<0.05 表示差异有统计学意义。
2 结果
2.1 OA 对小鼠骨微结构及指标的影响 如图1 所示,OVX 组骨小梁数量显著减少,骨微结构受到破坏,OA 组骨小梁数量较OVX 组增加,骨微结构破坏减少。如图2 所示,与SHAM 组相比,OVX组BMD、BV/TV 和Tb.N 明显降低,Tb.Sp 明显增高,差异均具有统计学意义(P<0.05);BS/BV 和Tb.Th 变化不明显,差异均无统计学意义(P>0.05)。与OVX组相比,OA 组BMD 和BV/TV 明显增高,Tb.Sp 明显降低,差异均具有统计学意义(P<0.05),Tb.N、BS/BV 和Tb.Th 变化不明显,差异均无统计学意义(P>0.05)。

图1 左侧股骨远端三维重建图Figure 1 Three-dimensional reconstruction of the left distal femur

图2 骨微结构参数变化Figure 2 Variation in bone microstructural parameters
2.2 OA 对小鼠血清ELISA 指标的影响 如图3所示,与SHAM 组相比,OVX 组促炎因子TNF-α、IL-6、骨吸收指标TRACP5b、β-CTX、骨形成指标P1NP 和LPS 明显增高,抗炎因子IL-10 明显降低,差异均具有统计学意义(P<0.01);与OVX组相比,OA组P1NP、TRACP5b、β-CTX、TNF-α、IL-6、和LPS明显降低,IL-10 明显增高,差异均具有统计学意义(P<0.01或<0.05)。
2.3 OA对小鼠肠道菌群的影响 由图4A 可知,三组小鼠肠道菌群中共有的OTU为437个,其中24个为SHAM 组所特有,30 个为OVX 组所特有,10 个为OA 组所特有,OVX 组的OTU 数量最多,OA 组最少。本研究通过PCoA 分析可知,SHAM 组主要分布于右下象限,OVX组主要分布于右上象限,OA组主要分布于左下象限,且P=0.001,R 值为0.837,表明可明显区别三组样本(图4B)。随着测序深度加大,在OTU水平的Shannon指数不再增加,表明测序数据量合理,能够反映样本中绝大多数的微生物多样性信息(图4C)。由图4D 可知,与SHAM 组相比,OVX 组Chao、Ace 和Shannon 指数变化不明显,差异均无统计学意义(P>0.05);与OVX 组相比,OA 组Chao 和Ace 指数明显降低,差异均具有统计学意义(P<0.01),Shannon 指数变化不明显,差异无统计学意义(P>0.05)。
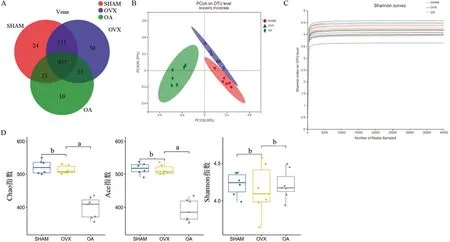
图4 各组肠道微生物组分析Figure 4 Analysis of the gut microbiome of each group
如图5A 所示,肠道菌群在门水平的相对丰度排名前7 的菌群分别为拟杆菌门(Bacteroidota)、厚壁菌门(Firmicutes)、脱硫杆菌门(Desulfobacterota)、疣微菌门(Verrucomicrobiota)、放线菌门(Actinobacteriota)、弯曲菌门(Campilobacterota)及变形菌门(Patescibacteria)。其中,OVX 组Actinobacteriota 丰度较SHAM 组明显降低,差异具有统计学意义(P<0.01),OA 组Actinobacteriota 丰度较OVX 组明显增高,差异具有统计学意义(P<0.01)(图5B)。肠道菌群在属水平的相对丰度如图6A所示。与SHAM组相比,Staphylococcus、Coriobacteriaceae_UCG-002 和Enterorhabdus 丰度在OVX 组中明显降低,Odoribacter 丰度明显增高,差异均具有统计学意义(P<0.01 或<0.05);与OVX 组相比,OA 组Staphylococcus、Coriobacteriaceae_UCG-002和Enterorhabdus 丰度明显增高,Odoribacter 丰度明显降低,差异均具有统计学意义(P<0.01或<0.05)(图6B)。
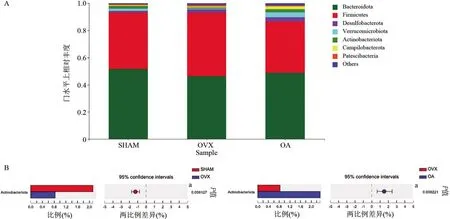
图5 各组小鼠肠道菌群门水平上差异分析Figure 5 Difference of the gut microbiota of each group at the phylum level
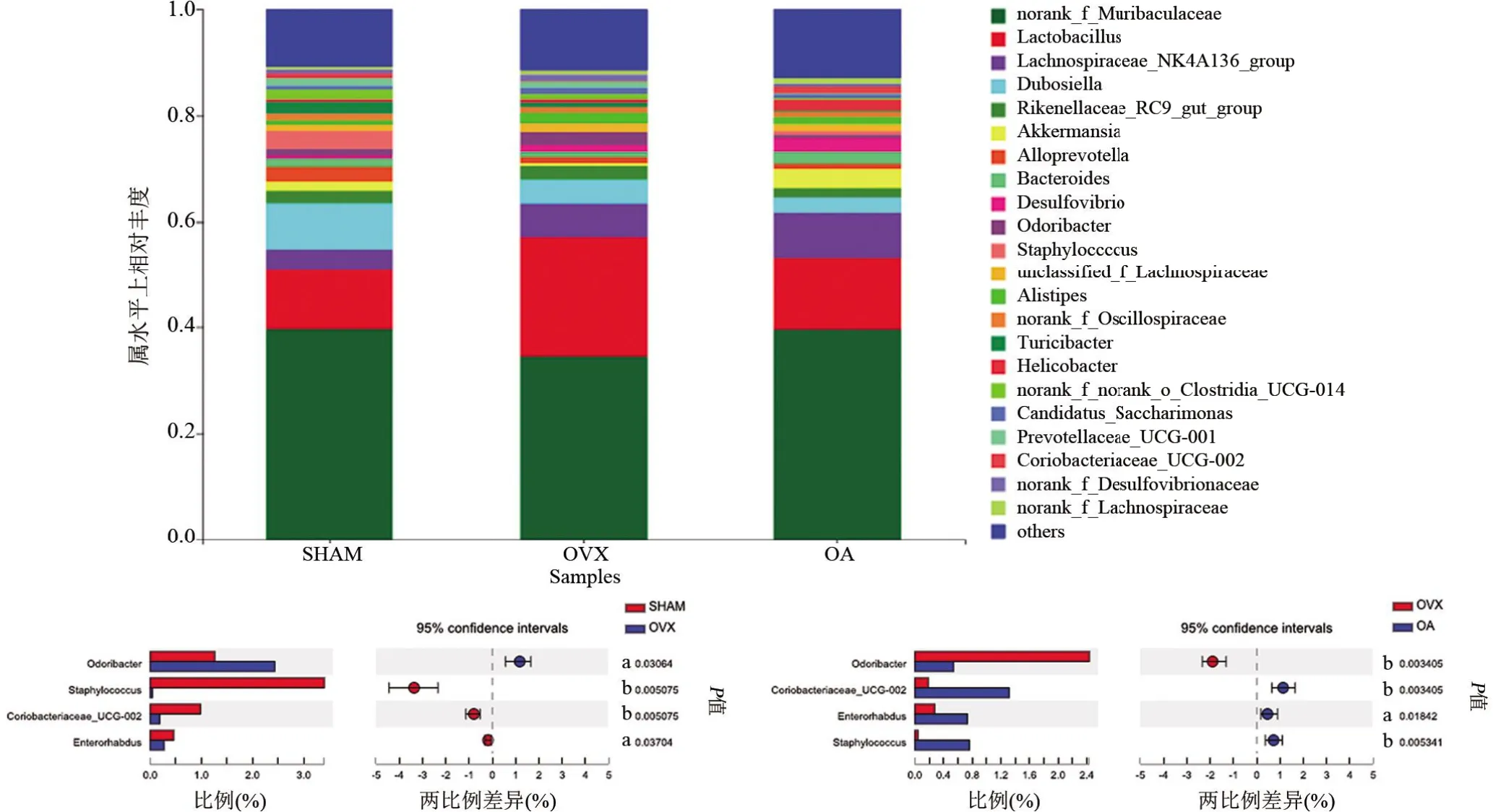
图6 各组小鼠肠道菌群属水平差异分析Figure 6 Difference of the gut microbiota of each group at the genus level
3 讨论
近年来,越来越多的研究表明,肠道菌群不仅可以调节局部反应,还可以调节包括骨代谢在内的全身反应,影响宿主代谢、免疫反应和激素分泌[11]。肠道菌群紊乱会造成成骨细胞和破骨细胞之间的失衡,导致骨量减少、骨质疏松风险增加[12]。中医药在预防和治疗PMO 中起着积极作用,OA通过抑制破骨细胞生成和刺激成骨细胞生成发挥骨保护作用[6-8]。然而目前尚无报道OA对OVX小鼠肠道菌群的影响。因此,本实验观察了OA干预OVX小鼠其骨量、炎性因子及肠道菌群的变化。
TRACP5b是骨吸收敏感指标,能反应破骨细胞活性[13]。β-CTX和P1NP 是目前国际公认的敏感性相对较好地反映骨吸收与骨形成的指标[14]。本研究与既往研究一致[8],OA 可显著增加OVX 小鼠股骨BMD 和BV/TV,显著降低Tb.Sp 和血清TRACP5b、β-CTX 及P1NP含量,提示OA可增加OVX小鼠骨量,抑制骨吸收,促进骨形成,降低骨转换,从而延缓骨丢失。
TNF-α可促进破骨细胞生成,间接激活骨吸收陷窝的形成,使破骨细胞骨吸收功能增强[15]。IL-6 能够刺激破骨细胞活性,抑制成骨细胞活性,从而增加骨吸收,促进骨量流失,诱发骨质疏松[16]。IL-10 对破骨细胞生成有明显的抑制作用[17]。LPS是革兰氏阴性细菌细胞壁的主要成分,可促使炎性细胞因子产生,损害肠道屏障,导致肠道通透性增高[18-19]。本实验发现,OA 能够显著降低OVX 小鼠血清IL-6、TNF-α和LPS水平,显著升高IL-10水平,提示OA可降低OVX小鼠炎性反应,改善肠道通透性,发挥抗骨质疏松作用。
α多样性指数(Chao、Ace、Shannon 指数)代表了小鼠肠道菌群整体上的组成差异,但不能代表细菌相对丰度的差异。因此,本团队更深层次地探究了菌群在门和属级别的差异。有研究发现,在门水平,Actinobacteriota 丰度与BMD 呈正相关[20-21],与本实验一致。OVX小鼠肠道菌群中Actinobacteriota丰度显著升高,OA 干预可显著降低Actinobacteriota 丰度。在属水平,Odoribacter丰度与TNF-α呈显著正相关[22]。Staphylococcus可产生具有抗菌活性的葡萄球菌素,该类物质具有潜在抗炎作用[23]。在葡聚糖硫酸钠(DSS)诱导的小鼠溃疡性结肠炎模型中,Coriobacteriaceae_UCG-002 丰度与血清中IL-6、TNF-α和IL-1β水平呈负相关,与IL-10 水平呈正相关[24]。已证实Enterorhabdus 丰度与促炎因子水平呈负相关,表明其在肠道稳态中起积极作用[25]。本实验发现OVX 小鼠的Odoribacter丰度显著增加,Staphylococcus、Coriobacteriaceae_UCG-002 和Enterorhabdus 丰度显著降低,表明Actinobacteriota、Staphylococcus、Coriobacteriaceae_UCG-002和Enterorhabdus可能是防治骨质疏松的有益菌,而Odoribacter可能是促使骨质疏松发生的有害菌,OA干预可有效改善这种菌群结构,提示这可能是OA防治PMO的潜在作用靶点之一。
综上所述,OA 能够增加OVX 小鼠骨量、延缓骨丢失,其机制可能是通过改善肠道通透性、调节肠道菌群中Actinobacteriota、Staphylococcus、Coriobacteriaceae_UCG-002、Enterorhabdus和Odoribacter丰度及结构、抑制炎性反应实现的。本实验尚存在一定局限,即未验证OA 通过炎性因子及Actinobacteriota、Staphylococcus、Coriobacteriaceae_UCG-002、Enterorhabdus、Odoribacter 调控骨吸收的分子机制,需后续进一步研究证实。
