基于CT的计算机视觉特征和影像组学特征的诺模图术前预测胃腺癌淋巴结转移
2023-12-03彭杨灵沈合松李小芹陈秋智张久权
唐 浩 彭杨灵 沈合松 李小芹 陈秋智 张久权
胃癌(gastric cancer,GC)是全球第五大最常见癌症,也是全球癌症相关死亡率的第三大原因[1]。在2008年100万新诊断的胃癌中,74%的病例发生在亚洲,中国占大约一半[2]。而淋巴结转移(lymph node metastasis,LNM) 是胃癌最常见的转移方式[3]。LNM 是胃癌最常见且重要的预后影响因素,因此,术前评估LNM 对于临床辅助治疗的确定和手术方式的选择是至关重要的[4]。
腹部多期增强CT是胃癌术前评估LNM 的首选影像学方法[2]。以往的研究中,根据淋巴结大小评估,CT 报告的淋巴结状态的准确性大约是60%,这个结果是不令人满意的[5]。准确性低可能导致假阴性和假阳性转移[6]。因此,它在临床上使用受到了限制。
影像组学是一种新兴的方法,可以从医学图像中提取出高通量的定量特征[7]。已有相关研究表明,影像组学具有术前预测胃癌患者LNM 的能力[8],其准确性远优于CT 报告的淋巴结状态。影像组学特征(radiomics features,RFs)是通过数学公式提取得到的,但是这些特征容易受到噪声的影响[9]。
计算机视觉特征(computer vision features,CVFs)广泛应用于医学图像处理[10],且对噪声不敏感。几项研究[9]报道CVFs可用于疾病检测、疾病诊断、肿瘤分化和LNM 的预测,但CVFs 在临床上的应用有限。因此,本研究旨在探索基于CV-score 和R-score 的诺模图用于术前预测胃腺癌(gastric adenocarcinoma,GAC)患者的LNM。
方法
1. 一般资料收集
回顾性收集2013年7月—2018年8月于重庆大学附属肿瘤医院经手术病理证实为胃腺癌患者171 例。纳入标准:①病理证实为胃腺癌;②术前2 周内完成腹部多期增强CT 检查。排除标准:①术前进行新辅助化疗和放疗(n=1);②患有其他恶性疾病(n=1);③未经手术切除(n=115);④胃扩张不良(n=56);⑤具有伪影的CT 图像(n=29),例如呼吸运动伪影、蠕动伪影、食物残渣的影响;⑥CT 图像上很难识别出病变(n=10)。患者招募流程图如图1 所示,患者随机分组:训练组(n=120)和验证组(n=51)。本研究通过医院伦理委员会批准,患者知情同意书被豁免。

图1 患者招募流程图
2. 图像采集
采用2 台CT 扫描仪(SOMATOM Definition AS和SOMATOM DRIVE)行腹部多期增强CT。扫描范围覆盖整个胃部区域,动脉期经肘前静脉以3.0 mL/s的速率注射碘普罗胺(370 mgI/mL),总共80~100 mL(1.5 mL/kg),利用团注追踪技术,扫描在触发阈值(100 HU)后7 s 开始,在动脉期扫描后延迟25 s开始静脉期,平衡期在静脉期扫描后延迟90 s开始。扫描参数:管电压120 kV,参考管电流150~200 mA,螺距1.0,旋转时间0.5 s。重建参数:层厚1.5 mm,层间距1 mm,软组织卷积核(I31)。
3. 图像分析
2 名腹部诊断经验丰富的放射学医师(医师1 和医师2,均具有5年以上腹部CT 诊断经验),在根据CT 图像评估淋巴结状态时,均对病理结果不知情。如有分歧,两者协商达成一致结果。对于胃周淋巴结,短径大于6 mm 被认为是淋巴结阳性;对于胃周外淋巴结,短径大于8 mm被认为是淋巴结阳性[11]。
由腹部放射学医师(医师1) 使用Philips_Radiomics_v94_distribution,在腹部多期增强CT 的静脉期图像上,手动勾画肿瘤最大横截面作为感兴趣区(regions of interest,ROI)。3 个月后,随机选择30 名患者,由医师1 和医师2 再次勾画ROI,以评估观察者内和观察者间ROI的可重复性。
4. 特征选择和模型构建
根据IBSI 参考手册[12],我们使用自制软件对图像特征提取进行了标准化处理。影像组学特征是基于pyradiomics(https://pyradiomics.readthedocs.io/)提取的,使用最小-最大归一化方法在范围[1,100]内对原始图像进行重新缩放。最终提取1 227 个定量的影像组学特征。包括三类定量影像组学特征:①一阶特征,描述肿瘤大小;②形状特征,描述肿瘤形状和强度特性;③纹理特征,描述肿瘤异质性。
从分割图像中来提取计算机视觉特征。包括局部二值模型特征(local binary pattern)594 个、有向梯度直方图特征(histogram of oriented gradients)1 764个、加速鲁棒特征(speeded up robust features)1 280个和haar 样特征(haar-like features)4 096 个。基于Python 3.7 计算得到7 734 个计算机视觉特征(https://www.python.org/)。
为了筛选出关键特征,我们采用由粗到细的特征选择策略。第一步,应用单因素分析(Mann-WhitneyU检验)来比较LNM+和LNM-组间的RFs和CVFs。计算所有特征的P值并按升序排列,选择前5%的特征进行进一步分析。第二步,计算每对特征之间的Pearson 相关系数(r),并检测到较小的P值,其中|r|>0.85。最后,应用一种基于随机森林的Boruta 方法进行关键特征的筛选。经过特征筛选后,这些选定的关键RFs 和CVFs 分别在训练组中通过logistic 回归方法建立术前预测LNM 的识别标志。同时,计算每个患者的R-score和CV-score。
采用单因素分析选择具有统计学意义的临床病理特征(P<0.05)。为了给临床提供一个可视化、个性化的LNM 术前预测模型,使用多因素logistic 回归分析,将筛选出的临床病理特征、R-score 和CV-score构建一个诺模图。通过使用似然比检验,以Akaike的信息标准作为停止规则,进行了向后逐步选择。
对于二元结果(LNM+或LNM-),受试者工作特征(receiver operating characteristic,ROC)曲线的曲线下面积(area under the curve,AUC)用来描述模型的分辨力。校准曲线反映了预测结果和观察结果之间的一致性。决策曲线分析可以量化模型临床实用性。当这两个模型处于最佳诊断截点时,净重分类改进(net reclassification improvement,NRI)用于量化这两个模型之间预测准确性的提高。
5. 统计学分析
结果
1. 临床数据
本研究共计纳入患者171 例,其中男性133 名,女性38 名;年龄27~81 岁,平均年龄为(59.7±9.9)岁。所有患者的临床病理特征如表1 所示。训练组和验证组的LNM+概率无统计学差异(52.50% 对64.70%,P=0.143)。这些临床病理特征在训练组和验证组之间无显著差异(均P>0.05)。

表1 训练组和验证组的临床病理特征
2. 观察者内和观察者间ROI可重复性
观察者内和观察者间ROI 的可重复性较好(ICC分别为0.858和0.862)。
3. 特征筛选和Signature构建
利用上述特征筛选方法,分别选择了6个关键影像组学特征(分别为radiomicsFeatures_WaveletGLDM_wavelet-HLH_DependenceNonUniformity、radiomicsFeatures_NGTDM_Coarseness、radiomicsFeatures_WaveletGLSZMwavelet-HLH_LargeAreaLowGrayLevelEmphasis、radiomicsFeatures_LogarithmGLSZM_logarithm_Large AreaLowGrayLevelEmphasis、radiomicsFeatures_ExponentialGLSZM_exponential_ZonePercentage、radiomicsFeatures_FirstOrder_TotalEnergy)和11个关键计算机视觉特征(分别为surf202、surf1166、hog1486、haar3703、 hog286、 surf1148、 surf190、 surf1187、hog1246、surf930、haar281)。R-signature是使用这6个关键影像组学特征通过logistic回归构建的。同样地,CV-signature由11个关键计算机视觉特征构建。然后,计算每个患者的R-score和CV-score。
4. 诺模图的建立
在训练组中,LNM+患者的R-score(0.514 对0.449,P<0.001) 和CV-score (0.559 对0.436,P<0.001)均显著高于LNM-患者。在年龄、性别、肿瘤部位、CA19-9 水平、CEA 水平和组织学分级,LNM+与LNM-方面差异无统计学意义(均P>0.05)。单因素分析显示,在训练组中,CT 报告的淋巴结阳性患者比CT 报告的淋巴结阴性患者在胃腺癌中具有更高的LNM 风险(P=0.001)。多因素logistic 回归分析结果显示,R-score(OR:1.876;95%CI:1.066~3.586;P=0.041)和CV-score(OR:5.268;95%CI:2.672~12.240,P=0.001) 是术前预测胃腺癌患者LNM 的独立预测因素(表2)。整合R-score 和CVscore 建模形成胃腺癌患者术前预测LNM 的诺模图(图2A)。CT 报告的淋巴结状态在训练和验证组中的预测性能分别为0.64和0.63。
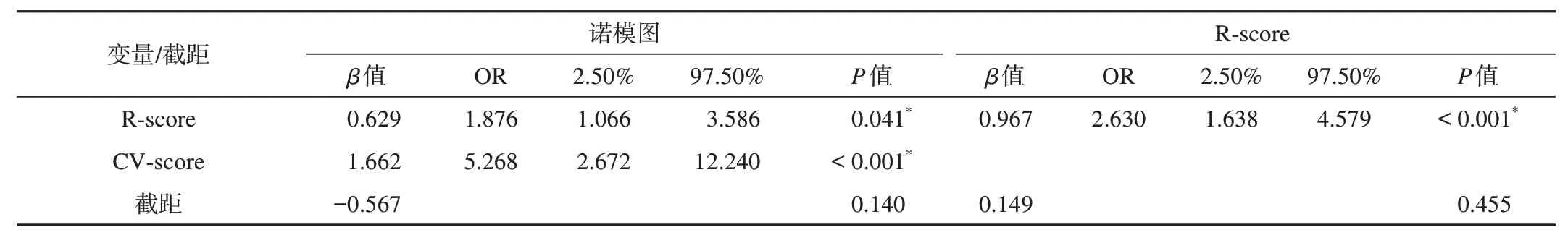
表2 胃腺癌患者淋巴结转移多因素logistic回归分析结果
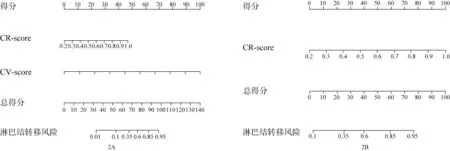
图2 用于预测胃腺癌患者LNM的诺模图
5. 诺模图性能评估及验证
在训练组和验证组中,诺模图术前预测胃腺癌患者LNM 的预测效能良好,AUC 分别为0.850 和0.820。诺模图的AUC 显著高于R-score(在训练组和验证组中,AUC分别为0.730和0.709;DeLong检验:P=0.003 和0.042),如图3A 和图3B 所示。诺模图和R-score 术前鉴别胃腺癌患者LNM 的灵敏度、特异度和准确度见表3。诺模图和R-score 对训练组中LNM概率的校准曲线显示了预测和观察之间具有良好一致性(图3C、图3D)。决策曲线分析表明相比R-score,诺模图有更多的临床受益(图4)。相较于R-score,诺模图的预测效能明显提高(训练组:NRI=0.819,P<0.001;验证组:NRI=1.010,P<0.001)。
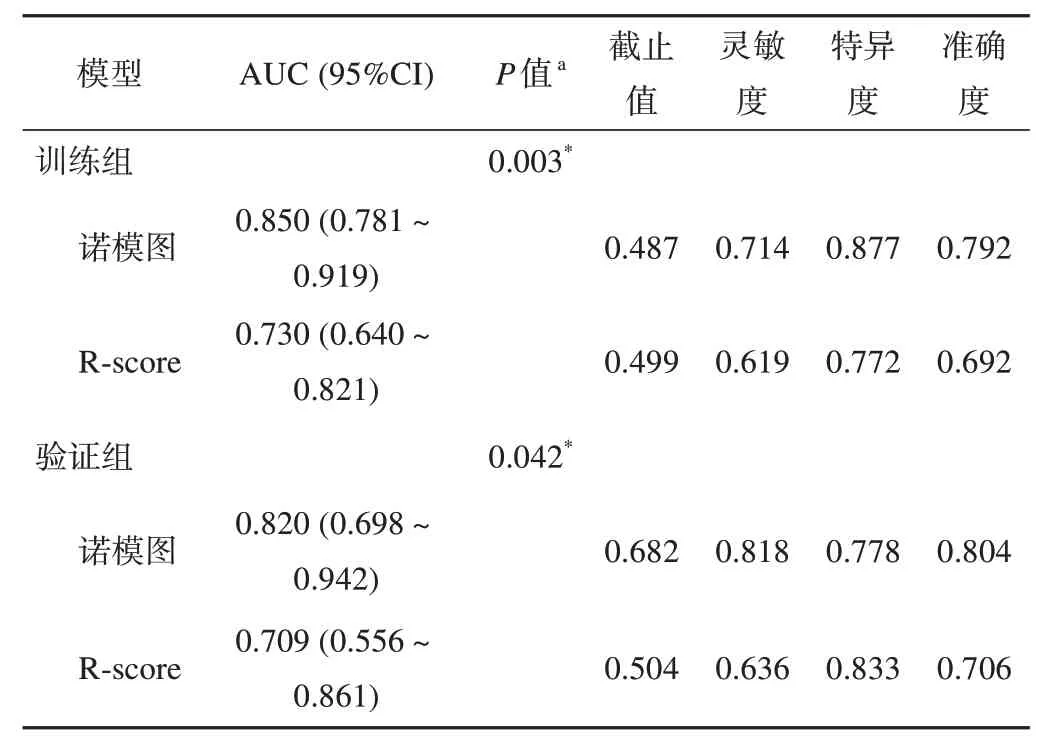
表3 鉴别淋巴结转移的预测性能
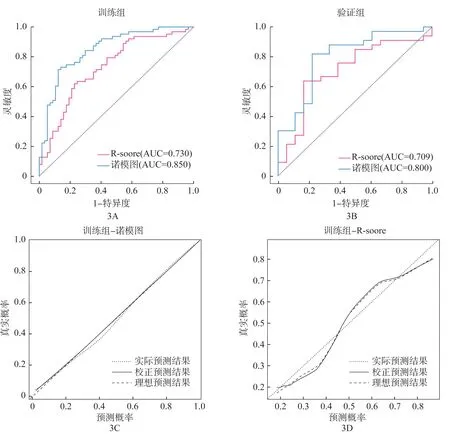
图3 诺模图和R-score在训练组(A)和验证组(B)中的ROC曲线以及训练组诺模图(C)和R-score(D)的校准曲线
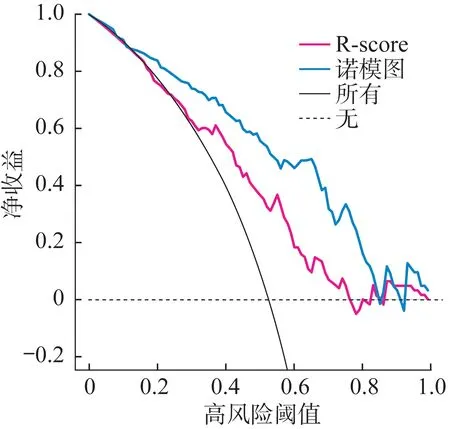
图4 训练组中诺模图和R-score的决策曲线分析
讨论
在本研究中,我们建立并验证了诺模图用于术前预测胃腺癌患者LNM,该图整合了R-score 和CVscore。在训练组和验证组中,诺模图的预测效能均优于单独的R-score(0.850 对0.730,P=0.003;0.820对0.709,P=0.042)。诺模图是一种基于回归模型而创建的图形计算工具,可用于胃腺癌患者术前预测LNM。
术前准确预测LNM 对胃腺癌患者的预后和最佳临床治疗策略的选择具有重要意义。在临床上,腹部多期增强CT是术前检测LNM 最常用的成像方式。在我们的研究中,CT 报告的淋巴结状态在训练和验证组中的预测性能分别为0.64和0.63。我们研究结果与之前的研究一致[5],表明CT 报告的淋巴结状态界定淋巴结大小标准不足以准确预测淋巴结状态。尽管在我们的研究中,CT 报告的淋巴结状态单因素分析结果有统计学意义,但未纳入最终的独立预测因素中,其原因可能是所筛选出的CV-score 和R-score 强大的区分能力大大减弱了CT 报告的淋巴结状态在最终多因素logistic回归模型中的贡献。
R-score在训练组和验证组中的AUC分别为0.730和0.709,与CT报告的淋巴结状态相比,我们发现Rscore 在区分LNM 方面有更好的性能。这与之前的一项研究相似[13],表明影像组学特征比CT 报告的淋巴结状态具有更好的鉴别能力。影像组学转换的高通量定量特征可以反映肿瘤的异质性[14]。这些高通量定量特征是通过数学公式提取的,这些特征易受噪声影响[9]。由于没有预学习过程,计算机视觉特征对噪声不敏感,我们探索了计算机视觉特征在胃腺癌患者术前预测LNM 的有效性。在我们的研究中,CV-score和R-score 是预测胃腺癌患者LNM 的独立预测因子。在胃腺癌患者中,CV-score 和R-score 越高,发生LNM 的风险越高。结合CV-score 和R-score 的诺模图在LNM 预测中的性能优于R-score(DeLong 检验:在训练组和验证组中分别P=0.003 和0.042)。决策曲线分析表明相比R-score,诺模图有更多的临床受益。相较于R-score,诺模图的预测效能明显提高(训练组:NRI=0.819,P<0.001;验证组:NRI=1.010,P<0.001),表明CV-score 的添加可以提高诺模图性能。这一结果与Wu等[9]的研究结果一致。尽管他们的研究对象是食管鳞癌患者,但结果仍然表明计算机视觉特征的加入显著提高模型的重新分类能力。计算机视觉特征能获得更加详细的、不能被数学公式定义的肿瘤信息。
我们的研究有几个局限性。首先,这是一个回顾性的单中心研究,样本量较少。第二,计算机视觉在胃癌中的应用尚不成熟,有待大样本的进一步研究。第三,本研究特征是基于2D ROI提取。尽管3D特征可以提供更多的信息,但是以往的一些研究表明,与2D 特征相比,3D 特征并没有显著的改善[15]。最后,本研究仅关注了胃腺癌患者的二元分类(有/无LNM)。准确预测N分期有待进一步研究。
总之,诺模图结合CV-score 和R-score 对胃腺癌患者LNM 的预测优于单纯的R-score。作为一种非侵入性的方法,诺模图提供了对LNM 的个体化术前评估,并可能提高临床决策的信心。
