烟草靶斑病LFD-RPA快速检测方法的建立
2023-12-03黎妍妍邱梦娟李锡宏张艺千徐婷婷许汝冰马畔郑露李伦安黄俊斌
黎妍妍 邱梦娟 李锡宏 张艺千 徐婷婷 许汝冰 马畔 郑露 李伦安 黄俊斌






摘 要:烟草靶斑病是由立枯丝核菌(Kühn)侵染引起的烟草叶部病害,近年来在我国部分省份发生严重,危害烟草生产。为开发烟草靶斑病的早期快速诊断方法,本研究根据该病原菌的内转录间隔区(ITS),设计了重组酶聚合酶扩增技术相关引物RsRPA-F3/R3,建立了一种靶斑病菌的重组酶聚合酶扩增结合侧流层析试纸条(LFD-RPA)检测方法。该方法能够在37 ℃,15 min内特异性地检测到(1.40×10 copies/µL)质粒DNA,与常规PCR灵敏度一致。在田间烟草靶斑病实时检测中,准确率达95.83%。本方法具有快速、简单、可视化等特点,为烟草靶斑病菌的田间快速诊断提供了技术支撑。
关键词:烟草靶斑病;立枯丝核菌;重组酶聚合酶扩增技术;侧流层析试纸条
中图分类号:S435.72 文献标识码:A 文章編号:1007-5119(2023)05-0062-08
Establishment of LFD-RPA Rapid Detection Technique for Tobacco Target Spot
LI Yanyan, QIU Mengjuan, LI Xihong, ZHANG Yiqian, XU Tingting,
XU Rubing, MA Pan, ZHENG Lu, LI Lun’an, HUANG Junbin
(1. Tobacco Research Institute of Hubei Province, Wuhan 430030, China; 2. College of Plant Science and Technology, Huazhong Agricultural University, Hubei Provincial Key Laboratory for Crop Disease Monitoring and Safety Control, Wuhan 430070, China;3. Enshi Marketing Department in Enshi company of Hubei Tobacco company, Enshi, Hubei 445000, China)
Target spot caused by Kühn is a tobacco leaf disease. In recent years, it has occurred seriously in some provinces of China, which endangers tobacco production. In this study, the recombinant enzyme polymerase technology related primers RsRPA-F3/R3 were designed according to the internal transcribed spacer (ITS) of the pathogen, and a method of recombinase polymerase amplification combined with a lateral flow dipstick (LFD-RPA) was developed to establish early and rapid diagnosis technique for tobacco target spot disease. The LFD-RPA detection technology could detect plasmid DNA of (1.40×10 copies/µL) within 15 min at 37 ℃. The sensitivity was consistent with that of conventional PCR. The detection technology can be applied to the real-time detection of tobacco target spot disease in the field with a 95.83% accuracy rate. The rapid detection technology established in this study has the characteristics of fast, simple and visual, and provides a new method for the rapid field diagnosis of tobacco target spot.
tobacco target spot; ; recombinase polymerase amplification (RPA); lateral flow dipstick (LFD)
基金项目:湖北省烟草公司科技项目(027Y2021-004、027Y2022-020);中国烟草总公司重大科技项目[110202101045(LS-05)]
作者简介:黎妍妍(1982-),博士,研究員,主要从事烟草绿色防控技术创新与推广工作。E-mail:yanyanli0025@126.com
*通信作者。E-mail:李伦安,32616727@qq.com;黄俊斌,junbinhuang@mail.hzau.edu.cn
收稿日期:2023-06-29 修回日期:2023-09-11
烟草靶斑病是由立枯丝核菌(Kühn)侵染引起的烟草叶部病害,有性世代为瓜亡革菌[ (Frank) Donk]。烟草靶斑病于2006年在我国辽宁省丹东市首次报道,随后该病害在广西、黑龙江、吉林、云南、四川、湖南、贵州、湖北等地相继发现。 具有菌丝融合现象,至今被报道14个融合群,包括AG-1到AG-13与桥接群AG-BI,国内外侵染烟草造成烟草靶斑病的主要是AG-3融合群 。 可在一个生长季节多次进行再侵染,从而导致烟草靶斑病极易扩散传播,给烟草产业造成重大经济损失。
植物病害的快速诊断技术可为病害的及时防控提供重要参考依据。植物病原真菌检测和鉴定主要采用常规组织分离法对田间病害样品进行分离,再进一步对分离物使用柯赫氏法则验证,操作程序复杂,且鉴定过程存在的人为误差可能影响试验结果。分子生物学检测技术的出现解决了传统检测技术耗时长、准确率低的弊端,常规PCR、实时荧光定量PCR、巢氏PCR、多重PCR等技术已用于烟草黑胫病、根黑腐病、青枯病、猝倒病等烟草病害的检测,但这些检测技术均需要价格昂贵的热循环仪等设备,易受到设备条件限制。
重组酶聚合酶扩增技术(Recombinase ploymerase amplication,RPA)是一种新型恒温核酸扩增技术,与PCR相比,操作简便、反应快速、灵敏度高、特异性强,是一种可以替代PCR 的核酸检测技术。与侧流层析试纸条(Lateral flow dipstick,LFD)结合的LFD-RPA检测方法通过在基础体系中加入核酸外切酶Ⅳ、生物素(Biotin)标记的引物,并携带荧光基团(FAM)的探针,最终形成5′端带有FAM、3′端带有Biotin标记的产物。当产物加入定量的缓冲液后可分别与试纸条上的Biotin抗体和FAM抗体发生抗原抗体反应,从而在检测线上显色。该方法操作简单,仅需肉眼就可完成反应结果的判别,不需借助其他设备或仪器,在短时间内可完成大量样品的检测,在口岸与田间检测中具有极大的应用潜力。
迄今为止,LFD-RPA检测技术已广泛应用在食品、人体和动物病原微生物以及植物病原微生物的检测中。但目前关于丝核菌属LFD-RPA检测的报道较少,仅鞠玉亮等以小麦纹枯病菌()的ITS(Internal Transcribed Spacer,内转录间隔区)序列为靶标基因建立了Rc-LFD-RPA技术,尚未见烟草靶斑病菌LFD-RPA检测方法的报道。本研究根据烟草靶斑病菌ITS序列建立RPA扩增技术与LFD试纸条结合的LFD-RPA检测方法,为烟草靶斑病的田间快速可视化检测提供重要参考依据和技术支持。
1 材料与方法
1.1 材料
1.1.1 供试菌株 本研究供试菌株信息见表1, AG-3 PT菌株由沈阳农业大学吴元华教授提供。其他菌株经组织分离、柯赫氏法则验证、形态学与分子鉴定后,由华中农业大学植物真菌病害研究室保藏。
1.1.2 试剂 2×Heff PCR Master购自上海翊圣生物科技有限公司;NaOH溶液购自上海国药集团化学试剂有限公司;Tris⁃HCl(pH=8.0)购自北京Solarbio公司;荧光定量PCR试剂盒(2× Green qPCR SuperMix)和-T1Cloning Kit购自北京全式金公司;大肠杆菌DH5α由日本Takara公司提供;TIANprep Mini Plasmid Kit(质粒小提试剂盒)由北京天根生物科技有限公司提供;土壤DNA提取试剂盒(EZNA® Soil DNA Kit)和DNA纯化试剂盒(DNA Pure Cycle Kit)购自美国Omega Bio-Tek公司;TwistAmp® Basic Kit(核酸等温扩增试剂盒)与Milenia HybriDetect试纸条购买于英国TwistDX公司;RPA核酸扩增试剂盒(试纸条法)购自江苏奇天基因生物科技有限公司;DNA纯化试剂盒(DNA Pure Cycle Kit)购自美国Omega Bio-Tek公司;10×Loading Buffer购于日本Takara公司。
1.2 方法
1.2.1 基因组DNA提取 供试菌株基因组DNA提取:将所有供试菌株均置于PDA平板25 ℃恒温培养箱培养,挑取边缘菌丝块于新鲜PDA平板25 ℃恒温培养7 d后使用CTAB法提取真菌基因组DNA。
田间烟草病害样品DNA提取:使用NaOH快速裂解法提取,每毫克烟草叶片组织中加入10 μL 的0.5 mol/L NaOH溶液,在研钵中将植物组织充分磨碎成糊后,转入1.5 mL离心管中;12 000 r/min离心6 min;取上清液5 μL,加入495 μL 0.1 mol/L Tris-HCl(pH=8.0),混合均匀,得到含有靶斑病菌的烟草基因组DNA溶液。
1.2.2 引物筛选与探针设计 根据TwistDX官网(www.twistdx.co.uk)提供的引物与探针设计原则,选择AG-3的ITS序列靶标基因,设计烟草靶斑病RPA上、下游引物。利用DNAMAN软件将 AG-3 ITS序列(HQ241274.1)和GenBank数据库中已报道的我国各省份烟草靶斑病菌进行序列比对,选择特异性区域,使用Primer primer 5.0软件设计引物RsRPA-F1/R1、RsRPA-F2/R2和RsRPA-F3/R3(表2)。使用TwistAmp® Basic Kit等温扩增,扩增体系为:29.5 µL Rehydration Buffer、2.4 µL F/R(10 µmol/L)、12.2 µL ddHO以及1 µL分离菌株XFQJ2-4的基因组DNA(40 ng/µL),然后将预混液加到含有冻干酶粉的TwistAmp® Basic反应管中,涡旋振荡后再加入2.5 µL MgAc(280 nmol/L)激活反应,将反应管放入PCR仪中于39 ℃、30 min孵育。选择与烟草靶斑病为害症状相似的烟草炭疽病菌()、烟草赤星病菌()和烟草茎点霉叶斑病菌()的DNA,进行Basic-RPA反应,初步筛选RPA引物的特异性。扩增产物使用DNA Pure-cycle Kit纯化后,吸取4 µL扩增产物与1 µL的10×Loading Buffer混合,使用1%琼脂糖凝胶进行显色反应检测。根据初筛后的引物设计LFD-RPA相關探针。
1.2.3 LFD-RPA检测方法的建立 使用RPA核酸扩增试剂盒(试纸条法)进行LFD-RPA检测,反应体系:25 µL缓冲液V、2.1 µL Primer RsRPA-F3、2.1 µL RsBio-R3、0.6 µL探针RsRPA-P(引物和探针浓度为10 µmol/L)、15.7 µL ddHO、2 µL DNA模板。将预混液加入到含有冻干酶粉的反应管中,最后加入2.5 µL的乙酸镁激活反应,将反应管放入PCR仪中37 ℃孵育15 min。吸取5 µL反应产物加入到100 µL HybriDetect分析缓冲液中,室温下孵育3~5 min,然后将侧流试纸条样品端浸入反应管中,在3~5 min内观察质控线和检测线是否出现有颜色条带。如质控线和检测线均出现条带,则为阳性结果;如质控线出现条带,而检测线未出现条带,则判定为阴性结果。
1.2.4 LFD-RPA检测灵敏度评价 将稀释好的1.40×10、1.40×10、1.40×10、1.40×10、1.40×10、1.40×10 copies/µL六个浓度梯度的质粒DNA进行常规PCR、荧光定量PCR与LFD-RPA检测,每个处理3次重复。同时将LFD-RPA反应产物纯化回收后使用1%琼脂糖凝胶电泳进行显色反应。
1.2.5 LFD-RPA检测特异性评价 选择与烟草靶斑病病害症状相似、常见烟草真菌病害以及水稻纹枯病病原菌的DNA进行特异性检测,供试菌株见表1,同时将LFD-RPA反应产物纯化回收后使用1%琼脂糖凝胶电泳进行显色反应。
1.2.6 田间自然发病样品的LFD-RPA检测 将田间自然发病样品按常规组织分离法进行病原菌的分离,将能分离得到 AG-3的样品记为阳性样品,未能分离得到 AG-3的样品记为阴性样品,阳性样品和阴性样品按照1.2.1的方法提取DNA后进行LFD-RPA检测,每个处理3次重复,同时将LFD-RPA反应产物纯化回收后使用1%琼脂糖凝胶电泳进行显色反应。
1.2.7 常规PCR和荧光定量PCR检测 使用 AG-3融合群荧光定量PCR特异性引物RsTqF1(5′-AAGAGTTTGGTTGTAGCTGGTCTA TTT-3′)/RsTqR1(5′-AATTCCCCAACTGTCTCA CAAGTT-3′)用于常规PCR检测。常规PCR扩增体系(总体系为25 µL):2×HeffTM PCR Master Mix 12.5 µL,RsTqF1 1 µL,RsTqR1 1 µL,DNA模板1 µL,ddHO 9.5 µL。PCR反应程序:94 ℃预变性5 min;94 ℃变性30 s,63 ℃退火30 s,72 ℃延伸15 s,35个循环;72 ℃终延伸5 min。
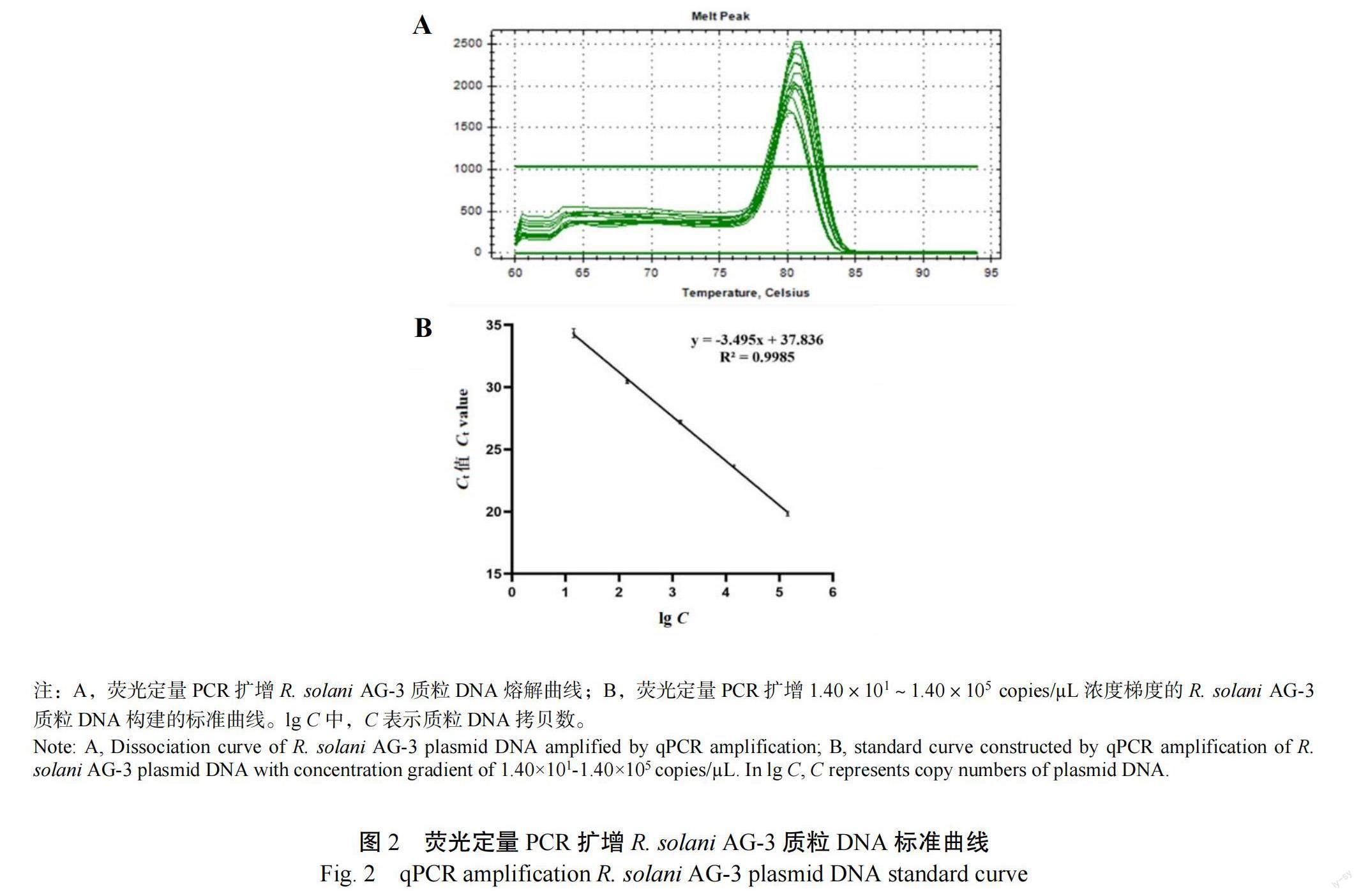
PCR产物经1%琼脂糖凝胶电泳检测后使用DNA Pure Cycle Kit回收,克隆至pEASY®-T1载体,转至大肠杆菌感受态DH5α细胞中,经含有氨苄抗性的LB固体培养基筛选后,获得阳性转化子并测序。将测序成功的阳性转化子转入LB液体培养基中,于37 ℃,200 r/min振荡培养12 h后使用TIANprep Mini Plasmid Kit提取过表达质粒DNA,使用NanoDrop™ Lite分光光度计测定质粒DNA浓度为61.7 ng/µL,质粒拷贝浓度(copies/µL)=6.02×10×质粒质量浓度(g/µL)/质粒分子质量(g/mol),质粒分子质量(g/mol)=质粒碱基数(bp)×650 da/bp。式中质粒碱基数为4026 bp(其中-T1载体片段大小为3928 bp,目的片段扩增长度为98 bp),计算得到质粒DNA拷贝数为1.40×10 copies/µL。将稀释好的1.40×10~1.40×10 copies/µL 5个浓度梯度的质粒DNA进行实时荧光定量PCR检测,扩增体系为:10 µL 2× Green qPCR SuperMix,10 μmol/L上、下游引物RsTqF1/RsTqR1各0.4 µL,模板DNA 2 µL,加入ddHO补足到20 µL。荧光定量PCR反应在CFX96 Real-time PCR System中进行,反应程序为:初始阶段95 ℃ 15 min,95 ℃反应15 s,56 ℃反应30 s,共扩增40个循环。熔解曲线的检测中,从60 ℃到95 ℃每30 s增加0.5 ℃。每个浓度处理3次,荧光定量PCR扩增完成后,根据值()与其相对应的质粒DNA拷贝数的对数()在Microsoft Office Excel 2016中绘制标准曲线并计算相关系数。
2 结 果
2.1 引物的筛选
对设计的3对RPA引物进行初筛,产物纯化后经1%琼脂糖凝胶电泳检测,结果表明(图1),RsRPA-F1/R1与RsRPA-F2/R2引物专化性较差,其他参考菌株也出现扩增条带;而RsRPA-F3/R3引物仅能检测到 AG-3分離菌株XFQJ2-4的基因组DNA,其他菌株无扩增条带。因此,选取RsRPA-F3/R3引物设计探针并进行后续LFD-RPA试验。
2.2 荧光定量PCR标准曲线的建立
使用10倍梯度浓度的质粒DNA进行荧光定量PCR扩增,结果表明,该引物熔解曲线峰值单一(图2A),值为80.5 ℃,表明该引物为特异性扩增引物;根据值()与其相对应的质粒DNA拷贝数的对数()绘制标准曲线(图2B),线性回归方程为=−3.495+37.836,决定系数²=0.998 5,扩增效率=93.25%,符合高效率扩增条件。
2.3 LFD-RPA检测灵敏度评价
灵敏度试验结果表明(图3),浓度为1.40×10~1.40×10 copies/µL的 AG-3质粒DNA均能够在LFD试纸条上出现检测线,结果呈阳性,其中1.40×10 copies/µL浓度的质粒DNA的检测线微弱;而浓度为1.40×10 copies/µL与1.40×10 copies/µL的AG-3质粒DNA在LFD试纸条上只能够显出质控线,结果呈阴性。常规PCR检测结果与琼脂糖凝胶电泳检测结果和LFD方式检测结果一致。然而,荧光定量PCR检测1.40×10 copies/µL浓度的质粒DNA时,值<35,说明LFD-RPA检测技术的灵敏度与常规PCR一致,略低于荧光定量PCR。
2.4 LFD-RPA检测特异性评价
分别使用琼脂糖凝胶电泳和LFD对表1中18个菌株的DNA扩增产物进行检测,结果表明(图4):2个菌株(XFQJ2-4和XEHL3-5)与标准菌株 AG-3 PT扩增条带清晰,LFD出现检测线,结果呈阳性;而其他菌株检测结果呈阴性,与琼脂糖凝胶电泳的检测结果一致。
2.5 田间自然发病样品的LFD-RPA检测效果
对32个田间自然发病样品进行了常规组织分离、凝胶电泳检测和LFD-RPA检测。根据常规组织分离法分离结果,1~24号样品能够分离到烟草靶斑病病原菌,25~32号样品未分离到该病原菌。琼脂糖凝胶电泳检测结果与常规组织分离法分离结果一致(图5),1~24号样品均能扩增出大小为207 bp的条带,为阳性样品;而25~32号样品无扩增条带,为阴性样品。在LFD-RPA检测结果中,24个阳性样品中有1个检测为阴性(样品9),为假阴性,其他23个阳性样品均出现检测线,8个阴性样品的检测结果与常规组织分离法和琼脂糖凝胶电泳检测结果一致,仅出现质控线,说明LFD-RPA检测体系的准确率为95.83%。
3 讨 论
前人对融合群的ITS序列进行了分析,本研究将AG-3的ITS序列作为RPA检测体系的靶标序列设计RPA引物,同时与LFD结合建立了烟草靶斑病的LFD-RPA快速检测方法。该方法能够在37 ℃,15 min内特异性检测到浓度为1.40×10 copies/µL的质粒DNA,与常规PCR灵敏度一致,略低于荧光定量PCR。将该方法应用于田间烟草靶斑病病害样品中,发现能够以约95%的检出率特异性地检测烟草靶斑病田间样品。该方法特异性高、操作简便、反应迅速,结果可视化,无需使用大型设备,可用于田间靶斑病样品的实时检测。
的快速检测方式主要包括多重PCR、荧光定量PCR、巢式PCR等,近些年随着核酸等温扩增技术的发展,LAMP检测技术也广泛地应用于的检测中。张照茹根据水稻纹枯病菌( AG1-IA)的rDNA-ITS序列建立的RS-ITS-LAMP快速检测体系,根据羟基萘酚蓝(HNB)颜色反应可观察到该体系的最低检测极限为1 pg/μL,是普通PCR的100倍,该检测方法具有高特异性,能够从其他融合群中特异性识别出AG1-IA。肖艳松等根据 AG-3的ITS序列设计的荧光LAMP检测体系能够特异性检测烟草靶斑病菌,检测的最低DNA浓度为100 pg/μL。目前关于丝核菌属LFD-RPA检测的报道较少,鞠玉亮等以小麦纹枯病菌()的ITS序列为靶标基因建立的Rc-LFD-RPA技术,可在38 ℃的等温环境中30 min完成检测,检测极限为1 pg/μL,与常规PCR检测极限一致,为丝核菌属真菌的LFD-RPA检测技术提供了重要参考依据和技术支持。暂未有烟草靶斑病(AG-3)LFD-RPA快速检测技术的报道,因此本研究结果可填补该领域的技术空白。
虽然本研究建立的LFD-RPA检测灵敏度较荧光定量PCR略低,但可以满足田间环境下对该病害的检测,其快速扩增与操作简便等优势明显优于荧光定量PCR。该体系存在假阴性误差的原因,主要有检测样品的纯度,操作过程引起的误差等,本研究使用NaOH快速裂解法提取田间样品的DNA可能导致提取的DNA纯度较差,扩增体系中可能存在干扰物质影响LFD检测线上的Biotin抗体与产物发生抗原抗体反应,从而影响在检测线上的显色;又或者使用LFD方式进行终端检测时,需要将LFD试纸条插入稀释后的扩增产物反应3~5 min,开盖面临环境核酸气溶胶污染的风险,从而导致结果存在误差。近年来一次性封闭式核酸检测装置的研发可使该问题得到一定改善。
4 结 论
本研究根据烟草靶斑病菌的ITS序列设计LFD-RPA引物与探针,开发了一种能够特异性检测 AG-3融合群的可视化快速检测方法,经过反复验证,该方法能够特异性检测烟草靶斑病田间样品,可应用到该病害的田间快速检测中。
参考文献
[1]吴元华,王左斌,刘志恒,等. 我国烟草新病害—靶斑病[J]. 中国烟草学报,2006,(6):22,51.
WU Y H, WANG Z B, LIU Z H, et al. Tobacco target spot disease: a new tobacco disease in China[J]. Acta Tabacaria Sinica, 2006, (6): 22, 51.
[2]XIA B, XU C T, XU J K, et al. First report of target leaf spot on flue-cured tobacco by Rhizoctonia solani AG-3 in Sichuan, China[J]. Plant Disease, 2019, 103(3): 581.
[3]苏燕妮,董雪,赵艳琴,等. 东北地区烟草靶斑病菌(Rhizoctonia solani)融合群、致病力分化及品种抗病性研究[J]. 植物保护,2016,42(1):170-174.
SU Y N, DONG X, ZHAO Y Q, et al. Anastomosis groups, pathogenicity differentiation of Rhizoctonia solani from tobacco target spot in the Northeast China and the disease resistance of tobacco varieties[J]. Plant Protection, 2016, 42(1): 170-174.
[4]譚海文. 广西烟草真菌性病害调查[D]. 南宁:广西大学,2012.
TAN H W. Investigation on fungal diseases of tobacco in Guangxi[D]. Nanning: Guangxi University, 2012.
[5]聂忠扬,林松,祖庆学,等. 贵州烟区靶斑病病原菌的融合群研究与戊唑醇室内毒力测定[J]. 安徽农业科学,2022,50(7):137-140.
NIE Z Y,LIN S,ZU Q X,et al. Study on anastomosis group and tebuconazole effect of target spot on tobacco in Guizhou[J]. Journal of Anhui Agricultural Sciences, 2022, 50(7): 137-140.
[6]邱梦娟,黎妍妍,徐婷婷,等. 湖北省烟草靶斑病病原鉴定及其菌丝融合群遗传分化研究[J]. 中国烟草科学,2022,43(5):50-55.
QIU M J,LI Y Y,XU T T,et al. Identification and anastomosis group study of tobacco target spot in Hubei Province[J]. Chinese Tobacco Science, 2022, 43(5): 50-55.
[7]肖艳松,钟权,吴文信,等. 湖南烟草靶斑病的病原鉴定及分子检测[J]. 湖南农业大学学报(自然科学版),2020,46(6):711-715.
XIAO Y S, ZHONG Q, WU W X, et al. Pathogen identification and molecular detection of tobacco target spot in Hunan Province[J]. Journal of Hunan Agricultural University (Natural Sciences), 2020, 46(6): 711-715.
[8]侯慧慧,孙剑萍,刘子仪,等. 云南烟草靶斑病(Rhizoctonia solani Kühn)病原鉴定及其融合群研究[J]. 沈阳农业大学学报,2018,49(2):203-208.
HOU H H, SUN J P, LIU Z Y, et al. Identification and anastomosis groups of tobacco target spot disease (Rhizoctonia solani Kühn) in Yunnan tobacco planting areas[J]. Journal of Shenyang Agricultural University, 2018, 49(2): 203-208.
[9]JOHNK J S, JONES R K H, SHEW H D, et al. Characterization of populations of Rhizoctonia solani AG-3 from potato and tobacco[J]. Phytopathology, 1993, 83: 854-858.
[10]WU Y H, ZHAO Y Q, FU Y, et al. First Report of target spot of flue-cured tobacco caused by Rhizoctonia solani AG-3 in China[J]. Plant Disease, 2012, 96(12): 1824.
[11]XU M L, HAO K Q, YANG J G, et al. First report of Rhizoctonia solani AG-3 causing tobacco target spot in Yunnan, China[J]. Plant Disease, 2018, 102(10): 2038.
[12]LI B, XIE S, LIU P, et al. Development and application of nested PCR assays for detection of Ralstonia solanacearum in tobacco[J]. Chinese Journal of Tropical Crops, 2014, 35(11): 2230-2235.
[13]劉萍花,方敦煌,吴祖建. 应用多重PCR检测烟草黑胫病菌、根黑腐病菌、猝倒病菌及立枯病菌[J]. 福建农林大学学报(自然科学版),2015,44(4):345-349.
LIU P H, FANG D H, WU J Z, et al. Triplex PCR detection of Ralstonia solanacearum, Phytophthora nicotianae and Pythium aphanidermatum from Infected Tobacco Tissues[J]. Journal of Fujian Agriculture and Forestry University (Natural Science Edition), 2015, 44(4): 345-349.
[14]PIEPENBURG O, WILLIAMS C H, STEMPLE DL, et al. DNA detection using recombination proteins[J]. PLOS Biology, 2006, 4(7): 1115⁃1121.
[15]KIM T H, PARK J, KIM C J, et al. Fully integrated Lab-on-a-Disc for nucleic acid analysis of food-borne pathogens[J]. Analytical Chemistry, 2014, 86(8): 3841-3848.
[16]CAO Y H, YAN D K, WU X Y, et al. Rapid and visual detection of milk vetch dwarf virus using recombinase polymerase amplification combined with lateral flow strips[J]. Virology Journal, 2020, 17(1): 102.
[17]周瑩,岳瑾,李云龙,等. 重组酶介导的等温扩增技术及其在植物病原检测中的应用[J]. 中国植保导刊,2020,40(6):27-31.
ZHOU Y, YUE J, LI Y L, et al. Recombinase polymerase amplification and its applications in plant pathogens detection[J]. China Plant Protection, 2020, 40(6): 27-31.
[18]MONDAL D, GHOSH P, KHAN M A, et al. Mobile suitcase laboratory for rapid detection of Leishmania donovani using recombinase polymerase amplification assay[J]. Parasit Vectors, 2016, 9(1): 281.
[19]PANG J, ZHAO C, SU H, et al. Rapid visual detection of Enterocytozoon hepatopenaei by recombinase polymerase amplification combined with lateral flow dipstick[J]. Frontiers in Marine Science, 2022, 9: 1-10.
[20]GUO Q, ZHOU K, CHEN C, et al. Development of a recombinase polymerase amplification assay for Schistosomiasis Japonica diagnosis in the experimental mice and domestic goats[J]. Frontiers in Cellular and Infection Microbiology, 2021, 11: 791997.
[21]LIU W, LIU H X, ZHANG L, et al. A novel isothermal assay of Borrelia burgdorferi by recombinase polymerase amplification with lateral flow detection[J]. International Journal of Molecular Sciences, 2016, 17(8): 1250.
[22]张珊珊,李楠,郝镯,等. 布鲁氏菌RPA-LFD快速检测方法的建立与应用[J]. 中国兽医科学,2021,51(10):1215-1220.
ZHANG S S, LI N, HAO Z, et al. Development and evaluation of a rapid visualization detection method for Brucella based on RPA-LFD[J]. Chinese Veterinary Science, 2021, 51(10): 1215-1220.
[23]CHI Y K, ZHAO W, YE M D, et al. Evaluation of recombinase polymerase amplification assay for detecting Meloidogyne javanica[J]. Plant Disease, 2020, 104(3): 801-807.
[24]LI C F, JU Y L, SHEN P F, et al. Development of recombinase polymerase amplification combined with lateral flow detection assay for rapid and visual detection of Ralstonia solanacearum in tobacco[J]. Plant Disease, 2021, 105(12): 3985-3989.
[25]DAI T, HU T, YANG X, et al. A recombinase polymerase amplification-lateral flow dipstick assay for rapid detection of the quarantine citrus pathogen in China, Phytophthora hibernalis[J]. PeerJ, 2019, 7: e8083
[26]DAI T, YANG X, HU T, et al. Comparative evaluation of a novel recombinase polymerase amplification-lateral flow dipstick (RPA-LFD) assay, LAMP, conventional PCR, and leaf-disc baiting methods for detection of Phytophthora sojae[J]. Frontiers in Microbiology, 2019, 10: 188.
[27]鞠玉亮,沈鵬飞,冯艳娟,等. 小麦纹枯病菌Rc-RPA-LFD快速检测方法的建立及应用[J]. 植物病理学报,2020,50(5):618-621.
JU Y L, SHEN P F, FENG Y J, et al. Development and application of Rc-RPA-LFD for the rapid detection of Rhizoctonia cereal[J]. Acta Pharmacologica Sinica, 2020, 50(5): 618-621.
[28]王燕,王春伟,王琳,等. 樱桃灰霉病菌LFD-RPA快速检测方法的建立[J]. 植物病理学报,2020,50(2):238-245.
WANG Y, WANG C W, WANG L, et al. Development of LFD-RPA assay for rapid detection of Botrytis cinerea in cherry[J]. Acta Pharmacologica Sinica, 2020, 50(2): 238-245.
[29]LEES A K, CULLEN D W, SULLIVAN L, et al. Development of conventional and quantitative real-time PCR assays for the detection and identification of Rhizoctonia solani AG-3 in potato and soil[J]. Plant Pathology, 2002, 51(3): 293-302.
[30]吴元华,伏颖,赵秀香,等. 烟草靶斑病菌菌丝融合群及ITS序列分析[J]. 植物病理学报,2013,2(43):215-218.
WU Y H, FU Y, ZHAO X X, et al. The anastomosis groups and ITS sequence analysis of Rhizoctonia solani isolates of tobacco target spot[J]. Acta Pharmacologica Sinica, 2013, 2(43): 215-218.
[31]张照茹. 水稻纹枯病菌及稻曲病菌LAMP检测体系的建立与应用[D]. 沈阳:沈阳农业大学,2020.
ZHANG Z R. Establishment and Application of loop-mediated isotheral amplication (LAMP) in detection of Rhizoctonia solani AG1-IA and Ustilaginoidea virens[D]. Shenyang: Shenyang Agricultural University, 2020.
[32]肖艳松,曹志辉,李武进,等. LAMP引物组包含其的用于烟草靶斑病检测的试剂盒及其应用和检测方法:CN112442548A[P]. 2021-03-05.
XIAO Y S, CAO Z H, LI W J, et al. The LAMP primer group includes its kit for the detection of tobacco target spot disease and its application and detection method: CN112442548A[P]. 2021-03-05.
