TMV、CMV和PVY三重荧光定量PCR同步检测方法的建立
2023-12-03白静科牛龙龙吴彦辉李建华李小杰李成军李淑君
白静科 牛龙龙 吴彦辉 李建华 李小杰 李成军 李淑君



摘 要:為建立同时检测烟草普通花叶病毒(TMV)、黄瓜花叶病毒(CMV)和马铃薯Y病毒(PVY)的多重荧光定量PCR方法,本研究根据GenBank中TMV、CMV及PVY的CP基因保守序列设计引物和探针,并对反应体系进行了优化,建立了可同时检测TMV、CMV和PVY的三重荧光定量PCR方法,并评价了该方法的敏感性、特异性、重复性及准确性。结果显示,建立的方法中TMV、CMV和PVY的检测下限分别为2.60×10、1.25×10、2.33×10 copies/µL,检测灵敏度比普通PCR法提高10倍;该方法可特异性检测出TMV、CMV和PVY,但烟草蚀纹病毒(TEV)、烟草脉带花叶病毒(TVBMV)和番茄斑萎病毒(TSWV)无法检出且无交叉反应,批内与批间重复性试验变异系数均小于1.5%,24份样本检测结果中TMV、CMV和PVY的阳性检出率分别为75%、100%和41.67%,且三重荧光定量PCR方法与普通单重PCR方法得出一致的检测结果。结果表明本研究建立的三重荧光定量PCR检测方法具有特异性强、稳定性好、准确性高等优点,可为后续TMV、CMV和PVY的病害诊断与流行调查提供技术支持。
关键词:烟草普通花叶病毒;黄瓜花叶病毒;马铃薯Y病毒;三重荧光定量PCR
中图分类号:S435.72 文献标识码:A 文章编号:1007-5119(2023)05-0055-07
Establishment of a Triplex Fluorescent Quantitative PCR for Simultaneous Detection of TMV, CMV and PVY
BAI Jingke, NIU Longlong, WU Yanhui, LI Jianhua, LI Xiaojie, LI Chengjun, LI Shujun
(1. Key Laboratory for Green Preservation & Control of Tobacco Diseases and Pests in Huanghuai Growing Area/Tobacco Research Institute, Henan Academy of Agricultural Sciences, Xuchang, Henan 461000, China; 2. Xuchang Branch of Henan Provincial Tobacco Company, Xuchang, Henan 461000, China)
To establish a multiplex fluorescent quantitative PCR for the detection of tobacco mosaic virus (TMV), cucumber mosaic virus (CMV) and potato virus Y (PVY), specific primers and probes were designed based on the conserved CP gene sequences of TMV, CMV and PVY, respectively. And the reaction system was optimized, subsequently the sensitivity, specificity, repeatability and accuracy were evaluated. Results showed that the detection limit for TMV, CMV and PVY was 2.60×10, 1.25×10, 2.33×10copies/µL, respectively. The detection sensitivity was 10 times higher than the conventional PCR method. No cross-reaction was found with tobacco etch virus (TEV), tobacco vein banding mosaic virus (TVBMV) and tomato spotted wilt virus (TSWV). The coefficient of variation between intra-assay and inter-assay were both under 1.5%. By using the triple fluorescent quantitative PCR, 24 samples were detected and the positive rate of TMV, CMV and PVY was 75%, 100%, 41.67%, respectively, which were consistent with the single-PCR. In conclusion, a specific, stable and accurate triple fluorescent quantitative PCR was established and could be used for diagnosis and epidemiological investigation of TMV, CMV and PVY.
TMV; CMV; PVY; triplex fluorescent quantitative PCR
基金项目:河南省农业科学院自主创新项目(2023ZC023);河南省烟草公司重点项目(2023410000240021);许昌市烟草公司科技项目(2021411000240104)
作者简介:白静科(1990-),女,助理研究员,硕士,主要从事烟草植物保护研究。E-mail:baijingke@126.com。通信作者,E-mail:13603749396@126.com
收稿日期:2023-04-20 修回日期:2023-06-14
烟草是我国的重要经济作物,病毒病是烟草的主要病害。烟草上常见的病毒主要有烟草普通花叶病毒(TMV)、黄瓜花叶病毒(CMV)、马铃薯Y病毒(PVY)、烟草蚀纹病毒(TEV)和烟草脉带花叶病毒(TVBMV)等。烟草病毒病田间症状复杂多样,经常多种病毒复合侵染,单纯依靠发病症状难以识别。因此,对烟草病毒进行快速有效检测,对预防和控制烟草病毒病具有重要意义。
免疫学方法和分子生物学方法深受烟草病毒检测学者们的青睐。免疫学方法中的酶联免疫吸附测定法(Enzyme-linked immunosorbent assay, ELISA)在烟草病毒检测上应用较广泛,但存在耗时长、干扰因素多、易出现假阳性等缺点;分子生物学方法中的反转录PCR反应(RT-PCR)因其灵敏度高等特点经常被应用于烟草病毒检测中;而荧光定量PCR(qRT-PCR)方法具有灵敏度高、特异性强、可对样品实时快速定量检测等优点,已被运用于多种植物病毒的有效检测中。
目前生产上主要通过截断烟草病毒病传播途径对其进行预防。TMV主要通过农事操作等机械摩擦方式进行传播,CMV和PVY主要通过带毒蚜虫刺吸烟株方式进行传播,传播方式不同将导致防治方法的差异,对其进行快速准确鉴定与精准预测是首要措施。因此,本研究利用TaqMan探针荧光定量PCR法能够在同一反应体系中检测多种目标基因的特点,拟建立TMV、CMV和PVY的三重荧光定量PCR同步检测方法,以期提高病毒检测效率,为烟草病毒病的有效诊断和精准防控提供技术手段。
1 材料与方法
1.1 材料与试剂
TMV、CMV、PVY、TEV、TVBMV及番茄斑萎病毒(TSWV)样本均保存于河南省农业科学院烟草研究所植物病理学实验室,用于验证试验的烟草病毒样本采自所试验田。
Trizol(Invirtogen公司);反转录试剂盒PrimeScript RT Reagent Kit、Premix Taq酶、DNA凝胶回收试剂盒Mini BEST Agarose GEL DNA Extraction Kit和pMDTM 18-T Vector均购自宝生物工程(大连)有限公司;感受态细胞(北京全式金生物技术有限公司);质粒提取试剂盒(天根生化科技有限公司)。
1.2 仪器与设备
ABI7500实时荧光定量 PCR 仪(美国ABI公司);D30紫外分光光度计(Eppendorf公司);凝胶成像仪(Bio-Rad公司);T100 PCR仪(Bio-Rad公司);卢湘仪TGL-16M型高速冷冻离心机。
1.3 引物设计与合成
根据GenBank中登录的TMV(AJ239099.1)、CMV(EF417579.1)和PVY(EU719650)的外殼蛋白(coat protein, CP)基因序列,通过Primer Premier 5.0软件设计特异性引物和探针,并利用NCBI中的Primer-BLAST进行比对,保证所设计引物的特异性,引物和探针均由生工生物工程(上海)股份有限公司合成,其序列见表1。
1.4 烟草总RNA的提取
分别取0.1 g TMV,CMV,PVY病毒样本,Trizol法提取总RNA,提取方法参照说明书。所提RNA的浓度由分光光度计测定,其完整性由1%琼脂糖凝胶电泳检测,挑选/在1.8~2.1的RNA样本保存备用。
1.5 重组质粒的制备与鉴定
以上述TMV,CMV和PVY的RNA为模板,Oligo dT Primer为引物,合成cDNA,然后通过常规PCR进行扩增,扩增体系包括:10 µL Premix Taq酶,0.5 µL的10 µmol/L上下游引物,2 µL的cDNA模板,7 µL的ddHO。反应条件:95 ℃,3 min;35个循环包括95 ℃、30 s,57 ℃、30 s,72 ℃、30 s;最后是72 ℃,10 min。纯化回收PCR产物并与pMD18-T Vector连接,并转化进入Trans 5α,蓝白斑筛选后进行测序鉴定。重组质粒浓度经测定后计算得到TMV、CMV和PVY重组质粒浓度拷贝数,分别为7.80×10、3.76×10、6.99×10 copies/µL。
1.6 三重荧光定量PCR反应体系优化
反应体系的优化方法参照文献[23],分别以TMV、CMV和PVY的重组质粒标准品为模板做单重荧光定量PCR反应,然后逐渐增加反应重数,并利用矩阵法对引物和探针浓度进行优化,建立荧光定量PCR最佳反应体系。
1.7 标准曲线的建立
将TMV、CMV和PVY的重组质粒分别按照10倍倍比稀释8个梯度,得到10、10、10、10、10、10、10、10数量级拷贝数,模板选用3种重组质粒等体积混合溶液,利用1.6中优化后的反应体系进行扩增,并利用Excel绘制,轴为重组质粒模板浓度对数,轴为值的标准曲线。
1.8 检测灵敏性试验
将TMV、CMV和PVY的重组质粒分别按照10倍倍比稀释至10~10共9个梯度,以每种质粒终浓度等体积混合为模板,利用1.6中优化后的反应体系进行扩增,同时分别以3种病毒的梯度重组质粒为模板,利用表1中的引物进行普通PCR扩增,比较两种方法的检测灵敏性。
1.9 检测特异性试验
参照1.4中方法提取TEV、TVBMV和TSWV样本总RNA,反转录为cDNA作为模板,同时以无酶水为阴性对照,利用1.6中优化后的反应体系及反应条件扩增,验证该方法是否具有特异性。
1.10 重复性试验
等体积混合TMV、CMV和PVY重组质粒的8个浓度梯度,模板选取此质粒标准品,按照1.6中优化后的反应条件进行扩增,每个浓度均进行3次批内和批间重复,并计算批内和批间的平均值、标准差和变异系数,验证该方法的稳定性和重复性。
1.11 检测准确性验证
分别利用建立的TMV、CMV和PVY三重荧光定量PCR方法与TMV、CMV和PVY的普通单重PCR方法(扩增引物参照文献[13]中的表1),对采自烟草研究所试验田的24份烟草病毒样本进行检测。
2 结 果
2.1 三重荧光定量PCR最佳反应体系
引物及探针经矩阵法优化后,得到TMV、CMV及PVY的上下游引物及探针的最优浓度分别为0.2和0.8 µmol/L,0.3和1.0 µmol/L,0.2和0.6 µmol/L。优化后的最佳反应条件为:95 ℃、30 s,95 ℃、5 s,57 ℃、15 s,72 ℃、30 s,共45个循环。
2.2 3种重组质粒的标准曲线
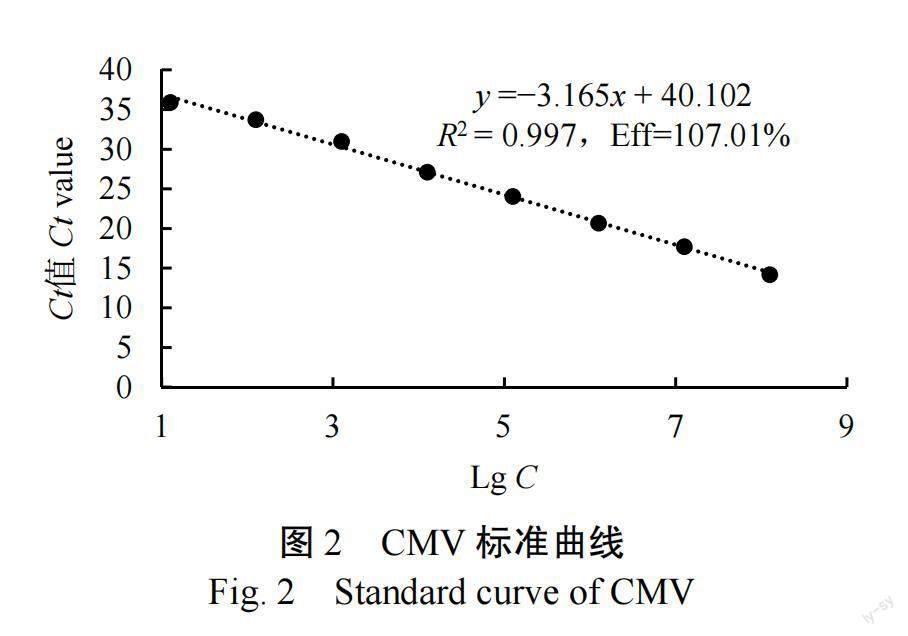
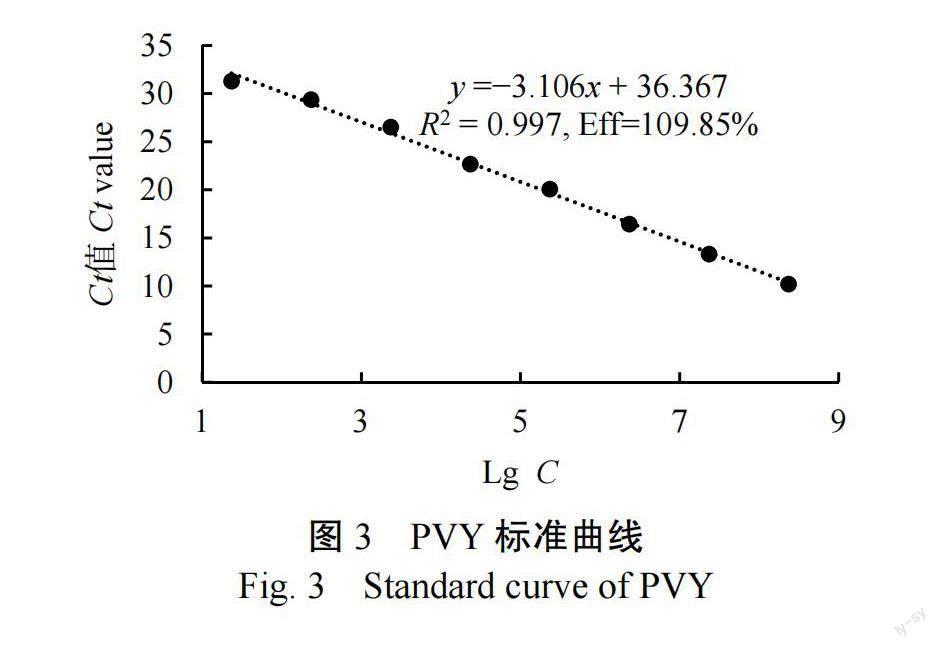
以TMV、CMV和PVY的3种重组质粒等体积混合为模板,经荧光定量PCR扩增后,发现在质粒标准品浓度10~10 copies/µL范围内,值同质粒标准品浓度之间线性关系良好,可以建立标准曲线。标准曲线的轴是重组质粒模板浓度的对数,轴是值,其中TMV的标准曲线是=−3.289+40.324(=0.997,Eff=101.39%)(图1),CMV的标准曲线是=−3.165+40.102(=0.997,Eff=107.01%)(图2),PVY的标准曲线是=−3.106+ 36.367(=0.997,Eff=109.85%)(圖3),参照标准曲线可计算待检样品中TMV、CMV与PVY的含毒量。
2.3 检测方法的灵敏性比较
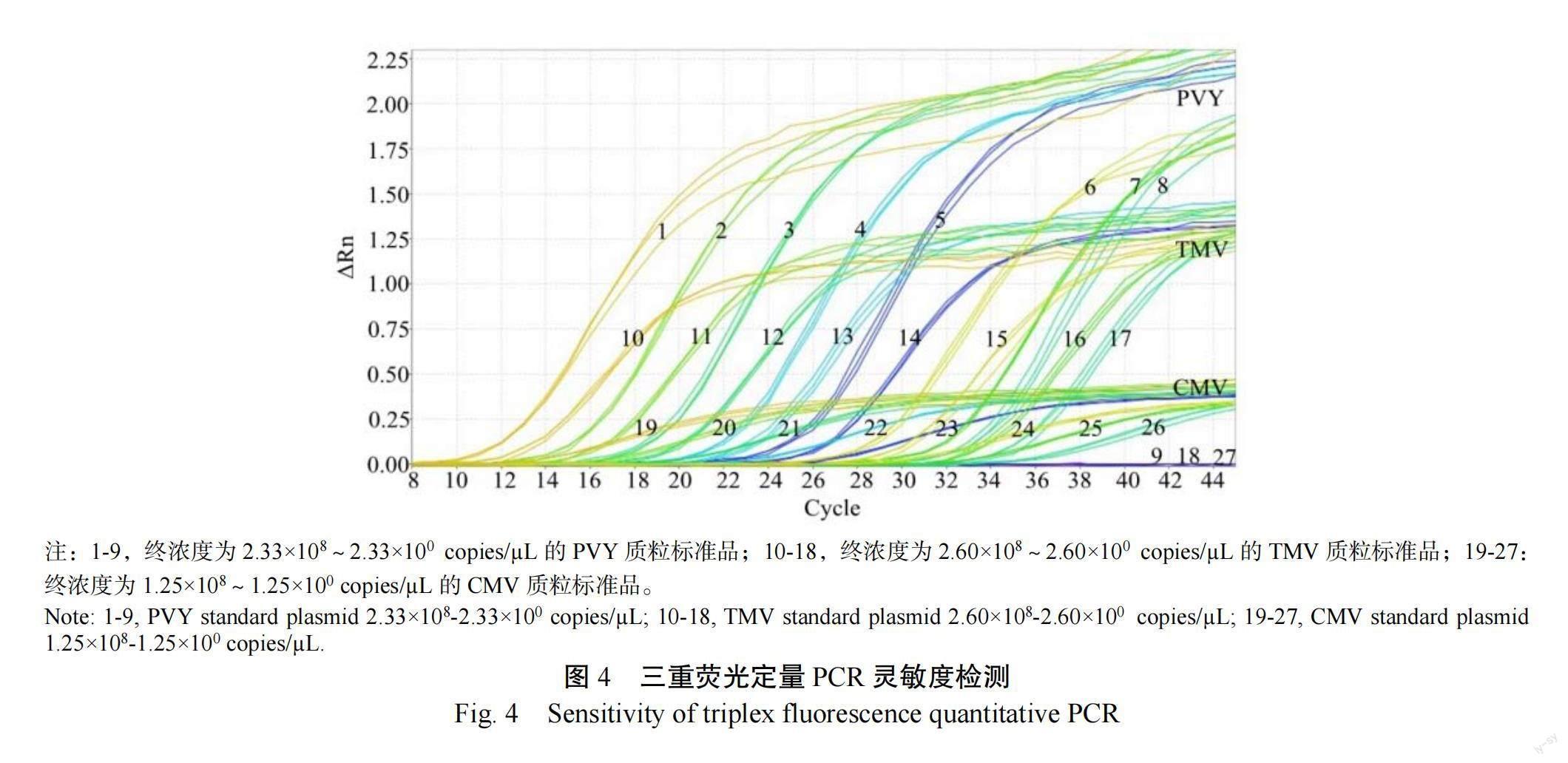
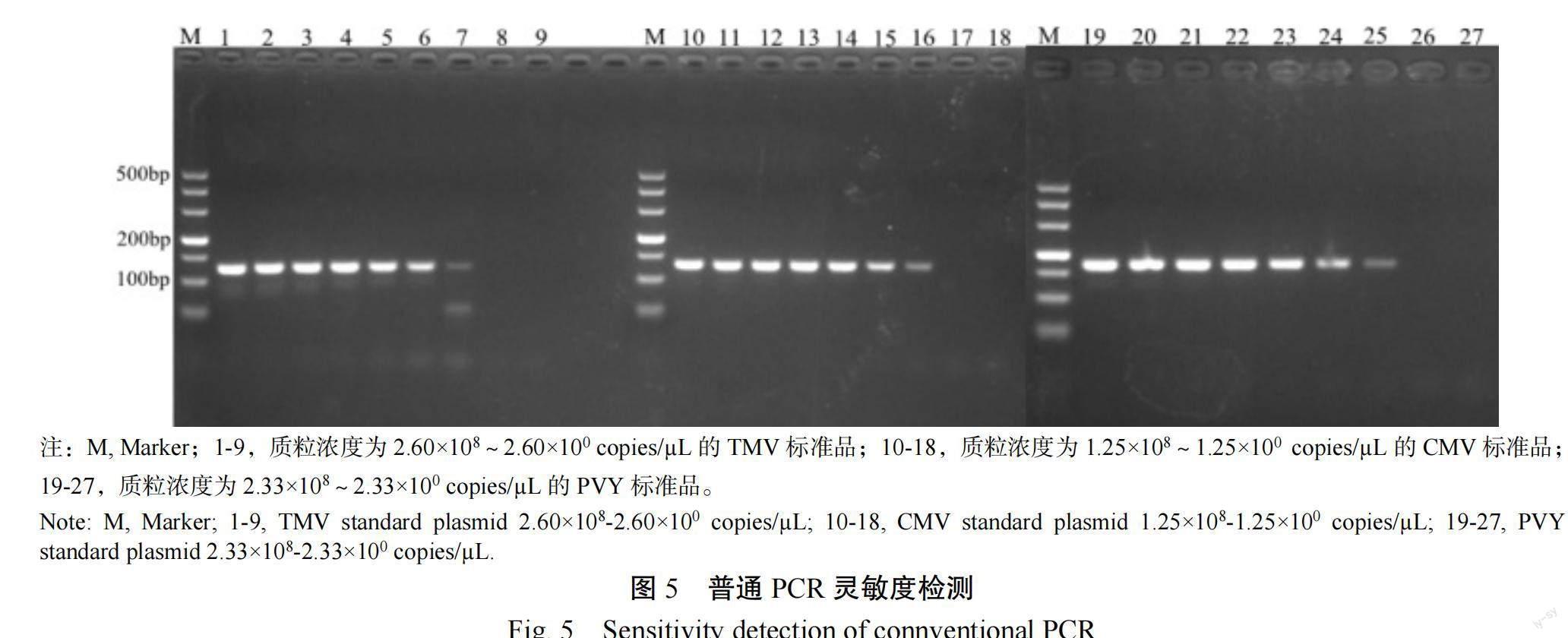
在三重荧光定量PCR检测方法中(图4),当TMV、CMV和PVY的混合模板梯度分别为10 copies/µL时,无明显扩增曲线,表明TMV的最低检出模板拷贝浓度为2.60×10 copies/µL,CMV的最低检出模板拷贝浓度为1.25×10 copies/µL,PVY的最低检出模板拷贝浓度为2.33×10 copies/µL,而在普通PCR扩增试验中(图5),当TMV、CMV和PVY的模板梯度分别为10 copies/µL时,1%琼脂糖凝胶电泳图中有明显扩增条带,低于此浓度则无扩增条带,这表明普通PCR中TMV、CMV和PVY的检测灵敏度分别是2.60×10、1.25×10和2.33×10 copies/µL。由此证明本试验建立的多重荧光定量PCR检测方法,灵敏度比普通PCR法提高10倍。
2.4 检测方法的特异性
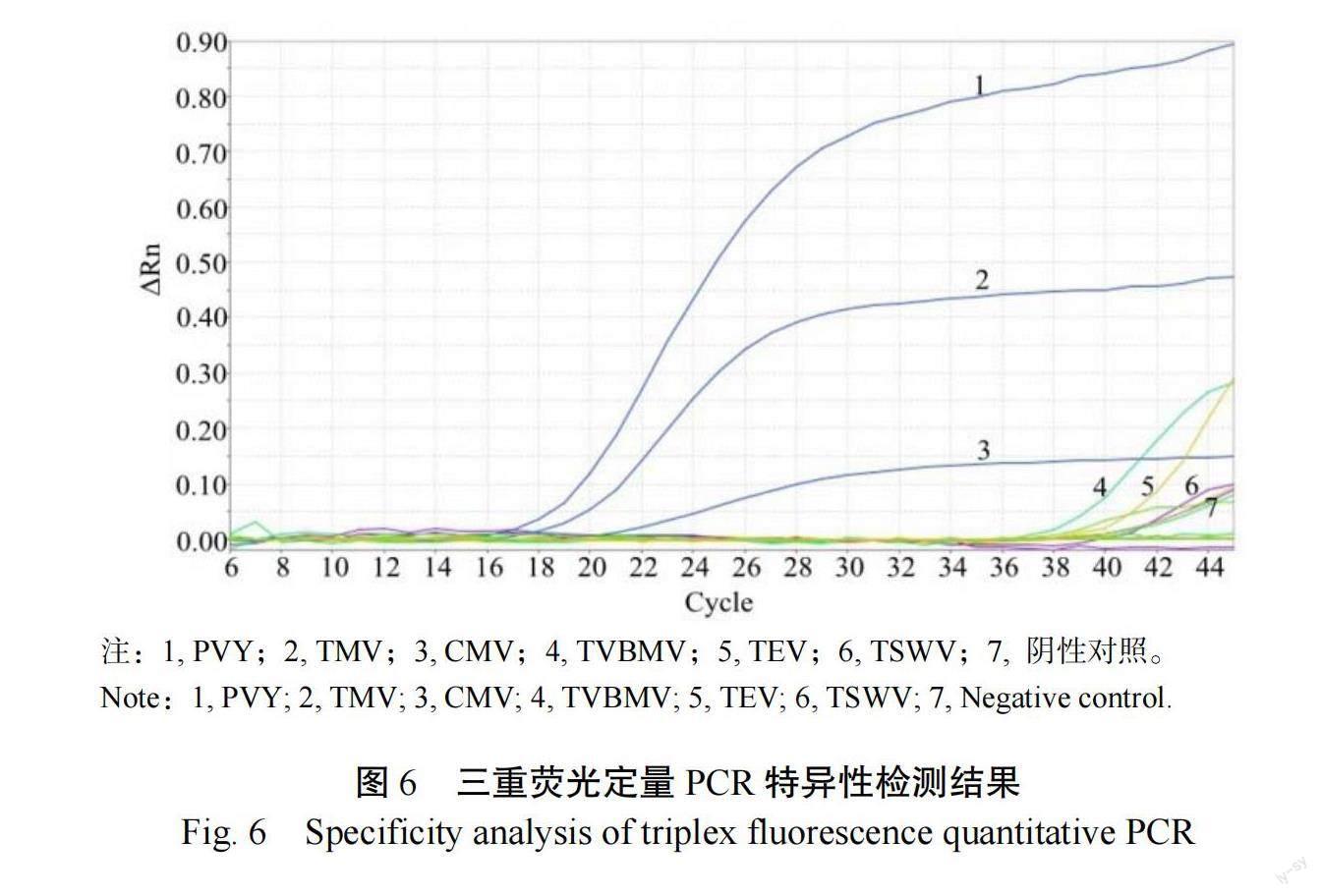
特异性试验结果显示(图6),仅TMV、CMV及PVY出现特异的扩增曲线,而对TEV、TVBMV、TSWV和阴性对照的扩增均未出现明显的相似曲线,因此,本研究建立的检测方法有较强的特异性。
2.5 检测方法的稳定性
重复性试验结果表明(表2),批内重复性试验的最大变异系数为0.81%,最小变异系数为0.06%;批间重复性试验的最大变异系数为1.28%,最小变异系数为0.40%,而这两者的变异系数均处于1.5%以下,表明本研究建立的检测方法具有良好的稳定性与重复性。
2.6 檢测准确率
利用建立的三重荧光定量PCR检测方法检测烟草病毒样本,并利用TMV、CMV和PVY的普通单重PCR方法对检测结果进行验证。检测结果显示,24份样本中TMV、CMV和PVY的阳性检出率分别为75%、100%和41.67%,且三重荧光定量PCR与普通单重PCR检测结果一致,表明建立的三重荧光定量PCR检测方法准确率较高。
3 讨 论
精准鉴别是有效控制病毒传播与流行的首要和关键步骤,荧光定量PCR方法较其他病毒检测方法具有系列优点,如灵敏、特异、稳定、可定量分析等,尤其是TaqMan探针法荧光定量PCR,由于探针与模板靶向结合释放荧光信号,可显著增强反应特异性,实现对病毒核酸拷贝数的定量检测。有研究发现,TaqMan荧光定量PCR的检测下限通常能达到10~10 copies/µL,分别是SYBR Green І染料法荧光定量PCR和普通PCR的100倍和1000倍。本研究建立的检测方法对TMV、CMV和PVY的检测灵敏度均可达到10 copies/µL,比普通PCR法提高10倍。
虽然TaqMan荧光定量PCR检测技术存在诸多优点,但在其推广应用中不得不考虑试验成本高的因素;鉴于此,学者们建立了多种病毒的多重荧光定量PCR方法,此类方法能在一次试验中通过同一反应体系实现多病毒检测,大幅缩短检测时间,明显降低试剂成本。在多重检测体系中,须考虑多对引物和探针之间的相互干扰问题,而如何解决探针报告基因荧光发射波长问题,也是在试验设计中必须兼顾的。本试验筛选大量引物和探针,并优化了其反应体系,最终将干扰降到最低,建立了TMV、CMV和PVY的三重荧光定量PCR同步检测方法。
4 结 论
本研究基于CP基因序列设计引物与TaqMan探针,建立了可同时检测TMV、CMV及PVY三种病毒的多重荧光定量PCR检测技术体系。所建立的三重荧光定量PCR检测体系中TMV最低检出模板拷贝浓度为2.60×10 copies/µL,CMV的最低检出模板拷贝浓度为1.25×10 copies/µL,PVY的最低检出模板拷贝浓度为2.33×10 copies/µL,检测灵敏度比普通PCR法提高10倍;检测特异性较强,3种病毒间及与其他常见病毒间均无交叉反应;准确率高且重复性好,可提高病毒检测效率,为烟草病毒病的诊断防治与预测预报提供技术手段。
参考文献
[1]青玲,牛颜冰,吴楚钊,等. 部分烟区烟草病毒病病原检测及复合侵染分析[J]. 烟草科技,2009(12):58-64.
QING L, NIU Y B, WU C Z, et al. Virus detection of tobacco viral disease and analysis of viruses mixed-infection in some tobacco growing areas[J]. Tobacco Science&Technology, 2009(12): 58-64.
[2]佟爱仔,赵兴能,孔宝华,等. 2011年云南烟草病毒病发生动态及复合侵染分析[J]. 植物病理学报,2013,43(1):100-103.
TONG A Z, ZHAO X N, KONG B H, et al. Analysis of dynamic occurrence and complex infection of tobacco viruses in 2011, Yunnan[J]. Acta Phytopathology Sinica, 2013, 43(1): 100-103.
[3]白静科,李淑君,李成军,等. 河南烟区烟草病毒病种类与分布[J]. 烟草科技,2018,51(10):20-26.
BAI J K, LI S J, LI C J, et al. Species and distribution of tobacco virus diseases in Henan Province[J]. Tobacco Science & Technology, 2018, 51(10): 20-26.
[4]时洪伟,刘陈晨,李科,等. 重庆丰都烟区田间烟草病毒病及其Dot-ELISA检测[J]. 中国烟草科学,2016,37(2):11-15.
SHI H W, LIU C C, LI K, et al. Detection of field viral diseases on tobacco in Fengdu county of Chongqing with the Dot-ELISA technique[J]. Chinese Tobacco Science, 2016, 37(2): 11-15.
[5]张毅,李斌,张顺,等. 攀枝花烟草病毒病检测与防治对策[J]. 安徽农业科学,2014,42(25):8600-8602.
ZHANG Y, LI B, ZHANG X, et al. Detection and prevention research of tobacco virus disease in Panzhihua[J]. Journal of Anhui Agricultural Sciences, 2014, 42(25): 8600-8602.
[6]李金嶺,罗晶,牛小义,等. 陕西省烟草主要病毒病种类及植物带毒的检测[J]. 西北农林科技大学学报(自然科学版),2013,41(1):78-84.
LI J L, LUO J, NIU X Y, et al. Detection and analysis of main tobacco viruses and viruliferous plants in Shaanxi Province[J]. Journal of Northwest A&F University (Natural Science), 2013, 41(1): 78-84.
[7]江彤,李爽,陈伟,等. 安徽省烟草病毒种类的血清学鉴定[J]. 中国烟草科学,2009,30(5):50-53.
JIANG T, LI S, CHEN W, et al. Serological identification of tobacco viruses derived from Anhui Province[J]. Chinese Tobacco Science, 2009, 30(5): 50-53.
[8]巢进,张洪波,肖启明,等. 湖南省烟草病毒病种类的鉴定[J]. 湖南农业科学,2008(4):104-106,108.
CHAO J, ZHANG H B, XIAO Q M, et al. Identification of tobacco virus types in Hunan[J]. Hunan Agricultural Sciences, 2008(4): 104-106, 108.
[9]李斌,夏先全,姚革,等. 四川烟草主产区烟草病毒种类及流行分析[J]. 西南农业学报,2007,20(6):1237-1240.
LI B, XIA X Q, YAO G, et al. The species and epidemiology of virus in main tobacco regions in Sichuan[J]. Southwest China Journal of Agricultural Sciences, 2007, 20(6):1237-1240
[10]郑轩,成巨龙,赵震,等. 五种烟草病毒 TMV、CMV、TEV、PVY及TVBMV的多重RT-PCR同步检测[J]. 植物病理学报,2011,41(2):146-153.
ZHENG X, CHENG J L, ZHAO Z, et al. Simultaneous detection of five viruses (TMV, CMV, TEV, PVY and TVBMV) infecting tobacco by multiplex RT-PCR[J]. Acta Phytopathologica Sinica, 2011, 41(2): 146-153.
[11]杨金广,张帅,申莉莉,等. 烟草中TMV、CMV和PVY多重RT-PCR检测体系的建立与应用[J]. 中国烟草学报,2010(4):83-88.
YANG J G, ZHANG S, SHEN L L, et al. Establishment and application of multiple RT-PCR for detection of TMV, CMV and PVY in tobacco[J]. Acta Tabacaria Sinica, 2010(4): 83-88.
[12]代园凤,朱虹,张永至,等. 毕节市烟草3种主要病毒检测及株系分析[J]. 西南大学学报(自然科学版),2020,42(9):63-70.
DAI Y F, ZHU H, ZHANG Y Z, et al. Detection and strain analysis of 3 tobacco viruses in Bijie area[J]. Journal of Southwest University (Natural Science), 2020, 42(9): 63-70.
[13]白静科,何雷,吴彦辉,等. 河南烟草主要病毒发生种类及侵染类型分析[J]. 中国烟草科学,2022,43(1):49-54.
BAI J K, HE L, WU Y H, et al. Detection and analysis of tobacco viruses and infection type in Henan Province[J]. Chinese Tobacco Science, 2022, 43(1): 49-54.
[14]丁天波,刘晓蓓,李洁,等. 番茄褪绿病毒实时荧光定量PCR检测技术的建立[J]. 中国农业科学,2018,51(10):2013-2022.
DING T B, LIU X B, LI J, et al. Development of a real-time fluorescent quantitative PCR method for the detection of tomato chlorosis virus and its application[J]. Scientia Agricultura Sinica, 2018, 51(10): 2013-2022.
[15]贺振,董婷婷,吴伟文,等. 莲藕中甘薯潜隐病毒实时荧光定量 PCR 检测技术的建立及应用[J]. 园艺学报,2020,47(7):1412-1420.
HE Z, DONG T T, WU W W, et al. Development and evaluation of a real-time fluorescent quantitative PCR assay for detection of sweet potato latent virus-lotus in lotus plants[J]. Acta Horticulturae Sinica, 2020, 47(7): 1412-1420.
[16]王艳娇,崔甜甜,黄爱军,等. 柑橘脉突病毒实时荧光定量 RT-PCR检测体系的建立与应用[J]. 园艺学报,2016,43(8):1613-1620.
WANG Y J, CUI T T, HUANG A J, et al. Development and application of a quantitative RT-PCR approach for quantification of citrus vein enation virus[J]. Acta Horticulturae Sinica, 2016, 43(8): 1613-1620.
[17]胡加谊,李向宏,罗志文,等. 菠萝凋萎相关病毒-3实时荧光定量PCR检测方法的建立[J]. 果树学报,2015,32(1):156- 162.
HU J Y, LI X H, LUO Z W, et al. Detection of pineapple mealybug wilt associated virus-3 by real- time fluorescent quantitative RT- PCR[J]. Journal of Fruit Science, 2015, 32(1): 156- 162.
[18]黄迎波,王哲,莫瑾,等. TaqMan探针法实时荧光定量 RT-PCR 检测番茄斑驳花叶病毒[J]. 植物检疫,2023,37(4):28-32.
HUANG Y B, WANG Z, MO J, et al. Detection of tomato mottle mosaic virus using TaqMan RT-qPCR method[J]. Plant Quarantine, 2023, 37(4): 28-32.
[19]尚晓楠,吴蓓蕾. 马铃薯X病毒荧光定量PCR检测体系的建立及应用[J]. 植物保护,2016,42(3):165-169.
SHANG X N, WU B L. Development and application of a real-time quantitative PCR system for detection of potato virus X[J]. Plant Protection, 2016, 42(3): 165-169.
[20]ZHANG Y Q, LIU H S, WU X D, et al. A novel real-time RT-PCR with TaqMan-MGB probes and its application in detecting BVDV infections in dairy farms[J]. Journal of Integrative Agriculture, 2015, 14(8): 1637-1643.
[21]ZHAO J R, BAI Y J, ZHANG Q H, et al. Detection of hepatitis B virus DNA by real-time PCR using TaqMan-MGB probe technology[J]. World Journal of Gastroenterology, 2005, 11(4): 508-510.
[22]赵立群,邱艳红,张晓飞,等. TaqMan探针法实时荧光定量PCR检测西瓜潜隐病毒[J]. 中国农业科学,2021,54(20):4337-4347.
ZHAO L Q, QIU Y H, ZHANG X F, et al. The detection of Citrullus lanatus cryptic virus using TaqMan-qPCR method[J]. Scientia Agricultura Sinica, 2021, 54(20): 4337-4347.
[23]赵绪永,宁豫昌,赵丽,等. 多重实时定量PCR快速检测PRRSV、CSFV和PCV2混合感染方法的建立[J]. 河南农业科学,2013,42(2):123-127.
ZHAO X Y, NING Y C, ZHAO L, et al. Detection of mixed infection of PRRSV, CSFV and PCV2 in swine by multiplex real-time PCR assay[J]. Journal of Henan Agricultural Sciences, 2013, 42(2): 123-127.
[24]王一丹,楊发龙,陈弟诗,等. 猪腹泻病毒一步法多重TaqMan荧光定量RT-PCR检测法的建立及应用[J]. 中国农业科学,2023,56(1):179-192.
WANG Y D, YANG F L, CHEN D S, et al. One-step multiple TaqMan real-time RT-PCR for simultaneous detection of swine diarrhea viruses[J]. Scientia Agricultura Sinica, 2023, 56(1): 179-192.
[25]ZHOU X R, ZHANG T S, SONG D P, et al. Comparison and evaluation of conventional RT-PCR, SYBR green I and TaqMan real-time RT-PCR assays for the detection of porcine epidemic diarrhea virus[J]. Molecular and Cellular Probes, 2017, 33: 36-41.
[26]王翠,赵雪丽,王东方,等. 口蹄疫病毒O型、A型和Asia I型三重实时荧光定量RT-PCR检测方法的建立及初步应用[J/OL]. 中国动物传染病学报. https://doi.org/10.19958/j.cnki.cn31-2031/ s.20230327.003.
WANG C, ZHAO X L, WANG D F, et al. Establishment and preliminary application of a triplex RT-PCR for detection of Foot-And-Mouth disease virus type O, A and Asia I [J/OL]. Chinese Journal of Animal Infectious Diseases. https://doi.org/10.19958/j. cnki.cn31-2031 /s. 20230327.003.
[27]劉影,闫若潜,杨海波,等. 猪流行性腹泻病毒、猪δ冠状病毒和猪急性腹泻综合征冠状病毒多重荧光定量RT-PCR检测方法的建立及应用[J]. 中国预防兽医学报,2022,44(11):1189-1195.
LIU Y, YAN R Q, YANG H B, et al. Development and application of a multiplex fluorescent quantitative RT-PCR for detection of porcine epidemic diarrhea virus, porcine δ coronavirus and porcine acute diarrhea syndrome coronavirus[J]. Chinese Journal of Preventive Veterinary Medicine, 2022, 44(11): 1189-1195.
[28]金玉兰,李寒影,董伟仁,等. 致病性猪圆环病毒基因分型三重荧光定量PCR检测方法的建立[J]. 中国兽医科学,2022,52(11):1360-1366.
JIN Y L, LI H Y, DONG W R, et al. Establishment of triple fluorescent quantitative PCR methods for genotyping pathogenic porcine circovirus[J]. Chinese Veterinary Science, 2022, 52(11): 1360-1366.
[29]苏金辉,赵春晖,夏冰. 非洲猪瘟病毒三重荧光定量PCR鉴别检测方法的建立及应用[J]. 中国兽医科学,2023,53(3):277-284.
SU J H, ZHAO C H, XIA B. Development and application of a triplex real-time PCR method for detection and differentiation of African swine fever virus[J]. Chinese Veterinary Science, 2023, 53(3): 277-284.
