基于表型组和转录组数据研究光对烟草早期幼苗发育的影响
2023-12-03曹廷茂罗贞宝刘奇源张民刘一灵刘仁祥李德仑李振华
曹廷茂 罗贞宝 刘奇源 张民 刘一灵 刘仁祥 李德仑 李振华



摘 要:為深入解析光对烟草早期幼苗发育的调控机理,以烤烟品种CV87为试材,设置12 h光周期和持续黑暗2个处理,采用表型组学研究了烟草种子培育第1~9天的形态变化,在此基础上采用转录组学研究了其发育第4天基因表达网络差异。结果表明,光下种子发芽势和发芽率提高约30%,子叶开口长增加约2 cm,而下胚轴长度缩短约2 cm。在早期幼苗发育阶段有551个基因差异表达受光诱导,其中364个表达上调,187个表达下调。551个基因中有28个在蛋白水平存在互作关系,其中包括、、等15个上调表达基因和、和等13个下调表达基因。GO富集表明,这28个DEGs主要与光合作用、光系统、植物激素响应有关。综上所述,本研究解析了烟草早期幼苗发育过程中响应光信号的表型变化,并通过转录组分析挖掘到一些调控表型差异相关基因,这些结果为进一步研究光环境对烟草萌发和早期幼苗发育的影响提供了参考。
关键词:种子萌发;早期幼苗发育;光信号;表型组;转录组;烟草
中图分类号:S572.01 文献标识码:A 文章编号:1007-5119(2023)05-0045-10
Study of Light-Regulated Early Seedling Development in Tobacco through Phenomic and Transcriptomic Data Analysis
CAO Tingmao, LUO Zhenbao, LIU Qiyuan, ZHANG Min,
LIU Yiling, LIU Renxiang, LI Delun, LI Zhenhua
(1. Bijie City Tobacco Company of Guizhou Province, Bijie, Guizhou 551700, China; 2. College of Agriculture, Guizhou University, Guiyang 550025, China; 3. College of Tobacco, Guizhou University, Key Laboratory of Tobacco Quality Research in Guizhou Province, Guiyang 550025, China; 4.Guizhou Academy of Tobacco Science, Guiyang 550081, China)
To delve into the intricate mechanisms governing the regulation of early seedling development in tobacco in response to light, the tobacco variety CV87 was chosen as the experimental material. Two treatments were implemented: a 12-hour light period and a continuous darkness, allowing for a comprehensive phenotypic study of morphological changes during the first nine days of tobacco seed incubation. Building upon this foundation, a transcriptomic analysis was employed specifically on the fourth day of development to investigate differential gene expression networks. The findings revealed that seed germination vigor and germination rate showed an increase of approximately 30% under light conditions. Furthermore, the elongation of cotyledon opening increased by approximately 2 cm, while the length of the hypocotyl decreased by approximately 2 cm. During the early stages of seedling development, 551 genes exhibited differential expression induced by light, with 364 genes being upregulated and 187 genes being downregulated. Among these 551 genes, 28 of them were found to interact at the protein level, including upregulated genes such as , , and , as well as downregulated genes such as , , and . Gene Ontology (GO) enrichment analysis demonstrated that these 28 differentially expressed genes were primarily associated with photosynthesis, light systems, and plant hormone responses. In conclusion, this study elucidates the phenotypic variations during early tobacco seedling development in response to light signals. Through transcriptomic analysis, several regulatory genes associated with the observed phenotypic differences were uncovered. These findings serve as a foundation for further research on the impact of light environment on tobacco germination and early seedling development.
seed germination; early seedling development; light signaling; phenome; transcriptome; tobacco
基金项目:国家自然科学基金项目(32060512、31860420);贵州省烟草公司项目(201904);贵州省科技厅项目{黔科合基础ZK[2022]一般288}
作者简介:曹廷茂(1979-),男,硕士,主要从事烟草育种及栽培技术研究。E-mail:caotingmao@sina.com。*通信作者,E-mail:zhli3@gzu.edu.cn
收稿日期:2023-01-08 修回日期:2023-09-05
寡照是我国部分烟区早春季节典型的气候特点,此时值烤烟育苗关键期,受该不良气候影响,烤烟易出现出苗缓慢,苗龄长,苗羸弱,移栽后还苗期长,幼苗抗逆性弱等问题。近年来,补光设施的利用一定程度上缓解了该不良气候的影响,但补光设施耗能耗资较大,规模化运用存在一定难度。
因此,解析光照调控烟草幼苗发育的分子机理,创制烟草抗逆种质对于未来烤烟生产具有重要意义。
植物通过光受体感受外界光质、光量和光周期调控幼苗发育。到目前为止,已在模式植物拟南芥中鉴定出13种光受体,其中,光敏色素(PHY)被认为是调控幼苗发育的主要光感受器。当种子在无光环境或土壤深处萌发后,幼苗的胚轴将向光生长,在幼苗顶端形成一个顶部弯钩来保护幼嫩的茎尖分生组织,最终发育为胚轴细长且带有顶部弯钩的黄化苗。当幼苗伸出土壤或在白光条件下培育时黄化苗将转绿,上述过程专业上分别称之为暗形态和光形态建成。无光条件下光敏色素(PHYs)失活,导致光敏色素互作因子PIF(PIFs)和E3泛素连接酶COP1和SPA蛋白组成的E3泛素连接酶复合体(COP1/SPAs)积累,从而促进暗形态发生。在黑暗环境下,缺失会导致幼苗表现出光形态特征,如:下胚轴较短,子叶展开和顶端缺陷。在有光条件下,PHYs被激活,调节PIFs的降解和减除COP1/SPA复合体稳定性,导致下胚轴伸长蛋白HY5的积累,促进光形态建成。我国部分南方烟区在育苗阶段易遭遇多雾、阴雨等天气,加上塑料大棚薄膜的隔绝,特别是多年使用的育苗大棚,其透光度显著降低,棚内往往出现寡照环境,致使烟苗出现茎秆细弱、叶色偏黄等暗形态建成特征,严重影响烟草移栽后的正常生长发育。
光是一种重要的环境因子,它几乎参与调控烤烟生长发育的各个阶段,如:种子萌发,幼苗发育、营养生长和生殖生長等。在幼苗发育阶段,光亦抑制烟草下胚轴伸长,促进子叶展开,顶部弯钩消失等。然而,关于光调控烟草幼苗发育的分子机理的研究却较少。因此,本研究以烟草为试材,比较有光和无光条件下种子萌发和幼苗发育表型的差异;在此基础上,以已经萌发的种子为试材,研究有光和无光条件下其基因表达差异,并通过Go富集和蛋白-蛋白互作网络的研究方法,构建了光调控烟草早期幼苗发育的分子网络。
1 材料与方法
1.1 试验设计
试验用CV87烟草种子,由贵州烟草研究所提
供。所有种子在授粉后40 d收获,在热风干燥机中40 ℃机械干燥36 h。脱粒后的种子在室温下保存,所有试验在1个月内完成。试验设2个处理,每个处理3次重复,分别在持续黑暗和12 h光/暗间断的光周期条件下进行种子萌发和幼苗发育试验,该试验在0.8%的琼脂发芽床上进行。在培育的第1~9天,通过3D-表型组学平台比较2种环境下种子萌发和幼苗发育的表型变化。在培育第4天,即种子萌发完成后即将进入幼苗发育阶段,将2个处理、3次重复共6个试验样品,每个样品称取0.5 g进行转录组测序,取样部位为幼苗整体,比较2种处理的差异表达基因和信号通路,探析光调控幼苗发育的分子网络。
1.2 试验方法
1.2.1 种子萌发和幼苗发育 种子萌发试验以及发芽率和发芽势的测定参照本课题组已公开发表的方法。将100粒烟草种子按照10×10的规格均匀点播在0.8%的琼脂发芽床表面,分别置于25 ℃,12 h光周期和持续黑暗的人工气候箱内萌发,每处理3次重复。从第1天开始记录种子发芽数,每隔1天记录1次种子萌发的数量,连续记录至第14天为止。于第7天计算发芽势和第14天计算发芽率。发芽势=7 d萌发种子数/被测种子数×100%,发芽率=14 d内萌发种子数/被测种子数×100%。种子萌发和早期幼苗发育2个阶段的界定标准参照本课题组已公开发表的方法,其中吸胀后第1至4天为种子萌发阶段,吸胀后第6至9天为幼苗发育阶段。
1.2.2 表型组数据 种子或幼苗表型测定参照文献[23-24]。将3次重复,每个重复100粒种子放置在一个成像室内,通过Scanalyzer HTS(德国,LemnaTec公司)以天为单位获得图像。使用LemnaTec HTS系统中的Lemna Grid软件处理图像,测量种子(幼苗)的总周长、总面积以及胚根、胚轴、子叶的周长和面积。从第1到9天测定种子(幼苗)的总周长和面积。从第6到9天测定胚根、胚轴和子叶的周长和面积;此外,在第6到9天测量子叶弯曲率。
1.2.3 转录组测序 转录组测序参照本课题组已公开发表的方法。首先使用TRIzol试剂盒(天根生化科技,北京)提取萌发4 d后种子中的总RNA。随后交由上海欧易生物技术有限公司进行转录组测序。通过NanoDrop 2000分光光度计(Thermo Science,美国)检测提取的RNA纯度,通过Agilent 2100生物分析仪(Agilent Technologies,美国)检测RNA的完整性。通过TruSeq Stranded mRNA LT Sample Prep Kit(Illumina,美国)构建基因文库。使用Illumina HiSeq X Ten平台对文库进行测序,并产生150 bp的成对末端读序。通过Triomatic处理原始读序。最后本课题组完成了数据分析,其中基因差异表达分析使用DESeq(2012)R包。<0.05,FC>2或<0.5以及FPKM>1被用作差异表达的阈值。随后,应用数学模型对转录组数据进行分析。筛选出了在发芽4 d的差异表达基因(DEGs),根据超几何分布,用hiplot pro(https://hiplot.com.cn/)的“GO/KEGG富集分析”进行基因本体Gene Ontology(GO)富集分析。
1.2.4 蛋白-蛋白互作网络的建立 通过高通量测序获得的差异表达基因来预测对应蛋白之间的相互作用网络,有助于挖掘核心调控基因。基于Genemania在线数据库(https://genemania.org/)将所有基因名称整理到一个列表,预测差异表达基因的互作关系。
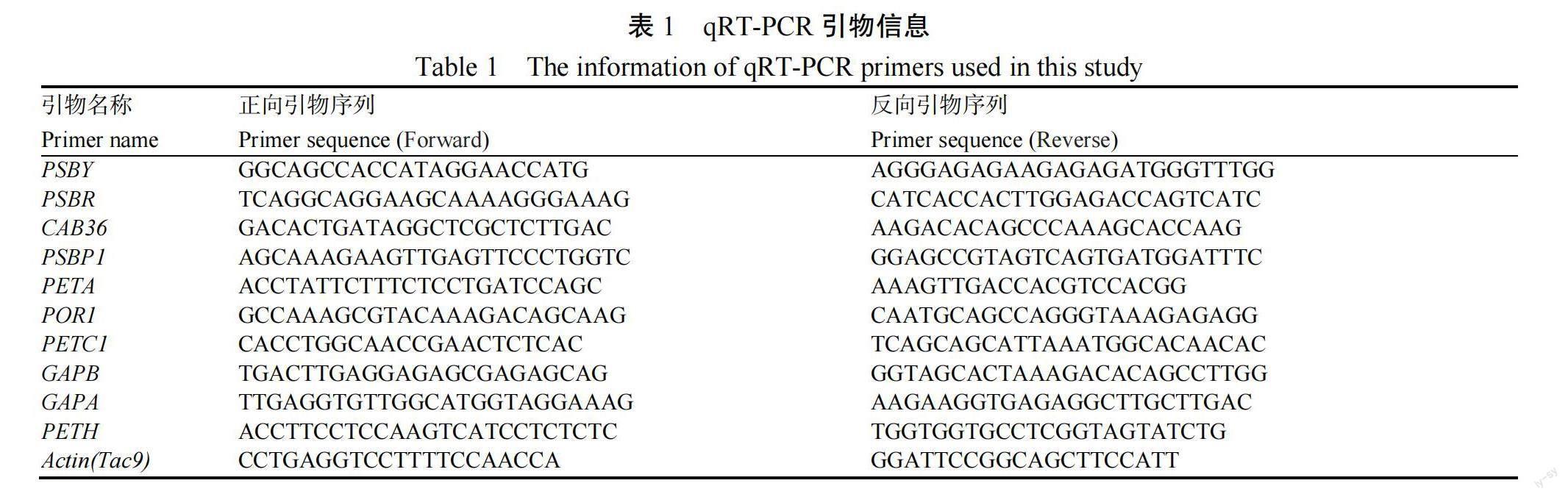
1.2.5 RT-PCR 为验证RNA测序的结果,在光合作用和碳代谢通路上随机选择10个表达差异较大的基因进行qRT-PCR验证,选择作为内参,反应体系参照文献[26],对qRT-PCR的相对表达水平和RNA-seq的FPKM值进行相关性分析,并根据相关系数分析RNA-seq测序结果的准确性。引物序列如表1所示。
1.2.6 统计分析 采用SPSS Statistics 25对处理数据进行方差分析和多重比较,采用Graphpad prism v9.5.0.730对数据进行整理并作图。
2 结 果
2.1 光照对烟草早期幼苗发育的影响
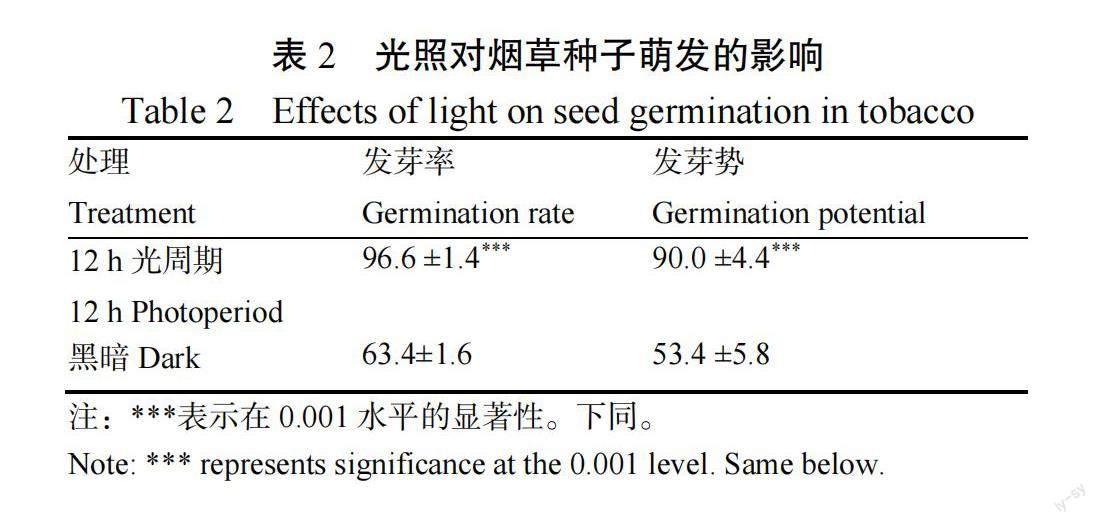
由表2可知,相比于黑暗处理,12 h光周期处理的种子发芽率提高了约30%,差异显著(<0.001)。由图1可知,12 h光周期处理和黑暗处理下萌发过程中的种子周长和面积差异不显著,而萌发后的幼苗面积差异显著(<0.001或<0.01)。其中,在发育的第6~7天,黑暗处理的幼苗周长和面积显著高于12 h光周期处理(<0.001或<0.01);第8天,两个处理周长仍存在显著差异(<0.001),而面积差异不显著;而第9天,12 h光周期处理的幼苗面积显著高于黑暗处理(<0.001)。以上结果说明光照影响种子的萌发率,但不影响种子的萌发表型;对幼苗发育表型影响较大。
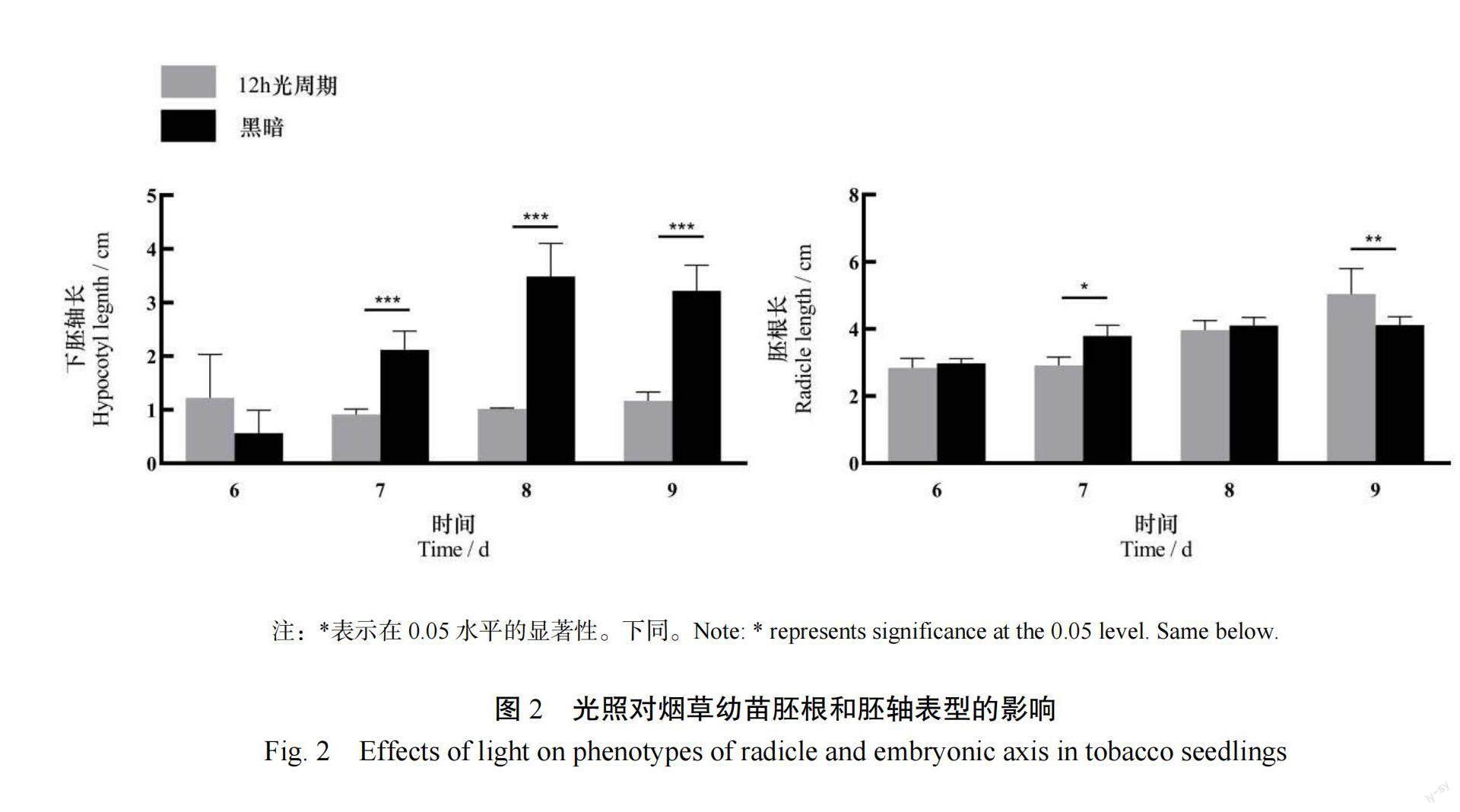
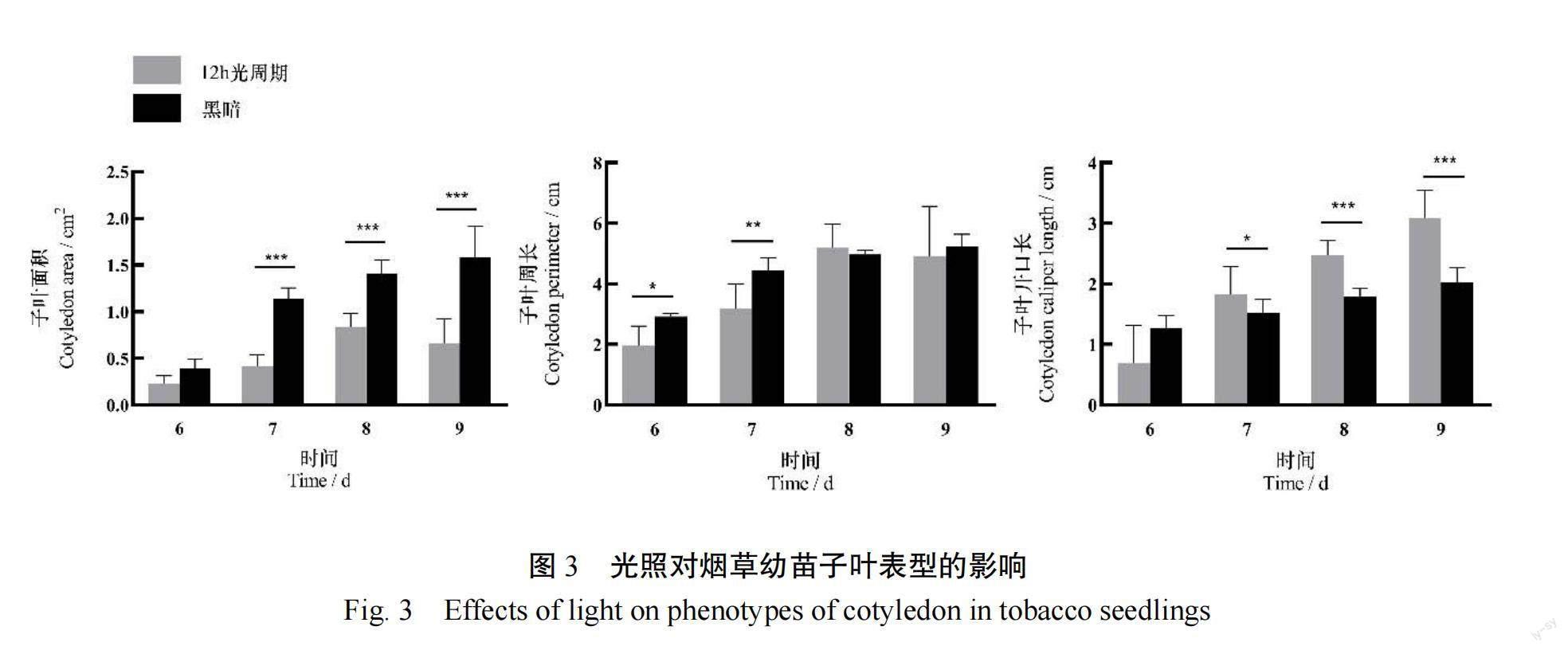
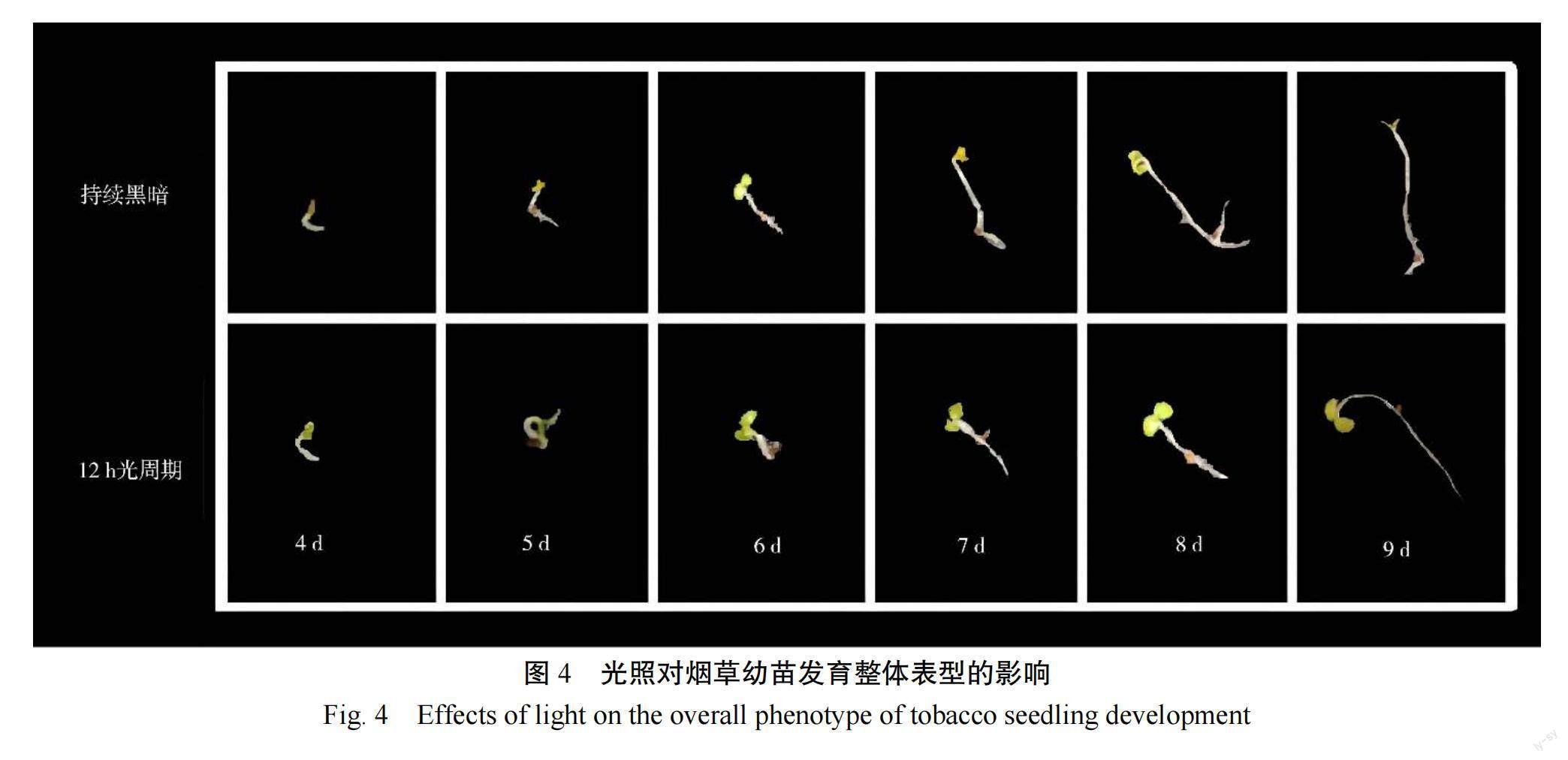
由图2可知,从发育第7天始,黑暗处理下幼苗的胚轴长显著高于12 h光周期处理(<0.001),在发育的第9天,下胚轴长度最终增加了约2 cm。在发育的第7天,黑暗处理的胚根长度显著大于12 h光周期处理(<0.05);而在发育的第9天,黑暗处理的胚根长度显著小于12 h光周期处理(<0.01)。由图3可知,从发育第7天始,黑暗处理下子叶面积显著大于12 h光周期处理(<0.001)。从发育第7天始,黑暗处理下幼苗的子叶开口长度显著小于12 h光周期处理,直至发育的第9天,子叶开口约缩短了2 cm(<0.05或<0.001)。综上所述,光环境显著影响了烟草种子的发芽指标和幼苗发育表型。相比于黑暗环境,12 h光周期更加适宜种子萌发。而在幼苗发育阶段,黑暗环境会减少幼苗的子叶开口开度,增加下胚轴长度(图4)。
2.2 光照对烟草幼苗发育早期基因表达水平的影响
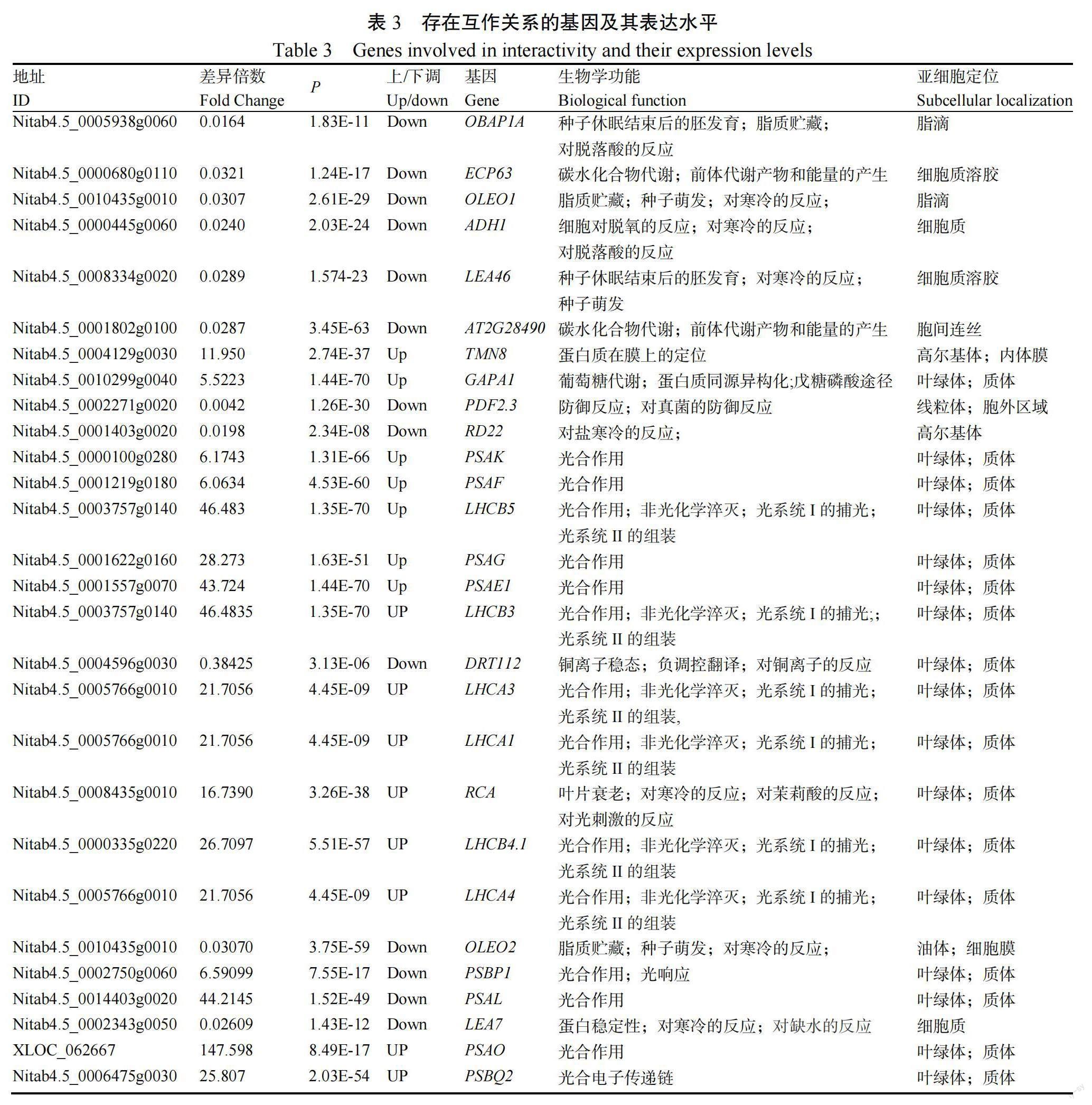
利用Illumina平台对12 h光周期和黑暗处理第4天的样品进行转录组测序,获得551个差异表达基因(Different expression genes, DEGs),其中364个上调、187个下调。对551个差异表达基因进行蛋白质互作网络分析,发现28个基因在蛋白水平存在互作关系(表3),其中等15个基表达上调。是类囊体膜蛋白基因,该蛋白与色素分子结合形成捕光色素蛋白复合体,而光捕获蛋白是绿色植物PSI的核心。、、、和等5个基因为膜内周蛋白基因,是正确组装PSI所必需的。编码叶绿体3-磷酸甘油醛脱氢酶GAPA亚基,而叶绿体3-磷酸甘油醛脱氢酶是催化卡尔文循环促进CO固定的关键酶。以上结果说明,在幼苗发育早期光照可能会促进PSI形成和卡尔文循环。等13個基因表达下调。、、、等4个基因参与调控种子脱水、休眠和早期胚发育。和参与油脂代谢。响应逆境反应。以上结果说明在早期幼苗发育阶段光照可能会抑制种子休眠和油脂代谢。
2.3 光照对烟草幼苗发育早期信号通路的影响
由图5可知,不同光照条件下烟草幼苗发育早期差异表达基因通过GO富集分成3个部分:生物过程(Biological processes,BP)、分子功能(Molecular functions,MF)和细胞组分(Cellular components,CC)。BP模块包括叶绿素代谢过程、代谢物和能量的前体形成、光合作用、色素合成、卟啉类化合物代谢过程。MF模块包括氧化还原酶活性、水杨酸结合和核糖体结构组成等。CC模块包括叶绿体葡萄球体、叶绿体葡萄球体膜、光合作用膜、质体葡萄球体、质体葡萄球体膜和质体膜。以上结果说明,种子萌发后光主要促进叶绿素合成和光合作用。
2.4 RT-PCR验证转录组测序结果
根据转录组数据,从代谢物和能量的前体形成、光合作用反应通路中随机选取10个差异表达基因,通过RT-PCR对这些基因从种子萌发到幼苗发育过程中的表达趋势进行动态分析,引物列表见表1。发现转录组测序FPKM值与RT-PCR基因相对表达量的皮尔逊相关系数普遍大于0.8,且所选的10个基因在幼苗发育的第4天时,两种方法下表达趋势一致(图6)。
3 讨 论
苗全苗壮是烟草高产高效栽培技术的基础,但壮苗受到诸多因素制约,除种子质量外,漂浮育苗期间的光环境亦影响烟苗素质。杨兴有等、刘国顺等和邹焱等研究表明,光照强度降低,烟苗高度增加,茎围、叶片厚度、干物质积累等均降低。李鹏志等和黄建等研究表明调光膜处理可以改变光质,使烟苗生育进程均比普通膜处理提前,最终成苗期提前5 d。在自然环境下,光照是不断变化的,常出现光环境与烟苗生长需求不协调的情况,在生产中易出现高脚苗、铁秆苗和黄化苗等,严重影响烤烟生产。本研究比较了烟草幼苗在12 h光周期和持续黑暗下的表型动态变化,发现相比于12 h光周期环境,在持续黑暗环境下,烟草幼苗发育成了细长且黄化的高脚苗,不适宜的光环境严重阻碍了烟草幼苗的正常发育。
种子萌发始于静止种子吸水膨胀,至胚根突破胚乳和种皮后露白而完成萌发。王素琴等研究表明光照对不同品种烟草种子发芽有显著影响,而招启柏等认为光不是烟草种子萌发的必要条件。宋碧清等根据光照对烟草种子发芽的影响程度,将烟草品种分为光照敏感型、中等光敏型和光照不敏感型3种类型,对于光照不敏感种子,它们在黑暗与光照条件下的发芽率差异不大,但光照能加快这些种子的发芽进程。Dong等和王尧等研究发现新采收的烟草种子萌发普遍需光,而后熟完成后种子萌发的光依赖性丧失。本研究试验材料为新鲜采收的种子,12 h光周期环境下烟草种子发芽率约为89.23%,显著暗环境下的发芽率52.61%,黑暗条件显著抑制了新鲜烟草种子的萌发,这说明未完成后熟的种子并不会丧失光依赖性。
种子萌发完成后,将进入幼苗发育阶段,也就是农民广泛关注的“出苗”事件。在模式植物拟南芥中,光参与调控幼苗发育的相关研究已经取得显著进展,与光形态相比,暗形态下胚轴更长,且形成了一个特异性组织顶钩。PIFs和COP1/SPAs促进暗形态发生;而PHYs和HY5促进光形态发生。烟草与拟南芥的发育模式类似,光抑制幼苗的下胚轴伸长,促进子叶展开、顶钩消失。本研究发现,在黑暗环境中生长的幼苗,其面积和直径显著高于12小时光周期处理的幼苗。此外,这些幼苗的下胚轴长度也显著更长,子叶面积显著更大,但子叶曲率显著小于12小时光周期处理的幼苗。而在转录水平上,本研究未筛选到拟南芥同源基因和类似的信号通路。Liu等通过转录组和蛋白组联合分析的方法也未筛选到参与烟草幼苗形态发育的光敏色素信号通路基因,今后需要通過遗传学试验进一步探究。本研究发现光促进家族6个光捕获蛋白编码基因表达上调,而参与调控种子成熟脱水、休眠和早期胚胎发育的、、、等4个基因表达下调。这可能表示暗环境促进了烟草种子休眠,并且抑制了烟草幼苗的捕光过程。
关于萌发后的种子是否也进行微弱的光合作用,目前仍不清晰。大洋洲海藻种子发芽期间就存在光合作用,以增强后续叶子和根部的生长。拟南芥种子在萌发初期便进行强烈的光合作用,而抑制其光合作用对萌发进程是有害的。在烟草种子完成萌发后,参与光合作用和叶绿体发育的信号通路就已经被激活,为苗期的光合作用做储备。在本研究中,通过GO富集发现叶绿素代谢过程、代谢物和能量的前体形成、光合作用、色素合成、卟啉类化合物代谢等与光合作用相关生物学过程参与了烟草早期幼苗发育的调控。这说明烟草在幼苗期虽然光合面积很小,但光合作用、光系统、碳代谢基因在幼苗在光环境中的发育似乎仍起到重要的作用。
4 結 论
光照是调控烟草种子萌发和幼苗发育的一个重要环境因子,本研究通过表型组学定量分析了光参与调控的烟草种子萌发和早期幼苗发育的全过程,同时通过转录组学筛选出受光诱导表达的基因和信号通路,并通过qRT-PCR进验证。研究发现,12 h光周期处理种子发芽势和发芽率较黑暗处理显著提高。光照不影响种子的萌发表型,但对幼苗发育表型影响较大;光抑制胚轴伸长,但促进子叶开展。光促进光捕获蛋白家族的6个基因和膜内周蛋白、和 三个基因的表达,而抑制、、、、和和等11个基因的表达,这些基因的功能包括油脂代谢、调控种子休眠、光合作用、光系统的组装和光系统的捕光等生物学过程。本研究解析了光调控烟草种子萌发的分子机制,可为今后烟草耐寡照育种提供了理论依据。
参考文献
[1]易建华,贾志红,孙在军. 不同根系土壤温度对烤烟生理生态的影响[J]. 中国生态农业学报,2008,16(1):62-66.
YI J H, JIA Z H, SUN Z J. Physiological and ecological effect of rhizospheric soil temperature on flue-cured tobacco[J]. Chinese Journal of Eco-Agriculture, 2008, 16(1): 62-66.
[2]周木子,彭细桥,杨虹琦,等. 湘南烟区不同增温方式培育烤烟壮苗研究[J]. 湖南农业大学学报(自然科学版),2013,39(2):141-144.
ZHOU M Z, PENG X Q, YANG H Q, et al. Breeding of robust seedling of flue-cured tobacco indifferent heating systems in Southern Hunan[J]. Journal of Hunan Agricultural University (Natural Sciences), 2013, 39(2): 141-144.
[3]黄建,张义志,李宏光,等. 增温补光对郴州烤烟漂浮育苗成苗素质的影响[J]. 中国烟草科学,2014,35(2):100-103.
HUANG J, ZHANG Y Z, LI H G et al. Effect of improving temperature and fill-in light on tobacco seedling quality in float system in southern Hunan[J]. Chinese Tobacco Science, 2014, 35(2): 100-103.
[4]JIAO Y, LAU O S, DENG X W. Light-regulated transcriptional networks in higher plants[J]. Nature Reviews Genetics, 2007, 8(3): 217-230.
[5]SHIN J, KIM K, KANG H, et al. Phytochromes promote seedling light responses by inhibiting four negatively-acting phytochrome-interacting factors[J]. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106: 7660-7665.
[6]LEIVAR P, QUAIL P H. PIFs: pivotal components in a cellular signaling hub[J]. Trends in Plant Science, 2011, 16: 19-28.
[7]GU D H, CHEN C Y, ZHAO M L, et al. Identification of HDA15-PIF1 as a key repression module directing the transcriptional network of seed germination in the dark[J]. Nucleic Acids Research, 2017, 45(12): 7137-7150.
[8]QIU Y J, LU M N, KIM R J A, et al. Daytime temperature is sensed by phytochrome B in Arabidopsis through a transcriptional activator HEMERA[J]. Nature Communication, 2019, 10(1): 140.
[9]HUANG X, YANG X O, DENG X W. Beyond repression of photomorphogenesis: role switching of COP/DET/FUS in light signaling[J]. Current Opinion in Plant Biology, 2014, 21: 96-103
[10]HOECKER U. The activities of the E3 ubiquitin ligase COP1/SPA, a key repressor in light signaling[J]. Current Opinion in Plant Biology, 2017, 37: 63-69.
[11]SHIN J, KIM K, KANG H, et al. Phytochromes promote seedling light responses by inhibiting four negatively-acting phytochrome-interacting factors[J]. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(18): 7660-7665.
[12]BALCEROWICZ M, FITTINGHOFF K, WIRTHMUELLER L, et al. Light exposure of Arabidopsis seedlings causes rapid de-stabilization as well as selective post-translational inactivation of the repressor of photomorphogenesis SPA2: Functional divergence between SPA1 and SPA2[J]. The Plant, 2011, 65(5): 712-723.
[13]PACIN M, LEGRIS M, CASAL J J. COP1 re-accumulates in the nucleus under shade[J]. The Plant Journal, 2013, 75(4): 631-641.
[14]SHEERIN D J, MENON C, OVEN-KROCKHAUS S, et al. Light-activated phytochrome A and B interact with members of the SPA Family to promote photomorphogenesis in Arabidopsis by reorganizing the COP1/SPA complex[J]. Plant Cell, 2015, 27(1): 189-201.
[15]OSTERLUND M T, HARDTKE C S, WEI N, et al. Targeted destabilization of HY5 during light-regulated development of Arabidopsis[J]. Nature, 2000, 405: 462-466.
[16]孫雨珍,陈辉. 烟草种子发芽与光照的关系[J]. 中国烟草,1990(2):1-4.
SUN Y Z, CHEN H. Relationship between tobacco seed germination and light conditions[J]. Chinese Tobacco, 1990(2): 1-4.
[17]WANG Y, ZHANG M, DONG S, et al. The opposite roles of white light in regulating germination of fresh and aged seed in tobacco[J]. Plants, 2021, 10: 2457.
[18]LIU Q, ZHANG M, DONG S, et al. Systematic analysis of photo/sko-regulated germination and post-germination development of shallow photodormant seeds in Nicotiana tabacum L[J]. Frontiers in Plant Science, 2022, 13: 1042981.
[19]李鹏志,罗贞宝,胡玮,等. 调光膜对烤烟漂浮育苗烟苗生长及生理的影响[J]. 中国烟草科学,2011,32(6):63-66.
LI P Z, LUO Z B, HU W, et al. Effects of Vinyl house with sunlight conditioning film on the growth and physiology of tobacco seedling with floating system[J]. Chinese Tobacco Science, 2011, 32(6): 63-66.
[20]任晓春,高华军,张本强,等. 不同雪茄烟品种生长发育对光强的响应差异[J]. 中国烟草科学,2022,43(3):96-102.
REN X C, GAO H J, ZHANG B Q, et al. The differential response of various cigar tobacco varieties to light intensity during growth and development[J]. Chinese Tobacco Science, 2022, 43(3): 96-102.
[21]DONG S, LIU Y L, ZHANG M. Maternal light environment interacts with genotype in regulating seed photodormancy in tobacco[J]. Environmental and Experimental Botany, 2022, 194: 104745.
[22]李振华,刘一灵,陈航,等. 琼脂床在烟草种子发芽势(率)检验中的应用[J]. 农业工程学报,2012,28(增刊2):270-273.
LI Z H, LIU Y L, CHEN H, et a1. Application of agar bed on tobacco seed germination testing[J]. Transactions of the Chinese Society of Agricultural Engineering, 2012, 28 (Supp. 2): 270-273.
[23]LIU Q, LI Z, ZHANG M, et al. Systematic analysis of photo/sko-regulated germination and post-germination development of shallow photodormant seeds in Nicotiana tabacum L.[J]. Frontiers in Plant Science, 2023, 13: 1042981.
[24]LI Z, LIU Y, LIU R. Integrating multiple-capsule traits quantitative evaluation of seed maturity by 3D phenotypic platform in Nicotiana tabacum[J]. Hortscience, 2019, 54: 993-997.
[25]BOLGER A M, LOHSE M, USADEL B. Trimmomatic: a flexible trimmer for Illumina sequence data[J]. Bioinformatics, 2014, 30(15): 2114-2120.
[26]LOVE M I, SONESON C, PATRO R. Swimming downstream: statistical analysis of differential transcript usage following salmon quantification[J]. F1000 Research, 2018, 7: 952.
[27]杨兴有,叶协锋,刘国顺,等. 光强对烟草幼苗形态和生理指标的影响[J]. 应用生态学报,2007,18(11):2462-2465.
YANG X Y,YE X F,LIU G S, et al. Effect of light intensity on morphological physiological characteristics of tobacoo seed-lings[J]. Chinese Journal of Applied Ecology, 2007, 18(11): 2462-2465.
[28]劉国顺,杨兴有,位辉琴,等. 光照强度对烤烟漂浮育苗成苗素质的影响[J]. 烟草科技,2007(8):51-54.
LIU G S, YANG X Y, WEI H Q, et al. Effects of light intensity on quality of tobacco seedlings in floating system[J]. Tobacco Science and Tecnology, 2007(8): 51-54.
[29]邹焱,石俊雄,蒋卫,等. 烤烟立体漂浮育苗LED补光效果[J]. 中国烟草科学,2014,35(6):17-20.
ZOU Y, SHI J X, JIANG W, et al. Effects of LED lighting on seedling production with multilayer float system of flue-cured tobacco[J]. Chinese Tobacco Science, 2014, 35(6): 17-20.
[30]李鹏志,罗贞宝,胡玮,等. 调光膜对烤烟漂浮育苗烟苗生长及生理的影响[J]. 中国烟草科学,2011,32(6):63-66.
LI P Z, LUO Z B, HU W, et al. Effects of Vinyl house with sunlight conditioning film on the growth and physiology of tobacco seedling with floating system[J]. Chinese Tobacco Science, 2011, 32(6): 63-66.
[31]黄建,张义志,李宏光,等. 增温补光对郴州烤烟漂浮育苗成苗素质的影响[J]. 中国烟草科学,2014,35(2):100-103.
HUANG J, ZHANG Y Y, LI H G, et al. The impact of temperature supplement and additional lighting on the seedling quality of cigar tobacco during floating cultivation in Chenzhou[J]. Chinese Tobacco Science, 2014, 35(2): 100-103.
[32]KUCERA B, COHN M A, LEUBNER-METZGER G. Plant hormone interactions during seed dormancy release and germination[J]. Seed Science Research, 2005(15): 281-307.
[33]王素琴,李杨立,刘凤兰. 不同光照时间对烟草种子发芽的影响[J]. 河南农业科学,1993(1):22-24.
WANG S Q, LI Y L, LIU F L. Effect of different light duration on germination of tobacco seeds[J]. Journal of Henan Agricultural Sciences, 1993(1): 22-24.
[34]招启柏,宋平,王广志,等. 光、温、激素对烟草种子萌发和幼苗生长的影响[J]. 中国烟草学报,2001,7(4):29-32,46.
ZHAO Q B, SONG P, MA G Z, et al. Effects of light, temperature and phytohormone on seed germination and seedling growth of tobacco[J]. Acta Tabacaria Sinica, 2001, 7(4): 29-32, 46.
[35]宋碧清,郑昀晔,马文广,等. 光照强度对光敏感型和光不敏感型烟草种子发芽的影响[J]. 中国烟草科学,2013,34(5):72-77.
SONG B Q, ZHENG Y Y, MA W G, et al. Effects of light intensity on germination of light sensitive and insensitive tobacco seed[J]. Chinese Tobacco Science, 2013, 34(5): 72-77.
[36]DONG S, LIU Y L, ZANG M, et al. Maternal light environment interacts with genotype in regulating seed photodormancy in tobacco[J]. Environmental and Experimental Botany, 2022, 194: 104745.
[37]王堯,董帅,张民,等. NtPHYB1与储藏温度互作调控烟草种子光休眠和后熟[J]. 中国烟草科学,2021,42(5):36-42,49.
WANG Y, DONG S, ZHANG M. NtPHYB1 interacts with storage temperature to regulate seed photodormancy and after-ripening in Nicotiana tabacum L.[J]. Chinese Tobacco Science, 2021, 42(5): 36-42, 49.
[38]CELDRAN D, MARIN A. Seed photosynthesis enhances posidonia oceanica seedling growth[J]. Ecosphere, 2013, 4(12): 1-11.
[39]EASTMOND P, KOLACNA L, RAWSTHORME S. Photosynthesis by developing embryos of oilseed rape (Brassica napus L.)[J]. Journal of Experimental Botany, 1996, 47: 1763-1769.
[40]LI Z H, ZHANG J, LIU Y L, et al. Time series analysis of differential expression transcript in four developmental phases of germinating tobacco seed[J]. International Journal of Agricultural and Biology, 2020, 23: 87-92.
