灵芝多糖及其菌群代谢产物对HepG2 细胞胰岛素抵抗的改善作用及机制
2023-12-03刘世锋董文静周佳丽刘东波
刘世锋,董文静,杨 兰,3,周佳丽,刘东波,
(1.湖南农业大学园艺学院,湖南长沙 410128;2.国家中医药管理局亚健康干预技术实验室,湖南长沙 410128;3.川北医学院,四川南充 637000)
糖尿病是一种以糖脂代谢紊乱为标志的慢性内分泌疾病,其发病受遗传及环境等因素综合影响[1]。2 型糖尿病是糖尿病分类中发病率最高、患病人数最多的一个分型,占糖尿病患病人群总数的90%以上[2]。持续的高血糖是糖尿病的主要特征,长期的高血糖会引起心脑血管、肾、眼、足及神经等病变,并引发酮症酸中毒、乳酸性酸中毒等急性并发症,甚至威胁生命[3-4]。2 型糖尿病患者中,组织细胞产生胰岛素抵抗是机体发生高血糖的主要诱因,85%的2 型糖尿病患者存在明显的胰岛素抵抗,胰岛素抵抗贯穿2 型糖尿病发生发展的全过程[5]。
肝脏作为糖脂代谢的中枢,在2 型糖尿病的发生发展中起到至关重要的作用[6]。正常生理状态下,肝脏处胰岛素浓度足够调节肝脏细胞的糖代谢途径,促进肝脏细胞摄取葡萄糖、加速肝糖原的合成,维持血糖稳态[7];当肝脏细胞对胰岛素信号敏感性下降,肝脏发生胰岛素抵抗时,胞内胰岛素信号级联受抑制,蛋白激酶B(protein kinase B,AKT/PKB)介导的转录因子叉头盒蛋白O1(forkhead box protein O1,FoxO1)磷酸化失活水平降低[8],使依赖于FoxO1 的糖异生限速酶磷酸烯醇丙酮酸羧激酶(phosphoenolpyruvate carboxy kinase,PEPCK)水平上调[9],糖异生作用过度激活,造成高血糖。胰岛素对肝脏细胞糖代谢调控能力减弱,肝脏细胞糖异生过度激活、糖原合成受阻、糖脂代谢紊乱。现有的肝脏胰岛素抵抗靶向治疗药物主要通过影响肝脏细胞的葡萄糖转运、糖异生及糖酵解等方面来调节肝脏糖脂代谢,包括钠-葡萄糖协同转运蛋白(sodium-glucose cotransporter,SGLT)抑制剂、糖原磷酸化酶(glycogen phosphorylase,GP)抑制剂、葡萄糖激酶(glucokinase,GK)激活剂、肝脏糖异生抑制剂等[10-12]。
灵芝(Ganoderma lucidumKarst)是我国传统的食药两用真菌,具有调节糖脂代谢、抗炎、抗氧化、调节免疫等药理作用[13]。灵芝多糖(Ganoderma lucidumpolysaccharides,GLP)是灵芝的关键药效成分之一,是其改善糖脂代谢的主要有效成分;灵芝多糖可通过提高胰岛素敏感性[14]、调控葡萄糖代谢酶活性[15]、抑制胰岛β细胞凋亡[16]等多途径缓解胰岛素抵抗,从而维持血糖的稳定。体外模拟消化研究发现,大分子碳水化合物难以在人体消化酶系统的单独加持下代谢为人体易吸收的寡糖或单糖[17],其大多数都是在结肠部经微生物菌群代谢酵解。微生物在代谢的过程中会生成一系列的代谢产物,如乙酸、丙酸和丁酸等短链脂肪酸(short-chain fatty acid,SCFAs)[18];而乙酸、丙酸和丁酸则可以通过调节糖脂代谢,改善机体生理功能[19-23]。在以往的研究中,多糖的菌群代谢产物已经表现出了其绝佳的生物活性;Lin 等[24]研究发现,亚麻籽多糖经肠道微生物酵解的代谢产物能够通过下调GLUT2、SGLT、过氧化物酶体增殖物激活受体γ(peroxisome proliferators-activated receptorγ,PPARγ)和增强子结合蛋白(CCAAT-enhancerbinding proteins,C/EBP)的mRNA 及蛋白表达水平,改善机体糖脂代谢水平。而灵芝多糖经肠道微生物代谢后的生物活性变化目前尚不可知。本试验使用HepG2 细胞构建肝脏胰岛素抵抗模型,并使用该模型来评价微生物酵解前后的灵芝多糖对肝脏胰岛素抵抗的作用,系统深入地阐明其具体机制;以期为解释灵芝多糖缓解2 型糖尿病的胰岛素抵抗提供新思路和理论依据。
1 材料与方法
1.1 材料与仪器
HepG2 人肝癌细胞 由湖南农业大学国家中医药管理局亚健康干预实验室提供;湘赤芝壹号子实体购自长沙九峰生物科技有限公司,经湖南农业大学园艺学院刘东波教授鉴定为湘赤芝壹号G.lucidumXiangchizhi No.1 干燥子实体);苯酚、浓硫酸、酒石钾钠、3,5 二硝基水杨酸、无水硫酸钠、氢氧化钠、无水乙醇、香草醛、冰乙酸、高氯酸、乙酸乙酯、磷酸、盐酸 国药集团化学试剂北京有限公司;葡萄糖、熊果酸、牛血清白蛋白 绿叶生物科技有限公司;胰岛素、地塞米松 Invitrogen;FBS Bioligical Industries,BI;DMEM 培养基、0.25% Trypsin-EDTA、Pen Strep Gibco;DMSO、糖原合成试剂盒 Solarbio;CCK-8 试剂盒、考马斯亮蓝 G-250、BCA 蛋白浓度测定试剂盒、细胞膜蛋白、细胞浆蛋白抽提试剂盒(Beyotime)、葡萄糖氧化酶法测定试剂盒 南京建成生物工程研究所;GAPDH(CST)、Recombinant mAb to IRS1 antibody(abcam,GR98847-22)、AKT Rabbit Polyclonal antibody(Proteintech,10176-2-AP)、Phospho-Akt(Ser473)Mouse Monoclonal antibody(Proteintech,66444-1-Ig)、GSK3βRabbit Polyclonal antibody(Proteintech,22104-1-AP)、Phospho-GSK3β(Ser389)Rabbit、Polyclonal antibody(Proteintech,14850-1-AP)、PEPCK(Proteintech)、GLUT2 Monoclonal antibody(Proteintech,66889-1-lg)、HRP 标记山羊抗兔 lgG(H+L)(Beyotime,A0208)、HRP 标记山羊抗小鼠 lgG(H+L)(Beyotime,A0192)、Immobilon Western HRP 底物 默克生物科技有限公司。
SHZ-D(Ⅲ)循环水真空泵、LC-RE-52A 旋转蒸发器 上海保玲仪器设备有限公司;ST-16R 高速冷冻离心机、A2 超净工作台、IBright FL1500 多色荧光成像系统 Thermo Fisher Scientific;ME54E/02电子天平、XS205 专业型分析天平 Mettler-Toledo公司;3503-2 无菌培养箱 美国Shel-lab;AE2000光学显微镜 Motic 公司;Spark 多功能酶标仪 瑞士TECAN;LDZX-75KBS 立式压力蒸汽灭菌锅上海申安医疗器械厂;S210 pH 计 Mettler Toledo;BV-3 蛋白垂直电泳仪 上海天能科技有限公司。
1.2 实验方法
1.2.1 灵芝多糖提取纯化 GLP 提取参考文献[18],以2 kg 湘赤芝壹号子实体为原料,以1:10 的料液比100 ℃蒸馏水浸提1 h,重复3 次并真空抽滤,滤液合并,55 ℃减压浓缩为原体积的五分之一;加入乙醇至终浓度为75%,4 ℃过夜,高速离心机7500 r/min离心20 min 获得多糖沉淀物;所得沉淀使用少量蒸馏水溶解,采用Sevage 法脱蛋白;将脱蛋白多糖溶液置于透析袋(3500 Da)中透析过夜以去除小分子物质;将获得的多糖溶液55 ℃减压浓缩并冷冻干燥获得灵芝多糖样品。前期研究发现,该灵芝多糖的平均分子量为133.1 kDa,主要由葡萄糖、半乳糖、甘露糖、焦糖、木糖、葡萄糖胺和葡萄糖醛酸组成,摩尔比为58.97:17.54:8.63:2.79:2.02:1.13:6.77[18]。
1.2.2 灵芝多糖体外模拟结肠酵解 灵芝多糖肠道菌群代谢物(Ganoderma lucidumpolysaccharide flora metabolite,GLP-F)由所提取灵芝多糖经过体外模拟结肠厌氧发酵获得;具体过程参考Liu 等[21]的方法进行,分别取3 名3 月内没有服用任何抗生素的健康志愿者新鲜粪便12.5 g 于250 mL PBS 中匀浆、离心取上清。将灵芝多糖溶液和配制好的酵解培养基与菌液以5 g:250 mL:250 mL 的比例混匀,在Forma 厌氧系统中进行体外模拟酵解,48 h 停止酵解,迅速采集样品,以0.22 μm 微孔滤膜过滤,滤过液-80 ℃冷冻保存,用于后续机制研究。
1.2.3 灵芝多糖及酵解产物主要理化表征测定 主要理化表征包括多糖、还原糖、三萜及蛋白质的含量测定。总糖含量采用苯酚-硫酸法[25]进行测定,以葡萄糖质量浓度(mg/mL)为横坐标,吸光度值A 为纵坐标,于490 nm 处测定吸光值,绘制葡萄糖标准曲线,得回归方程为y=5.1417x+0.0036,R2=0.9977。二硝基水杨酸法[26]测定还原糖含量,以葡萄糖质量浓度(mg/mL)为横坐标,吸光度值A 为纵坐标,于540 nm处测定吸光值,绘制葡萄糖标准曲线,得回归方程为y=6.7698x-00143,R2=0.9962。香草醛-熊果酸-高氯酸法[27]测定三萜含量,以熊果酸质量(mg)为横坐标,吸光度值A 为纵坐标,于542 nm 处测定吸光值,绘制熊果酸标准曲线,得回归方程为y=3.5463x-0.015,R2=0.9945。考马斯亮蓝法[28]测定蛋白质含量,以牛血清白蛋白浓度(mg/mL)为横坐标,吸光度值A 为纵坐标,于595 nm 处测定吸光值,绘制标准曲线,得回归方程为y=2.7847x+0.0038,R2=0.9991。
1.2.4 GLP 和GLP-F 对HepG2 细胞毒性与增殖的影响测定 将HepG2 细胞以1.5×104个/mL 浓度接种于96 孔板中,每孔100 μL。待细胞贴壁后移除上清液换用无血清的DMEM 高糖培养基饥饿处理12 h,饥饿完成后随机分为对照组(Control,CON)、模型组(Model,M)、GLP 组和GLP-F 组;将CON组培养基换成DMEM 完全培养基,M 组及GLP 和GLP-F 组培养基置换成含Ins+Dex(Insulin+Dexamethasone)(10-3+10)µmol/L 的DMEM 完全培养基,继续培养24 h[29];诱导HepG2 细胞成为IR-HepG2细胞后,吸取上清,100 μL PBS 缓冲溶液清洗2 次。CON 组和M 组分别加入100 μL DMEM 完全培养基继续培养24 h,GLP 和GLP-F 组分别加入100 μL含250、500、750、1000 μg/mL GLP 和GLP-F、以及50、100、200、400 µg/mL GLP 和GLP-F 的DMEM完全培养基干预24 h。24 h 后,吸取细胞上清液,各孔加100 μL 10% CCK-8 检测液,37 ℃、5% CO2培养箱继续培养2 h 后,酶标仪490 nm 处检测吸光值,计算各组细胞生长情况[30],考察不同浓度灵芝多糖及其菌群代谢物对细胞毒性与增殖的影响。
1.2.5 GLP 和GLP-F 对HepG2 细胞葡萄糖消耗量的影响测定 依据1.2.4 得出GLP 和GLP-F 干预IRHepG2 细胞作用浓度范围,设定适宜浓度梯度进行后续试验。CON 组和M 组分别加100 μL DMEM完全培养基继续培养24 h,GLP 和GLP-F 组分别加入100 μL 含0、50、100、200、400 μg/mL GLP 和GLP-F 的DMEM 完全培养基干预24 h,依据分组吸取上清至离心管,按照葡萄糖氧化酶法检测试剂盒详细步骤操作,37 ℃培养箱反应10 min 后,酶标仪505 nm 处检测吸光值,计算葡萄糖消耗量[31]。
1.2.6 GLP 和GLP-F 对HepG2 细胞糖原含量的影响测定 调整细胞浓度为1.5×105个/mL,接种于6 孔板中,每孔2 mL,进行胰岛素抵抗模型的建立、给药干预方法同1.2.4。干预24 h 后,移除旧培养基,PBS 重复清洗2~3 次,每孔加入适量胰酶进行消化,待细胞微微变圆,吸去胰酶,加入1 mL PBS 缓冲液重悬,将细胞悬液移至1.5 mL 离心管,以1000 r/min,离心15 min,弃上清液,加入300 μL PBS 缓冲液,混匀并进行匀浆。加入0.75 mL 糖原提取液,冰水浴条件下超声破碎(300 W,3~5 s/次,间隙10 s,重复30 次),使细胞充分破碎,取超声破碎后的细胞悬液按照BCA 总蛋白定量试剂盒说明书测定总蛋白含量。其余部分采用糖原测定试剂盒检测糖原合成量。
1.2.7 Western blot 蛋白免疫印迹检测胰岛素信号通路蛋白表达 生长状况良好的细胞消化铺板至6 孔板,胰岛素抵抗模型构建与药物干预方法同1.2.4。干预完成后,每孔加入100 μL 2% SDS 裂解液,枪头顺时针搅动提取各组细胞总蛋白;取部分样品利用BCA 蛋白浓度测定试剂盒测定蛋白浓度,确定蛋白免疫印迹上样量;其余部分加入5×上样缓冲液95 ℃金属浴10 min 使蛋白变性,作为蛋白免疫印迹检测供试样品。以GAPDH 为内参,检测IRS-1、P-AKT/AKT、P-GS3Kβ/GS3Kβ、PEPCK、GLUT2 的蛋白表达量[32]。取等量蛋白样品进行SDS-PAGE 凝胶电泳,后转至PVDF 膜。5%脱脂奶粉室温封闭2 h,加入一抗,4 ℃孵育过夜。弃去残液,清洗后对应加入HRP 标记的山羊抗兔/抗小鼠二抗,室温孵育1 h。滴加ECL 于化学发光成像分析系统曝光显影。Image J 软件对蛋白条带进行定量分析。
1.3 数据处理
所有数据均表示为平均值±平均值的标准误差(SEM)。采用单因素方差分析(ANOVA)评估统计学意义,以确定每组之间的显著差异。P<0.05 被认为有显著性差异。
2 结果与分析
2.1 灵芝多糖的得率及GLP 和GLP-F 物质组分差异
2 kg 灵芝子实体经提取纯化等流程后,共获得17.138 g 灵芝多糖,得率为0.8569%;GLP 和GLP-F物质组分差异如表1 所示,灵芝多糖样品(GLP)中总糖含量为64.84%±1.96%,还原糖含量为6.14%±0.004%,三萜含量为0.53%±0.02%,蛋白含量为5.51%±0.04%。灵芝多糖经菌群代谢所生成产物中总糖含量下降至15.48%±0.03%(P<0.01);还原糖含量降低为1.43%±0.03%(P<0.01),三萜含量为0.55%±0.03%,蛋白含量为5.56%±0.26%。
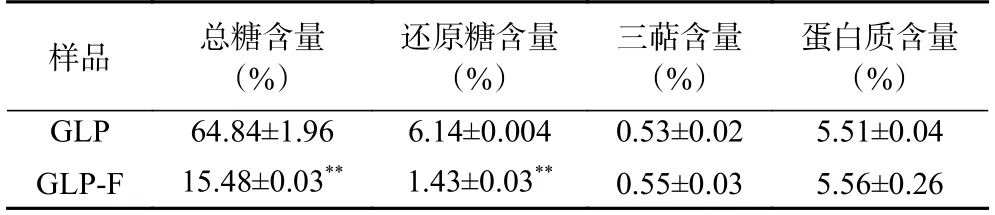
表1 GLP 和GLP-F 基本组成成分分析(n=3)Table 1 Basic component analysis of GLP and GLP-F (n=3)
2.2 GLP 和GLP-F 对细胞活力的影响
本实验使用胰岛素+地塞米松(Ins+Dex(10-3+10)µmol/L)诱导HepG2 细胞建立胰岛素抵抗细胞模型(IR-HepG2),并在此模型基础上研究GLP 和GLP-F 对胰岛素抵抗模型的作用。如图1 所示,Ins+Dex(10-3+10)µmol/L 不影响细胞活力;但随着GLP和GLP-F 的浓度升高(500~1000 μg/mL)HepG2 细胞活力逐渐降低,当GLP 和GLP-F 浓度分别为(GLP 500、750、1000 μg/mL;GLP-F 500、750、1000 μg/mL)时,细胞活力与CON 组以及M 组相比显著下降(P<0.05);随后,测试了GLP 和GLP-F(50~400)μg/mL对细胞活力的影响,发现(50~400)μg/mL 的GLP 与GLP-F 均未显著影响细胞活力(P>0.05)。
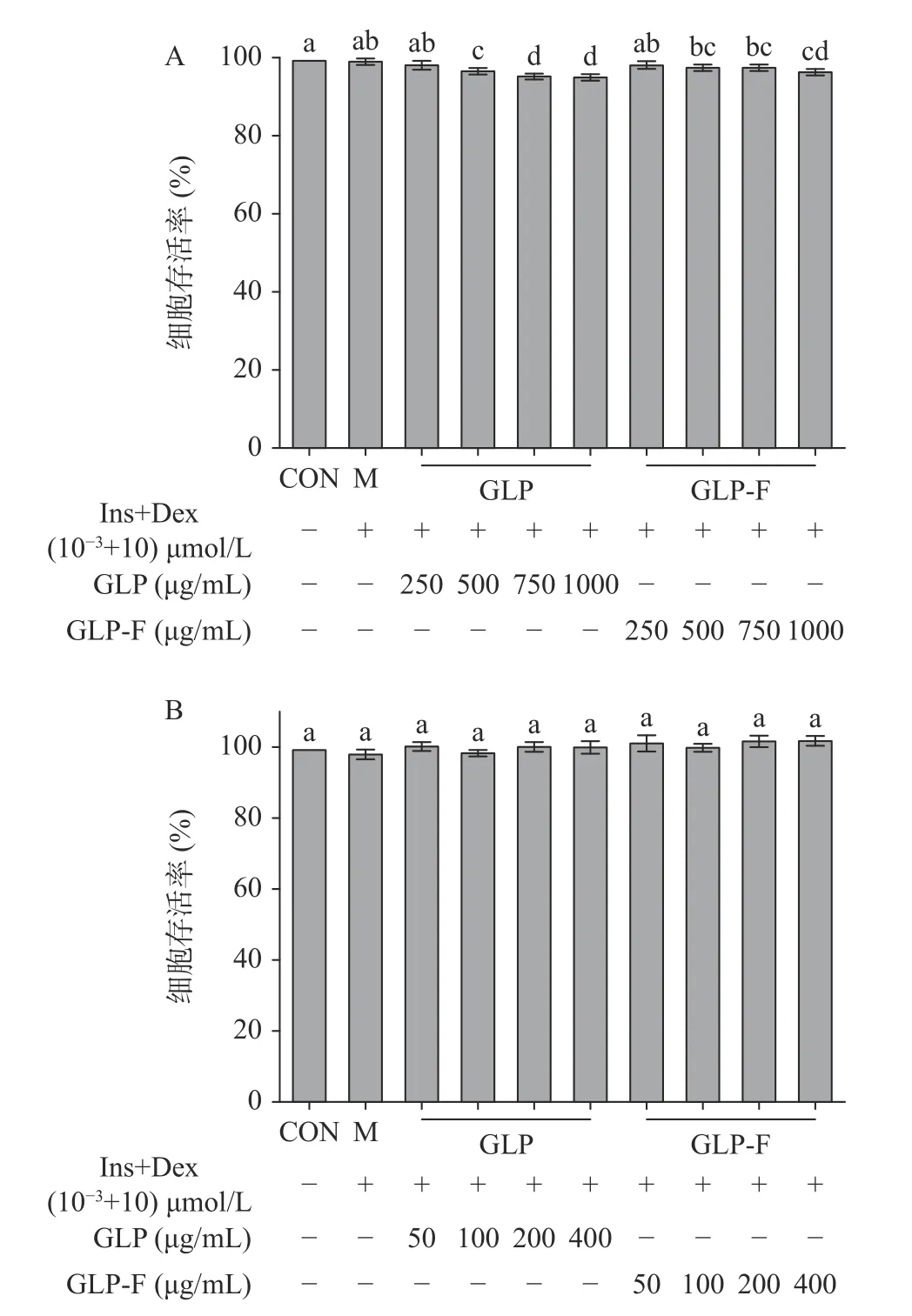
图1 GLP 和GLP-F 对HepG2 细胞活力的影响(n=3)Fig.1 The effect of GLP and GLP-F on the viability of HepG2 cells (n=3)
2.3 GLP 和GLP-F 对葡萄糖消耗量的影响
分别使用不同质量浓度(50、100、200、400 μg/mL)的GLP 和GLP-F 干预Ins+Dex(10-3+10)µmol/L 处理后的IR-HepG2 细胞。如图2 所示,IR-HepG2 细胞葡萄糖消耗量显著降低(P<0.05);经GLP 和GLP-F处理后,IR-HepG2 细胞葡萄糖消耗量显著上升(P<0.05);GLP 和GLP-F 组细胞均在400 μg/mL 有最大葡萄糖消耗量(15.80±2.15、17.66±1.28 mmol/L),且GLP-F 组显著高于GLP 组(P<0.05)。当细胞发生胰岛素抵抗时,细胞对胰岛素的敏感度降低,胰岛素信号转导受限,导致细胞对葡萄糖的摄取量降低;(100~400 μg/mL)的GLP-F 促进葡萄糖消耗显著优于同浓度的GLP,GLP 的微生物发酵促进了其改善胰岛素抵抗的功能。
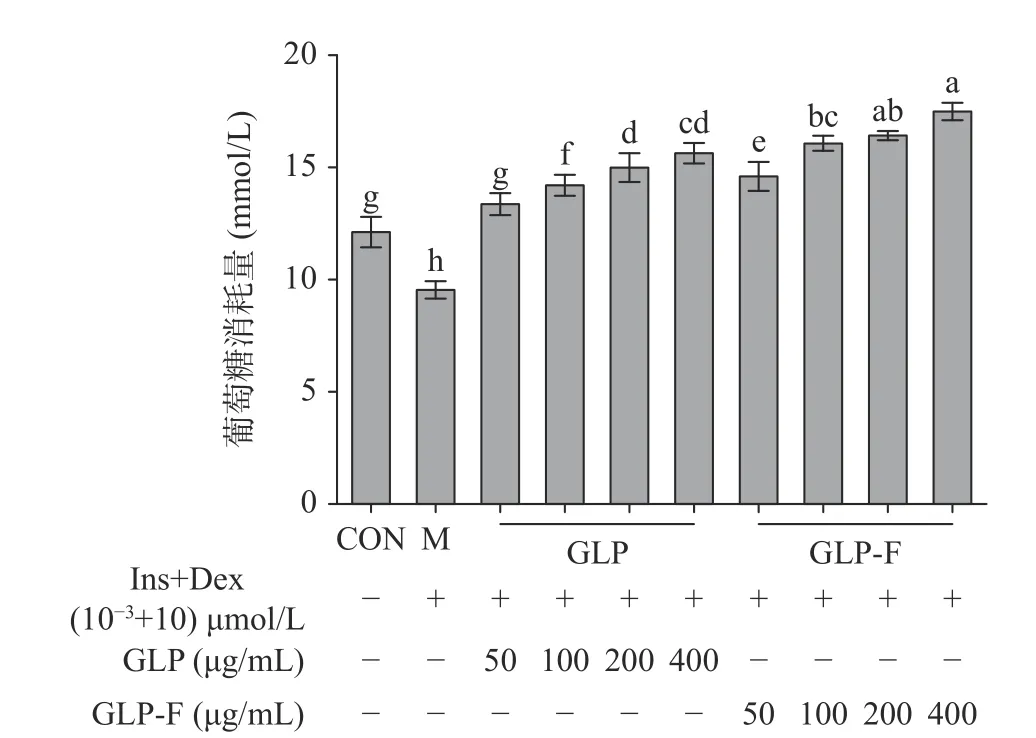
图2 GLP 和GLP-F 对IR-HepG2 细胞葡萄糖消耗量的影响(n=6)Fig.2 The effect of GLP and GLP-F on glucose consumption of IR-HepG2 cells (n=6)
2.4 GLP 和GLP-F 对糖原合成的影响
肝糖原是肝脏细胞储存葡萄糖的主要形式,其合成水平受胰岛素信号级联调控,当人体细胞产生胰岛素抵抗时,糖原合成受抑制,糖原合成量降低。结果如图3 所示,IR-HepG2 细胞糖原合成量显著低于CON 组(P<0.05);经不同质量浓度的GLP 和GLP-F处理后,IR-HepG2 细胞糖原合成水平显著恢复(P<0.05),且GLP 和GLP-F(200、400 μg/mL)处理组糖原合成水平显著高于CON 组(P<0.05),GLP 和GLP-F均表现出高浓度(200、400 μg/mL)促进肝细胞糖原合成的作用。
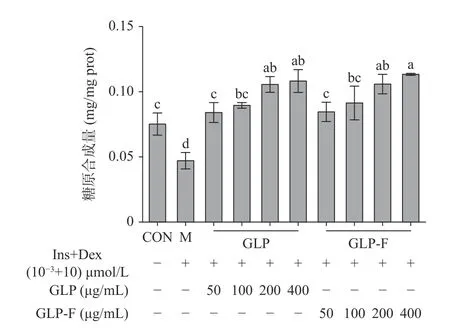
图3 GLP 和GLP-F 对IR-HepG2 细胞糖原合成的影响(n=3)Fig.3 The effect of GLP and GLP-F on glycogen synthesis of IR-HepG2 cells (n=3)
2.5 GLP 和GLP-F 对胰岛素信号级联关键蛋白的影响
实验发现(图4),与CON 组相比,Ins+Dex 处理后的IR-HepG2 细胞IRS-1 表达量极显著降低了36.715%(P<0.01)、P-AKT/AKT 极显著降低了44.62%(P<0.01)、PEPCK 极显著升高了23.60%(P<0.01)、P-GSK-3β/GSK-3β及GLUT2 分别极显著降低了23.90%、37.07%(P<0.01);经GLP 和GLP-F 400 µg/mL 干预后,其蛋白水平与模型组相比,IRS-1、PAKT/AKT、PEPCK、P-GSK-3β/GSK-3β、GLUT2 水平分别改变了(+31.58%、+31.81%)、(+125.09%、+148.88%)、(-31.83%、-51.59%)、(+59.40%、+80.71%)、(+40.04%、+43.54%),经过干预后这些蛋白的水平与M 组相比均具有显著性差异(P<0.01);其中,GLP-F 对糖异生关键限速酶PEPCK 的蛋白表达水平抑制极显著高于GLP(P<0.01);GLP 经微生物代谢后的产物GLP-F 对IR-HepG2 细胞糖异生途径的抑制作用强于GLP,GLP-F 对缓解肝脏细胞胰岛素抵抗具有比GLP 更强的效用。
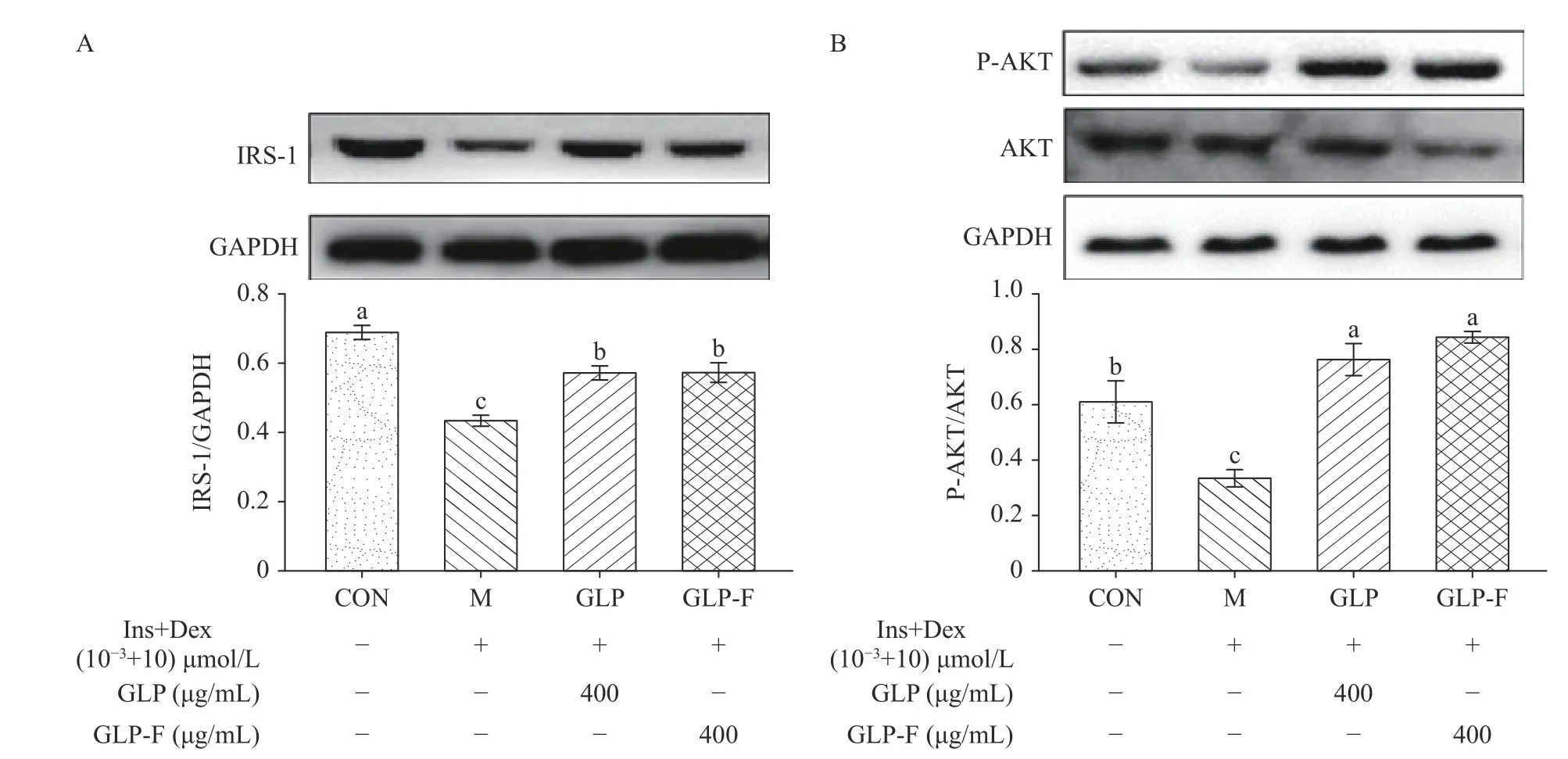
图4 GLP 和GLP-F 对IR-HepG2 细胞胰岛素信号级联的影响(n=3)Fig.4 Effect of GLP and GLP-F on insulin signaling cascade of IR-HepG2 cells (n=3)
3 讨论
肝脏作为胰岛素的主要靶器官,是调节体内血糖稳态的重要中枢[33];当肝脏细胞受到内源性或外源性信号的刺激,胰岛素信号级联出现异常,胰岛素不能正常调节其糖原合成、糖异生等糖脂代谢途径,引发肝脏胰岛素抵抗[34-35]。使用胰岛素+地塞米松(Ins+Dex(10-3+10)µmol/L)诱导人肝癌细胞HepG2细胞24 h 后,HepG2 细胞葡萄糖消耗量以及糖原合成量显著降低(P<0.05),表现出了明显的胰岛素抵抗表型(IR-HepG2)。而GLP 和GLP-F 以剂量依赖的形式恢复了Ins+Dex 对HepG2 细胞造成的葡萄糖消耗和糖原合成的抑制(图2、图3),GLP 和GLP-F表现出了显著的缓解胰岛素抵抗的效用。在以往的研究中,GLP 也表现出了缓解胰岛素抵抗的活性[9,36-37];Shao 等[36]在高脂饮食(HFD)和链脲佐菌素(STZ)诱导的糖尿病小鼠实验中发现,GLP 能够降低糖尿病小鼠的血糖水平、促进肝糖原合成和储存、修复胰岛细胞并增加胰岛素分泌,缓解胰岛素抵抗。此外,本研究发现50~400 µg/mL 的GLP-F 促进IR-HepG2葡萄糖消耗的能力比同等浓度的GLP 更加显著(P<0.05)。这表明,肠道微生物的代谢使得GLP 发挥出了更强的恢复细胞糖代谢稳态的生物活性。本实验数据表明,GLP 经体外模拟结肠发酵48 h 后,碳水化合物含量显著下降;其中,GLP 中总糖含量从64.84%±1.96%降低至15.48%±0.03%(P<0.01),还原糖含量从6.14%±0.004%降低至1.43%±0.03%(P<0.01)(表1),这表明GLP 可以被肠道菌群作为能量源所代谢利用[38]。本课题组前期研究表明GLP 可以富集肠道中降解和发酵多糖的优势菌种,拟杆菌属(Bacteroides)的水平[18];发酵液中乙酸、丙酸、丁酸等SCFAs 水平显著升高[18]。邓邦利[39]的研究表明,乙酸、丙酸、丁酸均能增加葡萄糖转运蛋白4(glucose transporter 4,GLUT4)的表达,并促进其进行膜转位,提高细胞摄取葡萄糖的能力。在肥胖和T2DM 动物模型中口服和静脉注射乙酸盐[40-42]、丁酸盐[43]和丙酸盐[43]可以通过增加肝脏AMPK 磷酸化和脂肪酸氧化、糖原储存、产热、糖异生通路相关靶基因,减少肝脏脂质积累并改善葡萄糖耐量。此外,用产丁酸盐细菌治疗大鼠可以预防饮食诱导的非酒精性脂肪肝的进展,并改善胰岛素抵抗[44]。由此推测,GLP-F 更强的糖代谢恢复能力可能是由GLP 经肠道微生物发酵产生的SCFAs 所介导的。
GLP 和GLP-F 可以通过上调IRS-1 的表达水平从而促进AKT 的磷酸化,P-AKT 通过调节下游效应蛋白GSK3β的磷酸化、降低PEPCK 的表达以及促进GLUT2 的表达,从而促进肝细胞糖原合成、抑制糖异生水平以及葡萄糖转运,缓解肝细胞胰岛素抵抗(图4)。这与在动物水平上的研究结果相似;Liu等[45]研究发现,GLP 能通过上调肝脏及肌肉组织中AKT 的磷酸化水平,以及糖异生关键限速酶糖原合酶(glycogen synthase,GS)和GLUT4 的表达水平,改善HFD 和STZ 诱导的T2DM 大鼠机体胰岛素抵抗状态;另外,在Xiao 等[46]的研究中,发现GLP 能够下调db/db 小鼠肝脏中糖异生限速酶(glucose-6-phosphatase,G6Pase)和PEPCK 的mRNA 及蛋白水平,并上调了葡萄糖转运蛋白GLUT2 的蛋白水平及mRNA 水平。而在本文的研究中发现,GLP 与GLP-F对IR-HepG2 细胞中糖异生限速酶PEPCK 的抑制效果存在显著的差异,与GLP 组相比,GLP-F 组对PEPCK 的抑制效用更强(P<0.01)。这种效应似乎是由GLP-F 中存在的SCFAs 所导致的,GLP-F 中含有较多的乙酸[18],而有研究表明,乙酸可以通过增加AMP/ATP 的比例直接激活AMPK,而在肝脏细胞中,AMPK 的激活降低了糖异生关键限速酶葡萄糖6-磷酸酶(G6Pase)和磷酸烯醇丙酮酸羧激酶(PEPCK)的表达[41]。本文证明了GLP 以及其在经过肠道微生物的代谢后的产物GLP-F 对IR-HepG2细胞胰岛素抵抗的缓解作用,同时发现发酵后的GLP 在促进肝细胞葡萄糖消耗以及抑制其糖异生通路具有更强的活性,这可能与发酵后产生的SCFAs有关。
4 结论
本研究探讨了肠道菌群在介导灵芝多糖(GLP)发挥药理活性中的潜在影响。利用HepG2 细胞胰岛素抵抗模型发现GLP-F 能够通过调节葡萄糖转运、糖原合成以及糖异生通路来缓解肝脏胰岛素抵抗;与GLP 相比,GLP-F 在促进其葡萄糖消耗、抑制其糖异生通路上具有更强的生物学效用。通过本实验发现,肠道菌群促进了GLP 缓解胰岛素抵抗的活性。本研究旨在为肠道菌群介导的灵芝多糖缓解肝脏胰岛素抵抗提供理论依据,为灵芝大健康产业的发展提供理论基础。
