烟草抗病嫁接对根际土壤微生物多样性的影响
2023-12-02黄昆鹏董昆乐李芳芳田效园姚建吴疆李洪臣王晓强周俊学孙聚涛
黄昆鹏 董昆乐 李芳芳 田效园 姚建 吴疆 李洪臣 王晓强 周俊学 孙聚涛

摘要:为探究抗病嫁接对烟草根际土壤微生物多样性的影响以及抗病增强的机制,为烟草嫁接抗病和筛选有益微生物提供理论基础。以烟草抗病品系8306作为砧木,以中烟100和NC89作为接穗进行嫁接,并以中烟100和NC89自根植株嫁接作为对照,利用高通量测序技术分析烟草根际土壤微生物群落结构特征。结果表明,抗病嫁接明显改变了烟草根际土壤中细菌和真菌的群落组成,增加了细菌OTU总数和特有OTU数量,提高了α多样性指数;降低了真菌OTU总数、特有OTU数量以及α多样性指数。与自根植株相比,中烟100/8306和NC89/8306根际土壤微生物中酸杆菌门相对丰度增幅分别为18.60%、12.02%;担子菌门相对丰度增幅分别为19.54%、17.24%,被孢霉门相对丰度增幅分别为97.78%、14.54%;RB41相对丰度增幅分别为28.52%、21.37%;土壤红杆菌属相对丰度增幅分别为1.41%、10.78%;被孢霉属相对丰度增幅分别为91.67%、14.16%;木霉属相对丰度增幅分别为43.30%、102.51%;毛壳菌属相对丰度增幅分别为1.80%、29.73%;镰刀菌属相对丰度分别降低了15.58%、51.09%,赤霉菌属相对丰度分别降低了76.79%、19.33%。研究表明,烟草抗病嫁接能够明显改变烟草根际土壤细菌和真菌群落的组成和数量,减少了病原微生物数量,增加了有益功能优势菌的相对丰度,有益功能优势菌的增加改善了根际土壤微生物环境,增加了土壤有机质和土壤养分含量,促进植株根系发育,这是烟株嫁接抗病性增强的重要原因之一。
关键词:烟草;嫁接;真菌;根际土壤;多样性;高通量测序
中图分类号:S435.72;S572.06文献标志码:A
文章编号:1002-1302(2023)20-0239-09
烟草是我国重要作物,为烟农提供了诸多經济机会,而土传病害在国内烤烟主产区危害呈加重趋势,造成了严重的经济损失。土传病害与根际土壤微生态环境密切相关,根际土壤微生态环境由植物、土壤和微生物群落组成[1-3]。土壤微生物中,细菌的数量是最多的,在维护土壤健康、拮抗土传病害、养分循环等方面起到关键作用[4];土壤真菌具有降解有机质、释放营养和微量元素及调控土壤养分的作用,在农业生态系统,以及植物生长过程中扮演着重要角色[5-7]。根系健康的微生物一方面可抑制植物病原菌过度繁殖,另一方面可酶解产生诱导物质并积累大量次生抗病物质,提高作物的抗病性,根茎通过增强养分和水分的吸收影响整体,增加内源激素的合成,提高对恶劣环境的抗性[8-9]。有研究发现,嫁接能够改变茄子、辣椒、番茄等茄科作物根系分泌物质组成及根际微生物群落结构,进而影响植株对土传病害的抗性[10-14]。长期的实践生产已证实,嫁接能克服连作障碍,并且对烟草黑胫病、烟草青枯病等有较好的防治效果[15-16]。然而关于嫁接引起的烟草根际微生物相互作用和群落组合的变化却知之甚少。
高通量测序技术不仅能检测土壤微生物的优势物种,亦可检测稀有物种及部分未知物种[14]。本研究采用嫁接技术,以土传病害高抗烟草品系8306砧木与烟草感病品种中烟100和NC89进行嫁接栽培,利用Illumina MiSeq高通量测序技术,分析抗病嫁接对烟草植株根际土壤微生物多样性及群落结构的影响,旨在探究烟草嫁接增强植株抗性的机制,并为利用嫁接技术防控烟草土传病害提供一定理论依据。
1 材料与方法
1.1 试验材料
试验于2021年在河南省许昌市襄城县汾陈镇(33°58′11.50″N,113°32′5.82″E)进行,供试大田土壤为黄壤,该地近年均温14.7 ℃,日照时长2 280 h,年均年降水量579 mm,平均无霜期217 d。供试烟草包括抗病品系8306、河南当前主栽品种中烟100、河南曾经主栽品种NC89,由河南农业大学烟草育种实验室提供。在温室中按漂浮育苗方法育苗,烟苗培育至6~7张真叶期,用于嫁接处理,嫁接方式参照文献[15]。以中烟100、NC89的烟苗作接穗,以8306的烟苗作砧木,并以中烟100、NC89自根苗嫁接作对照,共设4组嫁接,嫁接编号见表1。
1.2 试验方法
1.2.1 样品采集 在烟草移栽80 d时,在试验田进行样品采集。取样时去除地表杂物,然后将烟株整株挖起,去除主体根围土,采用抖根法收集须根 2 mm 范围内的土壤[17]。
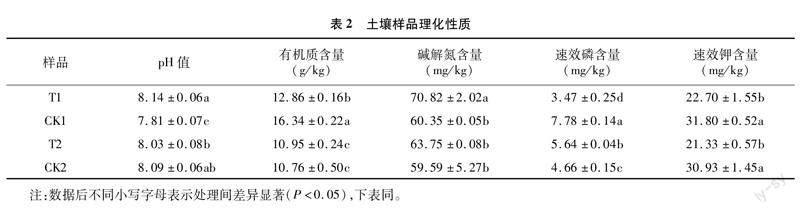
1.2.2 检测项目及方法 按5点取样法进行取样,每个处理取 5 株,收集完成后混匀并分为两部分,一部分土壤样品用于土壤真菌高通量测序,用 10 mL 无菌离心管装好置于干冰保藏箱中,快速带回实验室于-80 ℃超低温冰箱保存备用;另一部分土壤样品用于化学性质检测,用自封袋装好带回实验室,自然阴干,研磨过筛后备用,参照文献[18]中的方法进行检测,检测结果见表2。
1.2.3 基因组DNA的提取 样品DNA提取由上海美吉生物医药科技有限公司完成。根据 E.Z.N.A. soil DNA kit (Omega Bio-tek,Norcross,GA,U.S.)说明书进行根际土壤微生物总 DNA 的提取,使用1%琼脂糖凝胶电泳检测DNA的提取质量,使用NanoDrop2000 UV-Vis 分光光度计(Thermo Fisher Scientific,Wilmington,NC,United States),测定DNA 浓度和纯度。
1.2.4 目的基因扩增及 Illumina Miseq 测序 将同一样本的PCR产物混合后使用2%琼脂糖凝胶回收PCR产物,引物序列为ITS1F(5′-CTTGGTCATTTAGAGGAAGTAA-3′)和ITS2R(5′-GCTGCGTTCTTCATCGATGC-3′)。利用凝胶回收试剂盒[AxyPrep DNA Gel Extraction Kit (Axygen Biosciences,Union City,CA,USA)] 进行回收产物纯化,用2%琼脂糖凝胶电泳检测,并用QuantusTM Fluorometer (Promega,USA) 对回收产物进行检测定量。使用NEXTflexTM Rapid DNA-Seq Kit(Bioo Scientific,美国)进行建库,PCR 产物由上海美吉生物医药科技有限公司利用 HiSep 测序平台进行高通量测序。
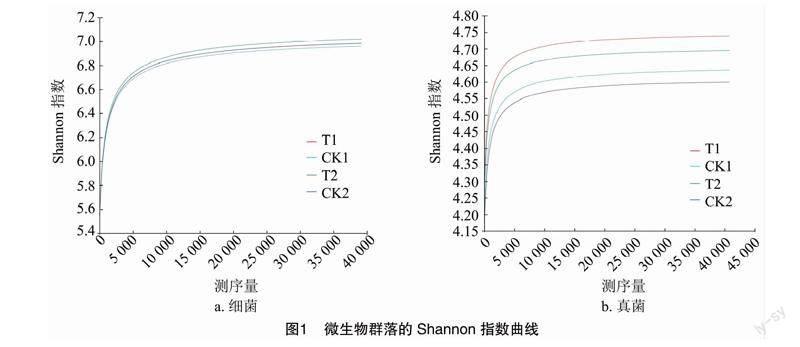
利用软件平台Usearch(version 7.0)对相似度在97%条件下的操作分类单元(OTU)进行质控拼接和Tag聚类去嵌合体,获得4 组 16 个样品的 OTU 的丰度和 OTU 代表序列。由图1可知,各不同嫁接处理样品细菌和真菌的OTU水平的Shannon指数曲线均在测序量约为5 000条时趋于平缓,证明本次测序数据量能够比较真实地反映土壤样本的微生物群落。表明本研究测序深度所产生的测序数据可满足后续试验要求。
1.3 数据分析
对原始测序序列进行质控、拼接、OTU 聚类并剔除嵌合体。利用[JP+1]Mothur(version v.1.30.2 )软件指数分析样本的α多样性分析,通过Ace 指数、Chao 1 指数、香农 (Shannon)指数和辛普森 (Simpson)指数反映微生物群落的丰富度和多样性[19]。利用主坐标分析(PCoA)法进行β多样性分析,PCoA是基于距离矩阵进行降维分析,以百分比评估各坐标轴对菌群结构总体差异的解释度。用 Microsoft Excel 2016和IBM Statistics SPSS 21.0 软件进行数据分析和正态分布检验。
2 结果与分析
2.1 不同嫁接处理根际土壤细菌和真菌群落 α多样性
由表3可知,土壤细菌、真菌样品的文库覆盖度分别达到了96.50%、99.50%以上,表明注释结果反映的群落生物信息能够代表真实环境中的微生物多样性。通过分析得出,细菌的 α 多样性指数明显高于真菌的 α 多样性,嫁接提高了细菌物种丰富度以及群落多样性,但不具有显著性差异。通过分析真菌的Ace 指数和Chao 1 指数可知,嫁接降低了真菌物种的丰富度以及群落多样性。
2.2 OTU水平Venn图分析
由图2可知,8306作为抗病砧木对中烟100 OTU数量的影响大于对NC89 OTU数量的影响。其中由图2-a可以看出,T1和T2的细菌OTU总数高于自根苗嫁接,其中T1特有的OTU为1 352个,CK1特有的OTU为1 283个,T2特有的OTU为 1 146 个,CK2特有的OTU为1 132个。由图2-b可知,真菌OTU总数、特有OTU数量均低于自根苗嫁接,T1特有的OTU为435个,而CK1特有的OTU为606个;T2特有的OTU为431个,CK2特有的OTU为436个。综合分析,嫁接增加了细菌的OTU数量及特有OTU数量,降低了真菌的OTU数量及特有OTU数量。
2.3 根际土壤微生物群落组成分析
2.3.1 基于门分类水平的微生物群体结构分析 由图3-a 可知,基于门分类水平分析发现,不同嫁接处理根际土壤中前4个优势菌门相对丰度累计总和为72.45%~74.93%。其中,放线菌门 (Actinobacteriota)在各嫁接处理中相对丰度占比最高 均值在25.48%~26.80%之间 各嫁接处理之间无明显差异;其次是变形菌门 (Proteobacteria),其占比在19.61%~24.65%之间,与自根植株嫁接相比,T1、T2处理变形菌门的相对丰度分别降低了14.82%、11.02%;酸杆菌门 (Acidobacteria)分别增加了18.60%、12.02%;绿弯菌门 (Chloroflexi)分别增加了2.08%、8.16%;黏菌门(Myxococcota)分别增加了3.55%、3.92%、Methylomirabilota分别增加了118.58%、10.91%;浮霉菌门 (Planctomycetota)分别增加了42.89%、4.28%;unclassified_k__norank_d__Bacteria分别增加了38.35%、20.71%;肠杆菌门(Entotheonellaeota)分别增加了48.15%、17.71%;Latescibacterota分别增加了174.7%、79.59%;NB1-j分别增加了118.58%、10.91%;髌骨细菌门(Patescibacteria)分别降低了54.62%、30.43%;蛭弧菌(Bdellovibrionota)分别降低了7.58%、13.28%;综合对比,嫁接烟株优势菌门相对丰度呈现共同上涨趋势的有9种,下降趋势的有3种。由图3-b可知,子囊菌门(Ascomycota)相对丰度占比最高,均值在55.24%~73.37%之間,与自根植株相比,中烟100/8306和NC89/8306的相对丰度分别减少24.72%、2.59%;其次是被孢霉门(Mortierellomycota),相对丰度占比在12.71%~25.14%之间,与对照相比增幅分别为97.78%、14.54%,担子菌门(Basidiomycota)相对丰度增幅分别为19.54%、17.24%;Aphelidiomycota 相对丰度增幅分别为242.86%、97.01%;毛霉门(Mucoromycota) 相对丰度降幅分别为93.23%、78.04%;罗兹菌门(Rozellomycota)相对丰度降幅分别为6.85%、75.58%;壶菌门(Chytridiomycota)相对丰度降幅分别为26.37%、25.41%。综合对比,嫁接对中烟100的影响大于对NC89的影响。
2.3.2 基于属分类水平的微生物群体结构分析 图4为抗病嫁接根际土壤中占比大于1.5%的优势菌属以及占比小于1.5%的其他菌属(以others表示)。如图4-a 所示,细菌属水平中,与自根植株相比,中烟100/8306和NC89/8306的norank_f__Vicinamibacteraceae、norank_f__norank_o__Vicinamibacterales、norank_f__Gemmatimonadaceae、RB41、norank_f__norank_o__norank_c__MB-A2-108、norank_f__norank_o__Rokubacteriales、土壤红杆菌属(Solirubrobacter)、norank_f__norank_o__norank_c__KD4-96、链霉菌属(Streptomyces)和norank_f__norank_o__norank_c__bacteriap25 菌属的相对丰度呈现相对增加的趋势,其中RB41相对丰度增幅分别为28.52%、21.37%,而芽殖球菌属(Blastococcus)、链霉菌属(Streptomyces)、鞘脂单胞菌属(Sphingomonas)呈现相对丰度降低的趋势,嫁接烟株优势菌属相对丰度呈现上涨趋势的有10种,呈现下降趋势的有3种。
由图4-b可知,真菌属水平中被孢霉属(Mortierella)的相对丰度占比最高,4组处理的均值在12.53%~24.01%之间,与自根植株相比,中煙100/8306和NC89/8306被孢霉属相对丰度增幅分别为91.67%、14.16%;木霉属(Trichoderma)相对丰度增幅分别为43.30%、102.51%;毛壳菌属(Chaetomium)相对丰度增幅分别为1.80%、29.73%;除上述3种菌属外unclassified_p_Ascomycota、Solicoccozyma、unclassified_o__Hypocreales、unclassified_o__Pleosporales、Pyrenochaetopsis、unclassified_o__Agaricales 菌属的相对丰度呈现增加的趋势,其中unclassified_o__Agaricales增加幅度较大,相对丰度增幅分别是 6 480.00%、579.30%。相对丰度降低的菌属有镰刀菌属(Fusarium),相对丰度降幅分别为15.58%、51.09%,赤霉菌属(Gibberella),相对丰度降幅分别为76.79%、19.33%,除此之外,新赤壳属(Neocosmospora )、青霉属(Penicillium)、短梗蠕孢属(Trichocladium)、unclassified_o__Sordariales、unclassified_c__Sordariomycetes、Cercophora、Plectosphaerella的相对丰度也呈现降低的趋势。
2.4 不同嫁接根际土壤微生物 β 多样性分析
PCoA 基于距离矩阵进行降维分析,以百分比评估各坐标轴对菌群结构总体差异的解释度,一般PCoA1和PCoA2总和达到50%以上较好[20]。由图 5-a 可知,T1和CK1、T2和CK2第1主成分(PC1)和第2主成分(PC2)对嫁接处理样品差异的贡献值之和分别为71.56%、 64.41%,大于50%,说明坐标轴对细菌群落结构总体解释度较好,T1和CK1的非度量多维标度(NMDS)分析结果为0.009,T2和CK2的NMDS分析结果为0.037,均小于0.1,说明模型模拟效果好,可靠性高。2个样本之间距离越接近,表示样本组成结构相似度越高,T1与CK1之间和T2与CK2之间相比,T1、CK1 2个样本之间距离较大,群落结构差异也较大。由图5-b可知,T1和CK1、T2和CK2的PC1和PC2对嫁接处理样品差异的贡献值之和分别为71.24%、51.05%,均大于50%,T1和CK1、T2和CK2的NMDS分析结果均小于0.1,模型符合数据要求。T1与CK1和T2与CK2 2个样本之间的距离相差不大,说明嫁接对真菌群落结构影响在2个品种之间基本一致。
2.5 不同嫁接根际土壤理化性质与微生物群落关联分析
冗余分析(RDA)又称多元直接梯度分析,将对应分析与多元回归分析相结合,使用二维平面展示环境因子、样品、菌群三者之间的关系。由图6可知,不同嫁接处理根际土壤细菌(图6-a)、真菌(图6-b)RDA1与RDA2之和分别为55.82%、70.44%,说明排序轴能够很好地反映环境因子与菌群之间的关系。在细菌属水平上(图6-a),斯皮尔曼(Spearman)相关系数显示,土壤碱解氮含量对细菌的影响比较显著,土壤碱解氮含量与norank_f__Vicinamibacteraceae、norank_f__norank_o__Vicinamibacterales、norank_f__norank_o__norank_c__MB-A2-108、 RB41的相对丰度呈显著正相关,其中与RB41的R=0.562(P<0.01);与芽殖球菌属(Blastococcus)、土壤红杆菌属(Solirubrobacter)的相对丰度呈极显著负相关,其中与土壤红杆菌属(Solirubrobacter)的R=-0.523(P<0.01);土壤速效钾含量与土壤红杆菌属(Solirubrobacter)(R=-0.552,P<0.01)的相对丰度呈显著负相关。在真菌属水平上(图6-b),斯皮尔曼(Spearman)相关系数显示,土壤pH值和土壤有机质含量对真菌属的影响比较显著,其中土壤pH值与被孢霉属(Mortierella)(R=0.674,P<0.01)的相对丰度呈极显著正相关,与赤霉菌属(Gibberella)(R=-0.602,P<0.05)的相对丰度呈显著负相关;土壤有机质含量与木霉属(Trichoderma)(R=-0.579,P<0.05)的相对丰度呈显著负相关;土壤碱解氮含量与被孢霉属(R=0.547,P<0.05)的相对丰度呈显著正相关。土壤碱解氮、土壤pH值和土壤有机质含量是影响根际微生物群落组成的重要土壤理化性质。
3 讨论
本研究结果表明,抗病嫁接明显改变了烟株根际土壤细菌和真菌的群落结构,其中嫁接增加了细菌OTU数量和特有OTU数量,这与刘娜等的研究结果[1]一致。嫁接后根际土壤优势菌门、优势菌属相同,嫁接改变了优势菌的相对丰度,其中细菌优势菌呈现增加趋势的数量大于降低的优势菌。烟草抗病嫁接对根际土壤细菌和真菌的α多样性指数的改变不具有显著性差异,但2个嫁接品种的结果与对照相比,改变趋势相同。通过根际土壤理化性质与微生物群落关联分析得出,土壤碱解氮含量、土壤pH值和土壤有机质含量是影响根际微生物群落组成的重要土壤理化性质,这与文献的研究结论[21]一致。
基于门分类水平分析,中烟100/8306和NC89/8306与自根植株相比,酸杆菌门、绿弯菌门等的相对丰度呈现增加的趋势,敖金成等研究发现烟草连作种植和根腐病发病的植株根际土壤中酸杆菌门、绿弯菌门的相对丰度呈明显降低趋势,说明健康的根际土壤微生物中酸杆菌门、绿弯菌门具有重要作用[22]。有研究表明,绿弯菌门能够分解纤维素,酸杆菌门可以通过降解木质素和纤维素增加土壤有机质含量,提高土壤养分含量[23-25]。变形菌门包含有大量的动植物致病菌,其相对丰度的降低能够提高土壤环境抗逆性,降低植株的病害损失[26]。担子菌门的相对丰度提高了19.54%、17.24%,担子菌门真菌作为土壤中主要分解者,与植物共生形成菌根,丰度的提高有利于植物生长,提高植株的抵抗力,增强抗病性[27-28]。被孢霉门的相对丰度增幅分别为97.78%、14.54%,被孢霉门属于真菌中的好氧型,偏好透气性良好的土壤环境,具有分解半纤维素、纤维素和木质素等物质的能力,并将土壤中的糖类物质进行自身的生长代谢,进而增加土壤养分和有机质含量[29]。基于属分类水平分析,RB41、土壤红杆菌属等的相对丰度呈增加趋势,其中RB41的相对丰度增幅分别为28.52%、21.37%。研究表明在所有生态系统中常见的属中,RB41和根瘤菌、链霉菌通过细菌生产力和呼吸共同构成了45%~57%的碳流,是碳循环的重要组成部分。土壤红杆菌属丰度增加有利于促进根系发育,植株的生长,提高植株得抵抗力[30]。被孢霉属的相对丰度增幅分别为91.67%、14.16%,有研究表明在土壤中添加被孢霉可显著增加钾、钙、镁和硼等元素的含量,能够增强土壤肥力[31-32];而且其分泌的不饱和脂肪酸是土壤微生物吸收利用的重要碳源,可以改变土壤微生物生境,进而影响土壤微生物群落组成[33]。木霉属的相对丰度增幅分别为43.30%、102.51%,木霉菌产生木聚糖、低聚糖、内肽化合物等小分子量化合物诱导植物产生防御反应[34-35],以空间竞争、营养竞争、重寄生、分泌抗菌物质等途径抑制或杀灭病原菌[36],而且木霉菌同时具有一定促进作物增产的效果,目前木霉菌被广泛用于防治烟草黑胫病[37-39];毛壳菌属的相对丰度增幅分别为1.80%、29.73%,有研究表明毛壳菌属是一种分布非常广泛的腐霉真菌,可以产生丰富的降解纤维素的酶,产生多种次生代谢物(如球毛壳素、毛壳素等),能够对多种病原菌起到良好的抑制作用[40-41]。镰刀菌属的相对丰度分别降低了15.58%、51.09%,赤霉菌属的相对丰度分别降低了76.79%、19.33%。研究表明,镰刀菌属可引发多种植物患病,是土壤中常见的致病菌,在烟草作物上可引起烟草枯萎病和根腐病[42-43];所有的赤霉菌都是镰刀菌的有性阶段,许多赤霉菌可以引起具有破坏性的植物病害,例如小麦赤霉病、玉米穗腐病、水稻恶苗病和马铃薯块茎干腐病等农业生产上重要的粮食作物[44],因此,镰刀菌属和赤霉菌属相对丰度的降低,有利于降低植株病害的发生。
4 结论
本研究通过Illumina MiSeq对抗病嫁接烤烟根际土壤进行宏基因組测序,探明了烟草抗病嫁接对土壤细菌、真菌群落结构的影响,嫁接富集了酸杆菌门、绿弯菌门、黏菌门、担子菌门、被孢霉门、RB41、土壤红杆菌属、被孢霉属、木霉属、毛壳菌属等有益菌,其中酸杆菌门、绿弯菌门、被孢霉门、毛壳菌属具有提高纤维素分解的能力,从而增加土壤有机质含量,提高土壤养分含量;木霉属、毛壳菌属对多种病原菌具有强大的拮抗能力,能够改善植株根际微环境,降低根际土壤环境中的病原菌;担子菌门、土壤红杆菌属相对丰度增加有利于促进根系发育,植株的生长,提高植株自身的病害抵抗力。由此推断,富集有益微生物,减少病原微生物的方式是嫁接植株抗性增强的重要机制之一。
参考文献:
[1]刘 娜,朱为民,鲁 博,等. 嫁接对番茄根际土壤微生态环境的影响[J]. 上海农业学报,2014,30(5):6-10.
[2]Shi S,Nuccio E E,Shi Z J,et al. The interconnected rhizosphere:high network complexity dominates rhizosphere assemblages[J]. Ecology Letters,2016,19(8):926-936.
[3]Kuzyakov Y,Razavi B S. Rhizosphere size and shape:temporal dynamics and spatial stationarity[J]. Soil Biology and Biochemistry,2019,135:343-360.
[4]贾洪柏. 石油污染土壤的微生物修复及对相关土壤细菌群落多样性的影响[D]. 哈尔滨:东北林业大学,2013.
[5]徐雪雪,王 东,秦舒浩,等. 沟垄覆膜连作马铃薯根际土壤真菌多样性分析[J]. 水土保持学报,2015,29(6):301-306,310.
[6]Ding Y,Jin Y,He K,et al. Low nitrogen fertilization alter rhizosphere microorganism community and improve sweetpotato yield in a nitrogen-deficient rocky soil[J]. Frontiers in Microbiology,2020,11:678.
[7]刘松涛,田春丽,曹雯梅,等. 基于不同土壤质地棉花根际微生物和酶活性特征分析[J]. 中国农业科技导报,2020,22(2):73-79.
[8]徐新雯,林正全,拓阳阳,等. 烟蒜轮作对烟株根际土壤细菌群落结构的影响[J]. 西南农业学报,2020,33(9):1917-1924,2137.
[9]Sharma A,Wang J,Xu D,et al. Melatonin regulates the functional components of photosynthesis,antioxidant system,gene expression,and metabolic pathways to induce drought resistance in grafted Carya cathayensis plants[J]. Science of the Total Environment,2020,713:136675.
[10]郝 晶,周宝利,刘 娜,等. 嫁接茄子抗黄萎病特性与根际土壤微生物生物量和土壤酶的关系[J]. 沈阳农业大学学报,2009,40(2):148-151.
[11]姜 飞,刘业霞,艾希珍,等. 嫁接辣椒根际土壤微生物及酶活性与根腐病抗性的关系[J]. 中国农业科学,2010,43(16):3367-3374.
[12]刘业霞,付 玲,艾希珍,等. 嫁接辣椒根系特征及根际土壤酶活性与青枯病抗性的关系[J]. 西北植物学报,2012,32(5):963-968.
[13]刘斯晗. 嫁接番茄根系分泌物活性物质鉴定及抗青枯病机理研究[D]. 南宁:广西大学,2021.
[14]庞师婵,郭 霜,任奎瑜,等. 番茄/茄子嫁接对其根际土壤生物学性状及细菌群落结构的影响[J]. 园艺学报,2020,47(2):253-263.
[15]刘剑君,朱保川,胡少先,等. 嫁接对烤烟生长发育及黑胫病抗性的影响[J]. 烟草科技,2018,51(7):8-16.
[16]黎妍妍,王 林,彭五星,等. 嫁接对烟草青枯病抗性及产质量的影响[J]. 中国烟草学报,2016,22(5):63-69.
[17]Epelde L,Becerril J M,Hernández-Allica J,et al. Functional diversity as indicator of the recovery of soil health derived from Thlaspi caerulescens growth and metal phytoextraction[J]. Applied Soil Ecology,2008,39(3):299-310.
[18]鲍士旦. 土壤农化分析[M]. 3版. 北京:中国农业出版社,2000.
[19]Pitta D W,Parmar N,Patel A K,et al. Bacterial diversity dynamics associated with different diets and different primer pairs in the rumen of Kankrej cattle[J]. PLoS One,2014,9(11):e111710.
[20]敖金成,周桂夙,李永梅. 连作烟田健株与根腐病感病烟株根际土壤微生物多样性研究[J]. 河南农业科学,2022,51(2):86-96.
[21] van Veen J A,Ladd J N,Amato M. Turnover of carbon and nitrogen through the microbial biomass in a sandy loam and a clay soil incubated wtih [14C(U)] glucose and[15N ](NH4)2SO4,under different moisture regimes[J]. Soil Biology and Biochemistry,1985,17(6):747-756.
[22]敖金成,李永梅,李 博. 连作烟田健株与感染根腐病烟株根际土壤细菌群落多样性研究[J]. 江苏农业科学,2022,50(4):198-204.
[23]孙建平,刘雅辉,左永梅,等. 盐地碱蓬根际土壤细菌群落结构及其功能 [J]. 中国生态农业学报,2020,28(10):1618-1629.
[24]Pankratov T A,Ivanova A O,Dedysh S N,et al. Bacterial populations and environmental factors controlling cellulose degradation in an acidic Sphagnum peat[J]. Environmental Microbiology,2011,13(7):1800-1814.
[25]Kanokratana P,Uengwetwanit T,Rattanachomsri U,et al. Insights into the phylogeny and metabolic potential of a primary tropical peat swamp forest microbial community by metagenomic analysis[J]. Microbial Ecology,2011,61(3):518-528.
[26]Wagg C,Dudenhffer J H,Widmer F,et al. Linking diversity,synchrony and stability in soil microbial communities[J]. Functional Ecology,2018,32(5):1280-1292.
[27]Yelle D J,Ralph J,Lu F,et al. Evidence for cleavage of lignin by a brown rot basidiomycete[J]. Environmental Microbiology,2008,10(7):1844-1849.
[28] Rosas-Medina M,Maciá-Vicente J G,Piepenbring M. Diversity of fungi in soils with different degrees of degradation in Germany and Panama[J]. Mycobiology,2020,48(1):20-28.
[29]林春英,李希来,张玉欣,等. 黄河源区高寒沼泽湿地土壤微生物群落结构对不同退化的响应[J]. 环境科学,2021,42(8):3971-3984.
[30]金 桃,冯 强,万景旺,等. 五种根际促生菌在改善植物的农艺性状方面的应用:CN201510541017.2[P]. 2020-05-12.
[31]Tamayo-Vélez ,Osorio N W. Soil fertility improvement by litter decomposition and inoculation with the fungus Mortierella sp. in avocado plantations of Colombia[J]. Communications in Soil Science and Plant Analysis,2018,49(2):139-147.
[32]宁 琪,陈 林,李 芳,等. 被孢霉对土壤养分有效性和秸秆降解的影响[J]. 土壤学报,2022,59(1):206-217.
[33]徐惠昌,尤龙辉,游惠明,等. 不同土壤管理模式对锥栗园土壤真菌群组成的影响[J]. 果树学报,2021,38(11):1942-1955.
[34]Daniel J F S,Filho E R. Peptaibols of trichoderma[J]. Natural Product Reports,2007,24(5):1128-1141.
[35]章行远,吴奇飞,卯婷婷,等. 辣椒枯萎病拮抗木霉菌的篩选及鉴定[J]. 贵州农业科学,2022,50(6):24-30,2.
[36]易 龙,邱妙文,陈永明,等. 烟草黑胫病的生物防治研究进展[J]. 中国农学通报,2017,33(25):146-151.
[37]Harman G E,Howell C R,Viterbo A,et al. Trichoderma species:opportunistic,avirulent plant symbionts[J]. Nature Reviews Microbiology,2004,2(1):43-56.
[38]饶清琳,钱发聪,张廷金,等. 哈茨木霉菌LTR-2对烟草黑胫病的田间防治效果[J]. 昆明学院学报,2021,43(3):16-19.
[39]张 良,刘好宝,顾金刚,等. 长柄木霉和泾阳链霉菌复配对烟苗生长及其抗病性的影响[J]. 应用生态学报,2013,24(10):2961-2969.
[40]徐全智,孙牧笛,李 帆,等. 宁夏枸杞内生真菌的分离及多样性分析[J]. 北方园艺,2017(10):103-109.
[41]蒙盼盼,冯 欢,陈 伟,等. 楸树实生苗和嫁接苗根相关真菌群落结构和多样性[J]. 菌物学报,2021,40(8):1965-1979.
[42] Farh M E A,Kim Y J,Kim Y J,et al. Cylindrocarpon destructans/Ilyonectria radicicola-species complex:causative agent of ginseng root-rot disease and rusty symptoms[J]. Journal of Ginseng Research,2018,42(1):9-15.
[43] Luo X,Yu C. First report of damping-off disease caused by Fusarium oxysporum in Pinus massoniana in China[J]. Journal of Plant Diseases and Protection,2020,127(3):401-409.
[44]崔云凤,黄 云,蒋伶活. 农业生产上几种重要的赤霉属真菌研究进展[J]. 中国农学通报,2007,23(7):441-446.
收稿日期:2023-01-01
基金项目:中国烟草总公司河南省公司重点项目(编号:2021410000240021);河南省烟草公司许昌市公司重点项目(编号:2020411000240069);河南省烟草公司平顶山市公司重点项目(编号:2022.41.04.01.24.0105)。
作者简介:黄昆鹏(1994—),男,河南商丘人,碩士研究生,研究方向为烟草抗病育种。E-mail:kph615@126.com。
通信作者:周俊学,农艺师,从事烟草栽培、生产管理等研究,E-mail:910675295@qq.com;孙聚涛,博士,讲师,主要从事烟草抗病育种研究,E-mail:1sjt@163.com。
